Микрофлюидная жидкостная система экстракции с химически индуцированным образованием трех фаз в потоке
Автор: Сляднев М.Н., Казаков В.А., Макаров Е.Д., Ганеев А.А., Москвин Л. Н.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Материалы научного семинара "Микрочиповые технологии в аналитической химии"
Статья в выпуске: 2 т.15, 2005 года.
Бесплатный доступ
Предложена оригинальная система двух гомогенных растворов, представляющих собой смеси гептан-хлористый метилен-ацетонитрил и вода-ацетонитрил, при смешивании которых происходит образование трех сосуществующих фаз. Первая органическая фаза содержит преимущественно гептан, вторая (акцепторная) органическая фаза включает ацетонитрил, хлористый метилен и небольшое количество гептана, третья фаза состоит преимущественно из воды. При введении двух исходных фаз в микроканал чипа размерами 200 мкм (Ш) × 100 мкм (Г) показана возможность образования трехфазного потока со стабильной поверхностью раздела между всеми фазами. Проведено изучение процесса массообмена в образующейся трехфазной системе на примере распределения родамина 6G, включенного в состав начального водно-ацетонитрильного раствора, при введении в систему хлорида калия и без него. Для равновесных условий распределения родамина между фазами при смешивании начальных растворов в стеклянном цилиндре измерены аналитические характеристики процесса массообмена (коэффициенты концентрирования и распределения) при различных объемных соотношениях начальных растворов. Для динамических условий проведения экстракции родамина в микроканале чипа показана возможность протекания массообмена до равновесного состояния за время около 1 секунды с момента начала контакта начальных фаз. Малое время установления равновесия в микроканале чипа обусловлено диффузией вещества на малые расстояния в поперечном сечении микроканала, большим отношением площади межфазной границы к объему фаз, а также механизмом протекания массообмена в условиях выделения большей части ацетонитрила из исходного водно-органического раствора в отдельную фазу с одновременным переходом в нее молекул красителя.
Короткий адрес: https://sciup.org/14264377
IDR: 14264377 | УДК: 582.288:
Текст статьи Микрофлюидная жидкостная система экстракции с химически индуцированным образованием трех фаз в потоке
Одним из направлений применения микрофлю-идных микрочипов (МФЧ) в аналитической химии является осуществление процессов массообмена в гомогенных и мультифазных системах создания микрофлюидных потоков. Исследования диффузионного процесса массообмена в гомогенной системе были проведены на примере операций смешивания, реакции или диффузионной фильтрации веществ в микроканалах чипов [1–5]. Реализацией процессов массообмена в мультифазных системах является проведение жидкостной экстракции (ЖЭ) в системах двух несмешивающихся жидкостей [6– 11], твердофазной микроэкстракции [12–13], абсорбции и парофазного анализа в системах жидкость—газ [14–17], а также диализа веществ через жидкую [18] или синтезированную органическую мембрану [19]. Проведение подобных процессов и операций, как правило, востребовано при реализации стадии пробоподготовки/дериватизации в МФЧ при создании интегрированных лабораторий на чипе для анализа веществ.
Как было показано в работах [10, 11, 18, 20–22], при осуществлении операций массообмена в МФЧ за счет ламинарного режима микрофлюидных по- токов достигается образование стабильного интерфейса между сосуществующими фазами и наблюдается преимущественно диффузионный характер массообмена. Математический аппарат для теоретического описания протекающих процессов основан на использовании законов диффузии Фика [23]. При этом полнота протекания процессов массообмена до равновесного состояния определяется временем контакта микрофлюидных потоков в микроканалах чипов.
При осуществлении операций массообмена в жидкостных системах время, необходимое для равновесного протекания процессов в микроканалах чипов с типичными геометрическими размерами порядка десятков и сотен микрометров, составляет десятки и сотни секунд и зависит от скорости диффузии веществ и природы применяемых растворителей [6–11, 18]. Хотя по сравнению с обычными макросистемами с линейными размерами порядка единиц и десятков сантиметров время достижения равновесия в условиях диффузионного распределения веществ в МФЧ чрезвычайно мало, в этих условиях для практического достижения подобных времен контакта необходимо создавать микрофлюидные потоки со скоростью порядка десятков и сотен пл/с, а также увеличи- вать длину микроканалов до нескольких десятков сантиметров [6 –11]. При этом возникают трудности, связанные с устойчивостью межфазной границы для мультифазных систем, а также с технической реализацией создания микрофлюидных потоков.
Ускорения протекания процессов массообмена в мультифазных жидкостных системах, по-видимому, можно достичь при создании системы микрофлюидных потоков, в которой происходит химически-индуцированное образование новой акцепторной фазы в микроканале чипа. При этом в зависимости от состава первоначальных жидкостных потоков и соотношения их объемных скоростей возникает возможность контроля ширины зоны этой фазы/(объемной скорости) в микроканале МФЧ и, таким образом, контроля полноты протекания диффузионного массообмена в поперечном сечении микроканала. Нами предложена система двух жидкостей, при контакте которых происходит образование подобной трехфазной системы экстракции (ТФСЭ).
Настоящая статья посвящена изучению условий образования ТФСЭ при смешивании двух гомогенных растворов: вода—ацетонитрил и гептанхлористый метилен—ацетонитрил в стационарных и динамических условиях. В качестве модельного вещества для изучения кинетики фазообразования и полноты протекания массообмена использован краситель родамин 6G, введенный в состав ацетонитрильно-водной фазы. Проведено изучение условий образования ТФСЭ в стационарных условиях при смешивании начальных фаз определенного состава в различном объемном соотношении в стеклянном цилиндре и определены аналитические характеристики массообмена модельного вещества (коэффициенты концентрирования и распределения) в этих условиях. Показана возможность проведения экстракции родамина в образующуюся акцепторную фазу в динамических условиях в микроканале МФЧ за короткий промежуток времени.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы, реактивы и оборудование
Исходный 10–2 М концентрированный раствор родамина 6G готовили растворением точной навески соответствующего вещества в 95 %-м этаноле. Раствор хранили в холодильнике при + 4 ºС и использовали в течение месяца. Рабочие водноорганические растворы красителя готовили перед измерениями разбавлением исходного ацетонитрилом и водой с введением в растворы солевой добавки хлорида калия или без солевой добавки. Концентрация красителя в рабочих растворах составляла 5.72∙10–4 М при концентрации солевой добавки (KCl) 300 мМ. Объемная доля ацетонитрила в растворе при этом составляла 45 %.
Для оценки аналитических характеристик установки флуоресцентного детектирования использовали свежеприготовленные спиртовые растворы родамина 6G в диапазоне концентраций 5∙10–7÷ 2∙10–3 М.
Органическая фаза для создания ТФСЭ представляла собой свежеприготовленную смесь органических растворителей (гептан—хлористый ме-тилен—ацетонитрил в объемном соотношении 10:2.5:1). В работе использовали органические растворители квалификации не ниже "х.ч." (Нева-Реактив).
Перед проведением экспериментов в МФЧ или в стационарных условиях водно-ацетонит-рильный раствор родамина и органическую смесь растворителей в пластиковых пробирках объемом 1.5 мл размешивали на центрифуге "5415D" (Eppendorf) при скорости 10 000 об/мин в течение 2 мин и дегазировали под вакуумом, создаваемым водоструйным насосом, в течение 3 мин.
Для определения состава образующихся фаз при смешивании трехкомпонентных органических смесей растворителей с водно-органическими растворами использовали газовый хроматограф "Цвет-100" с термостатируемой ( Т =60 ºС) капиллярной кварцевой колонкой (30 м × 0.32 мм) и плазменно-ионизационным детектором (ПИД). На стенки хроматографической колонки была нанесена неполярная полидиметилсилоксановая неподвижная фаза марки "Chrompack CP Sil-13 CB" (Chrompack). В качестве газа-носителя использовали азот, расход газа-носителя при проведении измерений составлял 1 мл/мин. Дозирование проб осуществляли шприцем МШ-1; объем пробы составлял 0.2 мкл.
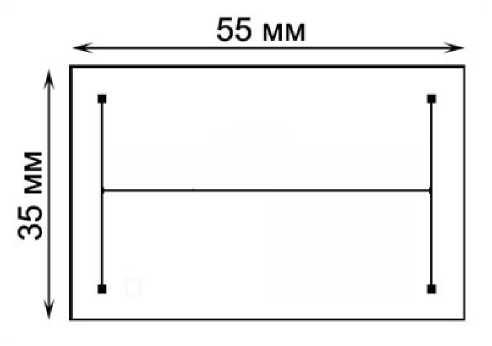
Рис. 1. Топология и габаритные размеры стеклян-но-кремниевого Н-образного микрочипа
Экспериментальная установка
Топология использованного в работе Н-образного стеклянно-кремниевого МФЧ и его габаритные размеры показаны на рис. 1, а технология его изготовления подробно описана в работе [11]. Размеры микроканалов трапециевидного поперечного сечения составляли 250 мкм (верхнее основание) × 90 мкм (нижнее основание) ×110 мкм (высота трапеции). Длина центрального микроканала контакта двух микрофлюидных потоков жидкостей составляла 45 мм.
Экспериментальная микрочиповая установка состояла из трех блоков: системы флуоресцентного детектирования, системы создания и контроля микрофлюидных потоков жидкостей в МФЧ и подвижной двухкоординатной платформы для держателя микрочипа.
Система флуоресцентного детектирования аналогична описанной в статье [11], за исключением используемой камеры и спектральных характеристик элементов оптической схемы. В качестве детектора флуоресцентного излучения выбрана камера (Electron-Optronic) на основе термоэлектрически охлаждаемой ПЗС-матрицы (до -10 ° С). Камера обеспечивала цифровую передачу изображения в ПЭВМ с разрядностью 12 бит при разрешении изображения 752 × 582 пикселей. Управление режимами камеры (температурой, экспозицией 0.16–5 с, усилением сигнала) осуществлялось через последовательный порт.
Источником возбуждения флуоресценции выбран светодиод (Lumileds Lighting), излучающий в диапазоне 490-600 нм, A max = 53 0 нм, с мощностью светового потока 120 мВт. Для спектральной фильтрации излучения использовались: интерференционный светофильтр с полосой пропускания 505–550 нм, дихроичное зеркало с полосой пропускания 560–800 нм и интерференционный светофильтр с полосой пропускания 570–640 нм (Omega Optical).
Интегральное увеличение оптической системы установки детектирования составляло 2.4 (поле наблюдения 1.6 × 1.2 мм), а разрешающая способность — величину ~2.1 мкм/пиксел.
Система создания микрофлюидных потоков жидкостей представляла собой блок, состоящий из двух шприцевых насосов (Люмэкс), описанный в работе [11]. Насосы использовались в нагнетательном режиме работы. Рабочий диапазон объемных скоростей микрофлюидных потоков, создаваемых шприцевыми насосами, составлял 0.2– 20.0 мкл/с.
Держатель с микрочипом в сборе был закреплен на подвижной двухкоординатной платформе. Платформа использовалась для точной юстировки положения изучаемой зоны канала относительно фокуса оптической системы. Держатель также служил для подвода жидкостных потоков к микрочипу и их отвода во внешние сливные емкости [11].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение условий образования трехфазной системы и распределения красителя в ней в стационарных условиях
Образование трехфазной системы было замечено нами при контакте гомогенного раствора состава гептан—хлористый метилен—ацетонитрил (Ф1) с водно-ацетонитрильным раствором (Ф2), как показано на (рис. 2, а). В качестве модельного вещества для изучения процессов массообмена в такой системе, исходя из спектральных характеристик установки флуоресцентного детектирования, был выбран краситель родамин 6G, вводимый в состав фазы Ф2. Родамин 6G из-за своих
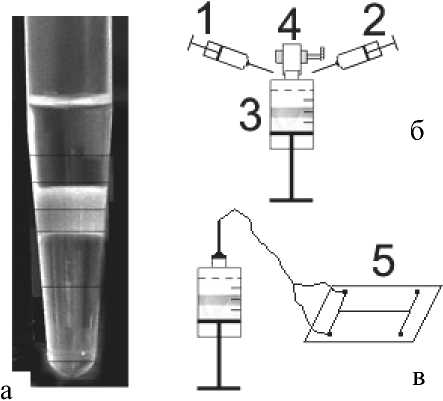
Рис. 2. Трехфазная система экстракции (ТФСЭ) в стационарных условиях.
а — трехфазная жидкостная система (модельное вещество: родамин 6G, добавка KCl в вод-но-ацетонитрильную фазу). Сверху вниз: неполярная органическая фаза, акцепторная органическая фаза, обедненная красителем водная фаза.
б — образование ТФСЭ; 1, 2 — шприцы для ввода начальных фаз; 3 — стеклянный шприц для определения объемов образующихся фаз ( 0 15 мм); 4 — силиконовый шланг и винтовой зажим для предотвращения испарения органических растворителей при установлении равновесия в системе.
в — поочередный ввод образовавшихся равновесных фаз в микроканалы чипа (5) для измерения аналитического сигнала химических свойств преимущественно переходит из первоначального ацетонитрильно-водного раствора в среднюю образующуюся фазу (см. рис. 2, а) и служит в качестве флуоресцентного маркера этой фазы. Изучение условий образования такой системы в стационарных условиях проводили с помощью установки, показанной на рис. 2, б. После ввода первоначальных фаз в стеклянный шприц для предотвращения испарения с помощью винтовых прижимов и силиконовых шлангов проводили герметизацию образующейся трехфазной системы, как показано на рис. 2, б, и считали протекающие процессы распределения родамина в ТФСЭ равновесными при времени контакта фаз с момента их слияния 1 час. При этом объемы первоначальных фаз составляли 4.4 (8.8) мл для Ф1 и 4.4 мл для Ф2, а площадь контакта фаз была равна 176.6 мм2.
При этом, судя по распределению красителя в системе и плотности используемых растворителей, верхняя органическая фаза преимущественно содержала гептан и, следовательно, была неполярной; средняя (акцепторная по отношению к красителю) органическая фаза включала растворители средней и высокой полярности: ацетонитрил и хлористый метилен; нижняя фаза состояла преимущественно из воды (рис. 2, а). В табл. 1 приведены объемы образующихся фаз при объемных соотношениях начальных фаз 1:1 и 2:1 (Ф1:Ф2). Для более четкого определения границ раздела трех фаз производили повышение коэффициента распределения родамина в образующуюся акцеп- торную фазу (АФ) за счет эффекта высаливания. С этой целью в первоначальный ацетонитрильноводный раствор родамина производили добавку хлорида калия. При СKCl =300 мМ при прочих равных условиях наблюдали повышение объема образующейся АФ за счет увеличения объемной доли ацетонитрила в ней (табл. 1). При этом, как видно из таблицы, при объемном соотношении начальных фаз 2:1 (Ф1:Ф2) происходило значительное уменьшение объема образующейся АФ по отношению к условиям равных объемов фаз с одновременным увеличением объема верхней органической фазы с большим содержанием гептана (рис. 2, а). Эффект солевой добавки, приводящий к увеличению объема АФ при равных объемах начальных фаз на ~9 %, приводил к увеличению объема АФ на 35 % при условии двукратного увеличения объема исходной органической фазы. При введении солевой добавки в систему наблюдали также значительно более быструю кинетику фазо-образования и одновременного распределения родамина в ТФСЭ.
С точки зрения возможности применения ТФСЭ в аналитической практике ключевую роль играет состав образующейся АФ. В табл. 1 приведен состав АФ при проведении экстракции родамина в статических условиях для объемного соотношения начальных фаз 1:1 и 2:1 (Ф1:Ф2). Состав АФ был определен с помощью газохроматографического анализа методом внутренней нормализации. При этом считали, что количество воды, которое невозможно измерить с помощью ПИД
Табл. 1. Объемы образующихся фаз и состав акцепторной фазы при различных объемных соотношениях начальных фаз в условиях солевой добавки в систему и без нее
|
V Ф1, мл |
V Ф2, мл |
С KCl в Ф2, мМ |
V АФ, мл |
V ОВФ, мл |
V ВОФ, мл |
Состав АФ, объем. % |
|
4.4 |
4.4 |
0 |
2.51 |
2.32 |
3.97 |
К1 — 10.8 ± 1, К2 — 36.6 ± 3, К3 — 52.6 ± 1 |
|
300 |
2.74 |
2.30 |
3.76 |
— |
||
|
8.8 |
4.4 |
0 |
1.50 |
2.30 |
9.40 |
К1 — 22.5 ± 2, К2 — 20.2 ± 3, К3 — 57.3 ± 2 |
|
300 |
2.03 |
2.13 |
9.04 |
— |
Примечание. К1 — гептан, К2 — хлористый метилен, К3 — ацетонитрил.
Ф1 — начальная органическая фаза (К1:K2:K3 = 10:2.5:1 ( V / V )); Ф2 — начальная водно-органическая фаза (К3:K4 = 1:1.25 ( V / V , К4 — вода)); АФ — акцепторная фаза, ОВФ — обедненная красителем водная фаза, ВОФ — верхняя органическая фаза (рис. 2, а)
газового хроматографа, в образующейся АФ пренебрежимо мало, что косвенно может быть подтверждено высоким содержанием гептана и хлористого метилена в этой фазе. Тем не менее, как видно из табл. 1, в составе АФ превалируют растворители высокой и средней полярности (ацетонитрил, хлористый метилен), объемная доля которых составляет более 80 %, что определяет полярность всей АФ. Ацетонитрил и хлористый метилен являются широко распространенными растворителями в аналитической практике, в том числе они находят широкое применение при анализе флуоресцирующих форм аналитов, квантовый выход которых в такой среде может быть в несколько раз выше по сравнению с водной [24, 25]. При этом полярность фазы, в приближении принимаемая равной полярности чистого ацетонитрила, способствует преимущественному переходу в нее широкого круга анализируемых соединений.
Поведение четырехкомпонентной системы состава "гептан—хлористый метилен—ацетонит-рил—вода" в зависимости от составов исходных фаз без учета роли солевой добавки можно прогнозировать с помощью построения трехмерной диаграммы расслаивания [26, 27]. Она представляет собой тетраэдр, вершины которого составляют чистые компоненты, по ребрам отложены составы бинарных систем, а грани являются диаграммами расслаивания трехкомпонентных смесей (треугольники Гиббса—Розебома [28]). С помощью построения такой диаграммы можно определить область сосуществования трех фаз. При этом объемы и составы образующихся фаз строго заданы составами исходных растворов и их объемным соотношением. Построение подобной диаграммы на основании данных газохроматографического анализа является предметом отдельного физикохимического исследования.
Аналитический сигнал (АС) от образующихся фаз измеряли с помощью установки флуоресцентного детектирования в микроканале МФЧ. Для этого осуществляли поочередный ввод первоначальных и образующихся фаз в микрочип с помощью шприца, как показано на (рис. 2, в). Время экспозиции кадра изображения при проведении измерений составляло 0.48 с. Такое время экспозиции было обусловлено перспективой изучения процессов массопереноса в МФЧ в быстро меняющихся динамических условиях проведения экстракции. Перед проведением измерений система детектирования при заданном времени экспозиции была откалибрована путем ввода спиртовых растворов с известной концентрацией красителя в микроканалы чипа. Целью калибровки являлся выбор рабочей концентрации родамина в начальном ацетонитрильно-водном растворе с точки зрения аналитических характеристик детектора. При этом для texp = 0.48 с линейный дипазон опреде- ляемых концентраций по родамину составлял 2∙10–5 ÷ 8∙10–4 М. На основании этих данных рабочая концентрация родамина составляла 5.72× ×10–4М.
Квантовый выход флуоресценции родамина ( φ R6G ) в спиртовом растворе на основании литературных данных [29, 30] составляет 0.95. При переходе от спирта к более полярным растворителям (ацетонитрилу и водным растворам) наблюдается изменение φ R6G и "синий" сдвиг спектров флуоресценции родамина 6G, что объясняется химическим строением молекулы красителя [31–33]. Поэтому при проведении измерений АС от фаз ТФСЭ учитывали влияние среды на флуоресценцию молекул красителя. Для этой цели в предварительных экспериментах проводили измерение АС в микроканале чипа от растворов с одинаковой концентрацией красителя в чистом ацетонитриле, 14 мМ боратном буферном растворе (рН 8.0) и спирте. Условные величины интенсивности флуоресценции (Fluorescence Intensity, FI) для ацетонитрильного раствора родамина и водного буферного раствора красителя составили соответственно 0.90 и 0.82 по отношению к FI красителя в спирте.
Коэффициенты концентрирования родамина после образования ТФСЭ рассчитывали по уравнению (1) и принимали равными отношению АС от образующейся АФ к АС от исходной донорной фазы (ИДФ) (Ф2) в микроканале чипа с учетом объемного соотношения этих фаз (при этом FI родамина в этих фазах принимали равной этой величине в чистом ацетонитриле):
K кS
(АС АФ / V АФ ) , (АС ИДФ / V ИДФ )
где АС АФ , АС ИДФ — интенсивности флуоресценции соответственно в акцепторной фазе и исходной донорной фазе, измеренные в микроканале чипа (усл. ед.); V АФ , V ИДФ — объемы акцепторной и исходной донорной фаз (мл).
Значения коэффициентов концентрирования для объемных соотношений исходных растворов 1:1 и 2:1 (Ф1:Ф2) приведены в табл. 2. Как видно из таблицы, коэффициенты концентрирования слабо зависят от введения солевой добавки в раствор ИДФ и возрастают с увеличением объемной доли Ф1 в начальной системе фаз. Это объясняется увеличением объема АФ при введении солевой добавки в систему и значительным уменьшением объема АФ при увеличении доли Ф1 в начальной системе (табл. 1). Полученные значения коэффициентов концентрирования являются подтверждением возможности проведения экстракции с одновременным концентрированием аналитов в АФ. Для повышения коэффициентов концентрирования (распределения) веществ в какую-либо из двух образующихся органических фаз (рис. 2, а),
Табл. 2. Значения коэффициентов концентрирования родамина R6G в образующуюся АФ и коэффициентов распределения красителя между АФ и ОВФ при различных объемных соотношениях начальных фаз в условиях солевой добавки в систему и без нее
|
V Ф1, мл |
V Ф2, мл |
С KCl в Ф2, мМ |
* K K S |
** K P S |
|
4.4 |
4.4 |
0 |
1.98 |
2.57 |
|
300 |
1.98 |
13.48 |
||
|
8.8 |
4.4 |
0 |
3.24 |
2.57 |
|
300 |
3.10 |
43.06 |
Примечание. В обозначениях К1 — гептан, К2 — хлористый метилен, К3 — ацетонитрил, К4 — вода:
Ф1 — начальная органическая фаза (К1:K2:K3 = 10:2.5:1 ( V / V ));
Ф2 — начальная водно-органическая фаза (К3:K4 = 1:1.25 ( V / V ));
C R6G в Ф2 = 5.72∙10–4 М.
*— расчет K KS по формуле (1); **— расчет K PS по формуле (2).
помимо оптимизации составов исходных фаз и их объемного соотношения, на наш взгляд, можно провести подбор условий протекания экстракции, например по ион-парному механизму, что является предметом отдельного исследования.
Коэффициенты распределения ( K PS ) родамина в ТФСЭ между двумя нижними фазами (рис. 2, а) рассчитывали по уравнению (2):
S (АС АФ / V АФ )
Kp — n р X
(АС ОВФ / V ОВФ)
где АС АФ , АС ОВФ — интенсивности флуоресценции в акцепторной фазе и обедненной красителем водной фазе, измеренные в микроканале чипа (усл. ед.); V АФ , V ОВФ — объемы акцепторной и исходной донорной фаз (мл); n р = 0.91.
KP S принимали равными отношению АС от образующейся АФ к АС от обедненной красителем водной фазы (ОВФ) в микроканале чипа с учетом объемного соотношения этих фаз и величин FI в них. При этом FI красителя для АФ принимали равной этой величине в чистом ацетонитриле, а FI родамина для ОВФ принимали равной этой величине в водном буферном растворе. Величина n P = FI ОВФ /FI АФ в уравнении (2) выражает отношение интенсивности флуоресценции родамина в этих растворах при равной концентрации красителя.
Значения KPS для объемных соотношений исходных растворов 1:1 и 2:1 (Ф1:Ф2) приведены в табл. 2. Как видно из таблицы, KPS родамина между АФ и ОВФ в образующейся ТФСЭ без соле- вой добавки не зависели от объемного соотношения исходных фаз, что можно объяснить постоянством составов АФ и ОВФ, поскольку коэффициент распределения вещества не зависит от объема фаз. При этом при увеличении соотношения Ф1:Ф2, как видно из табл. 1, происходило образование АФ примерно одинакового состава по основному компоненту (ацетонитрилу), а объем ОВФ оставался неизменным. Это говорит о постоянстве состава этой бинарной системы (ОВФ), поскольку образование ТФСЭ связано с перераспределением ацетонитрила в начальной системе фаз. Добавка KCl в ИДФ (Ф2) способствовала значительному повышению KPS. Это связано с эффектом высаливания органических компонентов из образующейся нижней водной фазы с высоким солевым фоном (рис. 2, а).
Следует отметить, что при проведении измерений АС от верхней неполярной фазы (рис. 2, а) оставался низким, что было связано с потерей флуоресцирующих свойств молекул родамина в среде с большой объемной долей гептана и большим объемом этой фазы (табл. 1).
Таким образом, путем варьирования составов контактирующих начальных фаз и их соотношения возникает возможность изменения объема образующейся АФ, ее полярности и других физических свойств, а также аналитических характеристик массообмена веществ (коэффициентов концентрирования и распределения) в образующейся ТФСЭ. Это может приводить к появлению новых нестандартных решений задач пробоподготовки и определения аналитов. Привлекательным в этом аспекте является проведение подобных исследований с помощью МФЧ.
Отметим, что с точки зрения целесообразности проведения пробоподготовки путем разбавления исходной пробы ацетонитрилом (или другим растворителем) с последующим выделением большей части этого растворителя и анализируемого вещества из материнского раствора в отдельную фазу эффект концентрирования аналита в образующуюся АФ по отношению к его концетрации в исходной неразбавленной пробе может быть невелик. Однако повышения чувствительности определения аналита можно достичь не только проведением операций по повышению уровня его концентрации, но и изменением характеристик анализируемого вещества, например значительным повышением квантового выхода флуоресцирующих форм в органической среде [24]. При этом следует отметить, что люминесцентные методы анализа из-за высокой чувствительности и технических характеристик систем детектирования нашли наиболее широкое применение в области микрофлю-идных аналитических систем по сравнению с другими [34].
Изучение условий образования трехфазной системы и распределения красителя в ней в потоке в микрофлюидном чипе
При проведении экстракции в динамических условиях в МФЧ для осуществления и стабилизации непрерывного "струйного" течения образующихся трех фаз в микроканале чипа (рис. 3, а) и предотвращения образования разрывов фазы АФ ("пробок") варьировали скорости микрофлюидных потоков двух начальных фаз и их соотношение.
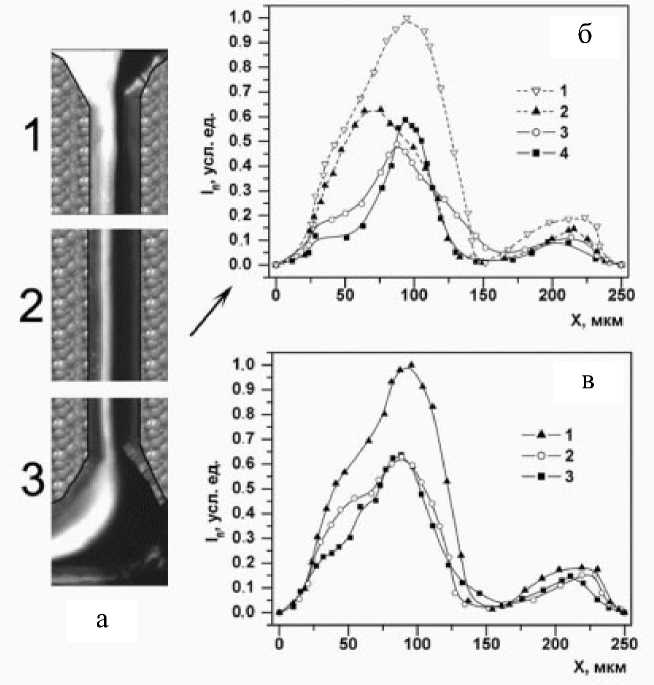
Рис. 3. Трехфазная система экстракции (ТФСЭ) в динамических условиях. а — образование ТФСЭ и кинетика распределения родамина 6G в системе по длине микроканала чипа при С KCl = 300 мМ (1, 2, 3).
б —профили интенсивности флуоресценции в поперечном сечении микроканала чипа при С KCl = 300 мМ в зависимости от времени контакта начальных фаз ( T конт ): 1 — 0 с; 2 — 0.1 с; 3 — 0.25 с; 4 — 1.12 с.
в — профили интенсивности флуоресценции в поперечном сечении микроканала чипа без добавки KCl в зависимости от времени контакта начальных фаз ( T конт): 1 — 0 с; 2 — 0.05 с; 3 — 1.12 с
При варьировании соотношения объемных скоростей подачи растворов Ф1 и Ф2 в МФЧ от 1:1 до 2:1 из-за физических свойств используемых жидкостей, топологии, размеров и формы поперечного сечения микроканалов чипа ширина зоны ИДФ (Ф2) в точке слияния начальных фаз в центральном микроканале чипа (рис. 1) изменялась от 60.0±0.5 до 57.0±0.5 % от максимальной ширины микроканала чипа. Измерения ширины зоны фаз Ф1 и Ф2 проводили после получения экспериментальных кадров оцифрованного изображения микроканала и построения профилей АС в его поперечном сечении [11]. Время экспозиции кадра изображения составляло 0.48 с. Оптимальные для стабилизации непрерывного течения трех образующихся фаз в микроканале МФЧ скорости мик-рофлюидных потоков составили 55 мкл/мин для органической фазы и 27 мкл/мин для ацетонитрильно-водного раствора родамина (соотношение скоростей подачи растворов в МФЧ 2:1). Поэтому для интерпретации полученных результатов по распределению родамина в динамических условиях с точки зрения равновесности протекания процессов использовали результаты по изучению распределения красителя в ТФСЭ в стационарных условиях при соотношении объемов начальных фаз 2:1 (Ф1:Ф2). При этом с помощью установки флуоресцентного детектирования наблюдали кинетику образования ТФСЭ и перехода родамина в АФ по длине микроканала чипа при добавке KCl в ИДФ или без нее.
На рис. 3, а показаны полученные экспериментальные кадры протекающих процессов массооб-мена по длине микроканала чипа при СKCl = 300 мМ в ИДФ. На рис. 3, б приведены профили аналитического сигнала в поперечном сечении микроканала для этих условий. Профили АС были получены путем математической обработки экспериментальных оцифрованных кадров изображения. Как видно из рис. 3, а (1, 2, 3), образование АФ происходило близко к середине микроканала чипа. По длине микроканала в этом месте постепенно формировалась зона шириной порядка 65 мкм с высоким значением АС, а также слева от нее зона обедненной красителем водной фазы (ОВФ) и справа зона неполярной органической фазы. Рост АС по краям микроканала в его поперечном сечении (рис. 3, б) был обусловлен эффектом отражения флуоресцентного излучения от образующейся АФ от зеркальных наклонных поверхностей кремниевых стенок [11]. По-видимому, ширина зоны АФ определена физическими свойствами жидкостей, а также размерами и формой микроканала. При проведении серии экспериментов с изменением объемной доли ацетонитрила в ИДФ от 20 до 50 % было замечено, что ширина зоны АФ в отличие от кинетики фазообра- зования при этом менялась слабо.
На рис. 3, в приведены профили АС в поперечном сечении микроканала МФЧ для условий образования ТФСЭ без добавки KCl. При этом, как видно из рис. 3, в, из-за низких коэффициентов распределения родамина в образующуюся АФ невозможно четко определить границу раздела АФ и ОВФ в образующейся в микроканале чипа ТФСЭ.
Время, прошедшее с начала контакта микро-флюидных потоков Ф1 и Ф2, рассчитывали по линейной скорости более медленного потока ИДФ по центральному микроканалу чипа в точке слияния потоков с учетом степени заполнения канала ИДФ. Линейная скорость ИДФ по микроканалу при проведении измерений составляла 4.0 см/с, что приводило к диапазону времен контакта фаз в нем от 0 до 1.12 с.
Величину, равную отношению АС от ОВФ в стационарных условиях к таковой в динамических условиях, считали критерием для оценки равновесности распределения родамина в ТФСЭ. Она составила 93.4 % при С KCl = 300 мМ и 73.7 % без добавки KCl для времени контакта начальных микрофлюидных потоков 1.12 с. Таким образом, солевая добавка способствовала ускорению процессов массообмена в МФЧ. За время контакта первоначальных потоков порядка 1 с процессы массообмена в микроканале чипа при С KCl = = 300 мМ проходили практически до равновесного состояния.
Как видно из рис. 3, б, в, при образовании ТФСЭ в микроканале чипа происходило падение АС в АФ (кривые 2–4 на рис. 3, б; кривые 2, 3 на рис. 3, в) по сравнению с АС от ИДФ в точке слияния начальных фаз (кривая 1 на рис. 3, б, в). АС от АФ для Т конт = 1.12 с составлял не более 35 % от АС этой фазы в равновесных условиях в полностью заполненном микроканале чипа. Наблюдаемое низкое значение АС от AФ в динамических условиях объясняли формированием зоны АФ в микроканале МФЧ толщиной не более 35 мкм при глубине микроканала (110 мкм). Используя эти допущения, из графика 4 (рис. 3, б) можно сделать вывод, что со стороны потока водной фазы (слева) профиль глубины АФ имеет более пологий характер, что связано с механизмом образования ТФСЭ путем перераспределения ацетонитрила в начальной системе фаз.
Отметим, что способом увеличения толщины АФ до высоты микроканала и стабилизации непрерывного "струйного" течения трех фаз в микроканале при меньших скоростях расхода начальных фаз может быть оптимизация топологии микроструктур МФЧ и/или формы поперечного сечения микроканала массообмена, как показано в работах [18, 35].
Быстрота протекания процессов массобмена при образовании ТФСЭ на 1–2 порядка выше по сравнению с проведением жидкостной экстракции в системе двух несмешивающихся жидкостей в МФЧ [6–11]. Это обусловлено прежде всего общими преимуществами всех микрофлю-идных систем (сокращенным временем диффузии вещества за счет уменьшенного расстояния и большим отношением площади межфазной границы к объему фаз), а также выбором растворителей предложенной оригинальной системы с низкими значениями вязкости и механизмом протекания массообмена в условиях одновременного образования новых фаз. Для более детального описания протекающих процессов и их оптимизации с построением физико-химических моделей требуется изучение образования ТФСЭ в микроканале МФЧ при изменении ряда параметров, например составов начальных фаз и температуры.
Тем не менее предложенную на этом этапе изучения систему можно использовать для анализа реальных (био)химических объектов на стадии пробоподготовки и дериватизации, например для определения катехоламинов (КА) в биологических жидкостях (кровь, моча человека) методом ВЭЖХ с флуоресцентным детектированием [24]. Привлекательность использования МФЧ помимо быстроты проведения пробоподготовки будет заключаться в малом расходе биопроб и реагентов в ходе выполнения анализов. При этом квантовый выход флуоресцирующих форм дериватов КА с высокочувствительным групповым реагентом NBD-F при переходе от водной среды к чистому ацетонитрилу и хлористому метилену возрастает в ~3– 7 раз [24].
ВЫВОДЫ
Предложена оригинальная жидкостная система для осуществления экстракции веществ в условиях одновременного с протеканием массообмена образования новой акцепторной фазы. При введении двух исходных фаз в микроканал чипа размером ~200 (Ш)×100 мкм(Г) показана возможность образования трехфазного потока со стабильной поверхностью раздела между всеми фазами. Проведено изучение процесса массообмена в полученной трехфазной системе экстракции (ТФСЭ) на примере распределения родамина 6G между образующимися фазами в стационарных условиях при смешивании двух начальных фаз в стеклянном цилиндре и динамических условиях при контакте двух начальных микрофлюидных потоков в микроканале чипа. Для стационарных условий проведения экстракции родамина измерены аналитические характеристики процесса массообмена (коэффициенты концентрирования и распределения).
Для динамических условий проведения экстракции родамина показана возможность протекания массообмена до равновесного состояния за время около 1 секунды с момента начала контакта мик-рофлюидных потоков при введении добавки хлорида калия в начальную систему фаз. Малое время установления равновесия в микроканале чипа обусловлено диффузией вещества на короткие расстояния в поперечном сечении микроканала, большим отношением площади межфазной границы к объему фаз, а также механизмом протекания массообмена в условиях выделения большей части ацетонитрила из материнского водно-органического раствора в отдельную фазу с одновременным переходом в нее молекул красителя.


