Микрофлюидное устройство с оптическим сенсорным элементом на основе натриевоборосиликатного пористого стекла для иммунного анализа
Автор: Есикова Надежда Александровна, Евстрапов А.А., Антропова Т.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 2 т.24, 2014 года.
Бесплатный доступ
В статье представлены результаты исследований по постановке конкурентного иммунного анализа на пористом стекле SBS-МАП (средний размер пор 490 нм, пористость 50 %) и в микрофлюидном устройстве с интегрированным сенсорным элементом. Продемонстрирована возможность обнаружения инсулина в диапазоне концентраций (2.9∙10 -7÷2.3∙10 -6) М в 600 мкл пробы на сенсорном элементе и в 40 мкл пробы в микрофлюидном устройстве с интегрированным сенсорным элементом.
Микрофлюидное устройство, конкурентный иммунный анализ, натриевоборосиликатное пористое стекло
Короткий адрес: https://sciup.org/14264933
IDR: 14264933 | УДК: 543.9:543.068.8:53.082.56
Текст научной статьи Микрофлюидное устройство с оптическим сенсорным элементом на основе натриевоборосиликатного пористого стекла для иммунного анализа
ВВЕДЕНИЕ СХЕМА ЭКСПЕРИМЕНТА
Разработка биосенсорных систем на основе микрофлюидных технологий является одним из перспективных направлений аналитического приборостроения [1]. Благодаря высокой специфичности связывания широкое распространение получили иммунные методы анализа [2]. Наиболее чувствительным методом детектирования результата иммунной реакции является флуоресцентный метод [3, с. 259–262]. Применение натриевобороси-ликатных пористых стекол (ПС), обладающих такими свойствами, как термическая, химическая и биологическая устойчивость, прозрачность в видимой области спектра в сочетании с регулируемыми структурными характеристиками и превосходными адсорбционными свойствами, обусловленными большим объемом пор с разветвленной поверхностью, способной к хемосорбции разнообразных веществ [4], позволяет дополнительно повысить чувствительность анализа. Для создания сенсорного элемента необходимо иммобилизировать на поверхность пористого стекла сенсорный слой, например, методом ковалентного связывания. Адаптация иммунного анализа под формат микро-флюидного устройства дает возможность снизить расход пробы и реагентов, повысить быстродействие и в перспективе объединить несколько стадий или весь анализ на одном устройстве [5].
Данная статья является развитием работы [6], в которой показана принципиальная возможность создания сенсорного элемента на основе натриево-боросиликатного пористого стекла.
Иммобилизация белка на натриевоборосили-катное пористое стекло проводится в 5 стадий: 1) предварительный прогрев стекла для удаления сорбированной влаги; 2) активация поверхности; 3) силанизация; 4) обработка глутаральдегидом и 5) непосредственно иммобилизация белка. Принцип функционирования сенсорного элемента основан на конкурентной иммунной реакции, что позволяет исключить стадию связывания образовавшегося иммунного комплекса с флуоресцентной меткой для детектирования:
IgG + (FITC–Ins–) + Ins
(IgG-FITC–Ins) + (IgG-Ins) + (FITC–Ins) + Ins, где IgG — иммобилизованный на пористое стекло иммуноглобулин G, FITC–Ins — меченный изоцио-натом флуоресцеина (fluorescein isothyocyanat, FITC) инсулин, Ins — немеченый инсулин, (IgG-Ins–FITC) и (IgG-Ins) — образующиеся меченый и немеченый иммунные комплексы.
В работе использовались реактивы фирмы Sigma Aldrich: белки (иммуноглобулин G, инсулин, бычий сывороточный альбумин) и соли для буферных растворов. Образцы натриевоборосиликатных пористых стекол разработаны и синтезированы в Институте химии силикатов им. В.И. Гребенщикова РАН.
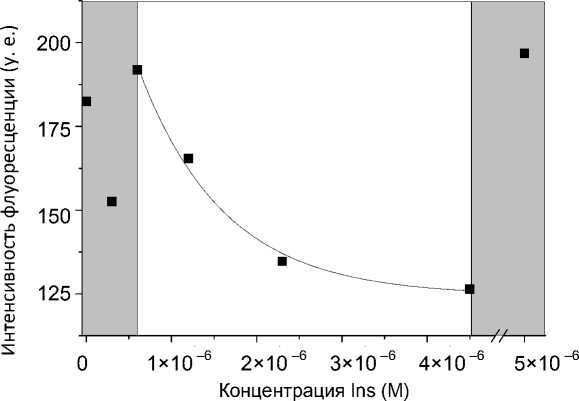
Рис. 1. Зависимость интенсивности флуоресценции сенсорных элементов от концентрации инсулина в пробе на длине волны 528 нм
ОБНАРУЖЕНИЕ ИНСУЛИНА В ПРОБЕ
Для обнаружения инсулина в пробе в статическом режиме было создано 17 образцов сенсорных элементов на основе ПС SBS-МАП (средний размер пор, согласно методу БЭТ, ≈ 490 нм, пористость ≈ 50 %) размером 8 × 8 × 0.5 мм. Концентрация раствора IgG для иммобилизации С IgG = = 5.7∙10–7 М, БСА — 25 мг на образец.
Для контроля воспроизводимости сенсорных элементов (пористого стекла с иммобилизованным IgG) проведены измерения интенсивности флуоресценции образцов в отраженном свете на макете, состоящем из лазера DPBL-9010F (Photop Suwtech Inc, Китай) с длиной волны излучения 473 нм, столика для позиционирования образца, рамановского акусто-оптического спектрометра РАОС-1 (НТЦ уникального приборостроения РАН, Россия) и волоконно-оптической системы (далее макет детектора). На полученных зависимостях наблюдался широкий пик флуоресценции глутаральдегида, используемого при иммобилизации белка, с максимумом на длине волны 540 нм. Данные показали, что по уровню флуоресценции сенсорные элементы можно разделить на 2 группы из 12 и 5 образцов: (5020 ± 130) и (4340 ± 150) у.е. Такое разделение образцов позволяет улучшить воспроизводимость измерений. Однако в связи с ограниченным числом образцов иммунная реакция для каждой концентрации аналита проведена на двух образцах из одной группы сенсорных элементов и на одном из другой, так чтобы учесть вклад, вносимый технологией изготовления в погрешность измерений. Коэффициент вариации (KV) интенсивности флуоресценции на 540 нм составил 2.7 %.
Конкурентная иммунная реакция на сенсорных элементах в статическом режиме осуществлялась в стеклянных бюксах. Для этого сенсорные элементы помещались в реакционную смесь (300 мкл меченого инсулина и 300 мкл инсулина) на 30 мин при температуре 37 °C. Измерения проводились при С FITC-Ins = 4.6∙10–6 М, для концентраций С Ins = = 4.6∙10–5, 4.6∙10–6, 2.3∙10–6, 1.2∙10–6, 5.7∙10–7, 2.8∙10–7 и 0 М. На рис. 1 приведены зависимости интенсивности флуоресценции (в отраженном свете) на длине волны 528 нм от концентрации инсулина после проведения иммунной реакции (по 3 образцам), измеренные на спектрофлуориметре HITACHI F-4010 (Япония). Коэффициент вариации (KV) не превышает 7 % для λ = 528 нм. Приведенные длины волн соответствуют максимумам полученных спектральных зависимостей. На зависимости (рис. 1) наблюдается монотонный участок в диапазоне концентраций от 5.7∙10–7 до 4.6∙10–6 М, пригодный для проведения анализа. При концентрации аналита, равной концентрации меченого инсулина, интенсивность флуоресценции резко возрастает. Увеличение сигнала при больших концентрациях немеченого инсулина, возможно, связано с увеличением суммарной концентрации и его более плотным размещением на поверхности.
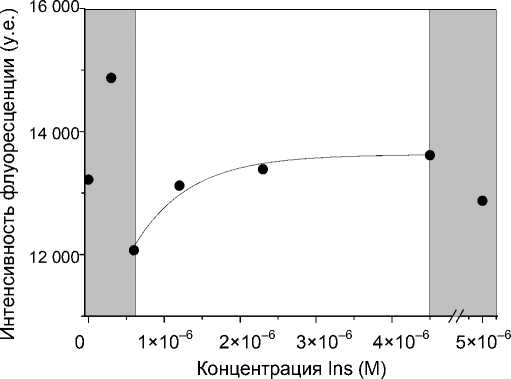
Рис. 2. Зависимость интенсивности флуоресценции от концентрации инсулина в пробе на длине волны 523 нм
Немонотонный участок с экстремумами также наблюдается при низких концентрациях инсулина.
Экспериментальные зависимости можно аппроксимировать функцией
- с/ F = F + A (1 - e/c0), где (для длины волны 512 нм) F0 = 249.6 у.е. — интенсивность флуоресценции при отсутствии инсулина в пробе (величина фонового сигнала); С — концентрация аналита; С0 = 10–6 М — характерная концентрация инсулина; А = –125 у.е. — коэффициент, зависящий от аппаратной функции прибора. Коэффициент корреляции между экспериментальными значениями и аппроксимирующей функцией составляет 0.997. При С << С0 зависимость близка к линейной, коэффициент чувствительности равняется A / C0; при С >> С0 происходит насыщение.
На рис. 2 приведена аналогичная зависимость, измеренная на макете детектора. Характер зависимости отличается от полученной на спектро-флуориметре. Вероятно, это связано с глубиной проникновения излучения в ПС (область детектируемого слоя). При малой интенсивности возбуждающего излучения аналитический сигнал регистрируется преимущественно с поверхности сенсорного элемента, в этом случае интенсивность флуоресценции возрастает при уменьшении концентрации аналита, что согласуется с теоретическими предпосылками. При использовании в качестве источника возбуждения флуоресценции лазера детектируется сигнал с более глубоких слоев сенсорного элемента. Величина аналитического сигнала существенно зависит от поглощения и рассеяния меченого и немеченого инсулина в объеме ПС, определяемом в том числе концентрацией аналита. Измерение интенсивности пропускания в проходящем свете позволяет регистрировать интегральный аналитический сигнал на фиксированной толщине сенсорного элемента. Коэффициент вариации аналитического сигнала при детектировании конкурентной реакции по трем измерениям для трех образцов не превышает 2.5 %. В случае проведения реакции только с меченным инсулином KV составляет 6 %.
Зависимость для длины волны 523 нм (рис. 2) также можно аппроксимировать функцией F при F 0 = 10202 у.е., С 0 = 7.25∙10–7 М, А = 3422 у.е. Коэффициент корреляции между экспериментальными значениями и аппроксимацией составляет 0.987. Используя полученные результаты, можно оценить рабочий диапазон определяемых концентраций инсулина на созданных сенсорных элементах, соответствующий монотонному участку зависимости: (2.9∙10–7÷2.3∙10–6) М инсулина в 600 мкл реакционной смеси.
ОБНАРУЖЕНИЕ ИНСУЛИНА
НА МИКРОФЛЮИДНОМ УСТРОЙСТВЕ
Прототипы микрофлюидного устройства для проведения иммунной реакции представляют собой двухуровневую систему подвода / отвода пробы и регентов к интегрированному в устройство
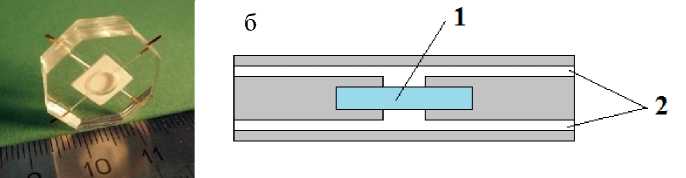
Рис. 3. Изображение прототипа микрофлюидного устройства (а) и его поперечное сечение (б).
1 — сенсорный элемент, 2 — двухуровневая система подвода / отвода пробы и реагентов
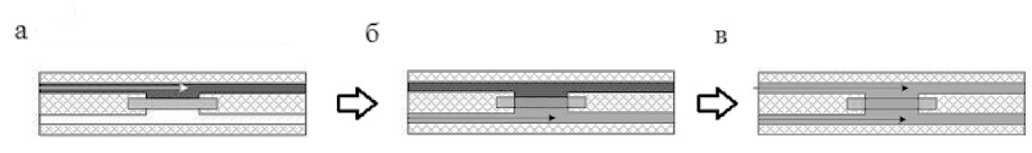
Рис. 4. Схема проведения анализа на МФУ.
а — введение пробы, б — проведение иммунной реакции, в — промывка МФУ
сенсорному элементу на основе пористого стекла (рис. 3) и позволяют проводить иммунный анализ в пробе объемом до 40 мкл. Материалом для МФУ выбран полидиметилсилоксан (Sylgard-184, Dow Corning), поскольку он обладает высоким свето-пропусканием в видимой области спектра и позволяет оперативно создавать прототипы устройств в условиях исследовательской лаборатории. Сенсорный элемент вклеивается в МФУ при помощи более вязкого силастика Т4 (ООО "Пента Север").
Измерения интенсивности флуоресценции от исходных сенсорных элементов в отраженном свете (концентрация IgG для иммобилизации С IgG = 9.2∙10–8 М) показали, что полученные образцы следует разделить на 3 группы по интенсивности флуоресценции на длине волны 524 нм: 8450 ± 125, 9650 ± 140 и 10350 ± 140 у.е.
Концентрация меченого инсулина для проведения иммунной реакции на МФУ составила C FITC-Ins = 4.6∙10–6 М. Концентрация БСА — 25 мг/образец. Измерения проводились при С Ins = 4.6∙10–6, 2.3∙10–6, 1.2∙10–6 и 7.5∙10–7 М.
Поскольку результаты исследования массопе-реноса через пористое стекло показали, что заполнение порового пространства ПС SBS-МАП раствором FITC-Ins происходит примерно за 4 мин, то применялась следующая последовательность операций: верхняя часть устройства заполнялась пробой, а через 5 мин нижняя часть устройства заполнялась буфером (пористая структура уже заполнена пробой) (рис. 4, а). Далее для проведения иммунной реакции МФУ выдерживалось 30 мин в термостате при температуре 37 °C, в течение которых нижняя часть сенсорного элемента промывалась натрий-фосфатным буферным раствором (PBS) при помощи перистальтического насоса (рис. 4, б). После этого обе стороны МФУ промывались буфером (рис. 4, в), а затем проводились оптические измерения. Общее время анализа, включая стадии заполнения, инкубирования и промывки устройства составило 1 ч 40 мин. Детектирование осуществлялось на макете детектора путем измерения интенсивности флуоресценции находящегося в МФУ сенсорного элемента в проходящем свете. Зависимость интенсивности флуоресценции образцов от концентрации инсулина в пробе после проведения иммунной реакции приведена на рис. 5.
Зависимость аппроксимируется функцией F , при этом: F 0 = 16111 у.е., С 0 = 1.25∙10–6 М — характерная концентрация инсулина, А = 8500 у.е. Коэффициент корреляции между экспериментальными значениями и аппроксимирующей функцией составляет 0.9994. Аналогичные зависимости также были получены для концентрации C FITC-Ins = 4.6∙10–6 М по 10 образцам.
Как следует из графиков, увеличение концентрации аналита приводит к повышению интенсивности флуоресценции. Корреляция аппроксимирующей функции и экспериментальных данных для измерений в проходящем свете существенно выше, чем для ранее проведенных измерений на сенсорных элементах в отраженном свете. Это может быть связано с тем, что при детектировании
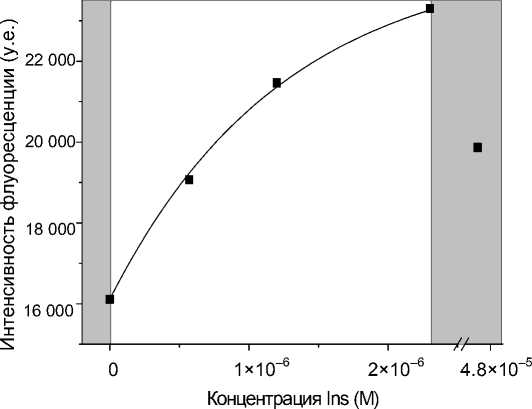
Рис. 5. Градуировочная зависимость при определении инсулина в пробе на МФУ.
C FITC-Ins = 4.6∙10–6 М. Длина волны измерений 528 нм
в проходящем свете исключается влияние концентрации аналита на глубину детектирования, не учтенное в аппроксимирующей функции.
Вышеприведенные результаты продемонстрировали возможность обнаружения инсулина в диапазоне концентраций (2.9∙10–7÷2.3∙10–6) М в 40 мкл реакционной смеси за 1ч 40 мин.
ОСНОВНЫЕ ВЫВОДЫ И РЕЗУЛЬТАТЫ
Разработан, создан и исследован прототип мик-рофлюидного устройства с интегрированным сенсорным элементом на основе натриевоборосили-катного стекла SBS-МАП для иммунного анализа.
Совокупность исследований позволила продемонстрировать возможность обнаружения инсулина в диапазоне концентраций (2.9∙10–7÷2.3∙10–6) М в 600 мкл пробы на сенсорном элементе в статическом режиме и в 40 мкл пробы в МФУ за 1 ч 40 мин.
При проведении анализа на сенсорном элементе и детектировании результатов иммунной реакции на спектрофлуориметре Hitachi-F4010 и макете детектора получены градуировочные зависимости, противоположные друг другу. Выдвинута гипотеза о том, что величина аналитического сигнала определяется глубиной проникновения возбуждающего излучения (зависящей в том числе от концентрации аналита), неоднородностью распределения иммунного комплекса по глубине пористого стекла и областью регистрации сигнала флуоресценции. Таким образом, детектирование результата иммунной реакции на пористом стекле в проходящем свете позволило уменьшить влияние данных факторов на аналитический сигнал.
Работа выполнена при поддержке субсидией молодым ученым, молодым кандидатам наук вузов, отраслевых и академических институтов, расположенных на территории Санкт-Петербурга КНВШ за 2013 г.
Авторы благодарят Цымбалова А.И. за создание мастер-форм для отливки деталей и устройств детектирования и д.ф.-м.н. Буляницу А.Л. за конструктивную критику и терпеливое обсуждение результатов, а также за ряд ценных замечаний и рекомендаций.


