Микрофлюидные аналитические системы (часть 1)
Автор: Беленький Б.Г., Комяк Н.И., Курочкин В.Е., Евстрапов А.А., Суханов В.Л.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Обзоры
Статья в выпуске: 2 т.10, 2000 года.
Бесплатный доступ
Проведен анализ литературных источников по микрофлюидным аналитическим системам - МФАС. Отмечены главные достоинства МФАС, определяющие высокий аналитический потенциал приборов. Рассмотрены физические принципы функционирования МФАС. Приведены основные формулы, позволяющие определить характеристики МФАС: эффективность, геометрическую дисперсию, качество электрофореза. Рассмотрены экстраколоночные эффекты. Обсуждены процессы микрофлюидики, в том числе безнасосной микрофлюидики. Изучены варианты конструкций микрофлюидных чипов и технологии их получения. Рассмотрены миниатюрные системы полного анализа. Определены приоритетные направления развития МФАС. Выявлены наиболее актуальные системы, создание которых является приоритетной задачей развития аналитического приборостроения в России.
Короткий адрес: https://sciup.org/14264123
IDR: 14264123 | УДК: 543
Текст научной статьи Микрофлюидные аналитические системы (часть 1)
1. Микрофлюидные аналитические системы
Современная аналитическая химия развивается в сторону сверхпроизводительного автоматического анализа многокомпонентных проб и супервысокой (в пределе — одномолекулярной) чувствительности. В этом нуждаются современная биотехнология, медицина и фармацевтическая промышленность, последняя — в связи с созданием новых лекарств на основе молекулярной фармакологии и комбинаторной химии. С другой стороны, исследования влияний мутаций генома пациента на действие лекарств (фармакогенетика) требуют развития сверхскоростного генетического анализа (прежде всего тестирования однонуклеотидных мутаций). Все это приводит к беспрецедентному скачку в качестве анализа: скорости, чувствительности и производительности в современной биоаналитической химии [1–3].
Экспоненциальный рост качества анализа в конце 90-х годов определяется применением новых методов сверхпроизводительного и сверхчувствительного анализа с использованием наиболее эффективных из современных аналитических сепарационных технологий: мультикапиллярного электрофореза и его чип-реализации — мультиканальных микрофлюидных аналитических систем МФАС [3] (см. в конце статьи «Перечень условных обозначений и аббревиатур»).
В табл. 1 представлены микроаналитические системы нового поколения — мультисенсоры. Наибольший интерес вызывает развитие и коммерциализация микрофлюидных аналитических систем — МФАС [1–5], являющихся чип-реализацией высокоэффективного капиллярного электрофореза (ВЭКЭ [6]). В основе МФАС лежит микрофлюидика (ламинарное движение жидкости в узких каналах). Пересекающаяся система каналов и реакторов МФАС дополняется элементами лазерной фотоники: лазерами, интегральной оптикой и оптоэлектроникой, новейшими фотоприемными устройствами. Все это развивается на основе миниатюризации и интеграции с использованием современных технологий микроэлектроники, химии полимеров, новых функциональных элементов пробо-подготовки, дериватизации и детектирования. Одна из перспектив развития МФАС видится в создании одноразовых приборов со сменными картриджами, снаряженными реагентами, в том числе на основе бесканальных МФАС.
Главными достоинствами МФАС, определяющими высокий аналитический потенциал этих приборов, являются:
-
1) универсальные аналитические возможности, пришедшие из высокоэффективного капиллярного электрофореза и хроматографии;
-
2) использование технологий биоузнавания (ДНК-гибридизация, иммунное связывание в растворе);
-
3) возможность интеграции многих аналитических компонентов и их дублирование (многоканальные системы) в одном чипе;
-
4) сверхэффективность, скоростной сверхпроизводительный анализ, в первую очередь в секвенировании и генотипировании ДНК (десятки тысяч проб в сутки), суперфракционирование без сорбентов;
-
5) использование микрофлюидики — движения жидкости в узких капиллярах с перемешиванием только за счет диффузии;
-
6) безнасосные подача реагентов и ввод пробы за счет электроосмотического движения растворов;
Табл. 1. Мультисенсоры (сенсор-линейки, чип-линейки)
|
Принцип действия |
Технология изготовления |
Число моно-сенсоров |
Приборная реализация |
Распо-знава-ние |
Детектирование |
Примечание |
|
Проточные МАС. Электрофоретическая чип-линейка |
Классические методы, фотолитография, лазерная аблация, литье полимеров |
До 100 дорожек |
Многоканальные чип-анализаторы |
Топологическое |
Лазер-индуцированная флуоресценция (ЛИФ), хемилюминесценция, амперометрия |
Массовое производство с использованием планарных технологий |
|
Оптоволоконный мультисенсор. Топологическое кодирование |
Фотополимеризация по фотошаблону |
До 500 |
Биосенсоры, хемосенсоры, интроскопиче-скоезондиро-вание |
Топологическое |
ЛИФ-ближнепольные оптоволоконные эффекты |
Полимериза-ционная фиксация на торце оптоволокна |
|
Использование виртуальной линейки микросфер (латексов). Двойное цветокодирова-ние |
Окрашивание латексов, пришивка моносенсоров. Создание магазина аналитических микросфер |
64 (в перспективе до 5000) |
Гибридизация, иммунореакция, биоаф-финное (аллостерическое, энзиматическое) взаимодействие. Распределение по закону случая — виртуальная линейка |
Цветояр-кометри-ческое |
ЛИФ-цвето-яркометрический сортер, оптоволоконный ЛИФ-ПЗС — имидж-анализатор |
Массовое производство. Изготовление и спецификация мультисенсоров из магазина микросфер . Генетические исследования, протеиновый профиль, комбинаторный синтез, High-Throughput Analysis |
|
Геночип (биочип), планарная топология сенсоров, топологическое — х, ( х, г ) — кодирование |
Фотоактиви-рованные, параллельный синтез и пришивка моносенсоров. Адресация моносенсоров или их блоков струйным аппликатором, электропозиционирование |
До 1 млн. |
Гибридизация, иммунореакции, биоаф-финное взаимодействие (аллостерическое, энзиматическое). Материальная линейка — микро-чипы |
Топологическое |
ЛИФ-сканирование, оптоволоконный ЛИФ-ПЗС— имидж-анализатор |
Определение однонуклеотидных мутаций посредством гибридизации , генетические исследования, протеиновый профиль (комбинаторный синтез + High-Throughput Analysis) |
|
Выделение клеток диэлектрофорезом, электролизис, электроактивирование. Гибридизационный анализ на биоэлек-тронных чипах |
Микрофабрикация, проточная камера с электродами для диэлектрофореза клеток и адресации моносенсоров |
До 1 млн. |
Тандем био-электронного чипа с двумерной электроак-тивированной гибридизационной линейкой |
Тополо-гичское, возможно, цветоярко-метрическое |
ЛИФ-сканирование, оптоволоконный ЛИФ-ПЗС— имидж-анализатор |
Экспресс-диагностика бактерий, раковых клеток в крови и других биологических веществ |
-
7) применение новых методов безнасосного движения жидкости путем электрофоретической миграции с контролируемым зарядом, сопряженной с их сорбцией–десорбцией, движения жидкости по гидрофильным дорожкам с возможностью их объединения путем образования мостиков через гидрофобные поверхности;
-
8) универсальность в масштабах сложности: от одноканального до многоканального (свыше 100 каналов) чип-ВЭКЭ (для сверхпроизводительного генотипирования и секвенирования ДНК) в виде лаборатории на чипе;
-
9) возможность альтернативных путей решения аналитических задач, перспектива создания сэндвич-сенсоров одноразового пользования;
-
10) заимствованные из микроэлектроники высокопроизводительные автоматизированные технологии разработки и изготовления МФАС (компьютерное проектирование, фотолитография, глубокая рентгеновская литография, микролитье и другие технологии изготовления пластиковых чипов), возможность неограниченного масштабирования производства на единой технологической основе, обеспечивающая быстрый переход от разработки к массовому выпуску специализированных приборов МФАС для конкретных целей;
-
11) беспрецедентные возможности усовершенствования иммуноанализа за счет МФАС-ЛИФ-реализации капиллярного иммуноэлектрофореза, позволяющие детектировать одномолекулярную иммунореакцию и повышать производительность иммуноанализа до сотен тысяч определений в сутки.
Микрофлюидные аналитические системы — МФАС — известны и под другими названиями, в которые авторы зачастую вкладывают разный смысл (см. табл. 2). Это новое поле аналитической техники бурно развивается, многие компании проявляют значительный интерес к развитию МФАС. В 1998 г. лидер аналитического приборостроения США компания Hewlett Packard и специализирующаяся в области МФАС биоинформационная компания Caliper Technologies подписали соглашение о совместном развитии микрофлюидных технологий для аналитических приборов и информационных систем [4]. Эти компании в первый год проекта инвестируют в эту технологию $ 20 млн и ежегодно по $ 20 млн в ближайшие четыре года. Мировой рынок МФАС XXI века определяется в $ 1 млрд в год. Полагают, что при развитии технологий МФАС, эти приборы станут значительно дешевле других аналогичных приборов, причем массовая продажа этих недорогих приборов будет приносить значительный доход.
МФАС обладают высоким потенциалом интеграции химии с механикой, электроникой и оптикой, что позволяет создавать аналитические системы на очень малой площади. В связи с этим прогнозируется [4] появление приборов карманных размеров, производящих множество параллельных аналитических операций с разделением компонентов во внелабораторных условиях (полевые исследования, экстренная помощь у постели больного, автоматический производственный контроль).
Поскольку технологии МФАС революционизируют и ускоряют процесс открытия лекарств на основе комбинаторных методов, фармацевтика в настоящее время является главным стимулятором развития МФАС [4]. Интерес фармацевтической индустрии к этой технологии связан с малым размером пробы и возможностью высокопроизводительного скрининга комбинаторных библиотек за счет высокой производительности. Среди преимуществ МФАС следует также отметить простоту их изготовления и функционирования, низкую стоимость эксплуатации. Повторим, реальный эффект микрофабрикации заключается в способности производить огромное количество химических анализов на единичном субстрате (чипе), что обеспечивает колоссальный выигрыш в производительности, особенно полезный для диагностики, базирующейся на генотипировании ДНК при фармацевтическом и медицинском применении.
В список потенциальных преимуществ МФАС один из наиболее продвинутых исследователей в этой области J. Michael Ramsey [4] включает увеличение точности и воспроизводимости анализа, возможность автоматизации, уменьшение отходов, одноразовое использование чипов. Этот автор полагает, что в будущем МФАС может быть использован не только для анализа продуктов комбинаторного синтеза, но и продуктов синтетических технологий более низкого уровня, обслуживания мониторинга окружающей среды, сложного биологического анализа. По его мнению, большая часть исследовательской активности по созданию МФАС концентрируется в следующих направлениях по созданию:
— аналитических систем секвенирования в проекте «Геном человека» и других геномных проектах;
— систем высокопроизводительного скрининга лекарств;
— систем тестирования химического и биологического оружия;
— устройств диагностики болезней;
— реакторов для синтеза сильно токсичных веществ (возможно, радиоактивных соединений).
2. Биочипы, микрофлюидные аналитические системы «lab-on-a-chip»
Главная цель миниатюризации МФАС — экстраординарное улучшение их качества независимо от размеров приборов, в которые они встраиваются, будь это высокоэффективный жидкостный хроматограф или масс-спектрометр.
Табл. 2. Принятые в литературе названия МФАС и их интерпретация
|
№ |
Название |
Авторы |
Что подразумевают авторы |
|
1 |
«lab-on-a-chip» |
Тed Harrison , профессор химии University of Alberta, Edmonton |
Канализированное планарное микрофлюидное устройство, на котором или в котором совершается значительное число химических процессов на пути от реактантов к продукту или от пробы к анализу |
|
2 |
«lab-on-a-chip» |
Michael Ramsey , корпоративный член и лидер группы «Oаk Ridge National Laboratory», Ridge, Tenn |
Последовательность: пробоподготовка → сепарация (ВЭКЭ) → детектирование и → обработка информации, где каждый этап реализуется в специальном микро- (макро-) модуле или интегрируется в единый канализированный микрочип — устройство, в котором проба и реагенты движутся и смешиваются для подготовки к анализу и производится непосредственный анализ путем ВЭКЭ |
|
3 |
«lab-on-a-chip» |
Andreas Manz , профессор аналитической химии Imperial Сollege , London |
Предпочитает не пользоваться этим термином, считает его гиперболизированным и ненаучным |
|
4 |
( µ -ТAS) — миниатю-ризован-ные системы полного анализа |
Andreas Manz , профессор аналитической химии Imperial Сollege , London |
ТAS — преобразует химическое свойство (сигнал) в оптический или электрохимический сигнал (1-й переход) , который, в свою очередь, преобразуется в электрический сигнал (2-й переход). 1-й переход может осуществляться протеин-инженерным биосенсором через стадию преобразования химического сигнала в молекулярно-конформационный сигнал (1а переход ) , далее преобразуемый в оптический или электрохимический сигналы (1 б переход ) . Выполняют подобные преобразования в микрометровой шкале на чипе сантиметровых размеров из стекла, кремния или пластика |
|
5 |
Биочип (ге-ночип) |
Michael Ramsey и Тed Harrison |
В отличие от МФАС — микролинейка ДНК, состоящая из сотен (тысяч) отдельных сенсорных элементов (олигонуклеотидов), топология которых известна. Представляет мультисенсор, который использует контактное (статическое, а иногда и кинетическое) биоузнавание фрагментов ДНК-мишени на основе гибридизации и по опознанным фрагментам, используя комбинаторные методы, определяет химическую структуру ДНК, точнее мутационный портрет носителя генома |
Для эффективности МФАС существенно лишь уменьшение пути, по которому движутся реагенты, при сохранении макроскопических, физических и химических законов, на которых основан анализ. Созданию эффективных МФАС способствует развитие новых технических средств, ведущих к миниатюризации и удешевлению элементов и модулей систем [5, 6]. Синонимами МФАС служат понятия µ -TAS и «lab-on-a-chip» (табл. 2). Однако Andreas Manz, профессор аналитической химии (Imperial Сollege, London), один из основоположников и крупный авторитет в области МФАС, предпочитает не пользоваться термином «lab-on-a-chip», полагая, что этот термин гиперболизирован и не является научным [4]. Ted Harrison, (University of Alberta, Edmonton) и Michael Ramsey, которых также можно отнести к основоположникам МФАС, определяют «lab-on-a-chip»
как «планарное устройство, на котором или в котором совершается значительное число химических процессов на пути от реактанта к продукту или от пробы к анализу» [4]. Эти авторы подчеркивают разницу между микрофлюидным устройством — чип-реализацией ВЭКЭ (в котором жидкость с пробой движется, а ее компоненты сепарируются в микроканалах) и другим видом мультисенсоров — высокопроизводительными сверхчувствительными аналитическими микросистемами, также созданными на основе технологий молекулярной биологии и микроэлектроники. По определению Ted Harrison и Michael Ramsey: «биочип (геночип) — это микролинейка олигонуклеотидов, из которых фабрикуется специализированный (подготовленный для высокоселективного анализа) мультисенсор с контактным (статическим, а иногда и кинетическим) биоузнаванием на основе гибридизации с мишенью ДНК». По этим фрагментам, с использованием комбинаторных методов, определяются комплиментарные фрагменты химической структуры ДНК, в совокупности представляющие мутационный портрет исследуемого объекта. Биочипы содержат от нескольких сотен единиц до десятков–сотен тысяч олигонуклеотидов. Они используются для определения вариаций ДНК и РНК и в настоящее время служат стандартным инструментом исследований в области молекулярной биологии, в клинической диагностике [7, 8], эпидемиологической и криминалистической экспертизе. Подобные биочипы производятся коммерческими компаниями, например Affimetrix (Santa Clara, Calif., USA).
2 D d 2 d 2
H ( u ) = —m + f m ( k ) -^ u + fs ( k ) -f u , u Dm Ds
1. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ МФАС
Размеры каналов МФАС. Эффективность
Глубина капиллярных каналов определяет эффективность капиллярных сепарационных систем. Это следует из уравнения Голея, описывающего скоростную зависимость высоты теоретической тарелки (т.т.) H ( u ) для открытых капилляров [9],
где D m , D s — коэффициенты диффузии в подвижной и стационарной фазах, d c — глубина канала, d f — толщина стационарной фазы, u — линейная скорость подвижной фазы, f m ( k ) и f s ( k ) — соответствующие функции фактора емкости вещества k в подвижной и стационарной фазах.
Изображенная на рис. 1 скоростная зависимость высоты теоретической тарелки H ( u ) показывает, что с уменьшением глубины канала минимум зависимости H ( u ) смещается в сторону более высоких линейных скоростей и меньших размеров канала, иными словами, уменьшение глубины канала позволяет при сохранении эффективности увеличивать скорость анализа.
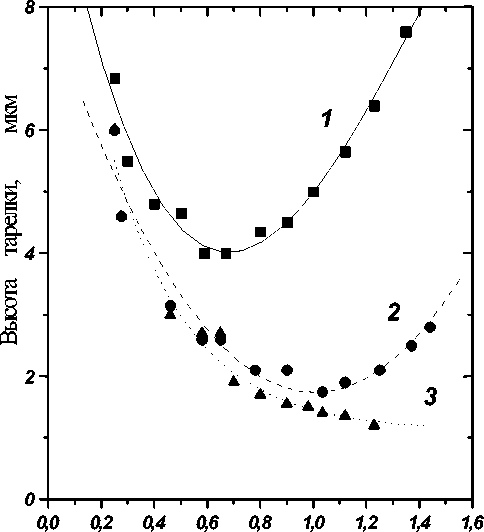
Скорость потока, мм /сек
Рис. 1. Зависимость ВЭТТ от линейной скорости электрохроматографии в открытых капиллярах с ОДС на чипах с глубиной каналов: (1) — 8,7 мкм, (2) — 4,7 мкм, (3) — 2,9 мкм. 10 мМ боратный буфер, рН 8,4 с 30 % ацетонитрила. Проба: кумарин С 460
Геометрическая дисперсия
В МФАС с высокой пространственной плотностью капилляров существенную роль в размывании играют боковые вариации скорости миграции и силы поля. Эта так называемая геометрическая дисперсия, пропорциональная отношению времени поперечной диффузии аналита ко времени продвижения, в течение которого совершается поворот его зоны. Последнее уменьшает сепарационную эффективность по сравнению с прямыми каналами такой же длины, особенно для молекул с малым коэффициентом диффузии. Дисперсия при движении аналита в искривленных каналах, o turn , описывается выражением [10]:
^ turn
A l
X
2 fW 1 - exp — t D
X
\ 12
,
где A l — различие путей аналита у наружной и внутренней стенок изогнутого капилляра, X — постоянная, определяемая формой входной функции; f — угол поворота в радианах; w — ширина верхнего основания трапеции сегмента; t D — время поперечной диффузии аналита; t t — время движения зоны аналита в искривленном участке капилляра.
Отношение величин ( t D / t t ) определяет геометрическую дисперсию в искривленных капиллярах.
Качество электрофореза
Эффективность разделения при одинаковых капиллярах и сепарационных условиях определяется напряженностью электрического поля ( E sep ), как это следует из уравнения (3), полученного в предположении постоянства вкладов размера зоны
пробы, геометрии капилляров и размера окна детектора в высоту т.т. Н [3, 11]:
l n l det 2 D m П (Sc ) 2
H =--1---1---1--.
161 161 uE 12L sep sep ^^ sep sep
Здесь l inj — длина зоны пробы, l det — размер окна детектора, L sep — длина разделительного канала, D m — коэффициент диффузии, E sep — напряженность электрического поля, ^ — электрофоретическая подвижность, n — число поворотов, Sc — разность длины линии по внешнему и внутреннему контуру капилляра на изгибе.
Теоретическая величина H при напряженности 1200 В/см составляет 1 мкм, вклад геометрии капилляра оценивается в 0,55 мкм (т. е. свыше 50 %) [11].
В работе [5] показано, что при ВЭКЭ увеличение E sep ведет к повышению эффективности сепарации N ( ~ Esep ,) улучшению разрешения пиков Rs ( ~ E sep 1/ 2), росту производительности N / 1 ( ~ Esep 2) и уменьшению времени анализа t ( ~ 1/ Esep ).
Экстраколоночные эффекты: дополнительное размывание при вводе пробы
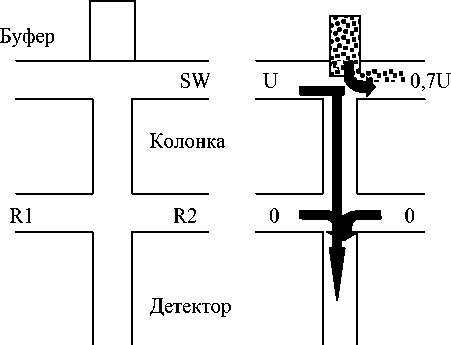
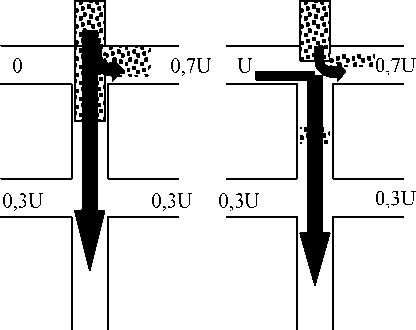
Важнейший фактор повышения эффективности сепарации связан с минимизацией объема пробы. Последнее достигается при использовании таких технологий, как стэкинг (электрокинетическое сжатие зоны при вводе пробы), запирающий потенциал, точечный ввод [11]. Рис. 2 иллюстри- рует принцип запирающего потенциала. Эта технология позволяет получать воспроизводимую зону пробы без визуального контроля и тем самым удобна для автоматизации. Дозирование осуществляется при постоянном потоке пробы через инжекционный крест, проба вводится при резком выключении запирающего потенциала. При этом поток отклоняется на короткое время, и проба в минимальном объеме попадает в сепарационный канал. После этого переключением потенциалов поток восстанавливают. При точечном вводе образец движется через инжекционный крест перпендикулярно разделительному каналу, и в момент ввода, при включении высокого напряжения на линии буфер – слив, узкая зона пробы направляется из пересечения каналов в сепарационный канал (рис. 3).
Система двойного Т-образного инжектора (рис. 4) [12] позволяет вводить очень малые объемы пробы (50–500 пл). Ширина каналов и симметрия инжектора имеют первостепенное значение для хорошей воспроизводимости. Отталкивание избытка пробы в боковые каналы эффективно только при низком гидравлическом сопротивлении потоку в боковых каналах.
Различия ионной силы буфера и пробы снижают воспроизводимость ввода пробы как по форме, так и по размеру зоны (вариации величин от 1,5 до 10 раз). Точное регулирование приложенных к терминалам напряжений помогает до некоторой степени сохранять форму пробы, хотя вариации могут достигать ~30 %. Поэтому применение стэ-кинга в МФАС требует осторожности.
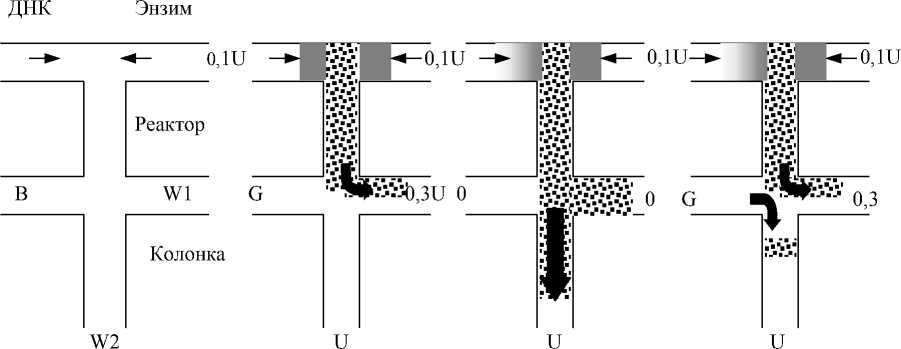
A B C
Рис. 2. Чип-анализатор с предколоночным реактором. Схема реактора, инжекционного креста и системы предколоночной дериватизации. Стадии анализа: А — ввод пробы в реакционную камеру, В — инжекция продукта реакции в сепарационную колонку, С — сепарация. Стрелки показывают движение анионов. G — заземление, В — буфер, W — слив
Проба
0,9U
W2
G
0,9U 0,9U
G G
A B C
Рис. 3. Чип-анализатор с постколоночным реактором для определения миоглобина в человеческой сыворотке. Схема инжекционного креста, сепарационной колонки и системы постколоночной дериватизации для анализа миоглобина: А — ввод пробы, В — инжекция, С — сепарация. Стрелки показывают миграцию катионов. R1 — люминол, R2 — H 2 O 2 , W — слив буфера, SW — слив пробы
Буфер Образец
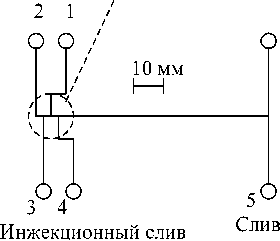
Рис. 4. Топология стеклянного чипа для ВЭКЭ [12, 20]
Сравнение метода запирающего потенциала в сочетании со стэкингом и точечного ввода показывает, что последний увеличивает эффективность разделения на 25–30 %. Однако стэкинг имеет преимущество (в 10 раз) в минимальном пределе детектирования.
-
2. ДЕТЕКТИРОВАНИЕ В МФАС
В МФАС могут применяться те же системы детектирования, что и в ВЭКЭ [5], но можно достичь большего эффекта, используя такие особенности МФАС, как планарность и неограниченные возможности в архитектуре чипа.
Так, например, получили широкое распространение высокочувствительные детекторы, регистрирующие хемилюминесценцию [13, 14]. В работе [14] описан хемилюминесцентный детектор с микрока-нальным стеклянным чипом, имеющим глубину каналов 10 мкм и снабженным алюминиевым зеркалом для увеличения сбора светового потока хемилюминесценции. Концентрационная чувствительность при детектировании пробы объемом в 1 нл составила 35 нМ (при отношении сигнал/шум = 3).
Огромные перспективы сверхчувствительного анализа в МФАС открывает одномолекулярное ЛИФ-детектирование с возбуждением в ближней ИК-области спектра. Выбор этого спектрального диапазона позволяет исключить фоновую флуоресценцию оптических сред и примесей в растворителях [15].
Лазер-индуцированное флуоресцентное детектирование одиночных молекул
Общая эффективность измерения E m определяется вероятностью детектирования молекулы аналита в пробе при соотношении уровня сигнала с уровнем фонового шума в области наблюдения 5 / N = 3 - 6:
E m = E t • E p • E d , (4)
где E d — эффективность детектирования вспышек флуоресценции в детектируемом объеме; ET — эффективность переноса пробы из точки ввода в область детектирования; E P =( E s - E t ) — пространственно-временная эффективность детектирования ( E s характеризует пространственную, а E t — временную эффективности); E s — коэффициент потери аналита, не попавшего в область засветки лазером и (или) в наблюдаемую детектором область.
Для непрерывного лазера или пульсирующего источника, частота которого обеспечивает заданное число встреч фотона лазера с флуорофором при его прохождении через зону наблюдения, E t ~ 1. Формула (4) позволяет сформулировать следующие условия ЛИФ-детектирования одной молекулы ( E m = 1) [15]:
-
— устранение фоновой флуоресценции (оптики, растворителя, примесей, стенок капилляра) путем использования лазеров ближней ИК-области спектра (в настоящее время синтезировано значительное число флуоресцентных меток для ЛИФ-анализа ДНК, белков и других веществ, возбуждаемых в ближней ИК области спектра [16-18]);
-
— полное или максимально возможное устранение влияния фонового рассеяния света лазера в детектируемом объеме на регистрируемый сигнал за счет применения сверхплотных (содержащих пары металлов) светофильтров и узкополосных одночастотных лазеров;
-
— полное освещение излучением лазера всего детектируемого объема ( E d = 1);
-
— использование лазера мощностью свыше 100 мВт, обеспечивающего получение более 5 флуоресцентных вспышек у одной молекулы за время прохождения области детектирования;
-
3. ЭКСТРАКОЛОНОЧНЫЕ ЭФФЕКТЫ: ДОПОЛНИТЕЛЬНОЕ РАЗМЫВАНИЕ ПРИ ДЕТЕКТИРОВАНИИ
-
4. КОНСТРУКЦИИ МИКРОФЛЮИДНЫХ ЧИПОВ. ИЗГОТОВЛЕНИЕ МФАС
— статистическая обработка сигнала для достоверного выделения фотонов флуоресценции аналита.
С ПОСТКОЛОНОЧНОЙ ДЕРИВАТИЗАЦИЕЙ
Организация постколоночных реакций на чипах является одним из основных направлений раз- работки архитектуры многофункциональных МФАС. В отличие от хроматографии, где процесс организован так, что компоненты аналита поступают в постколоночный реактор после завершения разделения, при электрофорезе, благодаря наличию градиента напряженности электрического поля в постколоночном реакторе, сепарация компонентов пробы происходит во время реакции. В результате постколоночная дериватизация в МФАС должна быть быстрой с эффективным перемешиванием компонентов, чтобы избежать уширения зон дериватизованных компонентов пробы из-за изменения их электрофоретической подвижности.
В работе [13] на примере двух вариантов реакторов с различной геометрией смесительной камеры изучалось влияние геометрии постколоночных реакторов на эффективность анализа. Было отмечено, что некоторые конструкции постколоночных реакторов снижают эффективность разделения до нескольких тысяч теоретических тарелок. Показано, что при использовании Т-образной камеры эффективность составляла 2000-4О00 т.т. в условиях, когда должно быть более 50 000 тарелок. Причиной этого служило вытягивание реагента по течению из бокового канала. Поэтому реагент, чтобы полностью перемешаться с зоной аналита, должен диффундировать поперек смесительного канала. Чтобы избежать этого, предлагались конструкции, где зоны реагирующих веществ встречаются «головами», занимая примерно половину канала, и после этого подвергаются диффузионному перемешиванию. Эффективность перемешивания определялась шириной каналов, углом их пересечения, химическими особенностями компонентов, поскольку даже небольшое различие рН реагентов и аналита проявляется в непредсказуемом течении реагирующей смеси.
Топология МФАС представляет сочетание каналов, микрореакторов, устройства ввода пробы и делителей потоков (рис. 2-4). В МФАС можно выделить две конструктивно обособленные системы:
— пробоподготовки и дериватизации, подобные ПИА, и
— систему сепарации и детектирования.
Обе системы нуждаются в оптимизации, причем критерии оптимизации могут различаться. Для системы пробоподготовки и дериватизации оптимально использование электроосмотического транспорта (ЭО). Как следует из табл. 3 [11], наиболее эффективным сепарационным процессом в МФАС является электрофорез (ЭФ). Приборная часть электрофореза обладает простой конструкцией, относительно большим детектируемым объемом и большой длиной оптического пути, которые определяют низкую предельно обнаруживаемую
Табл. 3. Рассчитанные параметры капиллярного электрофореза (КЭ), жидкостной хроматографии (КЖХ) и суперкритической флюидной хроматографии (КСФХ) при одинаковом качестве сепарации (эффективность N = 100 000 т.т., время анализа t = 1 мин, фактор емкости к’ = 5) [11]
|
Параметр |
КЭ (КЭКХ) |
КЖХ |
КСФХ |
|
Диаметр капилляра, d c (мкм) |
24 |
2,8 |
6,9 |
|
Длина капилляра, L (см) |
6,5 |
8,1 |
20 |
|
Давление, Р (атм) |
26 |
1,4 |
|
|
Напряжение, U (кВ) |
5,8 |
||
|
Пиковая емкость (количество пиков на колонку) |
180 |
220 |
220 |
|
σ х /d c |
~ 10 |
~ 200 |
~ 200 |
|
Требуемый объем детектирования, ~ o v /2 |
~ 47 |
~ 1,6 |
~ 26 |
|
Оптическая длина детектирования, d c (мкм) |
24 |
2,8 |
6,9 |
|
Сложность конструкции МАС |
* |
**** |
***** |
Примечание. Количество знаков * в графе символизирует относительную сложность конструкции
Табл. 4. Миниатюризация капиллярных аналитических систем. Факторы пропорциональности для некоторых параметров транспортных систем характеристической длине ( d) [11]
|
Параметр |
Аналитические системы |
|
|
Постоянного времени |
Диффузионноконтролируемые |
|
|
Время, t |
const |
d2 |
|
Линейная скорость, v |
d |
1/d |
|
Объемная скорость, F |
d3 |
d |
|
Давление, Р |
const |
1/d2 |
|
Напряжение, U |
d 2 |
const |
|
Напряженность электрического поля, U/L |
d |
1/d |
|
Расход реагентов |
*** |
* |
|
Чувствительность детектирования, (~ F) |
d (фотометрия) d3 (флуориметрия) |
|
|
Сложность конструкции |
* |
** |
Примечание. Количество знаков * в графе символизирует относительное количество свойства
концентрацию, а главное, резко (пропорционально ~ dc2 ) сокращают время анализа.
Миниатюризация влияет на качество капиллярных аналитических систем — постоянную времени (определяемую кинетическими характеристиками реагирующих систем, подобно ПИА) и диффузионноконтролируемых ВЭКЭ, КЖХ, и суперкритической флюидной хроматографии КСФХ. Результаты расчета факторов пропорциональности характеристической длине d (в нашем случае диаметру капилляра — dc или размеру частицы сорбента — dp) для этих систем приведены в табл. 4. Из таблицы следует, что в системах постоянного времени уменьшение dc резко снижает расход реагентов (~ dc3) и в той же степени уменьшает чувствительность анализа. Последний феномен выражен в значительно большей степени, чем уменьшение расхода реагентов, и определяет качест- во ПИА. Что касается диффузионно-контролируемых сепарационных систем, то здесь уменьшение dc ведет к менее значительному снижению расхода растворителей (и реагентов), в меньшей степени снижает чувствительность анализа, зато резко уменьшает его продолжительность.
Таким образом, миниатюризация значительно эффективнее повышает качество системы в случае диффузионно-зависимой сепарации, чем в системах постоянного времени. Оптимальный вариант МФАС включает ЭО для движения реагентов и пробы, ЭФ для сепарационной системы.
Это решение оптимально как с позиции аналитического качества МФАС, так и с позиции простоты, а следовательно, дешевизны аналитического прибора, повышения его надежности, воспроизводимости измерений и возможности сертификации.
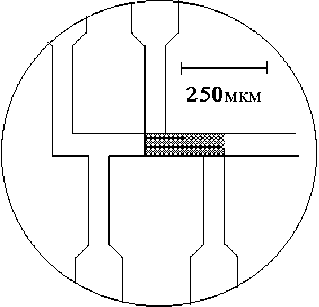
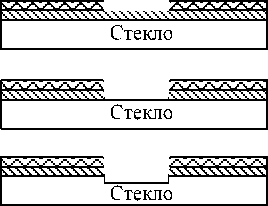
Микрофлюидные чипы представляют собой канализированные (длиной от 2–3 до 5–6 см) пластины из кремния, стекла, кварца или пластика с травлеными, выплавленными или тиснеными камерами
Cr & AU
Фоторезист

Стекло
(a)

(c)
(d)
(e)

(f)
(g)

Рис. 5. Изготовление инжектора и колонок ВЭКЭ на стеклянном чипе [19]. 1. Стадии фотолитографии: а) защита стеклянной пластины слоем Cr, Au, покрытие фоторезистом; b) экспонирование образца через шаблон; с) гидролиз экспонированного фоторезиста, образование окна; d) травление металла через окно в фоторезисте; e) травление стекла через окно в металле; f) получение канализированной пластинки; g) образование чипа путем соединения пластинки с покровным стеклом. 2. Вид поперечного сечения канала микрочипа. Светлые области — возможные нарушения профиля канала
и каналами, глубина которых менее 30 мкм. Материалы для изготовления чипов (корпусов МФАС) имеют свои особенности: кварц является хорошим диэлектриком, прозрачным в УФ-области, а полимеры — наиболее дешевой основой для массовой продукции. Использование кремния ограничено его невысоким напряжением пробоя. В размерах гидравлический чип МФАС может быть больше микроэлектронного чипа, поскольку анализируемая молекула много больше электрона. Однако нецелесообразно в целях сохранения чувствительности проводить уменьшение размеров микрофлюидного чипа более чем до 1 мм2.
В настоящее время возможна инжекция пробы объемом менее 1 пЛ. Для достижения полной эффективности электрофореза такой пробы требуются каналы длиной 10–50 мм [4]. Если для синтетических работ критично поперечное сечение каналов, определяющее производительность за единицу времени, то для высокочувствительного анализа предел детектирования определяет наименьший размер пробы. Ключевой концепцией миниатюризации является оптимизация массопереноса, термического транспорта и возможность увеличения (оптимизации) плотности физических и химических процессов.
Кремниевые и стеклянные чипы обычно изготовляются стандартными методами фотолитографии и травления, заимствованными из микроэлектроники (рис. 5). Для изготовления полимерных чипов используются горячее тиснение, инжекционное литье, лазерная аблация (испарение материала), а также глубокая рентгеновская литография (LIGA-технологии, обеспечивающие изготовление форм для литья полимеров). В качестве чипов также применяются липкие к стеклянной подложке обработанные плазмой канализированные пластины из силиконового эластомера. Чип герметизируется, снабжается токоподводящими электродами, необходимым детектором (оптическим или электрохимическим), высоковольтным источником напряжения и электроникой (микропроцессорным устройством). Технологиями микроэлектроники можно изготовить разнообразные микрокомпоненты МФАС: электрофоретические и хроматографические колонки [15], клапаны, реакторы, микронасосы, т.е. полностью изготовить микрохроматограф, но гораздо эффективнее использовать системы, у которых в качестве побудителя движения реагентов и пробы используется ЭФ и ЭО. В работе [4] отмечается, что изготовление чипов преимущественно ориентируется на развитие пластиковых технологий. Это более простые и дешевые технологии, требующие меньшей точности. Кроме того, пластмассовые материалы имеют хорошую прозрачность в видимой и ближней ИК-области. Очевидны также преимущества использования пластиковых чипов для анализа биополимеров.
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ И АББРЕВИАТУР
МФАС — микрофлюидные аналитические системы, ВЭКЭ — высокоэффективный капиллярный электрофорез,
ЛИФ — лазер-индуцированная флуоресценция, ПИА — проточно-инжекционный анализ, т.т. — теоретическая тарелка,
ЭО — электроосмос,
ЭФ — электрофорез,
ДЭФ — диэлектрофорез,
ПЦР — полимерная цепная реакция,
ПАВ — поверхностно-активные вещества,
МАС — микроаналитическая система.
Список литературы Микрофлюидные аналитические системы (часть 1)
- Manz A., Harrison D.J.,Verpoorte E., Wid-mer H.M.//Advances in Chromatography/Eds. Brown P.R., Grushka E. York: Marcel Dekker, 1993. P. 1-66.
- Беленький Б.Г., Зимина Т.М., Комяк Н.И.//Заводская лаборатория. 1997. Т. 63, № 7. С. 1-11.
- Беленький Б.Г., Зимина Т.М.//Научное приборостроение. 1999. Т. 9, № 3. С. 77-92.
- Freemantle M.//Chemical & Engineering news. 1999. February 22. P. 27-36.
- Lab-on-a-chip: the Revolution in Portable Instrumentation (Technical Insights)/Eds. Englewood. New York: John Wiley & Sons. (2nd Ed.).
- Беленький Б.Г.//Заводская лаборатория. 1993. Т. 59, № 12. С.1-13.
- Fodor S., Read J.L., Pirring M.C.//Science. 1991. V. 251. P.767-773.
- Hacia J.C., Makalovski W., Edgemon K.//Nature (Genetics). 1998. P. 155-158.
- Kutter J., Jacobson S.C., Matsumara N.//Anal. Chem. 1998. V. 70. P. 3291-3297.
- Culbertson Сh.T., Jacobson S.C., Ramsey J.M.//Anal. Chem. 1998. V. 70. P. 3781-3789.
- Jacobson S.C., Ramsey J.M.//Electrophoresis. 1995. V. 16. P. 481-486.
- Effenhauser С.S., Manz A., Widmer H.M.//Anal. Chem., 1993. V. 65. P. 2637-2642.
- Schultz-Lockyear L.L., Colyer C.L., Fan Z.H.//Electrophoresis. 1999. V. 20. P. 529-538.
- Regnier F.E., He B., Lin Sh., Busse J.//TIBTECH. 1999. V. 17, N 3. P. 101-106.
- Lee Y.-H., Maus R.G., Smith B.W., Wine-fordner J.D.//Anal. Chem. 1994. V. 66. P. 4142-4149.
- Near-Infrared Dyes for High Technology Application/Eds. Daehne S., Resch-Genger U., Wolbeis O.S. Dordrecht, Boston, London: Kluwer Academic Publischers in cooperation with NATO Scientific Allairs Division, 1999. P. 21-85.
- Syntheses, Optical Properties and Application of Near-Infrared (NIR) Dyes in High Technology Fields//NATO Advanced Research Workshop; Key and Invited lectures. Castle Hotel Trest (Bogemia), Czech Repablic, September 24-27, 1997. L1-L19.
- Williams D.C., Soper S.A.//Anal. Chem. 1995. V. 67. P. 3427-3432.
- Harrison D.J., Fan Z.H.//Anal. Chem. 1994. V. 66. P. 177-184.
- Effenhauser С.S., Manz A., Widmer H.M.//Anal. Chem. 1995. V. 67. P. 2284-2287.


