Микрофлора при послеродовых эндометритах свиноматок на промышленном свиноводческом комплексе
Автор: Шульгин Н.В., Плешакова В.И., Лоренгель Т.И., Жерносенко А.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 7, 2019 года.
Бесплатный доступ
Цель исследований - установить состав микрофлоры цервикально-влагалищного содержимого от свиноматок с клиническим проявлением послеродового эндометрита и ее персистентные свойства. Исследования проводили на крупном промышленном свиноводческом комплексе Омской области. Описаны клинические признаки эндометрита у исследуемых животных, состав микрофлоры цервикально-маточного содержимого от свиноматок с послеродовыми осложнениями (25 %). В первые, вторые и третьи сутки у исследуемых животных наблюдали угнетение, повышение температуры тела до 39,6-40,1 °C,понижение секреции молока, регистрировали выделение слизисто-гнойного экссудата из наружных половых органов, вынужденную позу при мочеиспускании. При бактериологических исследованиях проб с применением общепринятых микробиологических методов изучен состав микрофлоры цервикально-вагинального содержимого от свиноматок с клиническим проявлением послеродового эндометрита, устойчивость выделенных микроорганизмов к химиотерапевтическим препаратам, их персистентные свойства, а именно: проведен анализ антилизоцимной и антиинтерфероновой активности...
Свиньи, свинокомплекс, послеродовой эндометрит, микробиоценоз, биологические свойства микроорганизмов
Короткий адрес: https://sciup.org/140245659
IDR: 140245659 | УДК: 619:579.62:618.14-002:636.4
Текст научной статьи Микрофлора при послеродовых эндометритах свиноматок на промышленном свиноводческом комплексе
Интенсивное развитие свиноводства и его рентабельность напрямую связаны с репродуктивной способностью маточного поголовья и выращиванием полноценного приплода [1, 2].
При современном ведении свиноводства на крупных промышленных свиноводческих комплексах прослеживается значительное ограничение возможности проявления выработанных эволюцией физиологических функций свиноматок, которое способствует снижению репродуктивных качеств, нарушению метаболизма, дисфункции ряда органов и систем из-за перехода с традиционных условий кормления и содержания животных, отсутствия инсоляции и активного моциона. Результатом этого является получение нежизнеспособных или с ослабленным иммунитетом поросят, их низкое качество, отставание в развитии и росте, что сопровождает- ся большими экономическими убытками от выбытия животных [3, 4].
Значительную проблему представляют воспалительные заболевания репродуктивных органов, при которых в зависимости от формы воспалительного процесса преобладают клинически регистрируемые перегулы по циклу или прохолосты, что в целом увеличивает холостой период и снижает интенсивность хозяйственного использования маточного поголовья. Воспалительный процесс в матке способствует формированию неблагоприятных условий для спермиев, кроме того, даже после оплодотворения зародыш, попавший в полость такой матки, гибнет [4, 5].
Ряд исследователей установили, что развитие в матке воспаления во время супоросности, а также глубокие морфологические изменения ее слизистой оболочки (атрофия, дегенерация и др.) способны привести к снижению связи плодной части плаценты с материнской, а через поврежденный плацентарный барьер в ткани и органы плода проникают патогенные микроорганизмы и их токсины [6–9].
Причины послеродовых патологий у свиноматок и факторы, предрасполагающие к их развитию, многообразны, но в итоге сводятся к интеграции трех основных, а именно: уровню резистентности животных, как общей, так и локальной микрофлоре, и функциональному состоянию половых органов животных. Безвы-гульное содержание супоросных маток на свинокомплексах, концентратный тип кормления, зачастую несбалансированный по питательным макро- и микроэлементам рацион провоцировали снижение общей резистентности организма свиноматок, что благоприятствовало проникновению микроорганизмов в половые пути самок и развитию послеродовых осложнений [10, 11].
На крупных свиноводческих комплексах часто регистрируются послеродовые болезни свиноматок, протекающие в виде послеродового гнойно-катарального эндометрита, в развитии которого определяющая роль отводится микробному фактору [11–14].
Ранняя идентификация выделенных культур микроорганизмов позволяет определить этиологию воспалительного процесса, резистентность выделенных микроорганизмов к химиотерапев- тическим веществам и провести адекватное лечение.
Цель исследований: установить состав микрофлоры цервикально-влагалищного содержимого от свиноматок с клиническим проявлением послеродового эндометрита и ее персистентные свойства.
Объекты и методы исследований. Исследования проводили на крупном свиноводческом комплексе Омской области с промышленной мощностью более 50 тысяч голов. При клиническом обследовании свиноматок (n = 60) после турового опороса были обнаружены животные с симптомами послеродового воспаления слизистой оболочки матки (25 %). Образцы для бактериологического исследования были отобраны с учетом общепринятых методов, помещены в пробирки с транспортной средой и доставлены в производственную ветеринарную лабораторию.
Первичный посев изучаемых смывов из транспортной среды осуществляли на мясопептонный бульон (МПБ), мясо-пептонный агар (МПА), а также кровяной агар (КА). Посевы инкубировали в аэробных условиях при 37 °C в течение 24 ч.
В процессе выделения и культивирования микроорганизмов на питательных средах изучали их культурально-морфологические свойства.
В зависимости от морфологических и культуральных особенностей выделенные культуры пересевали на питательные среды: Эндо, желточно-солевой агар (ЖСА), МПБ с содержанием 6,5 % NaCl для дальнейшей идентификации. Аналогизм о родовой и видовой принадлежности отобранных микроорганизмов проводили по результатам микроскопического, бактериологического и биохимического анализов, используя «Определитель бактерий Берджи» (1997) и «Определитель зоопатогенных микроорганизмов» (Сидоров М.А. и др., 1995).
Изучение резистентности выделенных микроорганизмов выполняли, руководствуясь инструкцией по использованию дисков для определения чувствительности к антибиотикам, утвержденной Управлением по внедрению новых лекарственных средств и медицинской техники (МЗ СССР 08.07.1986). Для выявления устойчивости стрептококков применяли МПА с добавлением 5 % дефибринированной крови, для других микроорганизмов – среду АГВ (питательная среда для изучения чувствительности к антибиотикам).
Для определения антилизоцимной (АЛА) и антиинтерфероновой активности (АИА) бактерий на физиологическом растворе готовили разведения лизоцима в концентрациях от 1 до 25 мкг/мл и интерферона – 2,5–50 МЕ/мл. Взвесь суточной культуры в физиологическом растворе в концентрации 1,0∙109м.т./мл наносили на поверхность питательной среды, равномерно распределяя по поверхности, подсушивали, а затем выкладывали диски, пропитанные соответствующим реагентом (лизоцимом, интерфероном). За уровень признака принималась максимальная концентрация реагента в диске, вокруг которого не ингибировался рост изучаемой культуры (Методика эколого-гигиенической оценки воды, используемой для поения сельскохозяйственных животных. Благовещенск, 2005).
Полученный в исследованиях цифровой материал обработан статистически, с использованием Micrososft Office Excel на кафедре ветери- нарной микробиологии, инфекционных и инвазионных болезней ИВМиБ Омского ГАУ.
Результаты исследований. Клинический осмотр животных осуществляли в первые, вторые и третьи сутки после опороса. У свиноматок с клиникой послеродового эндометрита (n = 15) наблюдали снижение материнского инстинкта, угнетение, нарушения аппетита или отказ от корма, нередко вынужденную позу при мочеиспускании. Также отмечали повышение температуры тела до 39,6–40,1 °C, уменьшение секреции молока.
У животных с характерными клиническими признаками воспаления матки отмечали выделение слизисто-гнойного экссудата из наружных половых органов. При акушерско-гинекологическом осмотре у некоторых свиноматок наблюдали нарушение целостности слизистой оболочки наружных половых путей (мелкие травмы).
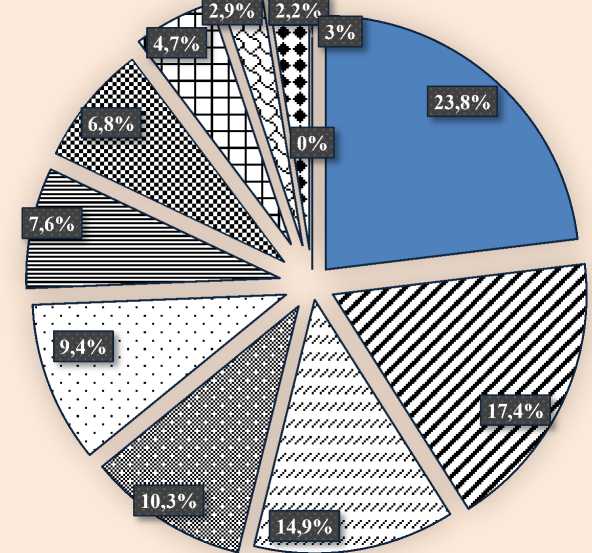
После проведенных бактериологических исследований проб цервикально-влагалищной слизи выделены культуры возбудителей, которые были идентифицированы с применением общепринятых микробиологических методов (рис.).
-
□ Staphylococcus spp.
-
□ Streptococcus spp.
-
□ Escherichia spp.
-
^ Proteus spp.
-
□ Citrobacter spp.
s Enterobacter spp.
0 Corynebacterium spp.
s Neisseria spp.
-
□ Micrococcus spp.
Б Serratia spp.
Микроорганизмы, выделенные при послеродовых эндометритах свиноматок
Зарегистрировано, что у самок с клиниче- видов микроорганизмов, относящихся к разным ским проявлением эндометрита выделяются 10 родам: Staphylococcus spp. (23,8 %), следующи-
ми по частоте выделения являются Streptococcus spp. (17,4 %); из семейства энтеробактерий - Escherichia spp. (14,9 %); Proteus spp. (10,3 %); Citrobacter spp. (9,4 %); Enterobacter spp. (7,6 %) ; а также выделяли Corynebacterium spp. (6,8 %). Другие микроорганизмы ( Neisseria spp., Micrococcus spp., Serratia spp. ) встречались редко и в основном в ассоциациях.
Так, среди микроорганизмов регистрировали следующие ассоциации: Staphylococcus spp. + Streptococcus spp. (34,3 %) пробах; Escherichia spp. + Proteus spp. (21,6 %) ; staphylococcus spp. + Escherichia spp. + Streptococcus spp. + Corynebacterium spp. (16,1 %). Corynebacterium spp. + Staphylococcus spp. + Enterobacter spp. (12,3 %). Также выделяли ассоциации Escherichia spp. + Proteus spp. + Citrobacter spp. + Neisseria spp. (7,4 %); Escherichia spp. + Streptococcus spp. + Micrococcus spp. (4,7 %). Proteus spp. + Serratia spp. (3,2 %).
Анализ устойчивости культур показал, что все идентифицированные микроорганизмы чувствительны к цефоперазону и неопену. Культуры Staphylococcus spp. и Streptococcus spp. оказались сенситивны к офлоксацину, спектаму, левомицетину и цефазолину. Выделенные культуры Staphylococcus spp. резистентны к эритромицину, а Streptococcus spp. - к доксициклину (75 %). Превалирующее количество культур Enterobacter spp. чувствительны к це-фазолину, спектаму и офлоксацину, но устойчивы к доксициклину, стрептомицину и эритромицину. Выделенные микроорганизмы Neisseria spp. и Corynebacterium spp. чувствительны ко всем химиотерапевтическим препаратам, за исключением стрептомицина и доксициклина.
Наибольшую антилизоцимную активность (АЛА) проявляли культуры рода Escherichia spp. и Citrobacter spp. (10,0±0,02 и 7,6±0,1 мкг/мл соответственно). Проявление средней антилизо-цимной активности зарегистрировано у микроорганизмов родов Proteus spp. - 6,8±0,03 мкг/мл и Enterobacter spp. - 5,4±0,1 мкг/мл. Значительно низкий показатель АЛА зафиксировали при изучении культуры Staphylococcus spp. и Corynebacterium spp. (2,9±0,1 и 2,7±0,1 мкг/мл соответственно).
При изучении антиинтерфероновой активности (АИА) у микроорганизмов разных родов, выделенных из цервикально-влагалищной слизи свиноматок при послеродовом эндометрите, установили, что данный признак проявляется реже в сравнении с АЛА микроорганизмов. Наибольшее проявление АИА зафиксировано у культур Proteus spp. и Escherichia spp. (0,42±0,О2 и 0,22±0,1 усл. ед. соответственно). Средние показатели АИА регистрировали у культур Citrobacter spp. и Corynebacterium spp. (0,11±0,04 и 0,8±0,03 усл.ед. соответственно). Самые низкие показатели АИА установлены при изучении культуры Staphylococcus spp. -0,05±0,02 усл.ед.
Выводы
-
1. При клиническом осмотре самок в первые, вторые и третьи сутки после опороса у 25 % опоросившихся свиноматок отмечали характерные признаки эндометритов, в частности выделение экссудата слизисто-гнойного характера, угнетение, снижение материнского инстинкта, плохой аппетит или отказ от корма, повышение температуры тела до 39,6–40,1 °C, снижение секреции молока. При акушерско-гинекологическом обследовании у части свиноматок регистрировали нарушение целостности слизистой оболочки наружных половых путей.
-
2. При проведении бактериологических исследований были выделены микроорганизмы: Staphylococcus spp. (23,8 %); следующими по частоте выделения были Streptococcus spp. (17,4 %). Из семейства энтеробактерий идентифицированы Escherichia spp. (14,9 %); Proteus spp. (10,3 %), Citrobacter spp. (9,4 %); Enterobacter spp. (7,6 %) ; из семейства корине-бактерии - Corynebacterium spp. (6,8 %). Такие микроорганизмы, как Neisseria spp., Micrococcus spp., Serratia spp., встречались почти всегда в ассоциациях.
-
3. Выделены ассоциации микроорганизмов: Staphylococcus spp. + Streptococcus spp. (34,3 %) пробах; Escherichia spp. + Proteus spp. (21,6 %) ; Staphylococcus spp. + Escherichia spp. + Streptococcus spp. + Corynebacterium spp. (16,1 %). Corynebacterium spp. + Staphylococcus spp. + Enterobacter spp. (12,3 %). Также выделяли ассоциации Escherichia spp. + Proteus spp. + Citrobacter spp. + Neisseria spp. (7,4 %); Escherichia spp. + Streptococcus spp. + Micrococcus spp. (4,7 %); Proteus spp. + Serratia spp. (3,2 %).
-
4. Выделенные микроорганизмы чувствительны к неопену и цефоперазону. Staphylococcus spp. и Streptococcus spp. чувствительны к спектаму, офлоксацину, цефазолину и левомицетину. Культуры Staphylococcus spp. проявили устойчивость к эритромицину; Streptococcus spp. в 75 % случаев – к доксициклину. Enterobacter spp. чувствительны к спектаму, цефазолину, гентамицину и офлоксацину, но резистентны к стрептомицину, доксициклину и эритромицину. Neisseria spp. и Corynebacterium spp. чувствительны ко всем химиотерапевтическим препаратам, за исключением стрептомицина и доксициклина.
-
5. Культуры рода Escherichia spp. и Citrobacter spp. (10,0±0,02 и 7,6±0,1 мкг/мл соответственно) показали высокую антилизоцим-ную активность; Proteus spp. – 6,8±0,03 мкг/мл и Enterobacter spp. – 5,4±0,1 мкг/мл – среднюю; Staphylococcus spp. и Corynebacterium spp. (2,9±0,1 и 2,7±0,1 мкг/мл соответственно) – низкую.
-
6. Высокую антиинтерфероновую активность проявили культуры Proteus spp. и Escherichia spp. (0,42±0,02 и 0,22±0,1 усл. ед. соответственно); Citrobacter spp. и Corynebacterium spp. (0,11±0,04 и 0,8±0,03 усл. ед. соответственно) – среднюю; Staphylococcus spp. 0,05±0,02 усл.ед. – низкую.
Список литературы Микрофлора при послеродовых эндометритах свиноматок на промышленном свиноводческом комплексе
- Нарижный А.Г., Джамалдинов А.Ч., Рудь А.И. и др. Воспроизводительная функция свиней в зависимости от моциона // Свиноводство и технология производства свинины. - Белгород, 2016. - С. 133-137.
- Джамалдинов А.Ч., Тихомиров А.И., Нарижный А.Г. Проявление охоты и показатели воспроизводства у свинок в зависимости от срока прихода в охоту // Ветеринарный врач. - 2017. - № 6. - С. 47-51.
- Хохлов А.М., Барановский Д.И. Воспроизводительные качества свиноматок в зависимости от биологических и технологических факторов // Вестн. Брянской гос. с.-х. акад. - 2017. - № 3 (61). - С. 37-41.
- Хлопицкий В.П., Филатов А.В., Ушакова Л.М. и др. Эмбриональная смертность у свиноматок: профилактика и лечение // Свиноводство. - 2018. - № 2. - С. 43-46.
- Бригадиров Ю.Н., Коцарев В.Н., Шапошников И.Т. и др. Иммунобиохимические показатели цервикально-маточной слизи при скрытом эндометрите у свиноматок и их диагностическое значение // Ветеринария. - 2017. - № 2. - С. 39-42.
- Масьянов Ю.Н., Бригадиров Ю.Н., Коцарев В.Н. Диагностика и прогнозирование эндометрита у свиноматок на основе определения иммунного статуса // Ветеринария. - 2015. - № 12. - С. 31-34.
- Бригадиров Ю.Н., Коцарев В.Н., Шапошников И.Т. К вопросу болезней свиней факторно-инфекционной природы // Ветеринарный врач. - 2017. - № 4. - С. 15-19.
- Бахтурин А.Я., Герасимов О.В. К вопросу о синдроме метрита-мастита-агалактии у свиней // Инновационная деятельность в модернизации АПК / КГСХА им. И.И. Иванова. - Курск, 2017. - С. 149-151.
- Бобрик Д.И., Разуванов С.А. Профилактика синдрома метрит-мастит-агалактия путем проведения коррекции родового акта у свиноматок // Ученые записки учреждения образования Витебская ордена знак почета гос. акад. ветеринар. медицины. - 2017. - Т. 53, №1. - С. 28-32.
- Плешакова В.И., Колычев Н.М., Лещева Н.А. и др. Инфекционная патология мочеполовой системы и молочной железы бактериальной этиологии у свиней / Омский гос. аграр. ун-т, Ин-т ветеринар. медицины. - Омск: Изд-во ОмГАУ, 2010. - 380 с.
- Плешакова В.И., Конина А.А., Зигунов В.В. Характеристика микробного пейзажа и гематологической картины крови при эндометритах свиноматок // Современные проблемы эпизоотологии / Сиб. отд. РАСХН. - Новосибирск, 2004. - С. 200-204.
- Филатов А.В., Хлопицкий В.П., Ушакова Л.М. и др. Послеродовой эндометрит и синдром ММА у свиноматок: профилактика и лечение // Свиноводство. - 2018. - № 3. - С. 51-54.
- Хлопицкий В.П., Сидорчук А.А., Шумский Н.И. Комплексный контроль возбудителей инфекций при воспроизводстве свиней // Ветеринария. - 2015. - № 3. - С. 8-12.
- Плешакова В.И., Коган Б.И., Зигунов В.В. и др. Эндометриты свиноматок бактериальной природы // Актуальные вопросы ветеринарной медицины: мат-лы Сиб. междунар. конгресса. - п. Краснообск, 2005. - С. 98-99.


