Микрохирургическая аутотрансплантация малоберцовой кости как оптимальный метод закрытия обширных костных дефектов у детей с нейрофиброматозом
Автор: Голяна С.И., Тихоненко Т.И., Галкина Н.С., Гранкин Д.Ю.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.29, 2023 года.
Бесплатный доступ
Введение. Псевдоартрозы и костные дефекты у детей являются наиболее частым следствием развивающегося нейрофиброматоза I типа - редкого наследственного заболевания. Разрушение костной ткани приводит к выраженным деформациям и нарушениям функции конечностей, а инвалидизация таких пациентов может достигать 70 %. Хирургическое лечение детей с данной патологией является длительным, трудоемким и многоэтапным. Традиционные ортопедические методы замещения дефектов костей часто оказываются неэффективными. Но с развитием микрохирургических методов лечения пациентов стало возможным производить костную пластику кровоснабжаемыми костными аутотрансплантатами.Цель. Доказать эффективность использования микрохирургической аутотрансплантации васкуляризированной малоберцовой кости для пластики костных дефектов у детей с нейрофиброматозом I типа.Материалы и методы. Ретроспективное моноцентровое исследование включало 27 пациентов детского возраста, которым в период с 2011 по 2021 г. была проведена реконструкция костных дефектов васкуляризированным малоберцовым костным аутотрансплантатом. Этиологией костного дефекта у всех пациентов был нейрофиброматоз I-го типа. Трансплантат малоберцовой кости использовали для реконструкции 8 голеней и 19 предплечий. Костные дефекты в среднем составляли 12 см. Медиана наблюдения составила 60 месяцев.Результаты. Выживаемость трансплантата малоберцовой кости составила 100 %. В 5 случаях был получен ложный сустав проксимальной части малоберцовой кости и реципиентной зоны, что потребовало костной пластики гребнем подвздошной кости. Общий показатель хороших и отличных результатов составил 74 %. Среднее время до консолидации составило 3 месяца.Обсуждение. По данным литературы, у детей с нейрофиброматозом I типа использование аутотрансплантации васкуляризированных костных фрагментов довольно ограничено, что связано с повышенным риском возникновения осложнений. Благодаря восстановлению кровотока в пересаженном васкуляризированном аутотрансплантате он сохраняет жизнеспособность и возможность ремоделирования костной ткани.Заключение. Микрохирургическая аутотрансплантация кровоснабжаемого фрагмента малоберцовой кости является эффективным, а иногда и незаменимым методом костной пластики дефектов длинных трубчатых костей у детей на фоне нейрофиброматоза 1 типа. Дефекты костей размерами от 5 и более см являются показанием к применению свободной аутотрансплантации васкуляризированного фрагмента малоберцовой кости. Данный метод, используемый в сочетании с традиционными ортопедическими методами лечения детей, позволяет получать хорошие анатомические и функциональные результаты.
Микрохирургия, аутотрансплантация малоберцовой кости, ложный сустав, дефект кости, нейрофиброматоз
Короткий адрес: https://sciup.org/142239014
IDR: 142239014 | УДК: 616.833-006.38.03-06:616.71-004.8-089.843-053.2 | DOI: 10.18019/1028-4427-2023-29-3-368-375
Текст научной статьи Микрохирургическая аутотрансплантация малоберцовой кости как оптимальный метод закрытия обширных костных дефектов у детей с нейрофиброматозом
Нейрофиброматоз I типа (NF1 или болезнь фон Реклингхаузена) представляет собой мультисистемное аутосомно-доминантное наследственное заболевание, характеризующееся поражением кожи, центральной и периферической нервной системы, глаз, а также костной системы. Данный тип патологии является самым частым наследственным заболеванием из группы факоматозов и характеризуется предрасположенно-
стью к возникновению опухолей периневрия. Частота встречаемости NF1 составляет 1:3000-1:4000 новорожденных [1]. Приблизительно в половине случаев заболевание проявляется минимально. Передача по отцовской линии более характерна, чем по материнской [2]. Помимо нейрофибром и пигментных пятен на коже, у 60,0 % больных NF1 развиваются скелетные аномалии. К ним относятся сколиоз, деформация грудной клетки, псевдоартроз, требующие оперативного лечения и длительной реабилитации. Врожденный псевдоартроз костей голени диагностируется у 5,0 % детей с NF1, составляя 80,0 % всех случаев данной патологии в общей популяции. Сколиоз выявляют у 60 %, остеопороз у 50,0 %, деформацию грудной клетки – у 37,6 %, микрогению – у 53,0 %, увеличенную окружность головы – у 25,0 %, дисплазию крыла клиновидной кости у 12,0 %, асимметрию лица – у 10,0 % больных с NF1 [3]. Кроме того, у данных пациентов определяются изменения в стенках артерий, которые могут привести к стенозу или окклюзии артерий Вил-лизиева круга и близлежащих артерий либо к внутричерепной аневризме. Ген NF1 локализуется на длинном плече 17 хромосомы (17q11.2) и кодирует синтез цитоплазматического белка нейрофибромина, который экспрессируется во многих типах клеток, но преимущественно, в Шванновских клетках и нейронах. Ней-рофибромин действует как супрессор роста опухоли за счет активации Ras-GTPase, которая вызывает подавление клеточной передачи сигналов через путь Ras/ митоген-активируемой протеинкиназы. Ген NF1 демонстрирует широкий диапазон вариабельности экспрессии и полную пенетрантность даже в пределах одной семьи. Несмотря на то, что нейрофиброматоз I типа наследуется по аутосомно-доминантному типу, в 20-50 % случаев развитие заболевания вызвано мутациями denovo [4-6].
Наличие врожденного ложного сустава верхних и нижних конечностей в большинстве случаев связано с NF1, при этом чаще всего поражаются кости голени и предплечья. Согласно систематическому обзору, проведенному Siebelt M. [7], из 84 пациентов с обширными дефектами костей предплечья у 74 % был диагностирован NF1. Однако данный результат может быть заниженным, так как, возможно, не у всех пациентов было проведено соответствующее тестирование на NF1 или результаты тестирования не сообщались. Выявление взаимосвязи врожденного ложного сустава с NF1 важно для составления списка обследований пациента, особенно, если это единственное проявление [7]. Кроме того, согласно данным исследований, следует учитывать, что частота отсутствия сращения врожденного ложного сустава, связанного с NF1, значительно выше (44-73 %), чем частота отсутствия консолидации при патологии, не связанной с NF1 (0-45 %) [8].
Вследствие редкости встречаемости врожденного ложного сустава предплечья на сегодняшний день отсутствуют единые рекомендации по лечению данной патологии. Консервативное лечение с использованием гипсовой иммобилизации и физиотерапии выполняется у небольшого количества пациентов и, как правило, не приводит к полной консолидации фрагментов кост- ной ткани [7, 9]. Хирургическое лечение при данной патологии показано пациентам с подвывихом и вывихом головки лучевой кости, дистальной радио-ульнарной нестабильностью и прогрессирующими деформациями костей предплечья [7, 9].
Клиническая картина врожденного псевдоартроза голени обусловлена наличием переднебокового искривления большеберцовой кости, сопровождающегося узким костномозговым каналом, что приводит к перелому большеберцовой кости и, в конечном итоге, формированию ложного сустава из-за нарушения процессов консолидации между костными фрагментами [10]. Целью лечения ложного сустава большеберцовой кости является достижение стабильного костного сращения фрагментов, коррекция асимметрии длины конечностей и предотвращение повторного перелома.
Согласно данным Khan T. [11], частота формирования первичной костной мозоли в послеоперационном периоде может достигать 50-75 %, однако, как показывает рентгенологическое обследование, только в 40-60 % восстанавливается нормальная костная структура. Отсутствие консолидации и повторные переломы являются основными хирургическими осложнениями лечения ложных суставов у детей с нейрофиброматозом. После повторного перелома частота консолидации в зоне ложного сустава составляет всего 35-50 % [11]. Кроме того, согласно проведенным исследованиям, формирование костной мозоли зависит от возраста ребенка на момент хирургического вмешательства и расположения ложного сустава: чем моложе возраст пациента и чем ближе место ложного сустава к дистальному отделу кости, тем легче добиться сращения кости [8].
Хирургические подходы, принятые большинством хирургов, включают внешнюю фиксацию по Илизарову, интрамедуллярную фиксацию стержнем в сочетании с костным трансплантатом, а также использование васкуляризированного костного аутотрансплантата [12, 13]. По данным различных авторов, выполнение микрохирургической пластики зоны врожденного ложного сустава аутотрансплантатом из малоберцовой кости у детей с данной патологией обеспечивает сращение в большем проценте случаев (61-89 %) [14]. Другие методы лечения включают использование костного морфогенетического белка (BMP) и бисфосфонатов [15].
С появлением операционной оптики возможности хирургов значительно расширились – появилась возможность использования пересадки кровоснабжаемых комплексов тканей. Так и в лечении детей с костными дефектами и ложными суставами стали применяться микрохирургические методы [14, 16-21]. Использование данных методов показало свою эффективность и в лечении детей с NF1, хотя при данном заболевании риск возникновения осложнений, связанных с консолидацией донорской и реципиентной костей, велик. Поэтому у детей с данной патологией применение микрохирургических методов, по данным литературы, пока еще ограничено и в литературе в основном встречается в виде описания немногочисленных клинических примеров [6, 14, 22].
Таким образом, в настоящее время ни один предложенный метод не может считаться «идеальным», что требует дальнейшего изучения и совершенствования алгоритмов и тактики лечения.
Цель – показать эффективность использования микрохирургической аутотрансплантации васкуляризированной малоберцовой кости для пластики костных дефектов у детей с нейрофиброматозом I типа.
МАТЕРИАЛЫ И МЕТОДЫ
В отделении реконструктивной микрохирургии и хирургии кисти ФГБУ «НМИЦ ДТО им. Г.И. Турнера» МЗ РФ с 2012 по 2021 год поступило 27 детей с ложными суставами и костными дефектами верхних и нижних конечностей на фоне нейрофиброматоза I типа. Диагноз нейрофиброматоза I типа выставляется на основании критериев, принятых международным сообществом по изучению данной патологии, таких как наличие 6 и более пятен цвета «кофе с молоком» размером более 5 мм в препубертатном периоде или 15 мм в постпубертатном периоде; наличие 2 и более нейрофибром, а также наличие дефектов (псевдоартрозов) трубчатых костей. Наличие 2-х и более из представленных критериев у пациента является основанием для постановки диагноза. Всем детям при поступлении проводились клинико-инструментальные исследования, в результате которых диагноз нейрофиброматоза I типа был поставлен всем пациентам, включенным в данное исследование. У 5 пациентов диагноз был подтвержден генетически. Распределение по полу составило 20 мальчиков и 7 девочек. Средний возраст пациентов составил 7 лет 8 мес. (от 4 лет 2 мес. до 14 лет 5 мес.). У 19 пациентов костный дефект локализовался в области костей предплечья, у 8 – в области костей голени.
Критерии включения в исследование:
– нейрофиброматоз 1-го типа с наличием ложных суставов и дефектов длинных трубчатых костей предплечья и голени;
– нейрофиброматоз 1-го типа у детей, которым производилась пластика дефектов и ложных суставов костей методом м/х пересадки кровоснабжаемых костных аутотрансплантатов.
Критерий исключения:
– нейрофиброматоз 1-го типа у детей, которым применялись не микрохирургические (традиционные) методы костной пластики.
Статистический анализ проводился на основании параметрических и непараметрических критериев. Анализ количественных шкал на нормальность распределения проводили по D-критерию Колмогорова – Смирнова и W-критерию Шапиро – Уилка. Статистический анализ был проведен с использованием пакета программ IBM SPSS Statistics (версия 25.0).
При поступлении пациентам проводился комплекс клинико-инструментальных исследований, включавший клинический осмотр, проведение лабораторных исследований, необходимых для оценки предоперационных рисков. Всем детям при поступлении в клинику выполнялась рентгенография пораженной и интактной конечности для определения размера и локализации дефекта, а также компьютерная томография с 3D-реконструкцией для оценки истинной длины фрагментов ложного сустава, протяженности и ширины костномозгового канала, а также визуализации пространственных взаимоотношений в суставах на фоне наличия псевдоартроза. Магнитно-резонансная томография с сосудистым режимом и допплерография донорской и реципиентной зоны были выполнены у 9 пациентов, что составило 33 %. Данные исследования позволили осуществить предоперационное планирование микрохирургической реконструкции костного дефекта с учетом анатомических особенностей кровоснабжения донорской и реципиентной зоны, что исключило в дальнейшем развитие сосудистых осложнений и лизиса пересаженного сегмента кости.
На основании анамнестических и клинических данных определено, что семейный анамнез по данной патологии имели 63 % детей. У всех пациентов были выявлены клинические проявления нейрофиброматоза I типа в виде кофейных пятен и псевдоартрозов длинных трубчатых костей (табл. 1).
Таблица 1
Основные характеристики поступивших пациентов
|
Характеристика |
Количество |
|
|
абс. |
% |
|
|
Семейный анамнез по NF1 |
17 |
63 |
|
Клинические проявления в виде «кофейных пятен» |
27 |
100 |
|
Псевдоартроз длинных трубчатых костей |
27 |
100 |
|
Наличие 2-х и более нейрофибром |
12 |
45 |
|
Указания на травму/перелом в анамнезе |
21 |
78 |
|
Наличие деформации на момент поступления, всего |
24 |
89 |
|
♦ верхние конечности |
16 |
84 |
|
♦ нижние конечности |
8 |
100 |
|
Консервативное лечение (до поступления в стационар) |
3 |
11 |
|
Оперативное лечение (до поступления в стационар), всего |
24 |
93 |
|
♦ однократно |
1 |
4 |
|
♦ двухкратно |
8 |
31 |
|
♦ 3 и более раз (не считая подготовительный этап к м/х) |
15 |
56 |
|
♦ как подготовительный этап для выполнения микрохирургического вмешательства (монтаж аппарата Илизарова) |
22 |
81 |
У большинства детей в анамнезе отмечались эпизоды травматических повреждений конечностей с формированием псевдоартроза, что составило 78 %. Соответственно у 89 % детей при поступлении уже определялась выраженная деформация конечности, при этом деформация голени при поступлении была отмечена у всех пациентов, имевших псевдоартроз голени. В 93 % (24) случаев дети были уже оперированы по поводу данного заболевания, причем из них в 56 % случаев количество операций составило больше трех. Отдельно следует отметить, что 22 пациентам выполнялось наложение аппарата Илизарова как подготовительный этап к выполнению микрохирургического вмешательства для устранения первичной деформации, выведения костных отломков в правильное положение и создания диастаза между ними для коррекции длины сегмента в дальнейшем (рис. 1).
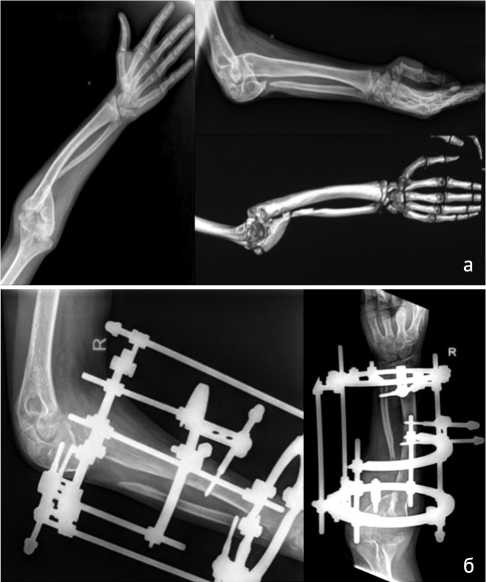
Рис. 1. Пациент К. Рентгенография костей правого предплечья до (а) и после 1-го этапа хирургического лечения – наложения аппарата Илизарова (б)
Все дети в зависимости от локализации дефекта и уровня ложного сустава были поделены на 5 групп. К первой группе были отнесены пациенты, которые имели только дефект лучевой кости, ко второй – изолированный дефект локтевой, к третьей группе – дефект лучевой и локтевой костей вместе. Четвертую группу составили дети с изолированными дефектами большеберцовой кости, пятую – дети с дефектами обеих костей голени (рис. 2).
На основании полученных данных отмечено, что у 71 % детей, поступивших в отделение для выполнения микрохирургического вмешательства, ложный сустав располагался в области верхней конечности, преимущественно в локтевой кости.
Ложный сустав на нижней конечности у трех пациентов выявлен на обеих костях голени (37 %), у 5 – была поражена только большеберцовая кость. При этом ложный сустав на верхней и нижней конечности локализовался в дистальном отделе в 59 % случаев.
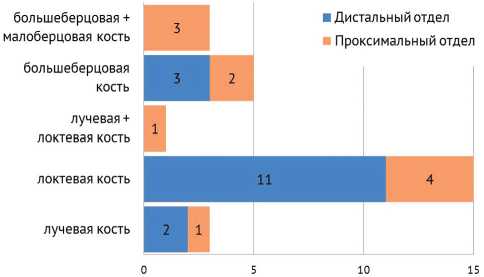
Рис. 2. Локализация и уровень костного дефекта или ложного сустава
Протяженность костного дефекта зависела от локализации патологического процесса. Так, у 13 пациентов она составила более 80 %, а у остальных детей не превышала 1/3 от долженствующей длины кости. Истинные размеры дефекта составляли от 5 до 15 см (в среднем – 12 см).
Показанием к микрохирургической реконструкции дефекта являлась протяженность дефекта более 5 см, неудовлетворительный результат предыдущего этапа лечения (использования КДА, костной пластики некро-воснабжаемыми ауто- или аллотрансплантатами и т.п.).
С учетом протяженности дефекта всем детям была произведена микрохирургическая реконструктивная операция с использованием кровоснабжаемого аутотрансплантата малоберцовой кости на сосудистой ножке. У 5 пациентов, учитывая наличие грубых рубцовых изменений мягких тканей на фоне проведенных многократных оперативных вмешательств, забор трансплантата включал малоберцовый лоскут для замещения дефекта мягких тканей (рис. 3).
Проведение оперативного вмешательства начинали с реципиентной зоны. При наличии, производили частичный или полный демонтаж аппарата Илизарова. Далее выполнялся дугообразный фигурный разрез в проекции псевдоартроза (дефекта кости). При ревизии раны на предплечье в 27 % случаев определялись множественные веретенообразные по форме утолщения со стороны локтевого нерва (в виде косички). Затем из мягких тканей выделяли проксимальный и дистальный фрагменты кости, а также соединительно-тканные тяжи между ними, резецировали патологически измененные концы дистального и проксимального фрагментов, после чего измеряли итоговую длину дефекта. Далее проводили мобилизацию аутотрансплантата малоберцовой кости с питающими сосудами (малоберцовой артерией с сопровождающими венами) по стандартной методике. Для оценки адекватности кровообращения в состав аутотрансплантата включали так называемый «буйковый лоскут». В случаях, когда проводили иссечение рубцовых тканей в реципиентной области, формировался мягкотканный дефект, аутотрансплантат формировали с малоберцовым лоскутом. Фиксацию трансплантата проводили с использованием осевой спицы различного диаметра. При необходимости дополнительно проводили остеосинтез с помощью повторного монтажа КДА.
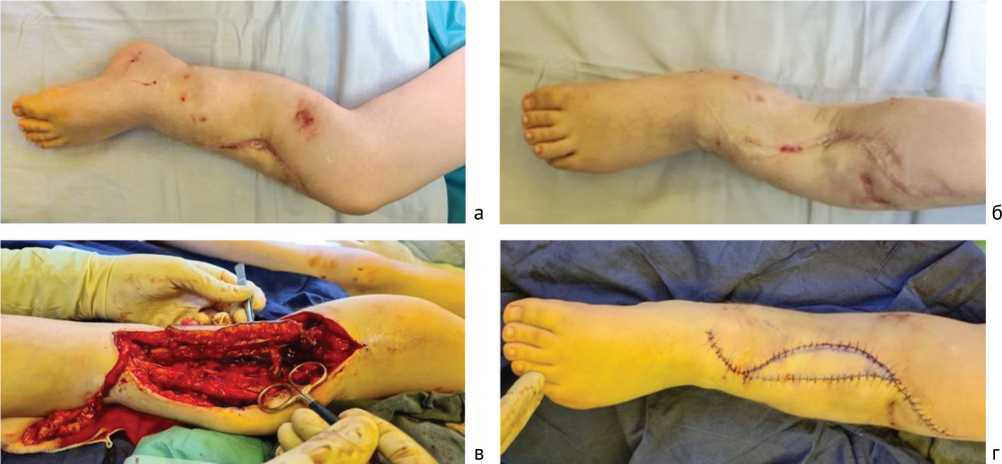
Рис 3. Пациент М. Клиническая картина при поступлении (а, б), трансплантат комплекса малоберцового лоскута и малоберцовой кости (в), внешний вид после оперативного лечения (г)
Ранние послеоперационные осложнения были отмечены у 2 пациентов и заключались в кровотечении из веток сосудистой ножки аутотрансплантата, которое было устранено в ходе оперативного вмешательства. Поздние послеоперационные осложнения отсутствовали.
РЕЗУЛЬТАТЫ
Средние сроки консолидации фрагментов составили 12 недель ± 4 недели. Максимальный катамнез составил 10 лет, минимальный – 6 месяцев. Результаты лечения в зависимости от локализации дефекта представлены на рисунке 4.
большеберцовая + малоберцовая кость большеберцовая кость лучевая+ локтевая кость локтевая кость лучевая кость
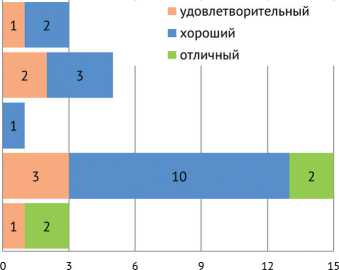
Рис. 4. Результаты лечения пациентов с нейрофиброматозом
Оценка результатов лечения пациентов проводилась по разработанной в отделении шкале на основании осмотра пациентов и проведения рентгенографии оперируемой конечности через 1 год после оперативного лечения. Данная шкала включала отличные, хорошие, удовлетворительные и неудовлетворительные результаты.
Под отличным результатом подразумевали позицию, когда у пациента после оперативного лечения отмечена полная консолидация фрагментов, и в дальнейшем ребенок больше не нуждался в оперативном лечении в данной области, доля таких детей составила 15 %. Хорошим результатом считали полную консолидацию фрагментов реципиентной и донорской кости после оперативного лечения, однако сохранялись вторичные деформации или укорочение конечности, которые в последующем потребовали повторных оперативных вмешательств. В нашем случае доля таких детей составила 59 %. У 6 пациентов, которым выполнялась микрохирургическая реконструкция большеберцовой кости, через 3 года отмечалась гипертрофия трансплантата: итоговый диаметр восстановленной большеберцовой кости практически соответствовал диаметру таковой на здоровой конечности, что в полтора раза больше изначального диаметра малоберцовой кости до пересадки. При этом у 2-х пациентов с реконструкцией большеберцовой кости в сроки более чем через год после микрохирургической реконструкции был отмечен перелом трансплантата, по всей вероятности, вследствие невыполнения рекомендаций лечащего врача и начала полноценной осевой нагрузки без дополнительной опоры.
Удовлетворительные результаты отмечены у 7 пациентов с проксимально расположенной зоной псевдоартроза. Отсутствие консолидации между пересаженным аутотрансплантатом и фрагментом реципиентной кости потребовало проведения повторного оперативного вмешательства в виде костной пластики губчато-кортикальным костным трансплантатом из гребня подвздошной кости. Данное обстоятельство расценили как удовлетворительный результат лечения, хотя цель восстановления разрушенной процессом кости была достигнута. Согласно литературным источникам, при наличии зоны ложного сустава в проксимальном отделе кости отсутствие консолидации составляет до 25-30 % [7, 9]. В нашем исследовании удовлетворительные результаты составили 26 %. При этом ни в одном случае не получено лизиса пересаженного кровоснабжаемого костного аутотрансплантата, что означало бы неудовлетворительный результат лечения.
ОБСУЖДЕНИЕ
Одним из методов костной пластики дефектов или псевдоартрозов как у детей, так и взрослых пациентов, по данным литературы, является микрохирургическая аутотрансплантация кровоснабжаемых костных фрагментов [9, 13, 18-20, 23-28]. Однако у детей с нейрофиброматозом I типа использование данного метода лечения довольно ограничено, что связано с повышенным риском возникновения осложнений. В основном это описания отдельных клинических случаев [14, 27, 29], и только в некоторых статьях приводится анализ более многочисленной серии исследований, касающихся хирургического лечения врожденных псевдоартрозов, в том числе возникших и по причине нейрофиброматоза [16, 17, 23, 30].
Большинство авторов начинает производить микрохирургические пересадки кровоснабжаемых костных аутотрансплантатов в возрасте 5-7 лет [17, 26, 31, 32]. Резорбция кости и формирование ложных суставов костей предплечья и голени возникают обычно к этому возрасту, что и являлось показанием к началу оперативного лечения. Некоторые авторы сообщают об успешных результатах пересадки костных аутотрансплантатов и в более раннем возрасте (3-4 года). El-Gammal на примере лечения 21 ребенка показал, что восстановление целостности костного сегмента происходит эффективнее, если производить микрохирургические вмешательства в возрасте 3-4-х лет. В нашем исследовании наименьший возраст ребенка, которому выполнялась микрохирургическая аутотрансплантация кровоснабжаемого костного сегмента, был 4 года, а средний возраст детей составил 7 лет 8 мес. Более старший возраст проведения вмешательств был обусловлен применением многократных и безуспешных традиционных методов оперативного лечения, предшествующих выполнению микрохирургического этапа.
Альтернативной методикой, применяемой у пациентов с ложными суставами голени на фоне нейрофиброматоза, является несвободная костная пластика по Г.А. Илизарову («bone transport»). Авторы сообщают о высоком проценте сращения фрагментов, приемлемом сроке аппаратной фиксации и хороших отдаленных результатах [35-37]. Однако выраженный рубцовый процесс в области голени (вследствие многочисленных ранее перенесенных оперативных вмешательств), а также величина пострезекционного дефекта (более 2/3 диафиза) не позволяли нам использовать данную методику.
Ряд авторов сообщает о формировании нестабильности голеностопного сустава в донорской области после заимствования костного аутотрансплантата [16, 18, 19]. Данное осложнение возникает в отдаленном периоде более 1 года после оперативного вмешательства и связано с нарушением стабильности голеностопного сустава ввиду короткого (менее 6 см) дистального фрагмента. Принимая во внимание данный факт, аутотрансплантат малоберцовой кости формировали таким образом, чтобы длина оставшегося дистального фрагмента малоберцовой кости составляла не менее 7 см.
По данным литературы, первичная консолидация на границе кость-трансплантат достигается в 96-98 % случаев, а среднее время консолидации колеблется от 2 до 10 месяцев [7, 28, 31, 33]. Средний срок консолидации фрагментов в нашем исследовании составил 12 ± 4 недели. В некоторых литературных источниках отмечено, что выбор способа фиксации пересаженного костного аутотрансплантата может влиять на результат лечения. Так, в случаях лечения с помощью интрамедуллярной фиксации стержнем или винтом отмечалась более низкая частота и более длительное время сращения по сравнению с внешней фиксацией: 76 % и 9 месяцев против 100 % и 1,9 месяца соответственно [26]. Однако при нейрофиброматозе I типа процесс консолидации в проксимальном отделе реципиентной кости и костного фрагмента воспринимающего ложа, как правило, замедлен ввиду изменения кровоснабжения в данной области на фоне основного заболевания [7, 9]. При этом Kesireddyetal [34] отмечает, что в случаях применения аппарата внешней фиксации чаще наблюдаются вторичные переломы восстановленной кости по сравнению со случаями интрамедуллярной фиксации: 45 % против 29 % соответственно. В исследовании El-Gammal [30] повторные переломы возникли в 21 случае (51,3 %) и почти у половины пациентов этой группы они повторялись от 2 до 4 раз.
Все авторы, которые производили костную пластику трубчатых костей с использованием пересадки кровоснабжаемого костного фрагмента, утверждают, что данные аутотрансплантаты значительно эффективнее по сравнению с другими методами костной пластики, особенно при закрытии обширных костных дефектов. Несмотря на развитие костных заменителей, факторов роста, эндопротезов и дистракционного остеосинтеза, метод костной пластики с использованием кровоснабжаемого костного аутотрансплантата остается актуальным и зачастую незаменимым в самых сложных случаях. Ключом к успеху традиционной костной пластики является кровоснабжение реципиентной кости и окружающих тканей [18, 19, 23]. Без достаточного кровоснабжения неваскуляризированные костные трансплантаты не способны к ремоделированию, и между ними и реципиентной костью происходит замедленная консолидация. Для контроля кровоснабжения фрагмента кости в большинстве случаев в состав трансплантата мы включали кожный лоскут на перфорантных кожных ветвях малоберцовой артерии – так называемый «буйковый». Отсутствие нарушения кровообращения в «буйковом» лоскуте позволяло сделать вывод, что у всех включенных в наше исследование пациентов кровоснабжение аутотрансплантата было адекватным. Благодаря восстановлению кровотока в пересаженном васкуляризированном аутотрансплантате, он остается живым, сохраняя возможность ремоделирования костной ткани. В этих случаях между аутотрансплантатом и реципиентной костью почти всегда формируется костная мозоль, и происходит консолидация в такие же сроки, как и при обычном переломе [19, 23, 24, 33]. Кроме того, анализ наших отдаленных результатов показал, что пересаженный костный трансплантат, благодаря кровоснабжению и функциональной нагрузке, имеет тенденцию к гипертрофии. И фрагмент мало- берцовой кости на сосудистой ножке, пересаженный в дефект большеберцовой кости, становился в диаметре таким же, как и реципиентная большеберцовая кость. И, хотя показатель осложнений составляет более 50 % (ложные суставы в позиции кость-трансплантат, инфицирование послеоперационных ран, невропатии), в случаях замещения значимых дефектов, в особенности с вовлечением в патологический процесс суставных отделов кости, альтернатив для пациентов детского возраста нет [20].
ЗАКЛЮЧЕНИЕ
Данное исследование показало актуальность, высокую эффективность и необходимость использования метода микрохирургической аутотрансплантации васкуляризированной малоберцовой кости при закрытии обширных костных дефектов у детей с нейрофиброматозом I типа.
В подавляющем большинстве случаев наблюдается значительное сокращение сроков сращения (в 3-4 раза) между пересаженным аутотрансплантатом и фрагментами кости в реципиентной зоне по сравнению с таковыми при пересадке свободных некровоснабжаемых костных аутотрансплантатов. Несмотря на улучшение кровоснабжения в реципиентной области, благодаря пересадке васкуляризированного костного аутотран- сплантата, в семи случаях нашего исследования имела место замедленная консолидация с последующим формированием ложного сустава (обычно в проксимальном отделе соединения кость-аутотрансплантат), что потребовало повторного оперативного вмешательства. Таким образом, можно сделать вывод, что микрохирургическая пересадка васкуляризированного костного аутотрансплантата является не панацеей, а одним из необходимых и эффективных этапов в комплексном хирургическом лечении пациентов с нейрофиброматозом, имеющих обширные костные дефекты. Эффективность данных оперативных вмешательств подтверждается высоким показателем хороших и отличных результатов – 74 %.
Список литературы Микрохирургическая аутотрансплантация малоберцовой кости как оптимальный метод закрытия обширных костных дефектов у детей с нейрофиброматозом
- Саханова А.Ш., Кенжебаева К.А., Бабий Д.В. и др. Нейрофиброматоз у детей. Медицина и экология. 2017;(1):47-55.
- Заболевания нервной системы у детей: В 2-х т. Под ред. Ж. Айкарди и др. Пер. с англ. под ред. А.А. Скоромца. М.: Издательство Панфилова, БИНОМ. 2013.
- Мустафин Р.Н. Особенности ортопедической патологии у больных нейрофиброматозом I типа. Гений ортопедии. 2022;28(2):296-304. doi: 10.18019/1028-4427-2022-28-2-296-304
- Feldman DS, Jordan C, Fonseca L. Orthopaedic manifestations of neurofibromatosis type 1. J Am Acad Orthop Surg. 2010;18(6):346-357. doi: 10.5435/00124635-201006000-00007
- Petrák B, Bendová S, Lisy J, et al. Neurofibromatosis von Recklinghausen typ 1 (NF1) - klinicky obraz a molekulárne-genetická diagnostika [Neurofibromatosis von Recklinghausen type 1 (NF1) - clinical picture and molecular-genetics diagnostic]. CeskPatol. 2015;51(1):34-40. (In Czech)
- Diallo ID, Iraqi Houssaini Z, Tantaoui M, et al. Bone Manifestations of Neurofibromatosis Type 1. Glob Pediatr Health. 2022;9:2333794X221101771. doi: 10.1177/2333794X221101771
- Siebelt M, de Vos-Jakobs S, Koenrades N, et al. Congenital Forearm Pseudarthrosis, a Systematic Review for a Treatment Algorithm on a Rare Condition. J Pediatr Orthop. 2020;40(5):e367-e374. doi: 10.1097/BP0.0000000000001417
- Li Z, Yu H, Huang Y, et al. Analysis of risk factors affecting union and refracture after combined surgery for congenital pseudarthrosis of the tibia: a retrospective study of 255 cases. Orphanet J Rare Dis. 2022;17(1):245. doi: 10.1186/s13023-022-02375-w
- Solla F, Lemoine J, Musoff C, et al. Surgical treatment of congenital pseudarthrosis of the forearm: Review and quantitative analysis of individual patient data. Hand Surg Rehabil. 2019;38(4):233-241. doi: 10.1016/j.hansur.2019.06.004
- Paley D. Congenital pseudarthrosis of the tibia: biological and biomechanical considerations to achieve union and prevent refracture. J Child Orthop. 2019;13(2):120-133. doi: 10.1302/1863-2548.13.180147
- Khan T, Joseph B. Controversies in the management of congenital pseudarthrosis of the tibia and fibula. Bone Joint J. 2013;95-B(8):1027-1034. doi: 10.1302/0301-620X.95B8.31434
- McCullough MC, Arkader A, Ariani R, et al. Surgical Outcomes, Complications, and Long-Term Functionality for Free Vascularized Fibula Grafts in the Pediatric Population: A 17-Year Experience and Systematic Review of the Literature. J Reconstr Microsurg. 2020;36(5):386-396. doi: 10.1055/s-0040-1702147
- Migliorini F, La Padula G, Torsiello E, et al. Strategies for large bone defect reconstruction after trauma, infections or tumour excision: a comprehensive review of the literature. Eur J Med Res. 2021;26(1):118. doi: 10.1186/s40001-021-00593-9
- Сосненко О.Н., Белоусова Е.А., Поздеев А.П. и др. Применение микрохирургической техники при лечении врожденного ложного сустава костей предплечья у детей с нейрофиброматозом (наблюдение из практики). Современные проблемы науки и образования. 2021;(3). doi: 10.17513/spno.30722. Доступно по: https://science-education.ru/ru/article/view?id=30722. Ссылка активна на 18.07.2022.
- Schindeler A, Ramachandran M, Godfrey C, et al. Modeling bone morphogenetic protein and bisphosphonate combination therapy in wild-type and Nf1 haploinsufficient mice. J Orthop Res. 2008;26(1):65-74. doi: 10.1002/jor.20481
- Авдейчик Н.В., Голяна С.И., Гранкин Д.Ю. и др. Возможности применения микрохирургической аутотрансплантации комплексов тканей у детей. Ортопедия, травматология и восстановительная хирургия детского возраста. 2020;8(4):437-450. doi: 10.17816/PT0RS17896
- McCullough MC, Arkader A, Ariani R, et al. Surgical Outcomes, Complications, and Long-Term Functionality for Free Vascularized Fibula Grafts in the Pediatric Population: A 17-Year Experience and Systematic Review of the Literature. J Reconstr Microsurg. 2020;36(5):386-396. doi: 10.1055/s-0040-1702147
- Bumbasirevic M, Stevanovic M, Bumbasirevic V, et al. Free vascularised fibular grafts in orthopaedics. Int Orthop. 2014;38(6):1277-1282. doi: 10.1007/s00264-014-2281-6
- Van Den Heuvel SCM, Winters HAH, Ultee KH, et al. Combined massive allograft and intramedullary vascularized fibula transfer: the Capanna technique for treatment of congenital pseudarthrosis of the tibia. Acta Orthop. 2020;91(5):605-610. doi: 10.1080/17453674.2020.1773670
- Гаркавенко Ю.Е., Захарьян Е.А., Зубаиров Т.Ф. и др. Микрохирургическая аутотрансплантация фрагмента малоберцовой кости при лечении дефектов костей у детей - возможности дальнейшей реконструктивной хирургии. Современные проблемы науки и образования. 2021;(2). doi: 10.17513/spno.30624. Доступно по: https://science-education.ru/ru/article/view?id=30624. Ссылка активна на 18.07.2022.
- Захарьян Е.А., Чигвария Н.Г., Гаркавенко Ю.Е. и др. Возможности реконструктивной хирургии конечностей при лечении врожденного ложного сустава костей голени у детей с применением микрохирургической техники - реконструкция или ампутация? Ортопедия, травматология и восстановительная хирургия детского возраста. 2022;10(4):429-439. doi: https://doi.org/10.17816/PTORS110805
- Narayana Kurup JK, Shah HH. Congenital pseudoarthrosis of the radius in Neurofibromatosis Type 1: An entity not to be missed! J Orthop. 2020;22:427-430. doi: 10.1016/j.jor.2020.09.013
- Catena N, Baldrighi C, Jester A, et al. Microsurgery in pediatric upper limb reconstructions: An overview. J Child Orthop. 2022;16(4):241-255. doi: 10.1177/18632521221106390
- Taqi M, Raju S. Fibula Free Flaps. 2022. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023.
- Bae DS, Waters PM, Sampson CE. Use of free vascularized fibular graft for congenital ulnar pseudarthrosis: surgical decision making in the growing child. J Pediatr Orthop. 2005;25(6):755-762. doi: 10.1097/01.bpo.0000186241.29415.df
- Bauer AS, Singh AK, Amanatullah D, et al. Free vascularized fibular transfer with langenskiold procedure for the treatment of congenital pseudarthrosis of the forearm. Tech Hand Up Extrem Surg. 2013;17(3):144-150. doi: 10.1097/BTH.0b013e318295238b
- Ding DY, LaMartina J, Tai C, Pandya NK. Congenital Pseudoarthrosis of the Distal Radius Treated With Physeal-Sparing Double-Barrel Vascularized Free Fibula Transfer: A Case Report. Hand (N Y). 2017;12(5):NP140-NP144. doi: 10.1177/1558944717702472
- Taylor GI, Corlett RJ, Ashton MW. The Evolution of Free Vascularized Bone Transfer: A 40-Year Experience. Plast ReconstrSurg. 2016;137(4):1292-1305. doi: 10.1097/PRS.0000000000002040
- Soldado F, Diaz-Gallardo P, Sena-Cabo L, et al. Vascularized fibular grafts extended with vascularized periosteum in children. Microsurgery. 2017;37(5):410-415. doi: 10.1002/micr.30063
- El-Gammal TA, El-Sayed A, Kotb MM, et al. Crawford Type IV Congenital Pseudarthrosis of the Tibia: Treatment With Vascularized Fibular Grafting and Outcome at Skeletal Maturity. J Pediatr Orthop. 2021;41(3):164-170. doi: 10.1097/BP0.0000000000001751
- Iamaguchi RB, de Moraes MA, Silva GB, et al. Is Obesity a risk factor for free vascularized fibular flap complications? Acta Ortop Bras. 2019;27(4):192-196. doi: 10.1590/1413-785220192704217444
- Rastogi A, Agarwal A. Surgical treatment options for congenital pseudarthrosis of tibia in children: cross-union versus other options: a systematic review. J Pediatr Orthop B. 2022;31(2):139-149. doi: 10.1097/BPB.0000000000000924
- Legius E, Messiaen L, Wolkenstein P, et al. Revised diagnostic criteria for neurofibromatosis type 1 and Legius syndrome: an international consensus recommendation. Genet Med. 2021;23(8):1506-1513. doi: 10.1038/s41436-021-01170-5
- Kesireddy N, Kheireldin RK, Lu A, et al. Current treatment of congenital pseudarthrosis of the tibia: a systematic review and meta-analysis. J Pediatr Orthop B. 2018;27(6):541-550. doi: 10.1097/BPB.0000000000000524
- Кутиков С. А., A.R. Lettreuch, A. Saighi-Bouaouina и др. Врожденный ложный сустав голени. Проблемы, возможные варианты решения. Гений ортопедии. 2014;(3):24-30.
- Борзунов Д. Ю., Горбач Е.Н., Моховиков Д.С. и др. Комбинированные костнопластические вмешательства при реабилитации пациентов с врожденным ложным суставом костей голени. Гений ортопедии. 2019;25(3):304-311. doi: 10.18019/1028-4427-2019-25-3-304-311
- Кутиков С. А. Борзунов Д.Ю., Дьячкова Г.В. Чевардин А.Ю. Лечение врождённого ложного сустава костей голени. Вестник хирургии имени И.И. Грекова. 2016;175(4):53-58.


