Микрохирургические методы исследования патологии лимфатической системы ex vivo при раке молочной железы
Автор: Ганцев Шамиль Ханафиевич, Татунов Михаил Александрович, Ганцев Камиль Шамилевич, Кзыргалин Шамиль Римович, Мухамедьяров Ришат Шавкатович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Цель исследования - ex vivo изучить особенности перфузии лимфатических узлов при метастазах рака молочной железы. Материал и методы. Объектом исследования служили лимфатические узлы, в разной степени пораженные метастазами. Лимфоузлы подвергались микрохирургической диссекции с выделением капсулы, лимфатических сосудов, паренхимы и стромы. Все манипуляции выполнялись после предварительной лимфатической диссекции у 100 больных раком молочной железы на препарате клетчатки аксиллярной области. Затем проводилась диссекция отдельно взятого лимфатического узла из этого региона. Выделение лимфатических узлов и сосудов из жировой ткани аксиллярной области производилось с помощью ультразвукового аппарата LySonix 3000® с PulseSelect™ методом соноли-подеструкции. Детальное исследование лимфатического узла и лимфонодулярного комплекса производилось с помощью операционного микроскопа OPTON - OPMI 6 CFC и набора микрохирургических инструментов. Проводилась цветная лимфография выделенных афферентных лимфатических сосудов 0,5 % раствором метиленового синего. Наряду с цветной лимфографией выполнялась цифровая морфометрия компонентов лимфатического русла (Image-Pro Plus 6.0), микрохирургическая диссекция капсулы лимфатических узлов, клапанов лимфангиона. Результаты. Получены и зафиксированы на цифровых носителях данные о перфузии лимфатического узла в норме и при метастазах рака. При анализе метастатической блокады лимфоидной дольки и афферентных лимфатических сосудов методом антеградной цветной лимфографии выявлено компенсаторное развитие обходных путей лимфоттока - интракапсулярного неолимфомикрангиогенеза, что подтверждено гистологическими результатами. Заключение. Цветная лимфография позволяет достоверно определить зоны функциональной перфузии и степени ее нарушения. Постлучевые изменения в тканях выраженно изменяют логистику тока лимфы и регионарного метастазирования. Капсула лимфатического узла с метастазами претерпевает патологическую трансформацию, характеризующуюся развитием сети лимфатических капилляров, выраженность которой зависит от степени метастатического блока. Метастатическое поражение лимфатического узла изменяет лимфатическую гидродинамику за счет изменения количества лимфатических сосудов и их диаметра.
Лимфатическая система, лимфатический узел, рак молочной железы, нарушение перфузии, метастатический блок
Короткий адрес: https://sciup.org/140254038
IDR: 140254038 | УДК: 616.19-006.6-033.2:611-018.98]-07-089 | DOI: 10.21294/1814-4861-2019-18-3-71-77
Текст научной статьи Микрохирургические методы исследования патологии лимфатической системы ex vivo при раке молочной железы
Роль лимфатической системы в процессе метастазирования рака остается объектом пристального внимания. Тем не менее до конца не ясно, какие механизмы объясняют масштабы распространения опухоли. Накоплено достаточно данных о том, что процесс диссеминации во многом зависит от логистики лимфы, и об особой значимости сторожевого лимфатического узла. Именно на его уровне происходят перераспределение потоков и транспорт раковых клеток. Тезис, что лимфогенное метастазирование происходит по зональному принципу, уже несостоятелен, этому есть объективные доказательства. С позиции зональности классические диссекции считались достаточными. В обновленном формате, когда этот патологический процесс рассматривается как меж- и многозональный, должно меняться и отношение к целесообразности лимфатических диссекций в пределах анатомических зон. Данные о межзональном рас- пространении опухолевых клеток уже на раннем этапе могут стать основой коррекции стадии рака по критерию N в сторону повышения.
Нами накоплен большой опыт по изучению регионарной лимфатической системы (подмышечного бассейна) при раке молочной железы (РМЖ), который позволяет сделать некоторые выводы, существенно влияющие на современную доктрину хирургического лечения этой патологии [1–3]. В данной статье представлены результаты собственных исследований, касающихся перфузии лимфатических узлов при РМЖ с метастазами в аксиллярной области. Следует заметить, что микрохирургические технологии при изучении таких состояний практически не применялись, поэтому данные наших исследований отличаются от результатов «макрохирургических» и «макро-анатомических» наблюдений.
Несмотря на малые размеры лимфатических узлов, в них происходят сложные процессы кле- точной дифференцировки, девитализация раковых клеток и др. Учитывая значительную функциональную нагрузку на узлы при раке, даже небольшие нарушения их перфузии «ломают» всю систему дренажа региональной зоны, особенно на уровне сторожевого лимфатического узла. Прежде всего, это касается блока одной или нескольких долек лимфатического узла, что затрудняет движение лимфы в сторону узла и приводит к значительному расширению приносящего сосуда. В этом кроется один из механизмов перераспределения потоков лимфы через вновь образованные и коллатеральные лимфатические сосуды за счет формирования недостаточности клапанов афферентного звена лимфоциркуляции. Это один из ключевых факторов, определяющих порядок метастатического каскада, характеризующийся бесконтрольностью и отсутствием логичной последовательности этого процесса.
Цель исследования – ex vivo изучить особенности перфузии лимфатических узлов при метастазах рака молочной железы.
Материал и методы
Объектом исследования служили лимфатические узлы, в разной степени пораженные метастазами, которые подвергались микрохирургической диссекции с выделением капсулы, лимфатических сосудов, паренхимы и стромы. Все манипуляции выполнялись после предварительной лимфатической диссекции на препарате клетчатки аксил-лярной области, а затем проводилась диссекция отдельно взятого лимфатического узла из этого региона. Лимфатическая диссекция и микрохирургические диссекции лимфатических узлов выполнены у 100 больных РМЖ. Контрольная группа была составлена из аксиллярных комплексов, изъятых у женщин, не имевших онкологических заболеваний в анамнезе и погибших в результате несчастных случаев,.
Лимфатические узлы и сосуды выделялись из жировой ткани аксиллярной области с помощью ультразвукового аппарата LySonix 3000® с PulseSelect™ методом сонолиподеструкции. Это позволяло получить лимфатическую карту, на которой можно было видеть весь лимфатический каскад, участвующий в движении лимфы. Больше всего изменений наблюдалось в узлах, приближенных к опухоли, их размеры колебались от 1,0 до 3,0 см. Причем размеры узлов второго и третьего порядка уменьшались в линейной пропорции в зависимости от расстояния от первичной опухоли.
Для микрохирургического исследования (М.А. Татунов) выбирался один, предположительно, «сторожевой» лимфатический узел с афферентными и эфферентным/ми лимфатическими сосудами. Детальное исследование лимфатического узла и лимфонодулярного комплекса производилось с помощью операционного микро- скопа OPTON – OPMI 6 CFC и набора микрохирургических инструментов. Препарат помещался в операционное поле микроскопа. Проводилось скелетирование лимфатического узла с приносящими и выносящими лимфатическими сосудами, капсулы, кровеносных сосудов.
Анатомический препарат считался готовым к исследованию, когда зона интереса и сосуды были полностью освобождены от прилегающих тканей. Цветная лимфография выделенных афферентных лимфатических сосудов проводилась 0,5 % раствором метиленового синего. Концентрация препарата была ранее экспериментально подобрана для оптимального проведения цветной лимфографии. Пункция афферентного лимфатического сосуда проводилась инъекционной иглой, диаметром 300 мкм. Наряду с цветной лимфографией проводилась цифровая морфометрия компонентов лимфатического русла (Image-Pro Plus 6.0), микрохирургическая диссекция капсулы лимфатических узлов, клапанов лимфангиона. Измерение диаметра лимфатических сосудов выполняли на расстоянии 10 мм от капсулы лимфатического узла.
Результаты и обсуждение
Из 100 процедур антеградной цветной лимфо-графии афферентных лимфатических сосудов в 70 (70 %) случаях мы получили удовлетворительные результаты, в 30 (30 %) случаях не удалось заполнить патологически измененный лимфатический сосуд. В основном трудности в проведении цветной лимфографии наблюдались у больных, получавших лучевую терапию. Это была основная причина рубцово-спаечного процесса (рис. 1).
Этот технический нюанс подтолкнул нас к мысли о влиянии лучевой терапии на процессы диссеминации опухоли. Если региональные подмышечные лимфатические сосуды после облучения склерозируются, то наступает коллапс лимфообращения. Возникает вопрос, куда и через какую сеть и коллатерали происходит сброс лим-
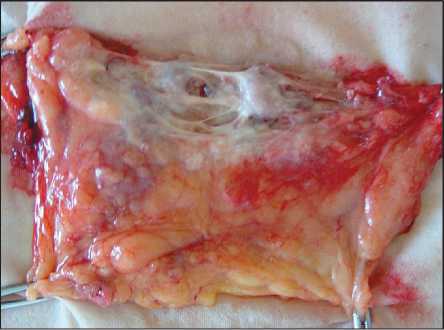
Рис. 1. Ткань подмышечной области при раке молочной железы после лучевой терапии. Отмечаются резко выраженные рубцово-склеротические изменения тканей, затрудняющие мобилизацию сосудов и узлов
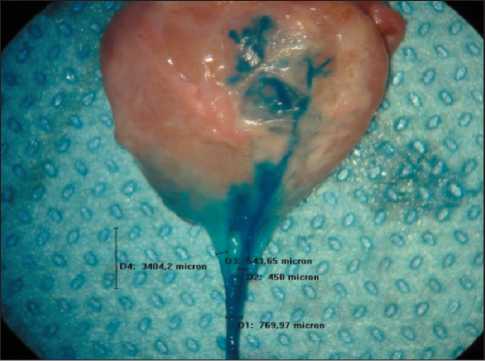
Рис. 2. Антеградная цветная лимфография афферентного лимфатического сосуда при метастазах рака в лимфатические узлы, блок І ст. подкапсульного синуса, ×20
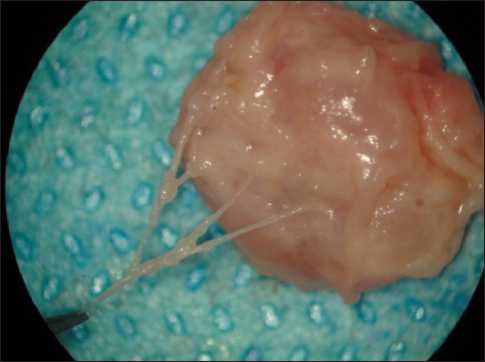
Рис. 3. Рассыпной тип приносящего лимфатического сосуда
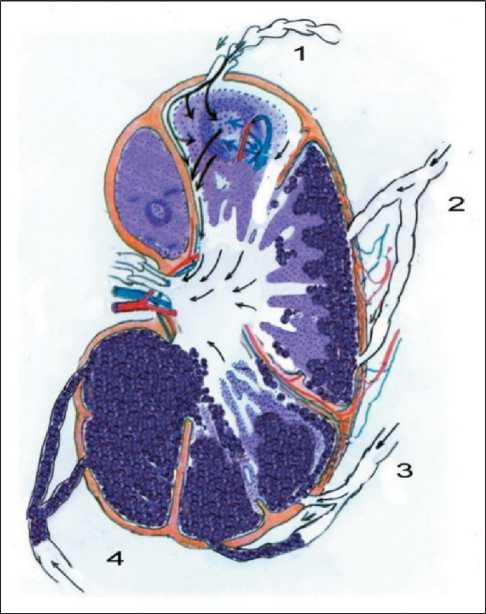
Рис. 4. Схема метастатической блокады лимфатического узла и афферентных лимфатических сосудов: 1 – афферентный лимфатический сосуд в норме; 2 – метастатическая блокада І степени – блок лимфоидной дольки раковыми клетками на уровне подкапсульного синуса; 3 – метастатическая блокада ІІ степени – блок лимфатического узла на уровне подкапсульного синуса и частичное поражение афферентных лимфатических сосудов; 4 – метастатическая блокада
ІІІ степени – блок афферентного лимфатического сосуда
фы, в том числе и от опухоли. На наш взгляд, это может быть негативным фактором в диссеминации раковой опухоли, ведь эффект девитализации не происходит мгновенно.
Возможности цветной лимфографии с использованием 20-кратного оптического увеличения позволили изучить лимфонодулярный переход. Также удалось получить сведения о перфузии лимфатического узла в норме и при метастазах рака в лимфатический узел и зафиксировать эти данные на цифровых носителях (рис. 2). Установлено, что лимфонодулярный переход имеет сложное анатомическое устройство. Сосуды могут проникать в узел в виде ствола (магистральный тип) и в виде множества лимфатических сосудов (рассыпной тип). Необходимо отметить, что рассыпной тип более характерен для опухолевой патологии, тогда этот компонент усиливается и за счет вновь образованных сосудов – феномен неолимфангиогенеза (рис. 3).
Процесс лимфатической перфузии в норме и нарушении перфузии при метастазах рака за счёт метастатической блокады лимфатического узла и афферентных лимфатических сосудов мы отобразили в виде схемы (рис. 4). Модель метастатической блокады позволяет оценить окклюзию дольки лимфатического узла, принадлежащей к определённому афферентному лимфатическому сосуду. Мы не можем говорить о метастатическом поражении всего лимфатического узла одновременно, так как структурно функциональной единицей лимфатического узла является лимфоидная долька, то распространение метастазов проходит из определённого региона по соответствующему ему лимфатическому сосуду и заканчивается в принадлежащей ему лимфоидной дольке. Судя по данным, полученным в ходе исследования, к одному афферентному лимфатическому сосуду в среднем может относиться от одной до трёх лимфоидных долек.
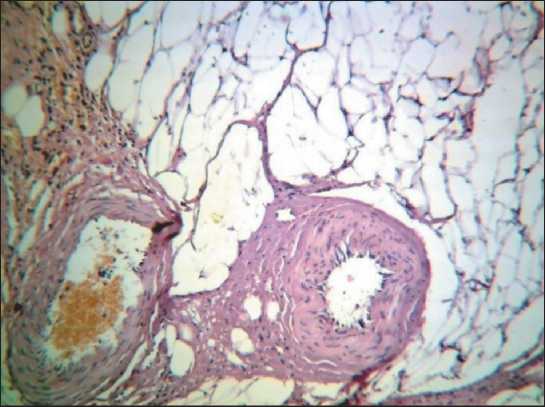
Рис. 5. Кровеносный и лимфатический сосуды в паранодаль-ной клетчатке. В просвете кровеносного сосуда прослеживаются клетки крови. В просвете лимфатического сосуда практически нет клеточных элементов. Окраска гематоксилином и эозином, ×90
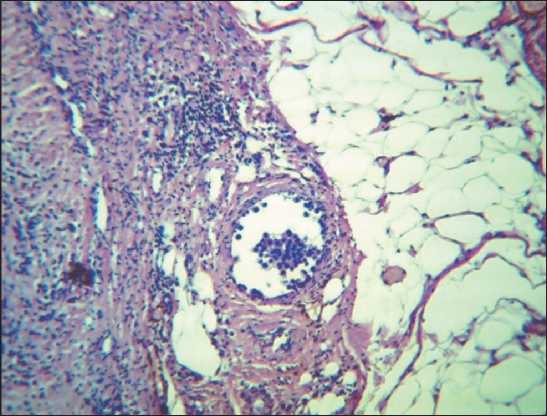
Рис. 6. Немногочисленные метастатические клетки в просвете приносящего лимфатического сосуда на уровне лимфонодулярного перехода (в капсуле). Окраска гематоксилином и эозином, ×90
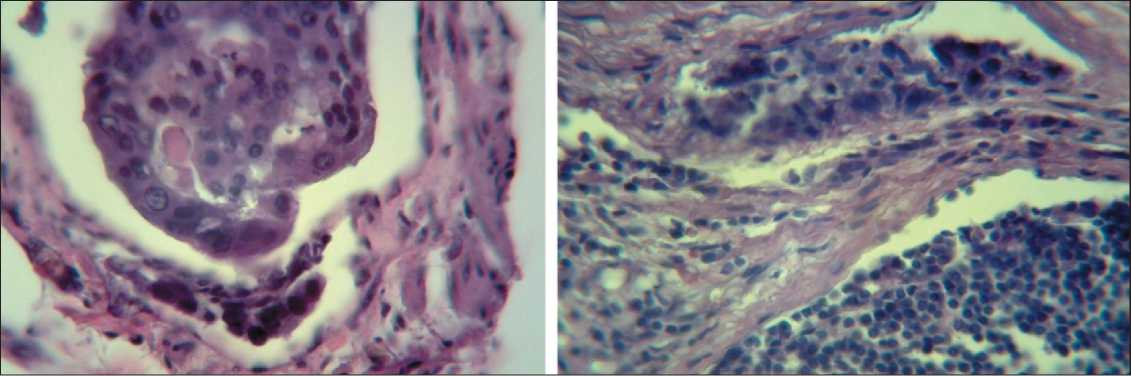
Рис. 7. Приносящий лимфатический сосуд, просвет которого на 80 % выполнен конгломератом опухолевых клеток. Окраска гематоксилином и эозином, ×900
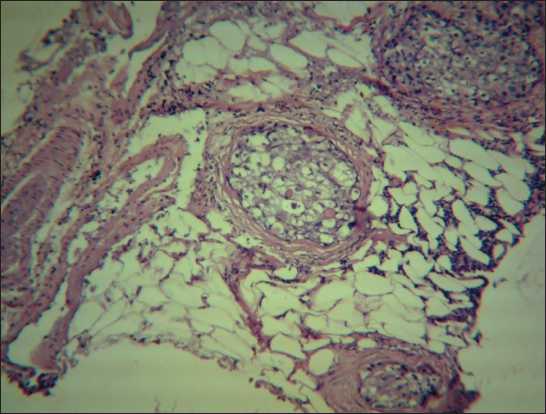
Рис. 8. Тотальный блок приносящего лимфатического сосуда раковыми клетками. Диаметры сосудов 216 и 281 мкм. Окраска гематоксилином и эозином, ×225
При исследовании метастатической блокады лимфоидной дольки и афферентных лимфатических сосудов методом антеградной цветной лимфографии был установлен факт компенсаторного развития обходных путей лимфоттока – интракапсулярного неолимфомикрангиогенеза, что подтверждено гистологическими исследованиями (рис. 5–9)
Метастатическая блокада обусловливала состояние афферентных и эфферентных лимфатических сосудов. Методом компьютерной морфометрии были измерены диаметры лимфатических сосудов сторожевых лимфатических узлов. Средний диаметр афферентных и эфферентных лимфатических сосудов при раке с метастазами больше диаметра афферентных и эфферентных лимфатических сосудов в контрольной группе на 75,5 %, и 31,5 % соответственно (рис. 10).
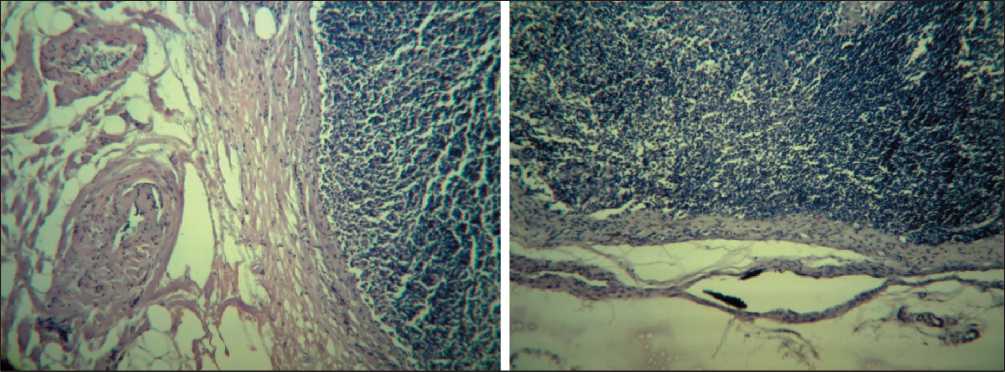
Рис. 9. Заполнение капсулы лимфатического узла лимфатическими капиллярами. Окраска гематоксилином и эозином, ×225 и ×90
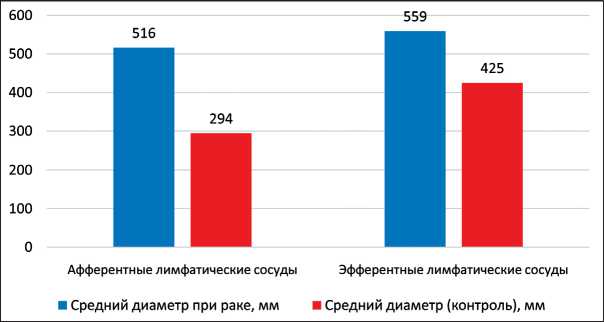
Рис. 10. Средние значения диаметра афферентных и эфферентных лимфатических сосудов сторожевых лимфатических узлов и лимфатических узлов в контрольной группе
Таким образом, цветная лимфография позволила определить особенности перфузии лимфатических узлов при раке молочной железы и установить степени её нарушения, а также установить факт развития коллатерального лимфообращения за счет неолимфомикрангиогенеза при метастатическом блоке.
Выводы
Цветная лимфография позволяет достоверно определить зоны функциональной перфузии и степени ее нарушения. Постлучевые изменения в тканях выраженно изменяют логистику тока лимфы и регионарного метастазирования. Капсула лимфатического узла с метастазами претерпевает патологическую трансформацию, характеризующуюся развитием сети лимфатических капилляров, выраженность которой зависит от степени метастатического блока. Метастатическое поражение лимфатического узла изменяет лимфатическую гидродинамику за счет изменения количества лимфатических сосудов и их диаметра.
Список литературы Микрохирургические методы исследования патологии лимфатической системы ex vivo при раке молочной железы
- Ганцев Ш.Х. Лимфатический узел и его микроокружение при раке. Атлас. М., 2018. 288.
- Ганцев Ш.Х., Умезава К., Султанбаев А.В., Ишмуратова Р.Ш., Фролова В.Ю., Ахметов А.Т., Фазлыева Э.А., Кзыргалин Ш.Р. Логистика лимфогенного метастазирования при раке молочной железы. Креативная хирургия и онкология. 2012; 2: 10-16.
- Ганцев Ш.Х. Новые технологии диагностики и лечения рака молочной железы. Креативная хирургия и онкология. 2009; 1: 6-9.


