МИКРОКЛАПАНЫ В МИКРОФЛЮИДНЫХ УСТРОЙСТВАХ. ЧАСТЬ 1. АКТИВНЫЕ МИКРОКЛАПАНЫ (ОБЗОР)
Автор: А. Н. Зубик, Г. Е. Рудницкая, А. А. Евстрапов
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Разработка приборов и систем
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Микроклапан является одним из важнейших функциональных элементов микрофлюидного устройства. Микроклапаны позволяют организовать движение потоков, их дозирование, регулирование расхода, смешивание, загрузку жидкости и ее изоляцию в реакционной камере, что широко используется в интегрированных микрофлюидных системах. Существует много типов микроклапанов, каждый из которых имеет разные характеристики и предназначен для решения определенных задач. Микроклапаны разработаны в виде активных или пассивных конструктивных элементов с механическими, немеханическими внутренними или внешними системами. В этой статье представлен обзор наиболее используемых конструкций микроклапанов в микрофлюидике, основанных на различных исполнительных механизмах.
Микрофлюидика, микроклапан, активный клапан, пассивный клапан
Короткий адрес: https://sciup.org/142238610
IDR: 142238610 | УДК: 62-33 + 62-38
Текст научной статьи МИКРОКЛАПАНЫ В МИКРОФЛЮИДНЫХ УСТРОЙСТВАХ. ЧАСТЬ 1. АКТИВНЫЕ МИКРОКЛАПАНЫ (ОБЗОР)
ВВЕДЕНИЕ боты в течение всего срока службы. Кроме того,
Микроклапаны являются ключевым компонентом многих микрофлюидных платформ "лаборатория на чипе" (lab on a chip) и систем полного микроанализа (μTAS, MicroTotal Analysis System). Идеальная микрофлюидная система объединяет многочисленные последовательные или параллельные операции, обеспечивает точное пространственно-временное высвобождение реагентов, управление потоками и необходимые условия для проведения синтетических или аналитических реакций, сбор продуктов реакций. Эффективные микроклапаны необходимы для интеграции в одно устройство нескольких операций, таких как транспортировка жидкости, смешивание, аликвотиро-вание, дозирование, промывка и фракционирование. Микроклапаны контролируют направление потоков жидкости, обеспечивают их синхронизацию и разделение внутри микрофлюидного устройства [1].
Однако многие современные подходы и требования при эксплуатации клапана усложняют конструкцию микрофлюидного устройства, поскольку приводят к необходимости включения дополнительных конструктивных элементов и влекут за собой дополнительные этапы или процессы при изготовлении [2].
В работе [3] отмечается, что основными показателями работы высокопроизводительного микроклапана являются: низкая утечка в закрытом состоянии, высокая скорость потока в открытом состоянии, низкое энергопотребление, устойчивость к загрязнениям и высокая стабильность ра- медицинские приложения, такие как носимые устройства для дозирования лекарств или имплантаты, требуют герметичности устройства, высокой надежности, а также биосовместимости всех смачиваемых или контактирующих с организмом поверхностей.
В качестве примера, где целесообразно использование клапанов с соответствующими требованиями, можно привести микрофлюидные устройства для полимеразной цепной реакции (ПЦР), которая играет важную роль в современных исследованиях в области биохимии, биологии и генетики. Потенциальные преимущества микро-чиповых устройств для ПЦР по сравнению с ПЦР-системами стандартного формата (микропланшеты и микропробирки) включают: снижение объемов потребления образцов и реагентов, сокращение времени анализа, большую чувствительность и портативность. Чипы для проведения ПЦР прошли путь от простых микрофлюидных чипов до высокоинтегрированных систем. Встраиваемые в чипы микроклапаны обеспечивают более высокий уровень интеграции и аналитической производительности, позволяя параллельно анализировать множество образцов, существенно сократить время анализа и избежать перекрестного загрязнения. Такие микроклапаны должны выдерживать давление, создаваемое при термоциклировании, и легко открываться после ПЦР. Оснащение клапанами входных, выходных или вентиляционных портов является важной функцией для успешного проведения ПЦР [4].
Конструкция микроклапанов определяется механизмом срабатывания, областью применения и функциональными особенностями. Большинство из них имеют микроканал и мембрану для управления его открытием / закрытием. Хотя в настоящее время существует множество конструкций микроклапанов, по-прежнему существуют такие проблемы, как утечка, низкая точность, невысокая надежность, значительное энергопотребление и высокая стоимость. Из-за огромного разнообразия нет общепринятой классификации конструкций микроклапанов [5].
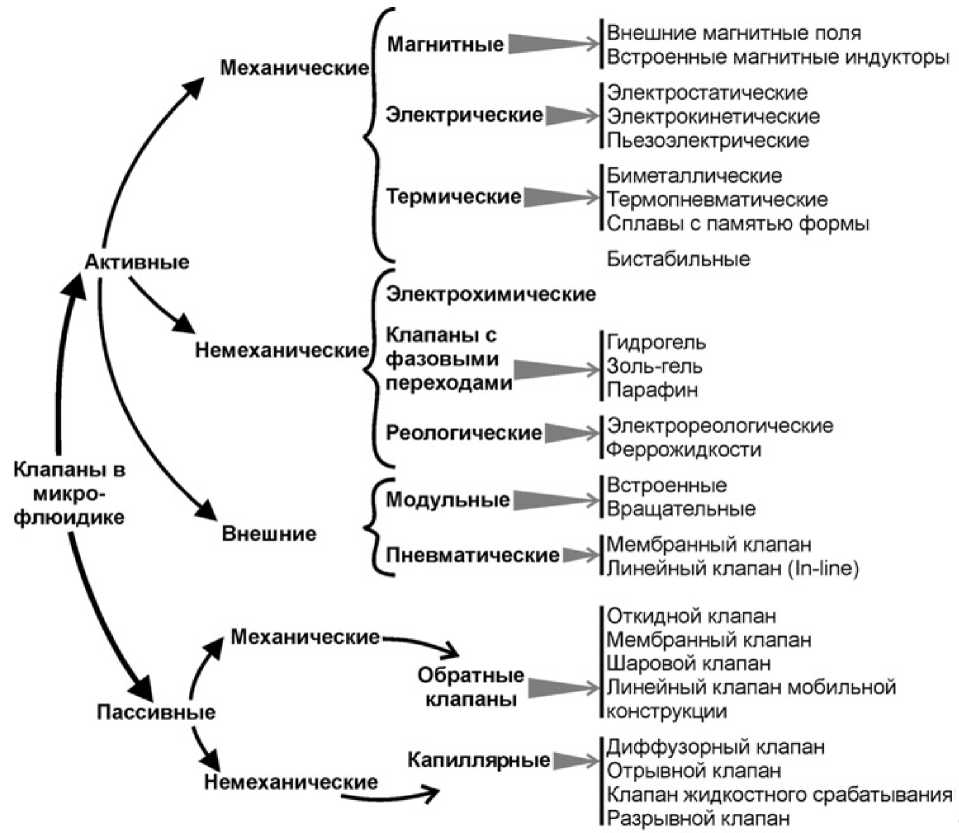
Авторы обзорной статьи [6] предлагают условно разделить микроклапаны на две основных категории, как показано на рис. 1.
В работе [5] предложено аналогичное деление. Отмечается, что активные клапаны используют внешние приводы, такие как магнитный, электрический или пневматический, для регулирования гидравлических сопротивлений микроканалов. Пассивные микроклапаны контролируют поток за счет обратного давления.
Кроме того, по исходному состоянию микроклапаны можно разделить на два типа: нормально открытые и нормально закрытые [5].
гель
Пассивные
Механические
Активные
Гидрогель
Парафин
Реологические^нРлектР°Реологические I Феррожидкости
Модульные
Внешние *
Механические
Капиллярные В*«»
Немеханические
Обратные клапаны
Встроенные Вращательные
Клапаны в микро-флюидике
Откидной клапан
Мембранный клапан
Шаровой клапан
Линейный клапан мобильной конструкции
Диффузорный клапан
Отрывной клапан
Клапан жидкостного срабатывания
Разрывной клапан
Пневматические^Мембранный клапан
_ 1Линеиныи клапан (In-line)
I Внешние магнитные поля Магнитные _ „ „ „ _
| Встроенные магнитные индукторы
Электростатические
Электрические ^►^ Электрокинетические
Пьезоэлектрические
Биметаллические
Термические^^*-»- Термопневматические Сплавы с памятью формы
*- Бистабильные
Электрохимические
\, I Клапаны с
Немеханические/
1 ШиоипЫМ И )переходами
Рис. 1. Классификация микроклапанов [6]
Нормально открытые микроклапаны препятствуют потоку жидкости только тогда, когда клапан активирован.
АКТИВНЫЕ МИКРОКЛАПАНЫ
Общая характеристика
Активные микроклапаны используют внешние физические поля или химическую стимуляцию для приведения в действие механических и немеханических движущихся частей и управления потоком жидкости [7, 8].
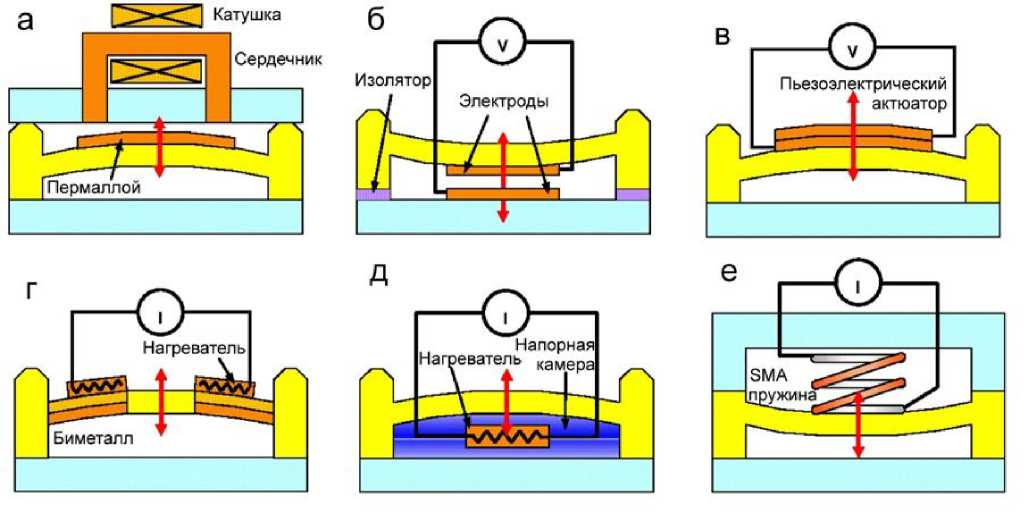
В активных микроклапанах применяются различные принципы срабатывания. Рис. 2 иллюстрирует широко используемые в конструкциях микроклапанов принципы срабатывания: магнитные, электрические, пьезоэлектрические, тепловые или другие способы [6].
Электростатический микроклапан
Электростатический микроклапан состоит из электрода, закрывающего клапан, электрода, открывающего клапан, и гибкой подвижной мембраны. Работа клапана осуществляется за счет управления напряжением, подаваемым на мембрану. Электростатические микроклапаны в основном представляют собой нормально закрытые микро- клапаны. Время отклика клапана короткое, а потребление энергии низкое [9]. Этот тип клапана в основном используется для управления потоком воздуха. Когда клапан используется для управления потоком жидкости, требуется высокое приложенное напряжение [5].
Конструкции нормально-закрытого электростатического микроклапана и нормально-открытого электростатического микроклапана не имеют явных отличий (рис. 3). Отличием является оригинальная форма мембраны, которая у нормально закрытого микроклапана она плоская, а у нормально открытого — вогнутая [10, 11].
Электрохимические микроклапаны
Электрохимические микроклапаны считаются высокоинтегрированными компонентами с очень низким мертвым объемом и потребляемой мощностью. Встраивание в микрофлюидную сеть может быть легко осуществлено благодаря их внеплоско-стной архитектуре. Клапан отличается компактным приводом, незначительной занимаемой площадью и подходит для массового производства. Эти характеристики делают подобные клапаны особенно привлекательными для приложений "лаборатория на чипе" [12].
Электроды
Нагреватель
Напорная
Нагреватель камера
Пьезоэлектрический актюатор
Биметалл
Изолятор
SMA с 'пружина
Катушка
Сердечник
Рис. 2. Иллюстрация принципов срабатывания активных микроклапанов с механическими подвижными частями.
а — электромагнитный; б — электростатический; в — пьезоэлектрический; г — биметаллический; д — термопневматический; е — привод из сплава с памятью формы [6]
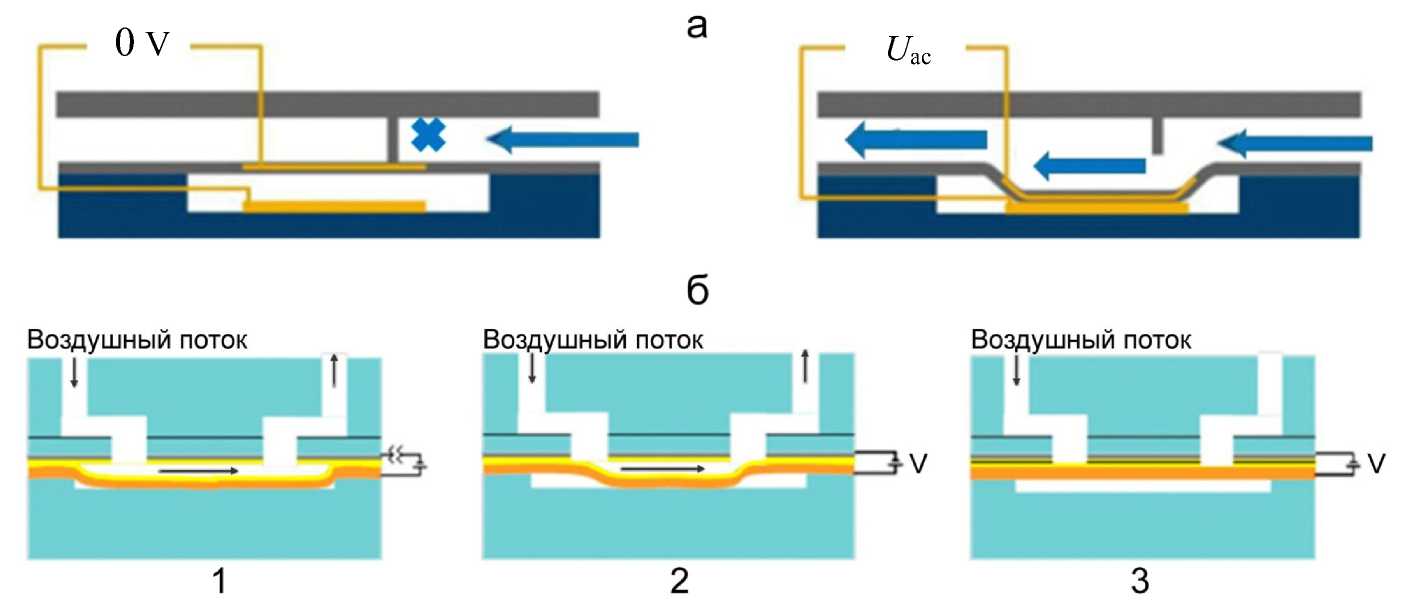
Рис. 3. Сравнение работы нормально закрытого (а) [11] и нормально открытого электростатических микроклапанов (б).
1 — напряжение отключено, клапан полностью открыт; 2 — напряжение включено, клапан начинает закрываться; 3 — напряжение включено, клапан полностью закрыт [10]
В отличие от электростатических микроклапанов, электрохимические микроклапаны используют электроды для электролиза растворов с целью получения водорода [13]. Микроклапан состоит из электрохимического привода, гибкой, например полидиметилсилоксановой (ПДМС) мембраны (или кантилевера из SU8) и микрокамеры. Привод имеет камеру, содержащую окислительновосстановительную пару в растворе, а объем раствора определяется требуемым объемом срабатывания клапана. Полученный при электролизе газ заставляет мембрану электрохимического микроклапана отклоняться [12].
Два типа принципиальных схем микроклапана с электрохимическим приводом:
-
1) микроклапан на основе кантилевера SU8 с электрохимическим приводом [12],
-
2) микрожидкостный клапан на основе мембраны с электрохимическим приводом [14], — показаны на рис. 4 и 5 соответственно.
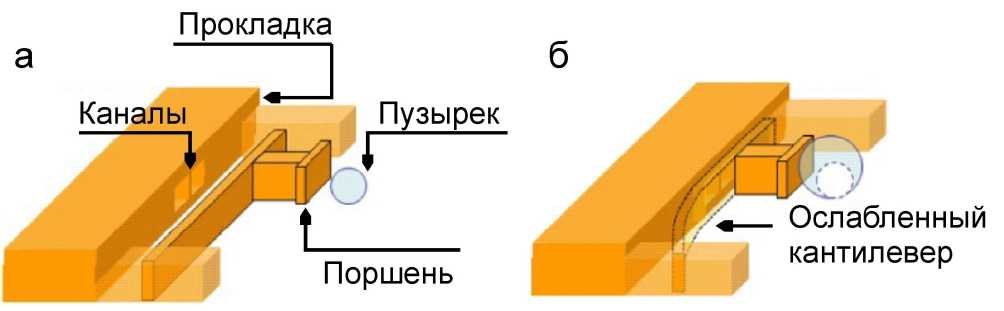
Рис. 4. Схематическое изображение работы электрохимического клапана с кантилевером.
а — в состоянии покоя и б — в закрытом состоянии [12]
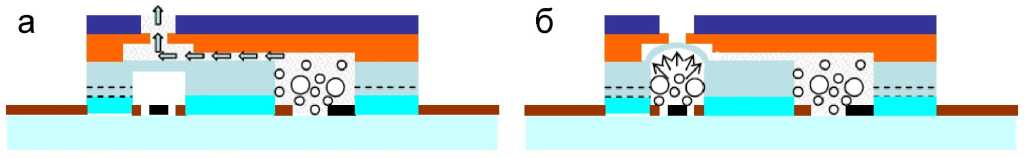
Рис. 5. Принципиальная схема работы электрохимического клапана [14].
а — клапан открыт, и жидкость откачивается из камеры и течет через клапан к выходу; б — клапан закрыт
Представленный в работе [12] клапан состоит из кантилевера, расположенного рядом с электрохимическим приводом, где пузырек газа образуется в результате реакции электролиза (рис. 4, а). Достигнув критического размера, пузырек начнет прижимать кантилевер к каналам с помощью поршня и блокирует их (рис. 4, б). Клапан имеет прокладку для минимизации утечек в закрытом режиме.
В работе [14] описана работа электрохимического микроклапана, изготовленного с помощью технологий LIGA (Lithographie, Galvanoformung, Abformung; литография, гальванопластика и формовка). Устройство состоит из двух электрохимических приводов. В качестве рабочего электрода использовались платиновые черненые электроды, а в качестве электрода сравнения — электроды Ag/AgCl (рис. 5).
Как показано на рис. 5, а, в результате электролиза раствора в правой камере возникающие пузырьки газа вытесняют жидкость и прогоняют ее через клапан к выходу. Электролиз в левой камере (рис. 5, б) приводит к увеличению перепада давления на ПДМС-мембране. Эта разница давлений толкает мембрану вверх. В результате мембрана закрывает выходное отверстие, и поток в канале останавливается.
Клапан можно снова открыть, манипулируя электрическим напряжением, подаваемым на электроды в камерах клапана. Перепад давления на мембране преодолевается силой восстановления эластичности мембраны, что приводит к уменьшению прогиба мембраны и открытию клапана.
Электрокинетический клапан
Электрокинетический клапан лучше всего описать как "маршрутизатор", который работает только с непрерывным потоком.
Группы А. Manz и J. Michael Ramsey [15, 16] продемонстрировали, как можно использовать электроосмотический поток для быстрого переключения жидкости из одного канала в другой на системе капиллярного электрофореза. В экспериментах использовали стеклянный микрочип (рис. 6); буферный раствор — 20 мМ тетраборат натрия (pH 9.2); образец — 100 мкМ раствор флуоресцентного красителя родамина В (в этом же буфере). При наложении электрического поля электроосмотический поток в канале чипа направлен к аноду [16].
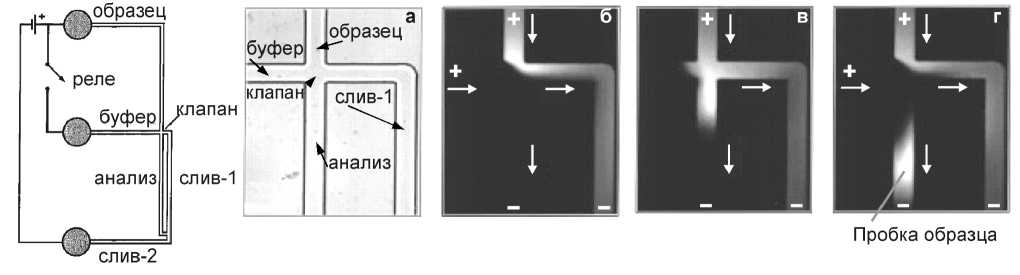
Рис. 6. Схема микрочипа с электрокинетическим клапаном (слева).
Изображение клапана в светлом поле (а); изображения флуоресценции красителя: б — загрузка, в — дозирование и г — в режиме анализа [16]
Потенциал, подаваемый на буферный резервуар через высоковольтное реле, препятствовал транспортировке пробы в канал анализа, а проба могла свободно течь по перекрестию в канал слива (рис. 6, б). Для подачи пробы в аналитический канал потенциал в буферном резервуаре выключается путем размыкания высоковольтного реле на короткий период времени, например 0.4 с (рис. 6, в). В результате чего образуется небольшая пробка образца, размер которой зависит от длительности выключения напряжения и скорости электроосмотического потока [16]. Таким образом проба электрокинетически транспортировалась в канал анализа. Чтобы остановить транспортировку образца в канал анализа, в буферном резервуаре был повторно приложен потенциал (рис. 6, г).
Электрокинетический клапан в настоящее время применяется в специфическом наборе приложений (главным образом в капиллярном электрофорезе, где используется электроосмотический поток) из-за серьезных недостатков, а именно на потоки жидкости при электрокинетическом транспорте влияют: 1) свойства поверхности каналов (на практике надежно работает только со стеклянными поверхностями, а микрочипы из стекла сложны и дороги); 2) ионный состав буфера. Кроме того, требуются дорогие и небезопасные источники высокого напряжения и коммутаторы напряжений, а для работы клапанов требуется течение непрерывного потока жидкости, поскольку работа клапана сводится только к перенаправлению двух потоков жидкости [16].
Пьезоэлектрический микроклапан
Пьезоэлектрические приводы широко используются в микронасосах, т.к. пьезоэлектрический эффект может генерировать как чрезвычайно большое изгибающее усилие (несколько МПа), так и малые перемещения (с деформацией менее 0.1%) [6].
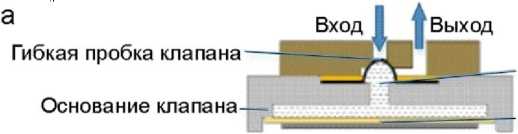
Важнейшими компонентами пьезоэлектрического микроклапана являются пьезоактюатор, мембрана клапана (гибкая пробка клапана) и седло клапана [17, 18]. К преимуществам клапанов этого типа относятся: относительная простота конструкции привода, масштабируемая геометрия, низкое энергопотребление, надежность и энергоэффективность. В традиционном варианте такого микроклапана пьезоэлектрический актюатор обычно используется в качестве пробки клапана, чтобы держать канал закрытым или открытым, поскольку смещение пьезоэлектрического актюатора невелико, пропускная способность и устойчивость к частицам низкие [19].
Представленный в работе [19] микроклапан приводится в действие дисковым пьезоэлектрическим актюатором, основанным на механизме гидравлического усиления. Пьезоэлектрический клапан (рис. 7) имеет гибкую запорную часть, основание
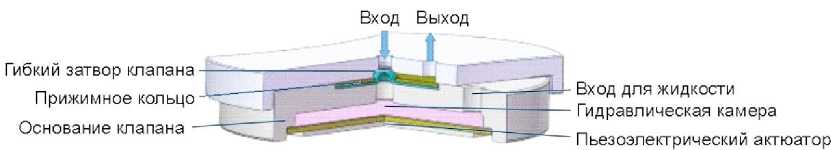
Рис. 7. Конструкция пьезоэлектрического микроклапана [19]
Движущая среда
Пьезоэлектрический актюатор
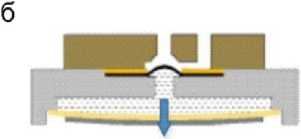
Рис. 8. Принцип работы пьезоэлектрического микроклапана.
а — нет внешнего напряжения; б — обратное напряжение; в — прямое напряжение [19]
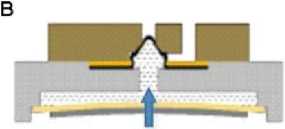
клапана, камеру для гидравлической жидкости, пьезоэлектрический актюатор, прижимное кольцо, входное отверстие для жидкости, выпускное отверстие и т.д. Гибкий затвор (пробка) клапана с полусферической поверхностью хорошо согласуется с отверстием клапана, что имеет очевидное преимущество.
Принцип работы микроклапана показан на рис. 8. Так как в камере с жидкостью имеется давление, гибкая пробка клапана со сферической формой плотно прилегает к отверстию клапана, имеющему соответствующую сферическую конфигурацию, обеспечивая хорошее уплотнение в "нормально закрытом" состоянии микроклапана (рис. 8, а). При подаче внешнего напряжения, называемого обратным напряжением, имеющим направление, совпадающее с направлением поляризации пьезоэлектрического актюатора, последний деформируется в направлении, показанном стрелкой (рис. 8, б). При этом жидкость в камере испытывает разряжение и заставляет гибкую пробку клапана соответственно сжиматься. Гибкая пробка клапана выходит из отверстия клапана, и канал открывается. При подаче внешнего напряжения, имеющего противоположное направление поляризации пьезоэлектрического актюатора (прямое напряжение), происходит его деформация, за счет которой возникает давление в жидкости, приводящее к уплотнению и перекрытию входного отверстия гибкой мембраной (рис. 8, в). Таким образом, разработанный микроклапан меняет рабочее состояние за счет изменения внешнего напряжения, воздействующего на пьезоэлектрический актюатор.
Магнитные клапаны
Типичный магнитный микроклапан состоит из постоянного магнита и гибкой эластичной мембраны из мягкого магнитного материала. Отклонение мембраны вызывается магнитными силами. Этот тип микроклапана относится к микроклапанам с внешним управлением. Простота конструкции обеспечивает низкую стоимость и портативность, что важно для одноразовых микрофлюидных систем. Магнитная консольная балка [20] и магнитный шарик [21–23] также могут быть использованы для управления (включение / выключение) клапаном. Кроме того, применение магнитореологических жидкостей, нанесенных на поверхность эластичной мембраны, позволяет управлять деформацией мембраны под действием магнита, обеспечивая возможность перекрытия микрофлюидного канала [24]. Таким образом, принцип работы магнитного микроклапана прост. Различные положения магнита определяют направление отклонения мембраны, а отклонение мембраны, вызванное магнитной силой, открывает или закрывает клапан. Операция может производиться дистанционно с помощью магнитных полей. Такой тип микроклапана приводится в действие извне, поэтому взаимодействие с контролируемой жидкостью отсутствует, что обеспечивает безопасность операторов при работе с некоторыми опасными веществами. Отмечается, что самым большим недостатком магнитных микроклапанов является невозможность полного перекрытия канала клапаном под действием магнитной силы [5].
В работе [20] использована магнитная V-образная консольная балка для управления клапаном. Базовая конструкция микроклапана показана на рис. 9, где представлены две основные части микроклапана: верхняя V-образная консольная балка и нижняя мембрана. Для того, чтобы закрыть микроклапан, V-образная балка имеет гальванически осажденный Co – Ni слой, который вызывает отклонение верхней балки в присутствии внешнего магнитного поля, создаваемого постоянным магнитом, расположенным вблизи микроклапана. Так, в зависимости от положения магнита, консольная балка открывает или закрывает путь течения жидкости (рис. 9).
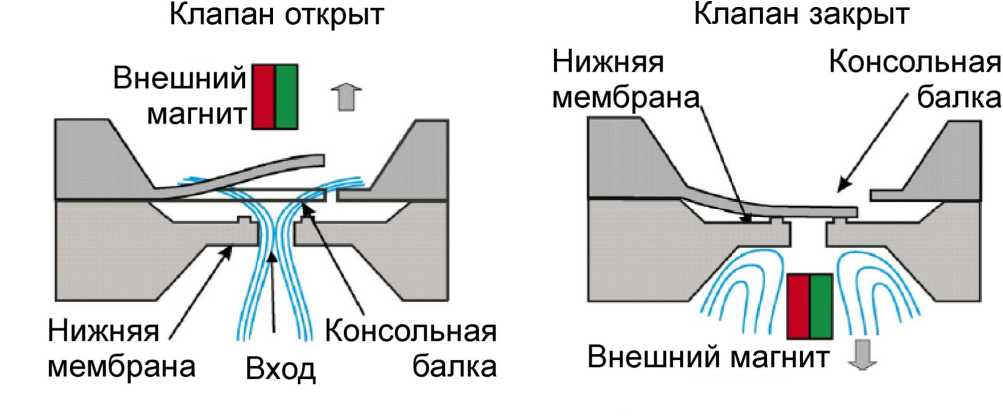
Рис. 9. Схема функционирования микроклапана с магнитным приводом [20]
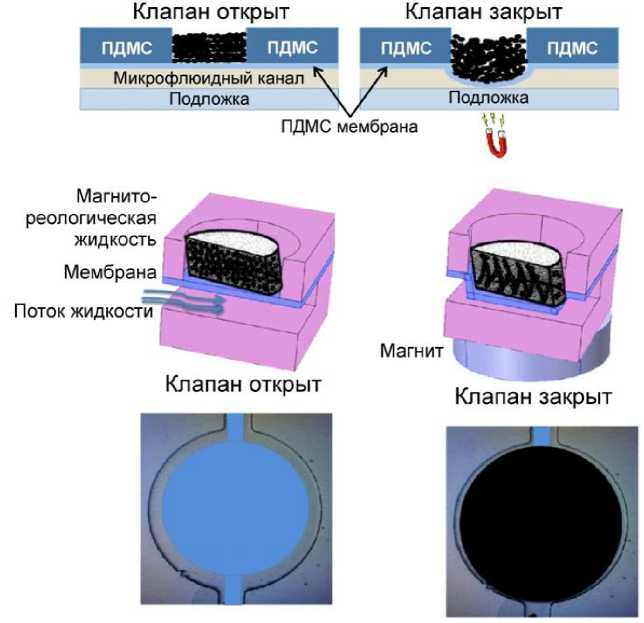
Рис. 10. Принцип действия эластомерного мембранного клапана с магнитореологической жидкостью и постоянным магнитом [24]
В работе [24] использовали магнитореологические жидкости, нанесенные поверх деформируемой мембраны из ПДМС. На рис. 10 приведен принцип действия микрофлюидного клапана с интегрированной мембраной с магнитореологической жидкостью. Воздействие магнита на магнитореологическую жидкость вызывает деформацию тонкого слоя ПДМС, что приводит к перекрытию канала.
Магнитореологическая жидкость представляет собой суспензию микрочастиц в жидкости-носителе. Ключевым преимуществом этого подхода является то, что магнитная проницаемость магнитореологической жидкости значительно выше по сравнению с магнитно-легированными ПДМС-мембранами, поэтому может быть достигнута значительно бóльшая деформация. Это позволяет изготавливать клапаны меньшего размера, что делает этот подход более подходящим для крупномасштабной микрофлюидной интеграции. Другими преимуществами этого подхода является экономическая эффективность, а также совместимость с широко используемыми процессами мягкой литографии для изготовления микрофлюидных каналов.
В [25] подробно описывается конструкция и использование магнитно-адгезивного клапана для хранения реагентов и управления потоком жидко- сти в микрофлюидном устройстве (рис. 11). Как схематично показано на рис. 11, первоначально закрытый клапан состоит из порта, соединяющего две (или более) камеры в разных плоскостях внутри многослойного устройства. Тонкое кольцо из чувствительной к давлению двусторонней клейкой ленты (PSA, pressure-sensitive adhesive) служило седлом для неодимового дискового магнита, который закрывает отверстие порта (рис. 11, "Закрыто"), предотвращая перемещение жидкости между двумя камерами. В закрытом состоянии клапана неодимовый дисковый магнит удерживается кольцом клеевой пленки над отверстием, соединяющим две камеры. Клапан приводился в действие путем контакта внешнего магнита с внешней поверхностью устройства (рис. 11, "Активировано"). Приложенное магнитное поле создавало усилие, достаточное для отрыва внутреннего магнита от кольца PSA и его смещения. При этом открывался соединительный порт между двумя камерами, что позволяло транспортировать содержимое между камерами в разных плоскостях просто при встряхивании устройства (рис. 11, "Открыто").
Нижняя панель рис. 11 содержит фотографии изготовленного магнитно-адгезивного клапана, соответствующие этапам работы, показанным на верхней панели.
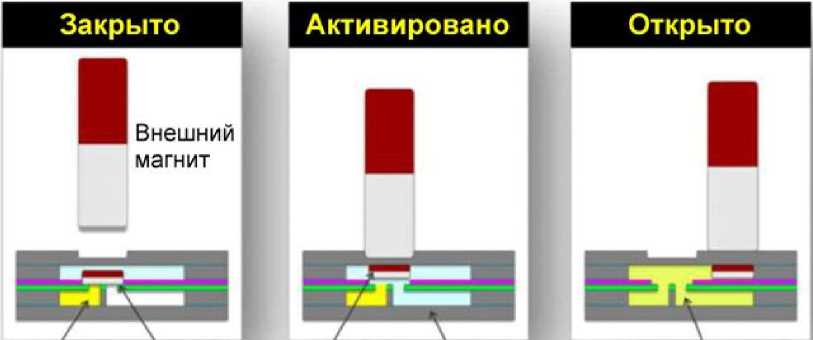

Рис. 11. Схема и фотографии работы магнитно-адгезивного клапана [25]
Таким образом, было продемонстрировано использование клапана на магнитно-адгезивной основе для контроля транспортировки и смешивания реагентов в устройстве без источников напряжения (источников энергии) с использованием только внешнего магнита и физического встряхивания устройства. Кроме того, приведение в действие клапана и управление потоком жидкости практически не требуют технических знаний или специального обучения, а также механических, тепловых или электрических воздействий. Это позволяет сохранить герметичность устройства во время работы, что повышает безопасность пользователя при анализе потенциально опасных материалов и помогает избежать загрязнения окружающей среды. Таким образом, простая и недорогая конструкция клапана (менее 0.20 доллара США за клапан) может облегчить разработку устройств "лаборатория на чипе" для использования в условиях ограниченных ресурсов [25].
Электромагнитный клапан
Разработаны специальные электромагнитные микроклапаны, основанные на использовании феррожидкости. Феррожидкости — это магнитные жидкости: взвесь ферромагнитных частиц размером 10 нм в жидкости-носителе. Жидкости-носители могут представлять собой воду, диэфиры, углеводороды или фторуглероды и подходят для различных применений. Феррожидкости принимают форму канала, потенциально обеспечивая хорошее уплотнение, и реагируют на внешние локализованные магнитные силы, обеспечивая срабатывание клапана. Конструкция и принцип работы электромагнитного микроклапана на основе феррожидкости показаны на рис. 12. Феррожидкость контролировала отклонение мембраны и регулировала поток жидкости в канале [26].
Клапан представляет собой многослойную конструкцию из трех кремниевых пластин, герметично соединенных между собой, и состоит из четырех основных частей: микроканала, электромагнитной катушки, гибкой мембраны из ПДМС и привода на основе феррожидкости. Микроканал размером 100 мкм × 3000 мкм × 15 мм (высота × ширина × длина) с полостью для удержания феррожидкости изготовлен методом глубокого реактивного ионного травления на кремниевой подложке
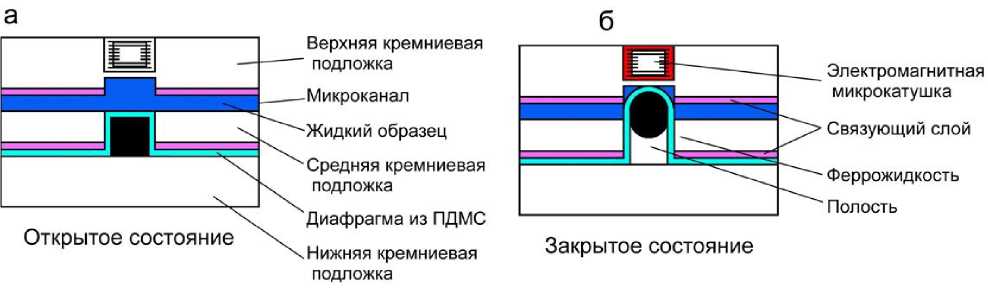
Рис. 12. Устройство и принцип работы электромагнитного микроклапана на основе феррожидкости [26].
размером 1000 мкм × 15 мм × 15 мм, расположенной посредине. Таким же способом получена полость для микрокатушки на верхней кремниевой подложке. Мембрана из ПДМС используется в качестве диафрагмы, а феррожидкость впрыскивается в полость. В качестве основания используется нижняя кремниевая подложка.
При подаче тока на микрокатушку создается поле магнитной индукции, которое вызывает электромагнитную силу между катушкой и феррожидкостью, вследствие чего мембрана между микрокатушкой и феррожидкостью упруго деформируется и блокирует поток жидкости в микроканале. Это — закрытое состояние клапана, как показано на рис. 12, б. Как только ток катушки отключается, электромагнитная сила исчезает, и диафрагма становится плоской благодаря силе упругости. Это — открытое состояние клапана, как показано на рис. 12, а.
Основная идея состоит в том, чтобы открывать и закрывать поток жидкости в микроканале, используя феррожидкость и электромагнитный привод. Отсутствие каких-либо механических движущихся частей и предотвращение загрязнения феррожидкостью являются основными преимуществами данной конструкции. Благодаря своей плоской конструкции такой микроклапан может быть интегрирован с другими микрофлюидными устройствами "лаборатории на чипе".
Пневматические микроклапаны
Пневматические микроклапаны широко используются в качестве ключевых компонентов для автоматизации манипуляций с жидкостями и управления потоком в микрофлюидике. Для их функционирования требуется внешняя система, обычно состоящая из вакуумного насоса (или компрессора) и пневматического привода.
Мембрана также является одной из наиболее важных частей пневматического микроклапана, изготавливаемая, например, из ПДМС, силикона или силиконовой резины [27]. Эти гибкие мембраны могут быть деформированы с помощью пневматического привода для закрытия или открытия жидкостного канала соответствующего клапана. В операционный (управляющий) канал встраивается тонкая мембрана, которая под действием разряжения или давления изгибается, что приводит к закрытию (или открытию) жидкостного микроканала, сопряженного с операционным. Толщина мембраны, давление срабатывания, конфигурация, уровень сложности конструкции и положение микроклапана в устройстве влияют на характеристики микроклапанов [5].
Варианты конструкций пневматических микроклапанов приведены в таблице [5].
Отметим, что наряду с клапанами, которые работают при приложении отрицательного давления (разрежении) в операционном канале (поз. 1 и 2, таблица), в микрофлюидике широко применяются клапаны, функционирующие при приложении повышенного давления к управляющему каналу или камере (поз. 3, таблица). Микроклапан такого типа изготавливается путем размещения тонкой мембраны из ПДМС между двумя микроканалами. Приложение пневматического давления к одному из микроканалов вызывает изгиб тонкой мембраны, в результате чего другой микроканал перекрывается [32–34].
Однако микроканал прямоугольного сечения (рис. 13, а) не способен обеспечить полное перекрытие потока жидкости из-за наличия прямых углов, т.к. мембрана не вписывается в прямоугольную форму микроканала. Это может привести к перекрестному загрязнению в случае использования микроклапанов для биологических экспериментов, например, с несколькими типами клеток.
Табл. Варианты конструкций пневматических микроклапанов [5]
|
№ п/п |
Принцип работы |
Ссыл ка |
Конструкция |
Давление (кПа) |
|||
|
Состояние |
|||||||
|
открыто |
закрыто |
||||||
|
1 |
LC W LC |
[29] |
большая мембрана |
1 |
0 |
||
|
каналах f—^ > управ ления^ Раб™й(^^ КапаJ 1 |
движение |
маленькая мембрана |
|||||
|
зазо^ |
|||||||
|
ne pi |
его родка |
||||||
|
[28] |
x^88v> Pi xv8& Pc ^38^ 'p s ^88v |
0 |
100 |
||||
|
2 |
frjgjjgjg^^ LC ®885 |
[30] |
Тонкая мембрана Толстая центральная ^акуум / мембрана ВХОД i М * ■** RL.^n |
40 |
|||
|
1 t;9?;w?;w?;w???? ег^м ;*х*????х»????х% ♦♦?;*; ■ bAWA%Vl«AWA№t Л^ХЛ* ■.■?.• -.♦.♦ЛМЛ-И |
|||||||
|
3 |
, ' LC p |
[31] |
6^6^ -^^3^ |
0 |
190 |
||
Примечание. LC — жидкостный канал; P — давление/разряжение, указывающее полость (канал, камера), в которой применяется давление для открытия или закрытия; штриховка означает слой ПДМС; диагональная штриховка — стекло или слои термопластика.
Для решения этой проблемы предложен микроканал с полукруглым поперечным сечением. В микроканале с таким сечением (рис. 13, б) мембрана способна надежно и плотно прилегать к стенке, что приводит к полному закрытию [32].
Из-за простой конструкции и низкой стоимости пневматический микроклапан применяется во многих приложениях, включая использование микро-флюидных контуров, для смешивания реагентов и сортировки капель, для быстрого ввода пробы и т.д. [5].
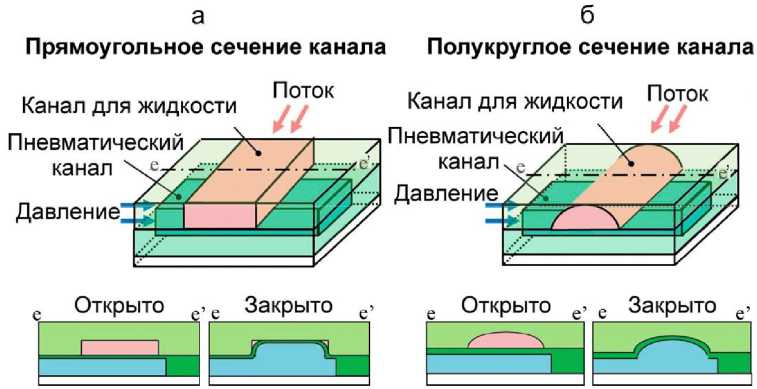
Рис. 13. Сечения микроканалов пневмоприводных микроклапанов [32]. а — прямоугольное сечение; б — полукруглое сечение
Микроклапаны на основе сплава с памятью формы
Эффект памяти формы является привлекательным явлением, обеспечивающим возможность приложения больших усилий в малых объемах, на основе которого разработан ряд простых и компактных конструкций микроклапанов, способных контролировать большие перепады давления и потоки [35–37].
Материалы с памятью формы (SMA, shape memory alloy) обладают термоупругостью и сверхупругостью, что позволяет им после существенной деформации (до 10%) восстанавливать свою форму, действуя с большими усилиями (доступные плотности энергии достигают 107 Дж/м3). Структуры SMA микрометрового размера допускают цикличность срабатывания порядка 100 Гц [38]. В работе [39] показано, что эффект памяти формы сохраняется для миниатюрных приводов размером до 100 нм.
Необычный запорный клапан (с управляющим элементом из SMA) для контроля движения жид- кого образца в ПЦР-чипе описан в работе [40] (рис. 14, а). Клапан представляет собой вентиляционное гидрофобное отверстие (диаметром 800 мкм) и внешний уплотнительный поршень, встроенный в микрочип и приводимый в движение проволокой из материала с памятью формы. Как только жидкая "пробка" образца под действием давления проходит мимо вентиляционного отверстия, давление сбрасывается, и образец останавливается за отверстием в определенном месте (рис. 14, б). Активация материала с SMA (на рисунке не показано) вызывает закрытие вентиляционного отверстия поршнем, при этом давление на "пробку" снова возрастает и приводит ее в движение (рис. 14, в). Благодаря встроенным клапанам в разработанном микрочиповом устройстве можно было проводить несколько этапов ПЦР-анализа (выделение ДНК, приготовление смеси для ПЦР, проведение реакции с определением конечного продукта) в полностью автоматизированном режиме [4].
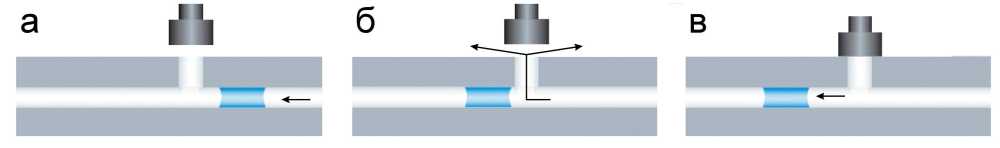
Рис. 14. Принцип работы микроклапанов с эффектом памяти для точного позиционирования образца.
а — жидкая "пробка" пробы проходит гидрофобное вентиляционное отверстие и сразу после него останавливается; б — воздух выходит через вентиляционное отверстие; в — после закрытия отверстия поршнем "пробка" пробы может двигаться дальше [40]
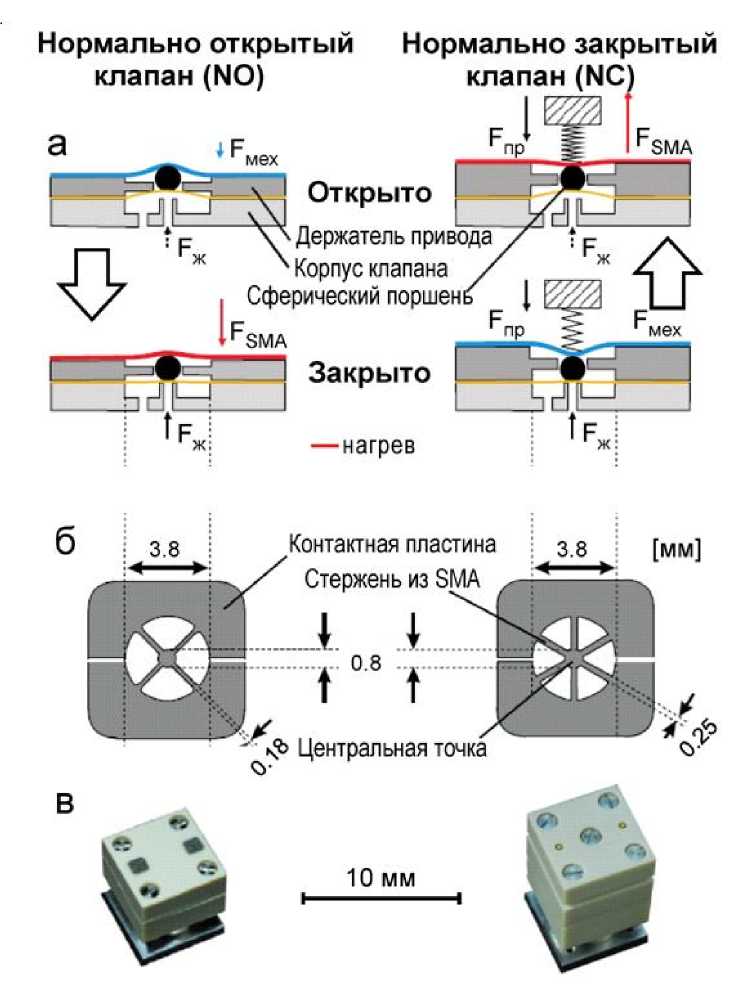
Рис. 15. Нормально открытый (NO) и нормально закрытый (NC) микроклапаны из сплава с памятью формы для переключения и управления жидкостями.
а — вид сбоку в открытом и закрытом состояниях; б — схематический вид сверху микроактюатора SMA для микроклапанов NO (слева) и NC (справа); в — фотографии микроклапанов [41]
В работе [41] описаны конструкции нормально открытого (NO) и нормально закрытого (NC) микроклапанов из сплава с памятью формы для управления потоками жидкости (рис. 15). Основным рабочим элементом клапанов является тонкая (толщиной 20 мкм) титано-никелевая SMA-фоль- га, которая обладает односторонним эффектом. В клапане фольга механически нагружается сферическим плунжером (диаметром 750 мкм) или нажимной пружиной (рис. 15, а). Для микроклапана NO при электрическом нагреве SMA-фольга принимает плоскую форму и прижимает плунжер вниз к седлу клапана. В микроклапане NC изначально пружина запирает клапан, при этом усилие пружины (Fпр) преобладает над механическим усилием (Fмех) фольги из SMA и давлением жидкости (Fж). При джоулевом нагреве SMA-фольга преодолевает усилие пружины и открывает микроклапан. Постоянные времени при электрическом нагреве определяются массой элемента из SMA, поэтому форма в виде расходящихся от центральной области тонких лучей позволила повысить скорость срабатывания клапана, а также регулировать усилие микропривода во внеплоско-стном направлении за счет изменения ширины, толщины и количества лучей (рис. 15, б). SMA-элемент изготавливается методом фотолитографии и мокрого химического травления, технологический процесс был специально разработан для серийного производства.
Микроклапаны были рассчитаны на расход 12.5 мл в минуту (вода) в открытом состоянии при разнице давлений 200 кПа. Расход регулируется обратной связью с помощью высокоскоростного датчика скорости потока. Точность управления потоком составила ~1.5%, время отклика — менее 24 мс. Высота микроклапанов NO и NC равна 7 и 11 мм соответственно (рис. 15, в). На верхней стороне обоих микроклапанов расположены четыре крепежных винта и две электрические соединительные площадки, а микроклапан NC имеет дополнительный винт для регулировки натяжения пружины.
В дальнейшем [42] был предложен многоходовой микроклапан, в котором два аналогичных элемента из SMA, работающих независимо друг от друга, обеспечивают смешивание или разделение потоков, предлагая либо два входа и один выход, либо один вход и два выхода. Контактирующие с жидкостью части клапана были изготовлены из биосовместимых материалов, благодаря чему микроклапан можно было использовать для биологических исследований.
С 2017 г. компания Memetis GmbH в Германии запустила в промышленное производство микроклапаны на основе фольги SMA, предназначенные для аналитических, биологических и медицинских применений. В работе [43] продемонстрирована компактная микрофлюидная платформа для полуавтоматического культивирования клеток, при изготовлении которой использовалось 11 клапанов Memetis GmbH, в том числе для точной регулировки расхода жидкости. Было протестировано два типа первичных клеток человека: эндотелиальные клетки пупочной вены и мезенхимальные стволовые клетки. Для сравнения использовали клетки, выращенные в стандартных культуральных чашках. Авторы работы [43] отмечают, что использование прецизионных миниатюрных клапанов и пьезоэлектрического насоса позволяет поддерживать ламинарный поток на протяжении всего многодневного анализа, избегая резких изменений напряжения сдвига во время перфузии среды, влияющих на клеточные культуры.
В работе [44] описан микроклапан на основе стержня из сплава с SMA, который сгибается / распрямляется при необычном способе нагрева: на подложку со стержнем нанесено парафиновое масло, которое нагревалось под действием поверхностных акустических волн от генератора радиочастотного сигнала и пары встречно-штыревых преобразователей. Как только температура SMA-стержня приближалась к температуре перехода (60 °С), стержень распрямлялся и алюминиевым упором перекрывал ПДМС-канал с жидкостью. Для нагрева 10 мкл масла требовалось 30 с, при этом мощность электрического сигнала должна быть не менее 21 децибел-милливатт. При увеличении мощности в 1.5 раза время включения микроклапана составило примерно 20 с, время выключения ― менее 46 с.
К преимуществам клапанов на основе SMA можно отнести: бесшумную работу, низкое энергопотребление, большие усилия и сравнительно большие перемещения.
Микроклапаны с немеханическими движущимися частями
Благодаря особым свойствам некоторые материалы могут использоваться для прямого приведения в действие микроклапанов. Например, материалы с фазовым переходом, включая полимерные (гидрогели, золь-гели), парафины, легкоплавкие сплавы (сплавы с низкой температурой плавления) и др. Микроклапаны с фазовым переходом являются относительно новыми и дешевыми по сравнению с традиционными механическими активными микроклапанами. Немеханические активные микроклапаны представляют особый интерес с точки зрения их простой конструкции и одноразовости, что делает их подходящими для применения в устройствах "лаборатории на чипе".
Биологические микроклапаны
Некоторые микроорганизмы и бактерии используются в качестве актюаторов микроклапана в составе микрофлюидных устройств. Существует вид колониальных одноклеточных зеленых водорослей рода Volvox , называемый V. Carteri , обладающий фототаксисом. В работе [45] сообщается о модели управляемого светом микроклапана, основанного на активации Volvox как подвижного элемента в многослойном микрофлюидном устройстве (рис. 16), изготовленном методом литья.
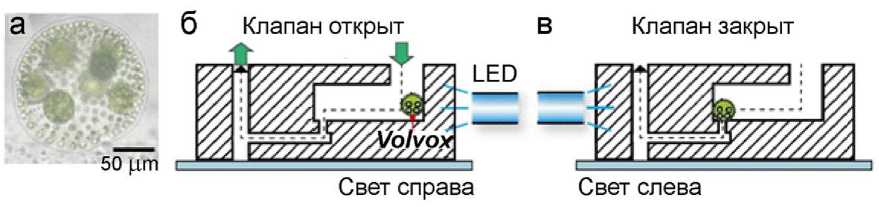
Рис. 16. Биологический микроклапан.
а — микрофотография колонии V. Carteri ; б, в — схема управления движением Volvox с помощью сине-зеленого светодиода LED [45]
Использовали фототаксическое поведение V. Carteri и контролировали их движение в микроканале при освещении светом. V. Carteri мигрировали по каналу к источнику света. Было обнаружено, что колония останавливает поток.
Микроклапаны с фазовым переходом
В микроклапанах используется парафин с низкой температурой плавления, фазовые переходы которого в твердую и жидкую фазы позволяют перекрывать поток жидкости в микроканале через деформируемую мембрану. Переключение клапана контролируется плавлением парафина при нагревании. Тонкая верхняя стенка отделяет канал для жидкости от парафиновой камеры, и основная задача заключается в том, чтобы жидкость в канале не была загрязнена твердым парафином. Для этого типа микроклапана требуется микрокамера для хранения парафина и микронагреватель для его нагрева. Время отклика на открытие и закрытие относительно медленное [5].
Авторы работы [46] разработали клапанный механизм, в котором парафин используется в качестве исполнительного материала, который претерпевает фазовый переход из твердого состояния в жидкое в ответ на изменения температуры. Продемонстрировано несколько схем клапана однократного применения (рис. 17). Первый клапан типа "закрыто – открыто" имеет блок из парафина, который изначально закрывает канал (рис. 17, а). Чтобы открыть канал, парафин расплавляется с помощью нагревателя под ним и под давлением перемещается по каналу далее по потоку. Как только расплавленный парафин выходит из зоны нагрева, он начинает затвердевать на стенке широкого участка канала, в результате чего канал становится открытым (рис. 17, б). Второй клапан типа "открыто – закрыто – открыто" представляет
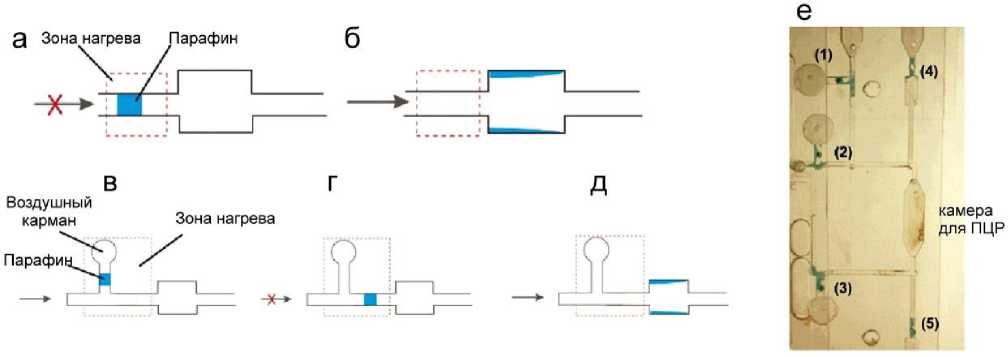
Рис. 17. Схематические иллюстрации конструкции парафинового микроклапана.
а, б — клапаны типа "закрыто – открыто"; в, г, д — клапаны типа "открыто – закрыто – открыто"; е — фотография камеры для ПЦР с парафиновыми микроклапанами [46]
собой нормально открытый клапан с блоком парафина, соединенным с воздушным карманом, который действует как воздушный насос с термическим приводом (рис. 17, в). При включении нагревателя воздух в кармане расширяется и выталкивает расплавленный парафин в регулируемый канал. Если нагреватель немедленно выключается, парафин затвердевает в канале основного потока, что приводит к закрытию канала (рис. 17, г). Канал можно снова открыть, повторно активировав нагреватель (рис. 17, д).
Планарная конструкция этих микроклапанов упрощает их изготовление и интеграцию. Эксперименты показали, что микроклапаны на основе парафина имеют нулевую утечку в "закрытом" положении. Клапаны на основе парафина прочны и обладают превосходной механической стабильностью. Время отклика, необходимое для открытия и закрытия клапанов на основе парафина, составляет порядка 10 с. Успешная амплификация ДНК в камере, закрытой микроклапанами на основе парафина, показала, что парафин совместим с ПЦР. На рис. 17, е, приведено изображение камеры ПЦР, окруженной пятью микроклапанами на основе парафина: клапаны 1–3 представляют собой "открытые – закрытые" клапаны, а клапаны 4 и 5 — "закрытые – открытые" клапаны. Перед началом ПЦР все клапаны находятся в "закрытом" положении.
Планарные конструкции клапанов на основе парафина не содержат гибкую диафрагму и поэтому являются более простыми, чем традицион- ные конструкции привода с мембраной, для которых требуются многослойные структуры [46].
Клапаны с применением металлического сплава с низкой температурой плавления
В работе [47] предложен ПДМС-клапан с фиксацией конечного положения за счет применения металлического сплава с низкой температурой плавления. По механизму работы клапан похож на пневматический, где к тонкой мембране на пересечении двух каналов (воздушному управляющему и жидкостному) добавляется промежуточный слой, заполненный материалом с низкой температурой плавления, известным как сплав или металл Филда (32.5% Bi, 51% In и 16.5% Sn) (рис. 18). Слой из металлического сплава при нагреве выше 62 °C становится жидким, позволяя управляющему воздушному каналу перекрывать участок жидкостного канала, при этом сплав Филда в жидком состоянии заполняет образовавшуюся выемку (рис. 18, б). Когда сплав остывает и затвердевает, закрытое положение клапана фиксируется (рис. 18, в) и может удерживаться в таком состоянии без потребления энергии. Клапан можно перевести в открытое состояние за счет нагрева в отсутствие пневматического давления, тогда восстанавливающая сила мембраны ПДМС выталкивает расплавленный сплав обратно в его исходную зону (рис. 18, г) с последующей фиксацией клапана в открытом положении после охлаждения (рис. 18, а).
Закрыто
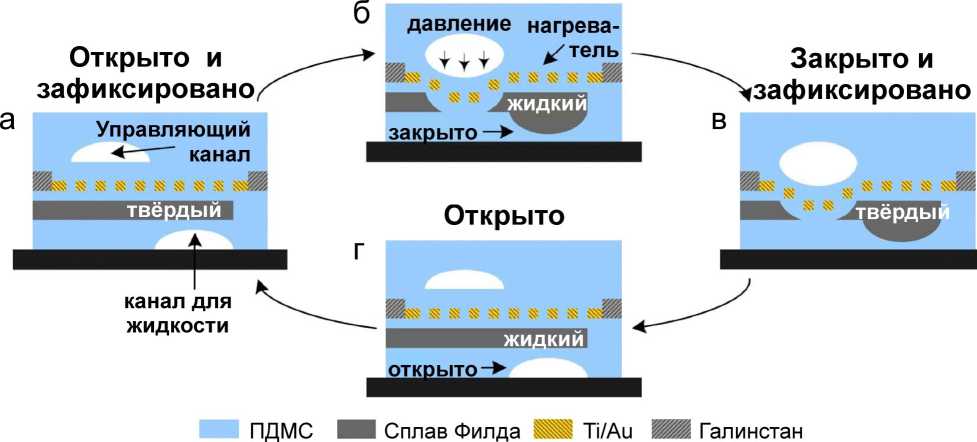
Рис. 18. Схема работы фиксирующегося клапана с легкоплавким сплавом [47].
а — клапан открыт и зафиксирован; б — локальный нагрев сплава Филда с помощью встроенного тонкопленочного нагревателя и подача пневматического давления в управляющий канал вытесняют сжиженный сплав Филда и закрывают клапан; в — отвод тепла приводит к затвердеванию сплава Филда, фиксируя клапан в закрытом состоянии; г — нагрев сплава Филда без пневматического давления возвращает клапан в открытое состояние
Регулируя пневматическое давление, мембрану можно зафиксировать в любом положении между открытым и закрытым состояниями.
Было изготовлено устройство из ПДМС с площадью мембраны клапана 100 мкм × 100 мкм. Нагрев осуществлялся за счет встроенного тонкопленочного металлического нагревателя. Время срабатывания определялось временем, требуемым для размягчения сплава Филда, и оценивалось примерно в 100 мс, время затвердевания сплава после отключения нагревателя было менее 33 мс. Мощность, необходимая для расплавления металла, составила 50 мВт при напряжении 1.2 В. Установлено, что при давлении жидкости выше 0.14 МПа мембрана закрытого клапана деформировалась, что приводило к утечке жидкости. Увеличение площади клапана позволило бы повысить критическое давление, однако это приведет к увеличению времени срабатывания клапана. Предполагается, что подобный запирающийся клапан можно использовать для хранения реагентов, когда рабочие давления невысокие, а требуется низкое энергопотребление и длительное хранение.
Гидрогелевые микроклапаны
Гидрогели представляют собой трехмерные сшитые полимерные сетки, способные поглощать большое количество воды. Гидрогели, чувствительные к стимулам, обладают большим потенциалом для миниатюрных, интегрированных сенсорных и исполнительных систем, особенно для технологии "лаборатория на чипе", но их применение все еще находится в зачаточном состоянии. Одна из основных причин может заключаться в том, что проектирование и реализация систем на основе гидрогеля являются сложными и трудоемкими [48].
Реагирующий на стимулы, или "умный", гидрогель способен обратимо и воспроизводимо изменять свой объем более чем на порядок даже при очень небольших изменениях параметров среды, таких как рН, температура, электрическое поле или световое излучение [6].
Beebe и коллеги [49] представили концепцию микроклапана на основе гидрогеля для автономного управления потоком внутри микрофлюидных каналов. Структурные элементы из гидрогеля были сформированы в микроканалах методом жидкофазной фотополимеризации in situ и были способны обратимо расширяться и сжиматься в зависимости от pH окружающей среды. Был разработан трехслойный гибридный микроклапан, который соединял гибкую ПДМС-мембрану с гидрогелевым приводом [50]. Гидрогелевый привод расширялся по мере того, как раствор с pH 11 протекал по управляющему каналу. Мембрана дефор- мировалась и полностью перекрывала рабочий канал.
Было обнаружено, что если поперечные размеры объектов из гидрогеля меньше высоты канала, они склонны деформироваться или мигрировать по каналу при изменении объема. Для изготовления стабильных объектов с малым временем отклика предложено полимеризовать гидрогелевые структуры вокруг предварительно изготовленных в канале штифтов. Штифты обеспечивают надежную поддержку, а также улучшают временной отклик благодаря небольшому расширению каждой из тонких гидрогелевых оболочек, окружающих
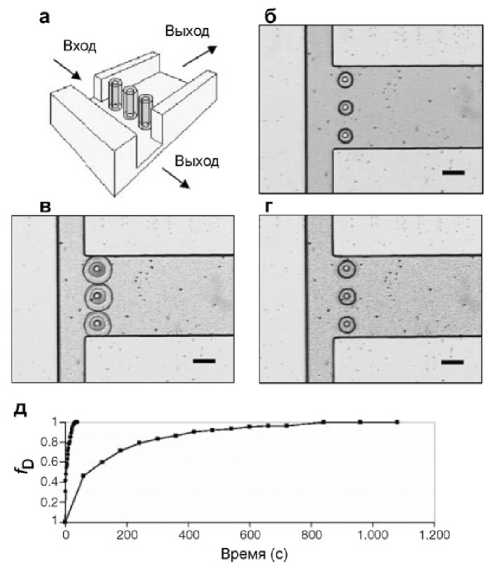
Рис. 19. Конструкция микроклапана со штифтами в микроканале, служащими опорой для гидрогелей [49].
а — схема клапана со штифтами с гидрогелевыми оболочками; б — изображение сечения канала после полимеризации гидрогеля; в — гидрогелевые оболочки блокируют боковой канал в активном состоянии; г — "сжатые" оболочки гидрогеля позволяют жидкости протекать по боковому каналу; д — улучшение временнóго отклика конструкции с гидрогелевой оболочкой (кружки) по сравнению с альтернативной конструкцией, в которой используется единственная цилиндрическая структура большего размера в канале того же размера (квадраты), fD — относительное изменение диаметра штифты. Массив штифтов с гидрогелевым покрытием может контролировать поток в больших каналах, как показано на рис. 19. Реакция на изменение рН для расширения этой конструкции клапана со штифтами составляет 8 с (реакция на сжатие имеет тот же порядок). Напротив, альтернативная конструкция клапана, в которой используется одна большая цилиндрическая структура в канале того же размера, имеет переходную характеристику 130 с в том же диапазоне pH. Таким образом, интеграция штифтов с гидрогелевыми оболочками в мик-рожидкостные системы обеспечивает преодоление основного недостатка гидрогелевых клапанов — медленного отклика [49].
В [49] также представлена конструкция, в которой гидрогелевый компонент может характеризовать химическую среду в одном канале и регулировать поток в соседнем канале, как показано
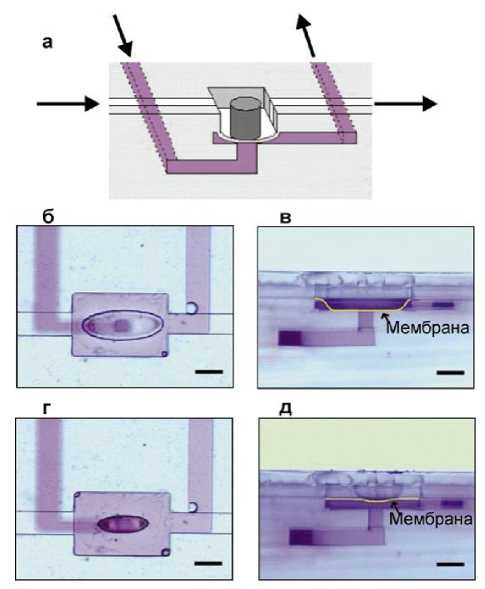
Рис. 20. Конструкция и принцип функционирования запорного клапана с гидрогелем [49].
а — конструкция клапана, стрелки обозначают направление потока жидкости; б, в — гидрогель расширяется и деформирует мембрану, блокируя поток в соседнем канале.
На изображениях слева (б, г) показан вид устройства сверху, а на изображениях справа (в, д) показан вид сбоку. Жидкость в закупоренном канале окрашена для наглядности; г, д — гидрогель сжимается, и мембрана возвращается в положение, позволяющее жидкости течь в соседний канал на рис. 20. Это устройство содержит гибкую мембрану, которая может деформироваться, блокируя поток в соседнем канале. Структура гидрогеля, полимеризованного в канале над мембраной, расширяется или сжимается при изменении рН. Силы, связанной с этими объемными изменениями, достаточно, чтобы деформировать мембрану и, следовательно, контролировать поток в нижнем канале.
В этой же работе [49] представлен "сортировщик потоков". Это устройство состоит из Т-образного канала, в котором вход в каждую ветвь перекрывается гидрогелевой структурой уникального химического состава. Гидрогель одного состава расширяется при высоком рН и сжимается при низком рН в первом канале, в то время как гидрогель другого состава закрывает второй канал и демонстрирует обратное поведение (т.е. сжимается при высоком рН и расширяется при низком рН). Устройство и график его результирующих выходных характеристик показаны на рис. 21. Это устройство автоматически направляет поток в центральном канале в ту или иную ветвь в зависимости от рН. В определенном диапазоне рН (5.7–6.8) оба гидрогелевых клапана набухают, закупоривая канал. Каждый гидрогелевый клапан выполняет исполнительные и регулирующие
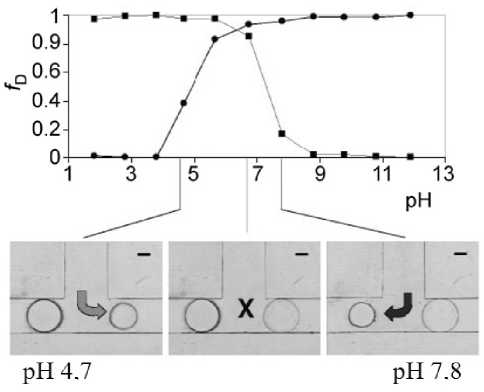
Рис. 21. Реакция разных гидрогелей на рН окружающей жидкости [49].
Вверху — относительное изменение диаметра (fD) гидрогелей в зависимости от pH. Внизу — изображения, демонстрирующие переключение ("сортировку") потока жидкости в зависимости от pH. Гидрогель, закрывающий правый канал (кружки), расширяется в щелочной среде и сжимается в кислой. Гидрогель, закрывающий левый канал (квадраты), расширяется в кислой и сжимается в щелочной среде. При рН 7.8 поток направлен в левый канал. При рН 4.7 поток направлен в правый канал функции, обычно реализуемые отдельными компонентами (клапан, датчики, электроника) в традиционной системе. Подбирая химический состав гидрогеля, можно изменить выходную характеристику, что позволяет использовать чувствительные к pH гидрогели в различных областях.
Известно, что термочувствительный гидрогель, поли(N-изопропилакриламид), претерпевает значительные обратимые объемные изменения при повышении его температуры от комнатной до температуры выше температуры фазового перехода 32 оC.
Wang и соавторы [51] воспользовались этим эффектом изменения объема для создания термоклапанов на основе гидрогеля для микрофлюид-ных систем. Эти клапаны привлекательны тем, что они не требуют каких-либо механических компонентов, в них нет движущихся частей, и их легко интегрировать в подложки из различных материалов. Были сконструированы два типа клапанов. В одном случае клапан состоял из цилиндрической пробки, вставленной в тефлоновую трубку. Во втором случае клапан был вставлен в полость, встроенную в поликарбонатную конструкцию. В последнем случае гидрогель занимал около половины объема полости. В обоих случаях время закрытия (набухания) клапана составило около 4.5 с. Время открытия клапана зависело от объема гидрогеля. Гидрогелевые клапаны работали в течение многих циклов открытия и закрытия с хорошей воспроизводимостью и без каких-либо видимых ухудшений производительности.
В работе [51] также описываются конструкции устройств с гидрогелевыми клапанами, их применение для управления потоками, дозирования образцов и реагентов, распределения образцов по нескольким каналам анализа.
На рис. 22 схематично показан делитель потоков на основе гелевых клапанов, который распределяет образец по четырем камерам. Устройство изготовлено из поликарбоната. Дозирующие камеры могут иметь как одинаковые, так и разные объ-
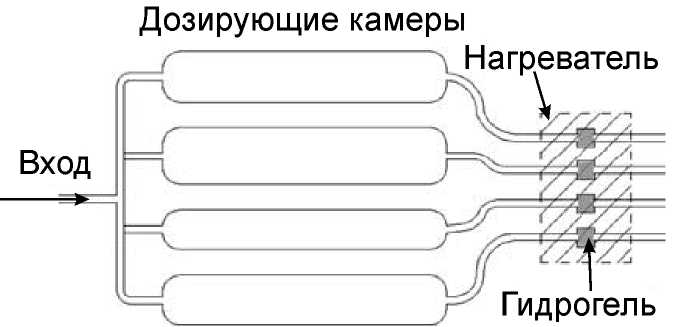
Рис. 22. Схема делителя потока с гелевыми клапанами [51]
емы. Каналы после дозирующих камер снабжены гидрогелевыми клапанами. Образец поступает через входной канал и заполняет дозирующие камеры. Камера с наименьшим гидравлическим сопротивлением заполняется первой. Когда жидкость достигает гидрогелевой пробки, гидрогель набухает и блокирует проход в этом конкретном канале. Затем заполняется другая из оставшихся камер и т.д., пока не будут заполнены все дозирующие камеры. Как только все дозирующие камеры заполнены, гидрогелевые клапаны нагреваются (термочувствительный гель сжимается) и открываются. Аликвоты жидкости из дозирующих камер продвигаются по четырем различным каналам анализа.
ЗАКЛЮЧЕНИЕ
Основной задачей при создании микроаналитических систем и систем "лаборатория-на-чипе" для биохимических, биологических и медицинских применений является обеспечение прецизионного и контролируемого движения микропотоков жидких (и газообразных) сред в микрофлюидном устройстве. Для решения этой задачи исследовательские группы предлагают разнообразные конструкции микроклапанов для активного управления потоками жидкости [4, 6]. Однако активные микроклапаны имеют ряд недостатков, а именно: относительно высокую стоимость, определенные трудности при интеграции в устройство, необходимость применения высокотехнологичных процессов при изготовлении и сборке, а иногда — достаточно сложных схем управления.
Активный механический клапан обычно состоит из механически управляемой мембраны или рычажной конструкции в сочетании с приводным механизмом для перекрытия потока жидкости. Привод клапана может быть встроенным в устройство (магнитным, электростатическим, пьезоэлектрическим или тепловым, таким как сплав с памятью формы или реологический материал) или приводиться в действие от внешних систем (источники магнитного или электромагнитных полей, вакуумные насосы или газовые компрессоры). Внешние системы увеличивают сложность и стоимость устройства, не подходят для компактных или миниатюрных систем.
Немеханические активные клапаны (с фазовым переходом, биологические, гидрогелевые), хотя и представляют особый интерес для исследователей с позиций простоты конструкции, невысокой стоимости, возможности однократного использования, но все-таки на настоящий момент времени являются достаточно редко применяемыми.
Следует отметить, что практически все активные клапаны, за исключением некоторых гидрогелевых, требуют использования внешних источников энергии для обеспечения работы приводов, что ограничивает их применение, например, при создании устройств для использования в условиях ограниченных ресурсов, например систем для диагностики на месте события "Point-of-Care".
Работа выполнена в рамках Государственного задания Министерства науки и высшего образования Российской Федерации № 075-01157-23-00, тема "Мик-рофлюидные устройства с интегрированными функциональными микро- и наноразмерными структурами для биологических и медицинских исследований", шифр FFZM-2022-0012.
Список литературы МИКРОКЛАПАНЫ В МИКРОФЛЮИДНЫХ УСТРОЙСТВАХ. ЧАСТЬ 1. АКТИВНЫЕ МИКРОКЛАПАНЫ (ОБЗОР)
- 1. Au A.K., Lai H., Utela B.R., Folch A. Microvalves and Micropumps for BioMEMS // Micromachines. 2011. Vol. 2. Р. 179–220. DOI: 10.3390/mi2020179
- 2. Woolf M.S., Dignan L.M., Lewis H.M., Tomley C.J., Nauman A.Q., Landers J.P. Optically-controlled closable microvalves for polymeric centrifugal microfluidic devices // Lab Chip. 2020. Vol. 20. Р. 1426–1440. DOI: 10.1039/C9LC01187K
- 3. Durasiewicz C.P., Güntner S.T., Maier P.K., Hölzl W., Schrag G. Piezoelectric normally open microvalve with multiple valve seat trenches for medical applications // Appl. Sci. 2021. Vol. 11, iss. 19. Id. 9252. DOI:10.3390/app11199252
- 4. Zhang C., Xing D., Li Y. Micropumps, microvalves, and micromixers within PCR microfluidic chips: Advances and trends // Biotechnology Advances. 2007. Vol. 25, iss. 5. P. 483–514. DOI: 10.1016/j.biotechadv.2007.05.003
- 5. Qian J-Y., Hou C-W., Li X-J., Jin Z-J. Actuation mechanism of microvalves: a review // Micromachines. 2020. Vol. 11, no. 2. Id. 172. DOI: 10.3390/mi11020172
- 6. Oh K.W., Ahn C.H. A review of microvalves // J. Micromech. Microeng. 2006. Vol. 16, no. 5. Р. R13–R39. DOI: 10.1088/0960-1317/16/5/R01
- 7. Wu J., Fang H., Zhang J., Yan S. Modular microfluidics for life sciences // J Nanobiotechnol. 2023. Vol. 21. Art. 85. DOI: 10.1186/s12951-023-01846-x
- 8. Huang M., Zheng L., Zhang H., Xue S., Ni H. Application of microvalve based on computer control in biological chemical and medical // Proceedings of the 2019 International Conference on Artificial Intelligence and Advanced Manufacturing - AIAM 2019. Dublin, Ireland. Art. 18. P. 1–6. DOI: 10.1145/3358331.3358349
- 9. Bae B., Han J., Masel R.I., Shannon M.A. A bidirectional electrostatic microvalve with microsecond switching performance // Journal of Microelectromechanical Systems. 2007. Vol. 16, no. 6. P. 1461–1471. DOI: 10.1109/jmems.2007.907782
- 10. Anjewierden D., Liddiard G.A., Gale B.K. An electrostatic microvalve for pneumatic control of microfluidic systems // J. Micromech. Microeng. 2012. Vol. 22. Id. 025019. DOI: 10.1088/0960-1317/22/2/025019
- 11. Yıldırım E., Arıkan M.S., Külah H., Arikan M.S. A normally closed electrostatic parylene microvalve for micro total analysis systems // Sens. Actuators A: Phys. 2012. Vol. 181. P. 81–86. DOI: 10.1016/j.sna.2012.05.008
- 12. Ezkerra A., Fernández L.J., Mayora K., RuanoLópez J.M. A microvalve for lab-on-a-chip applications based on electrochemically actuated SU8 cantilevers // Sens. Actuators B: Chem. 2011. Vol. 155, iss. 2. P. 505–511. DOI: 10.1016/j.snb.2010.12.054
- 13. Das C., Payne F. Design and characterization of low power, low dead volume electrochemically-driven microvalve // Sens. Actuators A: Phys. 2016. Vol. 241. P. 104–112. DOI: 10.1016/j.sna.2016.01.038
- 14. Lee N.E., Soper S., Wang W. Design and fabrication of an electrochemically actuated microvalve // Microsyst. Technol. 2008. Vol. 14. P. 1751–1756. DOI: 10.1007/s00542-008-0594-3
- 15. Harrison D.J., Fluri K., Seiler K., Fan Z.H., Effenhauser C.S., Manz A. Micromachining a miniaturized capillary electrophoresis-based chemical-analysis system on a chip // Science. 1993. Vol. 261, iss. 5123. P. 895–897. DOI: 10.1126/science.261.5123.895
- 16. Jacobson S.C., Ermakov S.V., Ramsey J.M. Minimizing the number of voltage sources and fluid reservoirs for electrokinetic valving in microfluidic devices // Anal. Chem. 1999. Vol. 71, no. 15. P. 3273–3276. DOI: 10.1021/ac990059s
- 17. Fazal I., Elwenspoek M.C. Design and analysis of a high pressure piezoelectric actuated microvalve // J. Micromech. Microeng. 2007. Vol. 17, no. 11. P. 2366–2379. DOI: 10.1088/0960-1317/17/11/026
- 18. Nafea M., Nawabjan A., Sultan Mohamed Ali M. A wirelessly-controlled piezoelectric microvalve for regulated drug delivery // Sensors and Actuators A: Physical. 2018. Vol. 279, iss. 15. P. 191–203. DOI: 10.1016/j.sna.2018.06.020
- 19. Chen S., Lu S., Liu Y., Wang J., Tian X., Liu G., Yang Z. A normally-closed piezoelectric micro-valve with flexible stopper // AIP Adv. 2016. Vol. 6, iss. 4. Id. 045112. DOI: 10.1063/1.4947301
- 20. Casals-Terré J., Duch M., Plaza J.A., Esteve J., PérezCastillejos R., Vallés E., Gomez E. Design, fabrication and characterization of an externally actuated ON/OFF microvalve // Sens. Actuators A: Phys. 2008. Vol. 147, iss. 2. P. 600–606. DOI: 10.1016/j.sna.2008.06.022
- 21. Chang P.J., Chang F.W., Yuen M.C., Otillar R., Horsley D.A. Force measurements of a magnetic micro actuator proposed for a microvalve array // J. Micromech. Microeng. 2014. Vol. 24, no. 3. Id. 034005. DOI: 10.1088/0960-1317/24/3/034005
- 22. Pan T., McDonald S.J., Kai E.M., Ziaie B. A magnetically driven PDMS micropump with ball check-valves // Journal of Micromechanics and Microengineering. 2005. Vol. 15, no. 5. P. 1021–1026. DOI: 10.1088/0960-1317/15/5/018
- 23. Fu C., Rummler Z., Schomburg W. Magnetically driven micro ball valves fabricated by multilayer adhesive film bonding // Journal of Micromechanics and Microengineering. 2003. Vol. 13, no. 4. P. S96–S102. DOI: 10.1088/0960-1317/13/4/316
- 24. Gholizadeh A., Javanmard M. Magnetically actuated microfluidic transistors: miniaturized micro-valves using magnetorheological fluids integrated with elastomeric membranes // J. Microelectromechanical Syst. 2016. Vol. 25, iss. 5. P. 922–928. DOI: 10.1109/JMEMS.2016.2586420
- 25. Harper J.C., Andrews J.M., Ben C., Hunt A.C., Murton J.K., Carson B.D., Bachand G., Lovchik J.A., Arndt W.D., Finley M.R., Edwards T.L. Magneticadhesive based valves for microfluidic devices used in low-resource settings // Lab Chip. 2016. Vol. 16. P. 4142–4151. DOI: 10.1039/C6LC00858E
- 26. Liu T.G., Wu J., Xia C., Qian Z.H. A microvalve driven by a ferrofluid-based actuator // Adv. Mater. Res. 2012. Vol. 433-440. P. 3767–3772. DOI: 10.4028/www.scientific.net/amr.433-440.3767
- 27. Hulme S.E., Shevkoplyas S.S., Whitesides G.M. Incorporation of prefabricated screw, pneumatic, and solenoid valves into microfluidic devices // Lab Chip. 2009. Vol. 9, no. 1. P. 79–86. DOI:10.1039/b809673b
- 28. Goldowsky J., Knapp H.F. Gas penetration through pneumatically driven PDMS micro valves // RSC Adv. 2013. Iss. 39. DOI: 10.1039/c3ra42977f
- 29. Perdigones F., Luque A., Quero J.M., Sánchez F.A.P. Pneumatically actuated positive gain microvalve with nchannel metal-oxide semiconductor-like behaviour // Micro Nano Lett. 2011. Vol. 6, no. 6. P. 363–365. DOI: 10.1049/mnl.2011.0150
- 30. Baek J.Y., Park J.Y., Ju J.I., Lee T.S., Lee S.H. A pneumatically controllable flexible and polymeric microfluidic valve fabricated via in situ development // J. Micromech. Microeng. 2005. Vol. 15. P. 1015–1020. DOI: 10.1088/0960-1317/15/5/017
- 31. Samuel R., Thacker C.M., Maricq A.V., Gale B. Simple and cost-effective fabrication of microvalve arrays in PDMS using laser cut molds with application to C. elegans manipulation in microfluidics // J. Micromech. Microeng. 2014. Vol. 24, no. 10. Id. 105007. DOI: 10.1088/0960-1317/24/10/105007
- 32. Kaminaga M., Ishida T., Omata T. Fabrication of pneumatic microvalve for tall microchannel using inclined lithography // Micromachines. 2016. Vol. 7, iss. 12. Id. 224. DOI: 10.3390/mi7120224
- 33. Oh J., Kim G., Noh H. A novel PDMS/Parylene microvalve with three dimentional dome petal shape // Proceedings of the 2010 IEEE 23rd International Conference on Micro Electro Mechanical Systems (MEMS), Wanchai, Hong Kong, China, 24–28 January 2010. Р. 1075–1078. DOI: 10.1109/MEMSYS.2010.5442396
- 34. Galanopoulos S., Chatzidai N., Melissinaki V., Selimis A., Schizas C., Farsari M., Karalekas D. Design, fabrication and computational characterization of a 3D micro-valve built by multi-photon polymerization // Micromachines. 2014. Vol. 5, no. 3. P. 505–514. DOI: 10.3390/mi5030505
- 35. Wolf R.H., Heuer A.H. TiNi (shape memory) films on silicon for MEMS applications // J. Microelectromech. Syst. 1995. Vol. 4, iss. 4. P. 206–212. DOI: 10.1109/84.475547
- 36. Kahn H., Huff M.A., Heuer A.H. The TiNi shape-memory alloy and its applications for MEMS // J. Micromech. Microeng. 1998. Vol. 8, no. 3. P. 213–221. DOI: 10.1088/0960-1317/8/3/007
- 37. Kohl M., Skrobanek K.D., Miyazaki S. Development of stress-optimised shape memory microvalves // Sensors Actuators A: Phys. 1999. Vol. 72, iss. 3. P. 243–250. DOI: 10.1016/S0924-4247(98)00221-0
- 38. Kohl M., Brugger D., Ohtsuka M., Takagi T. A novel actuation mechanism on the basis of ferromagnetic SMA thin films // Sens Actuators A: Phys. 2004. Vol. 114, iss. 2-3. P. 445–450. DOI: 10.1016/j.sna.2003.11.006
- 39. Kohl M., Schmitt M., Backen A., Schultz L., Krevet B., Fähler S. Ni-Mn-Ga shape memory nanoactuation // Appl Phys Lett. 2014. Vol. 104, iss. 4. Id. 043111. DOI: 10.1063/1.4863667
- 40. Münchow G., Dadic D., Doffing F., Hardt S., Drese K.S. Automated chip-based device for simple and fast nucleic acid amplification // Expert Rev Mol Diagn. 2005. Vol. 5, no. 4. P. 613–620. DOI: 10.1586/14737159.5.4.613
- 41. Megnin C., Kohl M. Shape memory alloy microvalves for a fluidic control system // Journal of Micromechanics and Microengineering. 2014. Vol. 24, no. 2. Id. 025001. DOI: 10.1088/0960-1317/24/2/025001
- 42. Megnin C., Moradi B., Zuern J. et al. Shape memory alloy based controllable multi-port microvalve // Microsyst Technol. 2020. Vol. 26. P. 793–800. DOI: 10.1007/s00542-019-04614-w
- 43. Orecchio F.M., Tommaso V., Santaniello T., Castiglioni S., Pezzotta F., Monti A., Butera F., Maier J.A.M., Milani P. A novel fluidic platform for semi-automated cell culture into multiwell-like bioreactors // Micromachines. 2022. Vol. 13, no. 7. Id. 994. DOI: 10.3390/mi13070994
- 44. Liu W.-Y., Fu X.-T., Zhang X.-Q., Hu W.-Y. A new shape memory alloy microvalve based on surface acoustic wave // Ferroelectrics. 2016. Vol. 504, no. 1. P. 22–30. DOI: 10.1080/00150193.2016.1238709
- 45. Nagai M., Oguri M., Shibata T. Characterization of lightcontrolled Volvox as movable microvalve element assembled in multilayer microfluidic device // Jpn. J. Appl. Phys. 2015. Vol. 54, no. 6. Id. 067001. DOI: 10.7567/JJAP.54.067001
- 46. Liu R.H., Yang J., Lenigk R., Bonanno J., Grodzinski P. Self-contained, fully integrated biochip for sample preparation, polymerase chain reaction amplification, and DNA microarray detection // Anal. Chem. 2004. Vol. 76, iss. 7. P. 1824–1831. DOI: 10.1021/ac0353029
- 47. Shaikh K.A., Li S., Liu C. Development of a latchable microvalve employing a low-melting-temperature metal alloy // Journal of Microelectromechanical Systems. 2008. Vol. 17, no. 5. P. 1195–1203. DOI: 10.1109/JMEMS.2008.2003055
- 48. Beck A., Obst F., Gruner D., Voigt A., Mehner P.J., Gruenzner S., Koerbitz R., Shahadha M.H., Kutscher A., Paschew G., Marschner U., Richter A. Fundamentals of hydrogel-based valves and chemofluidic transistors for Labon-a-Chip technology: a tutorial review // Advanced Materials Technologies. 2023. Vol. 8, no. 3. Id. 2200417. DOI: 10.1002/admt.202200417
- 49. Beebe D.J., Moore J.S., Bauer J.M., Yu Q., Liu R.H., Devadoss C., Jo B.H. Functional hydrogel structures for autonomous flow control inside microfluidic channels // Nature. 2000. Vol. 404 (6778). P. 588–590. DOI: 10.1038/35007047
- 50. Liu R.H., Yu Q., Beebe D.J. Fabrication and characterization of hydrogel-based microvalves // Journal of Microelectromechanical Systems. 2002. Vol. 11, no. 1. P. 45–53. DOI: 10.1109/84.982862
- 51. Wang J., Chen Z., Mauk M., Hong K.-S., Li M., Yang S., Bau H.H. Self-actuated, thermo-responsive hydrogel valves for Lab on a Chip. // Biomedical Microdevices. 2005. Vol. 7, no. 4. P. 313–322. DOI: 10.1007/s10544-005-6073-z


