Микроклональное размножение Gladiolus х hybridus сорта ‘пермский сувенир’ селекции Учебного ботанического сада ПГНИУ
Автор: Шибанова Н.Л., Черткова М.А., Чемарова Т.Д.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Ботаника
Статья в выпуске: 2, 2020 года.
Бесплатный доступ
Представлены результаты микроклонального размножения нового сорта гладиолуса гибридного ‘Пермский Сувенир’. Установлено, что для стерилизации эксплантов оптимальным является следующий порядок использования стерилизующих агентов: 7%-ный раствор гипохлорита натрия с экспозицией 15 или 20-25 мин. и 96%-ный этанол с экспозицией 30 или 60 сек. соответственно для клубнепочек и клубнелуковиц. Выход стерильной культуры при этом составил более 56% для клубнелуковиц и 76% для клубнепочек. На этапе микроразмножения хорошие результаты получены при добавлении к питательной среде Мурасиге и Скуга витаминов (0.1 мг/л тиамина, 0.5 мг/л пиридоксина, 0.5 мг/л никотиновой кислоты) и р-индолилуксусной кислоты (0.1-1 мг/л). Коэффициент размножения составил для клубнепочек - 2-3; для фрагментов клубнелуковиц с апикальной или пазушной почкой - 2-4. Приживаемость растений, переведенных из условий in vitro в in vivo, составила 70%. Диаметр полученных ювенильных клубнелуковиц из культуры in vitro и количество сформированных на них клубнепочек не имели статистически значимых отличий от посаженных in vivo (t = [1.16; 1.22] 05 = 1.96).
Микроклональное размножение, клубнепочки, клубнелуковицы, Gladiolus х hybridus hort., 'Пермский Сувенир'
Короткий адрес: https://sciup.org/147229649
IDR: 147229649 | УДК: 581.143.6: | DOI: 10.17072/1994-9952-2020-2-97-102
Текст научной статьи Микроклональное размножение Gladiolus х hybridus сорта ‘пермский сувенир’ селекции Учебного ботанического сада ПГНИУ
Одним из современных методов размножения растений является клональное микроразмножение, позволяющее круглогодично и в короткие сроки получать большое количество посадочного материала. Кроме того, метод in vitro позволяет с высокой эффективностью размножать редкие и плохо поддающиеся размножению в обычных условиях виды растений, а также единично полученные уникальные мутанты и гибридные экземпляры [Бабикова, Горпеченко, Журавлев, 2007].
Активная селекционная работа с гладиолусами ведется уже более ста лет и интерес к этим растениям неизменно растет. Появляются новые сорта, которые особенно нуждаются в массовом размножении. Методы клонального микроразмножения позволяют значительно сократить селекционный процесс [Шипунова, 2003]. Исследования последних лет направлены на изучение биологических особенностей различных типов эксплантов, оптимизацию минерального и органического состава питательных сред, повышение коэффициента размножения в культуре in vitro, получение здорового
посадочного материала [Ахмед, 2000; Мокшин, 2005; Prasad, Gupta, 2006; Осипова, 2008; Ruffoni, 2008].
Цель данной работы – оптимизация этапов микроклонального размножения новых сортов Gladiolus × hybridus селекции Учебного ботанического сада Пермского государственного национального исследовательского университета (ПГНИУ) на примере сорта ‘Пермский Сувенир’ (365-ОР-18 Черткова, Шумихин).
Материалы и методы исследований
Исследования проводились в 2018 г. в лаборатории микроклонального размножения кафедры ботаники и генетики растений и в Учебном ботаническом саду ПГНИУ. Сорт ‘Пермский сувенир’ был получен в результате скрещивания сортов ‘Si Foam’ (500-РС-80) и ‘Медовый Спас’ (327-С-97). Высота растений в период массового цветения составляет 105‒120 см, длина соцветия – 58‒61 см. Цветок светло-сиреневый с ярким желтомалиновым пятном на нижних долях околоцветника, имеет ровный с небольшими защипами край. Соцветие плотное, содержит 14‒17 цветков, из которых одновременно раскрыты 7–8. Оценка декоративных признаков составляет 97 баллов, оценка хозяйственно-ценных качеств – 44 балла [Пат. РФ …, 2018].
В качестве первичных эксплантов использованы клубнепочки и апикальные или пазушные почки клубнелуковиц. Всего было высажено 130 клубнепочек и 126 фрагментов клубнелуковиц. Стерилизацию материала проводили несколькими способами. Для клубнепочек применяли один режим стерилизации: раствор нейтрального детергента – 40 мин.; промывка проточной водой – 10
Таблица 1
Варианты питательной среды Мурасиге и Скуга для микроклонального размножения сорта гладиолуса ‘Пермский Сувенир’
|
Номер |
Витамины, мг/л |
Фитогормоны |
|
|
Ауксины, мг/л |
Цитокинины, мг/л |
||
|
1 |
+ |
ИУК – 0.5 |
– |
|
2 |
– |
– |
– |
|
3 |
0.1 – тиамин |
– |
– |
|
4 |
+ |
ИУК – 1 |
6-БАП – 0.5 |
|
5 |
+ |
НУК – 1 |
6-БАП – 2 |
|
6 |
+ |
ИУК – 0.1 |
– |
|
7 |
+ |
НУК – 1 |
6-БАП – 2 |
|
8 |
+ |
– |
– |
|
9 |
+ |
НУК – 10 |
6-БАП – 0.5 |
Примечание. + витамины по Р.Г. Бутенко 0.1 мг/л тиамин, 0.5 мг/л пиридоксин, 0.5 мг/л никотиновая кислота; прочерк означает отсутствие витаминов и/или регуляторов роста.
Клубнепочки высаживали на первые пять вариантов питательной среды MS, фрагменты клубнелуковиц – на все варианты. Клубнепочки брали самой мелкой категории (менее 4 мм), не рекомендуемые для посадки в открытый грунт [Громов, мин.; 7%-ный раствор гипохлорита натрия – 15 мин., 96%-ный этанол – 30 сек., с последующей промывкой в трех порциях стерилизованной дистиллированной воды по 5 мин. в каждой.
Для клубнелуковиц применяли 4 режима стерилизации, отличающиеся по времени нахождения в нейтральном детергенте и стерилизующем агенте, особенностям выделения почек. Стерилизация клубнепочек и I режим стерилизации клубнелуковиц были аналогичными. II и III режимы стерилизации: раствор нейтрального детергента – 50 мин.; промывка проточной водой – 15 мин.; 7%-ный раствор гипохлорита натрия – 20 мин., 96%-ный этанол – 60 сек.; IV режим стерилизации: раствор нейтрального детергента – 60 мин.; промывка проточной водой – 15 мин.; 7%-ный раствор гипохлорита натрия – 25 мин., 96%-ный этанол – 60 сек. Разделение клубнелуковиц на фрагменты и вычленение почек при I и II режимах проводили после стерилизации, при III и IV – до стерилизации.
Простерилизованный материал и экспланты, полученные при последующих пассажах, высаживали в пробирки на наиболее часто используемую для культуры растительных тканей твердую питательную среду с минеральной основой по Т. Murashige и F. Skoog (MS) [1962], 3%-ной сахарозой, 0.7%-ным агар-агаром. Исследовали влияние на культуру гладиолуса витаминов по Р.Г. Бутенко [1964], а также регуляторов роста: β-индолилуксусной кислоты (ИУК) в концентрациях 0.1; 0.5; 1 мг/л; α-нафтилуксусной кислоты (НУК) в концентрациях 1 и 10 мг/л; 6-бензиламинопурина (6-БАП) в концентрациях 0.5 и 2 мг/л. Всего использовано 9 вариантов среды с разным соотношением витаминов и фитогормонов (табл. 1).
Ардабьевская, 2002].
Питательную среду стерилизовали паром при температуре +120°С под давлением 1.1 атм. в течение 15 мин. Стерилизацию культуральных сосудов, инструментов и оборудования осуществляли согласно общепринятым методикам [Бутенко, 1964]. Процесс высадки эксплантов на питательную среду производили в ламинар-боксе в соответствии с правилами работы со стерильным материалом. Экспланты содержали в климатической камере Binder KBF LQC 240 с фотопериодом 14/10, при температуре +20±2°С.
Через 10‒14 дней после очередного пассажа выбраковывали материал, имевший признаки инфицирования. Одновременно вычисляли отношение числа стерильных объектов к общему числу эксплантов, подвергнутых стерилизации. Жизнеспособность стерильного материала определяли в процентах как число стерильных объектов с признаками регенерации. Часть растений, полученных в культуре in vitro , переносили в Учебный ботанический сад ПГНИУ, где выращивали в условиях открытого грунта. Почва экспериментального участка имеет искусственное происхождение, темно-гумусовая, влагоемкая, хорошо структурированная. Агрофон участка является выровненным. Реакция рН приближается к нейтральной (6.6‒7.2). Содержание органических веществ высокое (17.2– 23.8 мг на 100 г почвы).
Статистическую обработку результатов проводили с использованием стандартного пакета анализа Statistica 5.5. Для сравнения средних значений количественных признаков применяли t-критерий Стьюдента, для сравнения качественных показателей – критерий χ2.
Результаты и их обсуждение
Микроклональное размножение гладиолусов проводится в три этапа, выделение которых является общепринятым [Высоцкий, 1986]. Первый этап включал стерилизацию эксплантов и их посадку на твердую питательную среду MS. В дальнейшем проводилось микроразмножение. Заклю- чительный этап состоял в укоренении растений in vitro и перевод их in vivo.
Определяющую роль на первом этапе микро-клонального размножения играет стерильность культуры, которая для клубнепочек при выбранном режиме была 76.92%. В исследовании Н.Л. Шибановой, М.А. Чертковой, Т.В. Мельниковой [2017] по микроклональному размножению некоторых сортов гладиолуса гибридного клубне-почками с применением аналогичного режима стерилизации, выход стерильной культуры составил более 87%. Клубнелуковицы по-разному реагировали на стерилизацию. Наименьший процент стерильной культуры наблюдался при применении I режима (17.14%), а наибольший – при III (81.25%). II и IV режимы показали средние результаты (68.75 и 56.25% соответственно).
В результате анализа данных по выходу стерильной культуры можно сделать заключение, что клубнелуковицы и клубнепочки сорта ‘Пермский Сувенир’ по-разному реагируют на выбранный режим стерилизации. Стерильность культуры при использовании одинакового способа стерилизации для клубнепочек и клубнелуковиц (I режим) достоверно выше для первого типа экспланта (χ2 = 69.91, р<0.001). Выход стерильной культуры клубнелуковиц после применения I режима стерилизации достоверно ниже, чем при других способах (χ2 = [14.02; 42.71], р<0.001). Разница между II, III, IV режимами стерилизации клубнелуковиц и режимом стерилизации клубнепочек оказалась недостоверной (χ2 = [0.28; 3.38], р>0.001).
Развитие эксплантов начинается через 7 дней после посадки на твердую питательную среду MS, что представлено на рисунке. Результаты по развитию апикальных и пазушных почек клубнелуковиц гладиолуса на твердой питательной среде MS представлены в табл. 2.
Клубнепочки

а б
Клубнелуковицы
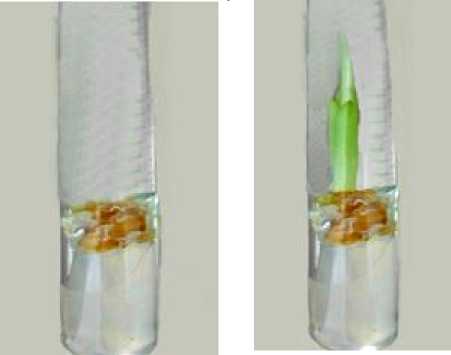
б
Развитие клубнепочек и клубнелуковиц гладиолуса на питательной среде MS: а – на момент посадки, б – через 21 день после посадки
Таблица 2
Развитие почек клубнелуковиц сорта ‘Пермский Сувенир’ на твердой питательной среде Мурасиге и Скуга
|
№ варианта среды |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Выживаемость, % |
66.67 |
50.00 |
0.00 |
100.00 |
0.00 |
81.82 |
16.67 |
33.33 |
21.43 |
|
Коэффициент размножения, M±m |
3.00±0.00 |
3.00±0.00 |
- |
2.00±0.71 |
- |
2.00±0.35 |
3.00±1.00 |
1.50±0.50 |
2.00±0.47 |
Примечания: 1 - с витаминами и ИУК (0.5 мг/л), 2 - без витаминов и фитогормонов, 3 - с тиамином (0.1 мг/л), без фитогормонов, 4 - витаминами, 6-БАП (0.5 мг/л) и ИУК (1 мг/л), 5 - с витаминами, 6-БАП (2 мг/л) и НУК (1 мг/л), 6 - с витаминами, ИУК (0.1 мг/л), 7 - с витаминами, 6-БАП (2 мг/л) и НУК (1 мг/л), 8 - с витаминами, без фитогормонов, 9 - с витаминами, 6-БАП (0.5 мг/л) и НУК (10 мг/л).
Анализ данных по развитию апикальных и пазушных почек клубнелуковиц на твердой питательной среде MS показал, что состав среды влияет на выживаемость эксплантов. Установлена достоверная разница между выходом жизнеспособного материала и составом среды. По критерию х2 экспланты на 4 и 6 вариантах среды были более жизнеспособны, чем на 7, 8 и 9 (х2 = [4.00; 9.76], р<0.05). Между 1-, 2-, 4- и 6-й средами достоверной разницы не обнаружено (х2 = [0.32; 1.88], р>0.05), так же как между 7-, 8- и 9-м вариантами среды (х2 = [0.32; 1.88], р>0.05). Возможно, это связано с тем, что в 1-, 4- и 6-м вариантах пита тельной среды из фитогормонов применили ИУК, более естественный для растений, чем НУК. Между формированием побегов на всех использованных питательных средах статистически достоверной разницы не наблюдалось (t = [0.00; 1.34] Результаты по развитию эксплантов клубнепо-чек гладиолуса на твердой питательной среде MS представлены в табл. 3. Таблица 3 Развитие эксплантов клубнепочек сорта ‘Пермский Сувенир’ на твердой питательной среде Мурасиге и Скуга № варианта среды 1 2 3 4 5 Выживаемость, % 92.31 95.65 100.00 95.24 82.35 Количество побегов, M±m 2.04±0.07 1.09±0.06 1.00±0.00 1.00±0.00 1.86±0.18 Количество корней, M±m 3.25±0.35 2.91±0.21 3.29±0.26 1.80±0.35 2.57±0.21 Примечания: 1 - с витаминами и ИУК (0.5 мг/л), 2 - без витаминов и фитогормонов, 3 - с тиамином (0.1 мг/л), без фитогормонов, 4 - с витаминами, 6-БАП (0.5 мг/л) и ИУК (1 мг/л), 5 - с витаминами, 6-БАП (2 мг/л) и НУК (1 мг/л). Анализ данных по развитию клубнепочек гладиолуса на твердой питательной среде MS показал, что состав среды не влияет на выживаемость эксплантов. Статистически достоверной разницы между выходом жизнеспособного материала и составом среды по критерию х2 не выявлено (х2 = [0.01; 3.29], р>0.05). Возможно, это связано с изначальным выбором типа экспланта - клубнепоч-кой, которая в своем составе содержит все вещества, необходимые для прорастания. Однако количество побегов, образовавшихся на клубнепочках на 1 варианте среды, было достоверно больше, чем на других вариантах (t = [4.68; 186.27] >t05 = 1.96). По количеству корней, образовавшихся на клубне-почках, наблюдается похожая картина (t = [2.00; 13.94] >t05 = 1.96), только с 3-м вариантом среды нет достоверной разницы (t = 0.23 В мае-июне 2018 г. 75 растений, выращенных in vitro, и 100 клубнепочек, рекомендуемых для посадки размером более 4 мм, полученных in vivo, были перенесены в условия открытого грунта Учебного ботанического сада ПГНИУ. Приживаемость растений из культуры in vitro в условиях открытого грунта составила 70%, «всхожесть» клубнепочек in vivo - 90%. В конце вегетационного периода 2018 г. был определен диаметр ювенильных клубнелуковиц, который для растений из культуры in vitro составил 2.26±0.38 см и незначительно уступал клубнепочкам, посаженным in vivo - 2.44±0.08 см. Разница по этому показателю оказалась статистически незначимой (t = 1.22 Среднее количество образовавшихся клубнепо-чек на одно растение, полученное в культуре in vitro, составило 5.25±1.77, что согласуется с литературными данными [Калинин, Кушнир, Сарнац- кая, 1992], в которых отмечается, что растения, перенесенные с корнями из пробирок в открытый грунт, через 4‒6 месяцев формировали клубнелуковицы с клубнепочками. У растений in vivo образовалось 9.22±0.56 клубнепочек на клубнелуковицу. Однако достоверной разницы между ними не обнаружено (t = 1.16 Заключение В качестве первичных эксплантов рекомендуется использовать как клубнепочки, так и фрагменты клубнелуковиц, содержащие апикальные и пазушные почки. Для получения хорошо растущей стерильной культуры клубнелуковиц необходимо увеличить время нахождения в нейтральном детергенте с 40 до 50 мин. и в стерилизующем агенте ‒ с 15 до 20 мин. (7%-ный раствор гипохлорита натрия) и с 30 до 60 сек. (96%-ный этанол). Для изученных эксплантов на этапе микроразмножения рекомендуется использовать вариант твердой питательной среды MS с добавлением ИУК в концентрации 0.1–1 мг/л и витаминов – 0.1 мг/л тиамин, 0.5 мг/л пиридоксин, 0.5 мг/л никотиновая кислота. Выход адаптированных растений к условиям открытого грунта составляет 70%.
Список литературы Микроклональное размножение Gladiolus х hybridus сорта ‘пермский сувенир’ селекции Учебного ботанического сада ПГНИУ
- Ахмед А.К. Создание высокоэффективной системы микроклонального размножения генетически стабильных растений гладиолуса: автореф. дис. ... канд. биол. наук. М., 2000. 16 с.
- Бабикова А.В., Горпеченко Т.Ю., Журавлев Ю.Н. Растение как объект биотехнологий // Комаров-ские чтения. 2007. Вып. 4. С. 184-211.
- Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. М., 1964. 272 с.
- Высоцкий В.А. Клональное микроразмножение растений // Культура клеток растений и биотехнология. М., 1986. С. 91-102.
- Громов А.Н., Ардабьевская Т.В. Гладиолусы. М.: ОЛМА-ПРЕСС Звездный мир, 2002. 176 с.
- Калинин Ф.Л., Кушнир Г.П., Сарнацкая В.В. Технология микроклонального размножения растений. Киев, 1992. 232 с.
- Мокшин Е.В. Морфо-физиологические особенности клонального микроразмножения in vitro различных сортов лилий и гладиолусов: автореф. дис. ... канд. биол. наук. Саранск, 2005. 20 с.
- Осипова Е.Ю. Технология размножения гладиолуса in vitro // Генетика, селекция и биотехнология: 61-я студ. науч. конф. / РГАУ-МСХА им. К. А. Тимирязева. М., 2008. С. 54-55. Пат. РФ № 9425. Селекционное достижение Гладиолус (Gladiolus L.) ПЕРМСКИЙ СУВЕНИР, 2018.
- Шибанова Н.Л., Черткова М.А., Мельникова Т.В. Использование клубнепочек в качестве первичных эксплантов при микроклональном размножении видов рода Gladiolus L. // Пермский аграрный вестник, 2017. №1 (17). С. 98-103.
- Шипунова А.А. Клональное микроразмножение садовых растений: автореф. дис. ... канд. с-х. наук. М., 2003. 24 с.
- Murashige T., Skoog F. A revised medium for rapid growth and bio assays with tobacco tissued cultures // Physiol. plant. 1962. Vol. 15. P. 473-497.
- Prasad V.S.S., Dutta Gupta S. In vitro shoot regeneration of gladiolus in semi-solid agar versus liquid cultures with support systems // Plant Cell Tiss Organ Cult. 2006. № 87. Р. 263-271.
- Ruffoni B. et al. Gladiolus micropropagation in temporary immersion system // Propagation of Ornamental Plants, 2008. Vol. 8, № 2. Р. 102-104.


