Микроматричный анализ аномалий числа копий ДНК опухоли молочной железы: : связь с эффектом неоадъювантной химиотерапии
Автор: Литвяков Николай Васильевич, Цыганов М.М., Чердынцева Надежда Викторовна, Слонимская Елена Михайловна, Иваньковская П.В., Ибрагимова Марина Константиновна, Гарбуков Евгений Юрьевич, Коростелев С.А., Потапова О.Ю., Чойнзонов Евгений Лхамацыренович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (63), 2014 года.
Бесплатный доступ
Представлены новые данные об аномалиях числа копий ДНК (Copy Number Aberration - CNA) в опухолях молочной железы и их связи с эффективностью неоадъювантной химиотерапии. Методы. В исследование включены 68 больных раком молочной железы (РМЖ), получавшие 2-4 курса неоадьювантной химиотерапии (НАХТ). Исследование несбалансированных хромосомных перестроек - числовых и структурных CNA - проводили в биопсийных образцах опухолевой ткани, полученных до лечения, с использованием микроматрицы высокой плотности CytoScan TM HD Array (Affymetrix, USA). Непосредственную эффективность НАХТ оценивали по критериям ВОЗ. Результаты. Амплификация 1q43 связана с хорошим ответом на НАХТ. У 83 % (33/39) больных с амплификацией 1q43 наблюдается частичная регрессия опухоли, тогда как у 78 % (18/23) больных с нормальным состоянием 1q43 хромосомного региона ответ на терапию отсутствует (р=0,00085 по критерию Фишера с поправкой Бонферрони). У 83 % (25/30) больных с делецией 11q22.123.3 отмечается ответ на НАХТ, а 68 % (23/34) больных с нормальным состоянием региона не отвечали на лечение (р=0,000047). Сочетание «амплификационных» и «делеционных» маркеров увеличивает чувствительность и специфичность прогнозирования ожидаемой эффективности НАХТ. Если наблюдаются амплификация в 1q43 и/или делеция 18р11.21 локусах, то у 92 % больных (35/38) отмечается частичная регрессия, при нормальном состоянии этих локусов у 81 % больных (21/26) отсутствует ответ на НАХТ (р=0,000002). Заключение. Наличие несбалансированных хромосомных перестроек в регионах 1q, 11q и 18p ДНК опухоли молочной железы до лечения коррелирует с выраженным эффектом химиотерапии и может быть использовано в качестве маркера для прогнозирования ожидаемой эффективности НАХТ с высоким уровнем доверительной вероятности.
Рак молочной железы, микроматричный анализ, хромосомные аномалии, факторы прогноза, неоадъювантная химиотерапия
Короткий адрес: https://sciup.org/14056428
IDR: 14056428 | УДК: 618.19-006.6:615.28:575.224.23
Текст научной статьи Микроматричный анализ аномалий числа копий ДНК опухоли молочной железы: : связь с эффектом неоадъювантной химиотерапии
Делеции или амплификации хромосомных регионов и отдельных хромосом называют аберрациями числа копий ДНК (СNA – copy number aberration). Эти типы цитогенетических нарушений могут влиять на экспрессию генов, локализованных в аберрантных регионах. Делеции приводят к снижению экспрессия генов, а амплификации – к повышению [14, 21]. CNA особенно распространены в солидных опухолях различных локализаций и, в частности, в опухоли молочной железы (www. [7, 13]).
В опухолях молочной железы наиболее часто СNA наблюдается в регионах 1q, 8q и 16q. Амплификации отмечаются в 1q, 8p12, 8q24.21, 17q12, 11q13.3 и 11q13.5, в которых локализованы такие известные онкогены, как HER2, с-Myc, CCND1 и PAK1, делеции – 8р, 11q, 16q и 17р хромосомных локусов [15]. Есть сведения о связи СNA опухолевой ДНК с молекулярными подтипами рака молочной железы (РМЖ) и экспрессионными характеристиками опухоли [4, 12, 13, 19]. Например, амплификации 1q21-43 и 16p12 хромосомных регионов и делеция 16q21-24 связаны с наличием на клетках опухоли рецепторов к эстрогену, а де-леции 4p13-16 и 5q11.2-31 сайтов ассоциированы с отсутствием рецепторов к прогестерону [9].
Большой интерес представляют работы, посвященные поиску специфических CNA паттернов, характеризующих высокий риск метастазирования РМЖ. В частности, установлено, что амплификации 8q22.3 и 11q14.1 регионов связаны с более низкими показателями безметастатической и общей выживаемости пациентов [8, 22]. Наличие делеции длинного плеча 11q хромосомы является неблагоприятным прогностическим фактором у больных с трижды негативным молекулярным подтипом рака молочной железы (клетки опухоли не имеют рецепторов к эстрогенам, прогестерону и эпидермальному фактору роста HER2), которые не получали послеоперационную химиотерапию [9]. В исследовании H. Wikman et al. (2012) установлена область 11p15, делеция которой ассоциирована с высокой частотой метастазирования в головной мозг [20].
Комбинированное лечение больных РМЖ включает неоадъювантную химиотерапию (НАХТ), которая направлена на уменьшение объема опухоли до резектабельных размеров или создает условия для проведения органосохранных операций. Однако регрессия опухоли при НАХТ наблюдается далеко не у всех больных, при этом не существует стандартных критериев прогноза непосредственного эффекта химиотерапии [2, 16]. Исследований, касающихся связи CNA с эффективностью НАХТ при РМЖ, немного. В работе корейских ученых на 15 образцах опухоли больных РМЖ, у которых не наблюдалось эффекта от НАХТ таксанами, установлены амплификации в 8q (24,3, 24.22, 22.1-3), 13q21.1 и 20q (13.2-13.33) регионах и делеции 8р23.3-1 и 17р13.3 сайтов [11]. Показано, что повышенный уровень CNA определяет неэффективность терапии таксанами и усиливает чувствительность к препаратам платины [17]. Учитывая немногочисленность и разрозненность клинических исследований, посвященных ассоциации CNA с эффективностью неоадъювантной химиотерапии, особенно в полногеномном масштабе, и важность самого этапа НАХТ в лечении больных РМЖ [10], представлялось актуальным проведение микрочи-пового исследования аберраций числа копий ДНК в опухоли молочной железы и оценка их ассоциации с эффектом неоадъювантной химиотерапии.
Материал и методы
В исследование включены 68 больных РМЖ IIA–IIIC стадии, с морфологически верифицированным диагнозом, в возрасте 28–68 лет, в среднем – 53,43 ± 0,78 года (таблица). В соответствии с «Con-sensus Conference on Neoadjuvant Chemotherapy in Carcinoma of the Breast, April 26–28, 2003, Philadelphia, Pennsylvania» [18] все больные получали 2–4 курса неоадъювантной химиотерапии по схемам FAC (фторурацил, доксорубицин, циклофосфан), CAX (циклофосфан, доксорубицин, кселода) или монотерапию таксотером. Через 3–5 нед после НAХТ проводилась операция, затем больным проводили 2 курса адъювантной химиотерапии по схеме FAC, а лучевая терапия и/или гормональное лечение назначались по показаниям. Исследование проводилось в соответствии с Хельсинкской декларацией 1964 г. (исправленной в 1975 и 1983 гг.), получено разрешение локального этического комитета ФГБУ «НИИ онкологии» СО РАМН. Были использованы биопсийные опухолевые образцы
(~10 мм3), взятые до лечения под контролем УЗИ. Образцы опухоли замораживали в жидком азоте и сохраняли при температуре –80ºС для выделения ДНК.
Эффективность предоперационной химиотерапии оценивали по критериям ВОЗ с помощью УЗИ и маммографии. Из исследования были исключены образцы больных, у которых была полная морфологическая регрессия опухоли, в связи с малочисленностью этой группы. Согласно международным рекомендациям, при проведении предоперационной химиотерапии больные РМЖ со стабилизацией или прогрессированием составляют группу с отсутствием ответа на НАХТ, а больные с частичной регрессией – группу с объективным клиническим ответом [16].
До лечения ДНК выделяли из 68 биопсийных образцов опухолевой ткани с помощью набора QIAamp DNA mini Kit (Qiagen, Germany) в соответствии с инструкцией производителя. Концентрацию ДНК и чистоту выделения оценивали на спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) (от 50 до 150 нг/мкл, А260/А280=2.10–2.35; А260/А230=2.15 –2.40). Целостность ДНК оценивалась при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA), фрагменты ДНК имели массу более 48 kbp.
Для обработки результатов микрочипирования использовали программу «Chromosome Analysis Suite 2.0» (Affymetrix, USA), которая разработана специально для анализа результатов микрочипирования на матрице CytoScanTM HD Array. В хромосомах определяли несбалансированные хро-
Таблица
|
Клинико-патологический параметр |
Число больных |
|
|
Возраст (лет) |
≤45 |
21 (30,9 %) |
|
>45 |
47 (69,1 %) |
|
|
Менструальный статус |
Пременопауза |
36 (52,9 %) |
|
Постменопауза |
32 (47,1 %) |
|
|
Гистологический тип |
Инвазивный протоковый рак |
58 (85,3 %) |
|
Инвазивный дольковый рак |
3 (4,4 %) |
|
|
Медулярный рак |
2 (2,9 %) |
|
|
Другие типы |
5 (7,4 %) |
|
|
Размер опухоли |
T 1 |
9 (13,2 %) |
|
T2 |
52 (76,5 %) |
|
|
т 3 |
3 (4,4 %) |
|
|
T 4 |
4 (5,9 %) |
|
|
Лимфогенное метастазирование |
N0 |
27 (39,7 %) |
|
N1 |
31 (45,6 %) |
|
|
N2 |
4 (5,9 %) |
|
|
N 3 |
6 (8,8 %) |
|
|
Рецепторы эстрогена |
+ |
33 (48,5 %) |
|
– |
31 (42,6 %) |
|
|
Нет данных |
4 (5,9 %) |
|
|
Рецепторы прогестерона |
+ |
35 (51,5 %) |
|
– |
29 (42,26 %) |
|
|
Нет данных |
4 (5,9 %) |
|
|
Рецепторы эпидермального фактора роста HER2 |
0/+ |
47 (69,1 %) |
|
++ |
10 (14,7 %) |
|
|
+++ |
6 (8,8 %) |
|
|
Нет данных |
5 (7,4 %) |
|
|
Молекулярный подтип |
Люминальный В |
40 (59,7 %) |
|
Трижды негативный |
17 (25,4 %) |
|
|
HER2-позитивный |
10 (14,9 %) |
|
|
Гистологическая форма |
Уницентрическая |
45 (66,2 %) |
|
Мультицентрическая |
23 (33,8 %) |
|
|
Степень лекарственного патоморфоза |
1 степень |
21 (30,9 %) |
|
2 степень |
22 (32,4 %) |
|
|
3 степень |
6 (8,8 %) |
|
|
Нет данных |
19 (27,9 %) |
|
|
Степень злокачественности |
1 степень |
2 (2,9 %) |
|
2 степень |
48 (70,6 %) |
|
|
3 степень |
6 (8,8 %) |
|
|
Нет данных |
12 (17,6 %) |
|
|
Схема НАХТ |
CAX |
21 (30,9 %) |
|
FAC |
33 (48,5 %) |
|
|
Тасотер |
14 (20,6 %) |
|
|
Ответ на НАХТ |
Объективный клинический ответ |
40 (58,8 %) |
|
Отсутствие ответа |
28 (41,2 %) |
|
Клинико-патологические параметры обследованных больных рМж
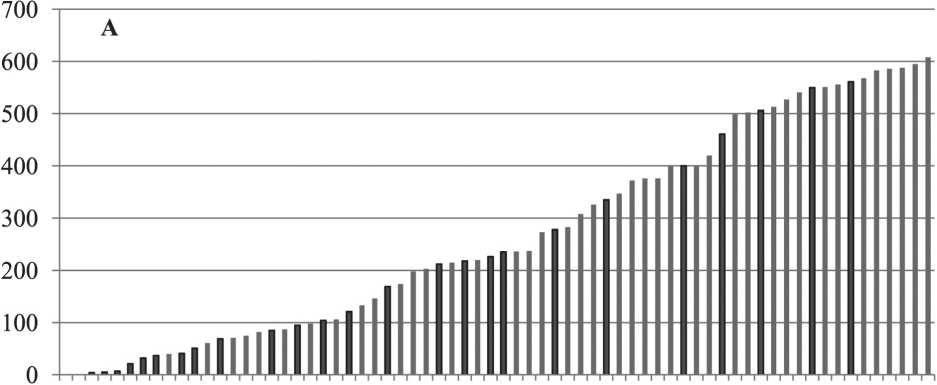
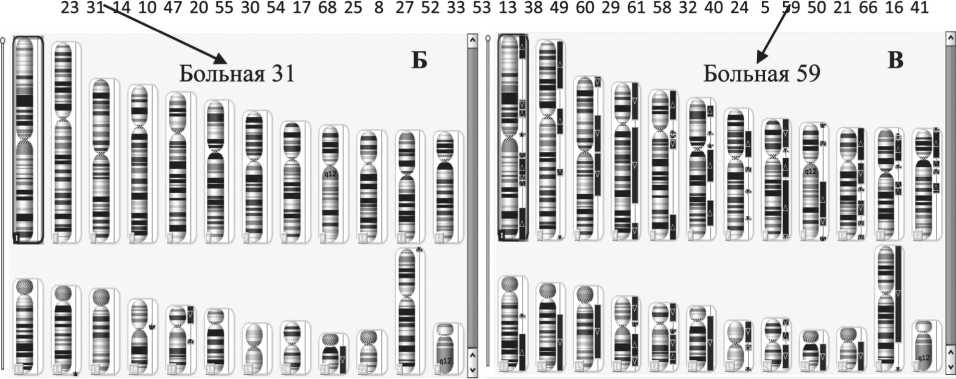
Рис. 1. Амплификации и делеции в ДНК опухолевой ткани больных РМЖ:
а) количество цитобэндов с CNА (делеции + амплификации) индивидуально у каждой больной раком молочной железы до лечения;
б) у больной 31 (слева) в опухолевой ткани практически отсутствуют CAN; в) у больной 59 CNA присутствуют в каждой хромосоме.
Примечание: на рис. 1а по оси абсцисс – номера больных, по оси ординат – количество цитобэндов с CNА, темные столбики – отсутствие ответа на НАХТ (стабилизация или прогрессирование); на рис 1б и 1в представлены окна программы «Chromosome Analysis Suite 2.0», участки амплификации выделены синим, участки делеций – красным
мосомные аберрации – делеции и амплификации (Loss и Gain). Поскольку в образцах опухолевой ткани обязательно присутствуют стромальные элементы и другие нормальные клетки, в полученной ДНК высок процент нормальной геномной ДНК. Микрочип CytoScanTM HD Array позволяет выявлять 5 % и более мутантной ДНК. Практически во всех случаях CNА были мозаичными, т.е. мутантная опухолевая ДНК определялась на фоне нормальной ДНК. Процент мутантной ДНК – статус числа копий (CN-state) – колебался от 15 до 88 %. В программе «Chromosome Analysis Suite 2.0» мозаицизм графически представляется аллельными пиками (Allele Peaks) с 4 «полосками» (AAA, AAB, ABB, BBB). Показатель snpQC колебался от 9 до 25 и отрицательно коррелировал с частотой CNА. Даже при низких значениях snpQC ширина Allele
Peaks была «хорошей» (по классификации базы progenetix [7]) для идентификации CNА.
При помощи программы «Chromosome Analysis Suite 2.0» оценивали наличие структурных CNA во всех 852 цитобэндах всех хромосом. Статистическую значимость связи частоты цитобэндов с CNA и эффекта НАХТ анализировали при помощи двухстороннего критерия Фишера. Отношение шансов – OR, относительный риск – RR и уровень значимости р по двухстороннему критерию Фишера вычисляли при помощи калькулятора html. Для поправки на множественные сравнения использовали поправку Бонферрони.
Результаты исследования
Количество цитобэндов с CNA в опухолях разных пациентов колеблется в очень широких пределах: от 1 до 608, что составляет от 0,1 % до 75 % от общего числа цитобэндов (рис. 1а), т.е. можно говорить о континууме частоты CNA. Встречаются пациенты, у которых в опухоли могут присутствовать протяженные делеции или амплификации в каждой хромосоме, в то время как у других они практически отсутствуют (рис. 1в и 1б соответственно).
Средняя частота выявленных амплификаций была почти в 2 раза ниже, чем частота делеций (92 против 170, р=0,0002), у 70,6 % (48/68) больных амплификации встречались реже, чем делеции. В группе больных, у которых амплификаций было больше, чем делеций, общая частота СNА в цитобэндах в 3 раза меньше, чем у больных, у которых делеции встречались чаще, чем амплификации (100 против 334, р=0,000001).
Количество цитобэндов с CNA связано с эффективностью НАХТ. В группе больных РМЖ с числом цитобэндов с CNA менее 60 (11/68 – 16 %) у 82 % (9/11) отмечается отсутствие ответа на НАХТ (стабилизация или прогрессирование). У 41 % (28/68) пациентов отмечается высокий уровень CNA, и частота цитобэндов с делециями или амплификациями составляет более 300. Отвечают на НАХТ 75% (21/28) этих больных. Можно полагать, что существенный дисбаланс клеточных сигнатур в опухоли, связанный с большим количеством CNA и развитием генетической нестабильности, способствует более выраженному цитотоксическому действию конвенциональных химиопрепаратов, используемых при лечении. Прежде всего, это касается лекарственных средств, действующих на молекулу ДНК (циклофосфан, фторурацил, кселода, препараты платины). Это подтверждают S.E. McClelland et al. (2009), которые показали связь повышенного уровня CNA с резистентностью к таксанам и чувствительностью к препаратам платины [17]. Весьма вероятно, что оценка числа цитобэндов с CNA будет полезной при выборе химиопрепаратов для предоперационной терапии больных РМЖ.
На следующем этапе проанализирована связь изменений всех 852 цитобэндов с эффективностью НАХТ. На рис. 2 представлены частоты CNA в опухоли больных с частичной регрессией (рис. 2а) и отсутствием ответа на НАХТ (рис. 2б). Отдельно вычислена разница в частоте амплификаций или делеций (рис. 2в) между опухолями пациентов (ответивших и не ответивших на НАХТ). Наи- большая разница по амплификациям (40–60 %) наблюдалась в длинном плече 1 хромосомы (максимальная – для цитобэнда 1q43). Амплификация длинного плеча 1 хромосомы (1q23.2-1q43) ассоциирована с хорошим ответом на НАХТ. У 76–83 % больных с амплификацией длинного плеча 1 хромосомы наблюдается частичная регрессия, тогда как у 60–78 % больных с нормальным состоянием 1q23.2-1q43 хромосомного региона отмечается отсутствие ответа на НАХТ. Анализ с использованием критерия Фишера показал, что наличие/отсутствие амплификации в 1q43 цитобэнде можно использовать в качестве маркера ожидаемой эффективности НАХТ рака молочной железы с отношением шансов OR=19,8 (5,29–74,01), относительным риском RR=5,09 (2,36–10,95) (р=0,000001 по критерию Фишера или р=0,00085 с поправкой Бонферрони на множественные сравнения), чувствительностью – 83 % (33/39) и специфичностью – 78 % (18/23) (все вычисления произведены для цитобэнда 1q43) .
Наибольшая разница по частоте встречаемости делеций (30–40 %) в опухолях пациентов с наличием и отсутствием ответа наблюдается в длинном плече 11 и 16 хромосом и коротком плече 18 хромосомы. У 83 % (25/30) больных с делецией 11q22.1-23.3 отмечается частичная регрессия при проведении НАХТ, а у 68 % (23/34) больных с нормальным состоянием региона отмечено отсутствие ответа на НАХТ. Наличие делеции в 11q22.1–23.3 регионе может выступать как маркер ожидаемой эффективности НАХТ с отношением шансов OR=10,45 (3,15–34,68) и относительным риском RR=2,58 (1,54–4,59) (р=0,000047 по критерию Фишера) с чувствительностью – 83 % и специфичностью – 68 %. При поправке Бонферрони уровень доверительной вероятности по критерию Фишера становится равным р=0,04. При делеции 18p11.21 отмечается 100 % специфичность, все больные с делецией имеют объективный клинический ответ на НАХТ.
Мы провели анализ предсказательной значимости сочетания «амплификационных» и «делецион-ных» маркеров. Если наблюдаются амплификации в 1q23.1-25.3 и/или делеции 11q22-24, то в 85 % (40/47) случаев отмечается частичная регрессия опухоли, если же у больных нормальное состояние 1q23.1-25.3 и 11q22-24 регионов, то в 86 % (18/21) случаев ответ на НАХТ отсутствует (р=3,4×10-8
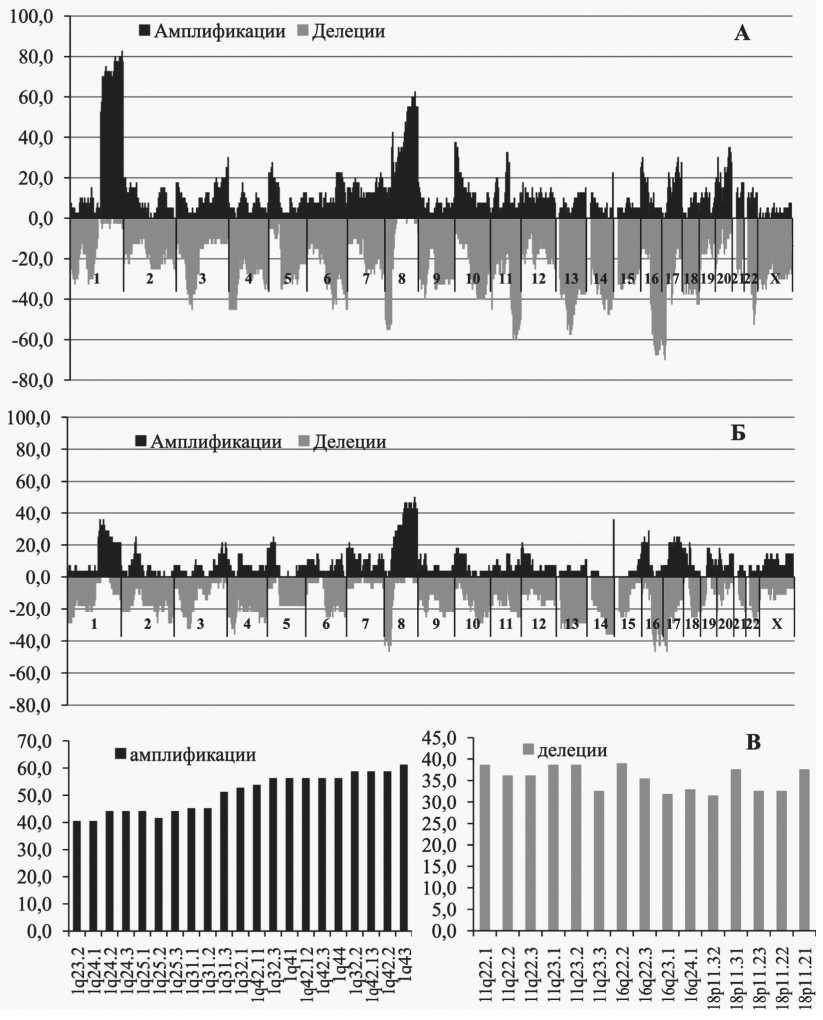
Рис. 2. Частота аберраций числа копий ДНК в группе больных с объективным клиническим ответом (а) и с отсутствием ответа на НАХТ (б); в – цитобэнды, в которых наблюдалась наибольшая разность (и величина разности) в частоте амплификаций (слева) и делеций (справа) между опухолью пациентов с объективным клиническим ответом и отсутствием ответа.
Примечание: на рис. 1а и 1б по оси ординат – процент больных, несущих CNA (амплификации – выше оси абсцисс, делеции – ниже оси абсцисс), по оси абсцисс – цитобэнды (n=852), распределенные по хромосомам, на рис. 1в по оси ординат – разность в процентах; по оси абсцисс – цитобэнды, показавшие наибольшую разность
или р=0,00003 с поправкой Бонферрони). Другое возможное сочетание – амплификация в 1q43 и делеция 18р11.21 локусах. При наличии амплификации и/или делеции данных локусов в ДНК опухоли молочной железы у 92 % больных (35/38) отмечается объективный клинический ответ на НАХТ, при нормальном состоянии этих локусов у 81 % (21/26) больных отсутствует ответ на химиотерапию. Использование сочетания СNA 1q43 и 18р11.21 локусов в качестве предсказательного маркера позволило бы прогнозировать эффективность НАХТ с OR=49 (10,61–226,33) и относительным риском RR=4,78 (2,17–10,78) (по критерию Фишера р=2,3×10-9 или р=0,000002 с поправкой Бонферрони), с чувствительностью – 92 %, специфичностью – 81 %.
Обсуждение
В настоящее время отсутствуют общепринятые критерии для прогнозирования эффективности НАХТ, решение о ее проведении принимается на основании клинических, морфологических характеристик опухоли и молекулярных подтипов [16]. ДНК микрочипы могут представлять больший интерес, по сравнению с экспрессионным анализом, для прогнозирования ожидаемой эффективности химиотерапии. Это обусловлено тем, что ДНК маркеры, в отличие от экспрессионных маркеров, относительно стабильны, а ДНК мутации и хромосомные аномалии являются основой процесса канцерогенеза и эволюции опухоли. Мутации и CNA связаны с экспрессией генов, например, мутация гена BRCA1 5382insC приводит к формированию стоп-кодона, при делециях экспрессия генов снижается, а при амплификациях – повышается [6, 14, 21]. Наконец, технология ДНК микрочипов может во многом нивелировать проблему внутриопухолевой гетерогенности [1, 3, 5], которая ограничивает применение экспрессионных чипов. ДНК-микрочипы позволяют с чувствительностью 5 % видеть одновременно весь спектр мутантных опухолевых клонов (генетический ландшафт опухоли). Все вышесказанное еще раз свидетельствует в пользу перспективности дальнейших исследований и валидации прогностической значимости найденных маркеров на независимых выборках.
Заключение
Таким образом, в результате исследования показана связь аберраций числа копий ДНК опухоли молочной железы и эффективности предоперационной химиотерапии. На основе CNA идентифицированы новые информативные прогностические маркеры, которые с высоким уровнем доверительной вероятности и с учетом поправки на множественные сравнения показали связь с эффектом НАХТ. Сочетанное использование нескольких CNA маркеров повышает чувствительность (до 92 %) и специфичность (до 81 %) прогнозирования клинического эффекта в ответ на проведение системной терапии. Особую значимость представляет тот факт, что они могут определяться до начала лечения по биопсийному материалу.
Полученные данные обосновывают перспективность проведения дальнейших проспективных исследований, в которых можно было бы оценить значимость идентифицированных маркеров для прогнозирования ожидаемой эффективности НАХТ и целесообразности ее проведения с целью индивидуализации выбора лечебной тактики.
Работа поддержана грантом РФФИ 13-04-98111 р_сибирь_а


