Микроразмножение in vitro субтропических, декоративных культур и эндемиков Западного Кавказа: оригинальные и оптимизированные протоколы
Автор: Коломиец Т.М., Маляровская В.И., Гвасалия М.В., Самарина Л.С., Соколов Р.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Статья в выпуске: 3 т.49, 2014 года.
Бесплатный доступ
Получение качественного посадочного материала в цветоводстве и садоводстве связывают с необходимостью применять высокие технологии оздоровления и тестирования. Как известно, методы микроразмножения также широко используются селекционерами для ускоренной репродукции ценного материала и служат важным способом поддержания существующего биоразнообразия в случае с видами, занесенными в Красные книги. Однако для ряда цветочно-декоративных, и особенно субтропических плодовых культур, редких исчезающих видов растений дикой флоры еще не описаны надежные приемы получения и размножения растений-регене-рантов in vitro. В настоящей работе представлены результаты разработки и усовершенствования методов микроклонального размножения чая Camellia sinensis (L.) Kuntze, лимона Citrus limon (L.) Burm, камелии японской Camellia japonica L. и Lilium caucasicum Miscz. ex Grossh. (исчезающий эндемичный вид Западного Кавказа). Для вышеперечисленных субтропических и декоративных растений выявлены особенности получения стерильной культуры и сезонные сроки (май-октябрь) их введения в культуру in vitro. Оптимизированы питательные среды и условия культивирования для микроклонального размножения изучаемых культур. Так, для чая культивирование эксплантов на питательной среде WPM (Woody Plant Media), дополненной фиторегуляторами 6-бензиламинопурином (6-БАП, 3,0 мг/л) и аденином (0,9 мг/л), способствовало индукции многочисленных адвентивных микропобегов. Активный рост микропобегов для камелии японской был отмечен также на питательной среде WPM с фиторегуляторами 6-БАП и индолил-3-уксусной кислотой (ИУК) в концентрации соответственно 2 мг/л и 0,5 мг/л. Для сортов лимона надежным способом размножения оказалась микропрививка. Выявлено, что после 3-го цикла микропрививки коэффициент размножения микрочеренков в 2 раза превышал аналогичный показатель для микропобегов из пазушных почек растений-доноров и составил 4,6 шт/побег. У L. caucasicum использование различных частей луковичных чешуй показало, что эффективность индукции морфогенеза in vitro зависела от того, какая часть использовалась в качестве экспланта. Через 48 сут в стерильных условиях из базальной и медиальной частей чешуй развивались преимущественно адвентивные побеги, реже происходил каллусо- и ризогенез, в то время как в культуре апикальных частей преобладал каллусогенез. В доступной литературе мы не нашли данных о возможности получения культуры тканей у L. caucasicum. Таким образом, нами впервые разработан протокол для размножения in vitro этого исчезающего эндемика Западного Кавказа.
Ступенчатая стерилизация, клональное микроразмножение, микропобеги, микропрививка, чай camellia sinensis (l.) kuntze, лимон citrus limon (l.) burm
Короткий адрес: https://sciup.org/142133509
IDR: 142133509 | УДК: 633.72+634.3+635.9]:576.7.086.83:58
Текст научной статьи Микроразмножение in vitro субтропических, декоративных культур и эндемиков Западного Кавказа: оригинальные и оптимизированные протоколы
В современном цветоводстве и садоводстве прослеживается четкая тенденция повышения требований к качеству посадочного материала и его сортименту, что связано с необходимостью использовать высокие технологии оздоровления и тестирования. Кроме того, сокращение сроков получения генотипов с хозяйственно ценными свойствами, ускорение их внедрения в производство, создание и содержание коллекций ценных форм также приоритетны для сельскохозяйственной науки (1).
Решению этих проблем может способствовать применение биотехнологических приемов, с помощью которых становится возможным в широких масштабах получать посадочный материал, свободный от вирусных, грибных и бактериальных болезней, вегетативное потомство у растений, которые трудно размножить в обычных условиях, быстро «тиражировать» ценные клоны сортов и гибридов, длительно хранить растительный материал в контролируемых лабораторных условиях (без контакта с экологическими факторами), осуществлять его международный обмен без риска занести карантинных вредителей, получать формы с измененной плоидно- стью, сомаклональные варианты и трансгенные растения, поддерживать существующее биоразнообразие редких и исчезающих видов, занесенных в Красные книги (2, 3).
К таким эффективным биотехнологическим приемам получения, оздоровления, ускоренной репродукции сортов и гибридов цветочно-декоративных и плодовых растений относится микроразмножение. Однако для многих из них, в частности для субтропических плодовых культур, редких исчезающих видов дикой флоры пока что не предложены методы надежного получения и размножения растений-регенерантов in vitro из изолированных тканей и органов (4, 5).
В СССР работы по использованию клонального микроразмножения для оздоровления растений чая как одной из важнейших субтропических культур были начаты еще в 1980-х годах (6). Подобный подход становится все более актуальным в связи с сокращением сельскохозяйственных площадей, кроме того, впервые появляется возможность для сохранения уникальных генотипов чая в депонированной коллекции в условиях лаборатории. Следует отметить, что в отношении древесных видов сохраняется проблема культивирования in vitro в стерильных условиях. Например, у растений чая основное препятствие в получении асептической культуры — большое количество фенольных соединений (7, 8), содержащихся в молодых побегах, которые используются как экспланты. Еще одна проблема при клональном микроразмножении чая — получение активно растущей стерильной культуры (9).
Среди субтропических культур важное место занимают цитрусовые (10). В нашей стране первые работы по культивированию цитрусовых in vitro проводились также в 1980-х годах (11-13). Несмотря на то, что за рубежом работы по оптимизации протоколов культивирования цитрусовых in vitro многочисленны, до сих пор так и не удалось разработать эффективную методику микроразмножения сортового материала в культуре вегетативных почек (14-16).
Применение биотехнологических методов в отношении декоративных кустарников часто обусловлено тем, что они плохо размножаются вегетативно вследствие очень низкого процента укоренения черенков. В частности, подобное относится к высокодекоративным (имеющим махровые цветки) сортам камелии Camellia japonica L., произрастающим в условиях субтропиков России (17). На территории Большого Сочи одна из самых представительных коллекций высокодекоративных сортов камелии японской произрастает в Субтропическом ботаническом саду Кубани (г. Сочи), основой которой стали растения, привезенные из различных ботанических садов России и из-за рубежа (18).
Все шире применяются биотехнологии для сохранения флористического биоразнообразия, в частности для поддержания растений, численность популяций которых резко падает, а также уникальных слабоизучен-ных форм, способных в будущем расширить и улучшить сортимент возделываемых культур. Созданием коллекций in vitro исчезающих и редких видов занимаются в Индии (19), США (20), Великобритании (21-24), Австралии (25) и в ряде других стран. С 2003 года во Всероссийском НИИ цветоводства и субтропических культур разрабатываются приемы для клонального микроразмножения некоторых уникальных для мировой флоры видов — местных эндемиков Campanula longistyla Fomin., C. alliari-folia Willd., C. latifolia L., C. taurica Juz., C. bzybica (26), Crocus speciosus Bieb. (27). К одному из видов таких редких эндемиков Западного Кавказа, требующих сохранения, относится Lilium caucasicum Miscz. ex Grossh.
( Liliaceae ) (27).
Цель проводимых нами исследований — разработка и совершенствование методов клонального микроразмножения и регенерации субтропических культур, декоративных растений и редких исчезающих представителей местной дикой флоры для ускорения селекции, производства оздоровленного посадочного материала и сохранения биоразнообразия.
Методика . Объектами исследования были растения чая Camelia sinensis (L.) Kuntze сорта Колхида и местной популяции, Citrus limon (L.) Burm сортов Новоафонский, Ударник, Бесколючий, Camelia japonica (L.) сортов Reine des Beautes, David Boschi и Duc de Bretagne, а также эндемичный вид флоры Западного Кавказа Lilium caucasicum Miscz. ex Grossh.
Эсплантами для введения в культуру in vitro у Camelia sinensis служили апикальные и пазушные почки, отобранные на молодых активно растущих побегах текущего года в период с апреля по октябрь. На этапе пролиферации морфогенных структур чая были испытаны три варианта минеральных питательных сред — Мурасиге-Скуга (MS) (28), Гамборга В5 (29) и WPM (Woody Plant Medium) (30). Микроразмножение C . sinensis (проводили адвентивными побегами и частью побега с пазушной почкой на питательной среде WPM, дополненной 6-бензиламинопурином (6-БАП, 3 мг/л) и аденином (0,9 мг/л).
Для получения стерильной культуры Camelia japonica из апикальных и пазушных почек, также отобранных на молодых активно растущих побегах текущего года в период с апреля по октябрь, было испытано шесть вариантов обработки эксплантов. Варианты различались по набору и концентрации стерилизующих агентов, а также времени их воздействия: 1-й — 70 % этанол (1 мин), 20 % хлорная известь (5 мин), 15 % пероксид водорода (5 мин); 2-й — 70 % этанол (1 мин), 20 % хлорная известь (5 мин), 8,5 % пероксид водорода (3 мин); 3-й — 0,5 % новодез эком-50м (действующие агенты — 25 % хлорид алкилдиметилбензиламмония и поверхностно-активное вещество; производитель ОАО НПО «Новодез», г. Москва) (30 мин); 4-й — 0,2 % новодез (20 мин); 5-й — К2МпО4 (30 мин) + 70 % этанол (1 мин) + 0,2 %-й новодез (20 мин) + 5 % пероксид водорода (1 мин); 6-й — K2MnO4 (40 мин) + 96 % этанол (1 мин). После каждого стерилизующего раствора образцы трижды промывали дистиллированной водой в течение 10 мин. На этапе введения в культуру in vitro экспланты C . japonica культивировли на питательной среде WPM c фитогормонами 6-БАП (2,0 мг/л) и а -нафтилуксусной кислотой (НУК, 0,5 мг/л). Через 22,5 мес микропобеги пересаживали на питательную среду со следующим содержанием фитогормонов: 6-БАП — 2,5 мг/л, НУК — 0,5 мг/л и гибберелловая кислота (ГК3) — 1,0 мг/л.
Получение микропривитых растений Citrus limon включало три этапа: выращивание привоев из пазушных почек, выращивание подвоев из сеянцев лимона Мейера ( Citrus х meyeri Meyer) и собственно прививка меристем, полученных от введеных в стерильную культуру пазушных почек. Пазушные почки цитрусовых стерилизовали в течение 25 мин 0,3 % велто-леном (ООО «НПО «ВЕЛТ», Россия); действующее вещество — клатрат четвертичного аммониевого соединения (дидецилдиметиламмоний) с карбамидом. Для получения привоя при культивировании пазушных почек C . limon использовали питательную среду MS с добавлением 6-БАП (0,1 мг/л) и НУК (0,5 мг/л). Культивирование подвоев и микропривытых растений осуществляли на питательной среде WPM, дополненной БАП (1 мг/л) и ГК3 (2 мг/л). Микропрививки лимона проводили на подвой лимона Мейера ( Citrus х meyeri Meyer) по методике L. Navarro (31) c модификациями
(4). У микропривитых растений динамику приживаемости тканей контролировали микроскопированием («ЛОМО», Россия).
В качестве эксплантов Lilium caucasicum использовали различные части чешуй луковиц, которые стерилизовали в 96 % этаноле 1 мин и далее в 2 % велтолене 10 мин. В качестве первичных питательных сред использовали прописи MS и MS с половинным количеством минеральных солей ( 1 / 2 MS) и различными сочетаниями фитогормонов НУК, 2,4-Д (2,4-дихлорфеноксиуксусная кислота) (в концентрациях 1,0-2,0 мг/л) и 6-БАП (3 мг/л).
При подготовке питательных сред рН доводили до 5,7, после чего их автоклавировали в течение 20 мин при температуре 120 ° C. Первичные экспланты и микропобеги культивировали при интенсивности освещенности до 5000 лк, 16-часовом фотопериоде и температуре 24±1 ° C.
Полученные данные обрабатывали по Б.А. Доспехову (32) с использованием программного обеспечения MS Office Excel.
Результаты . Основным этапом введения эксплантов в культуру in vitro была отработка режимов стерилизации растительных объектов. Для растений чая сорта Колхида и местной популяции из девяти протестированных вариантов эффективной оказалась ступенчатая стерилизация (последовательная обработка 20 % гипохлоритом натрия, 70 % этиловым спиртом и 0,2 % раствором диацида в течение соответственно 20, 30 и 25 мин).
Применение питательной среды MS (6) с добавлением 6-БАП (2,0 мг/л) и тетрациклина (1000 мг/л) оказалось наиболее эффективным для введения эксплантов чая в культуру in vitro. При культивировании растительных тканей на питательной среде Гамборга В5 с гибберелловой кислотой (ГК3 — 2,0 мг/л) происходило образование витрифицированных (сверховодненных) микропобегов.
Пассирование эксплантов на среде WPM с концентрацией цитокининов 6-БАП 3,0 мг/л и аденина 0,9 мг/л способствовало активной индукции микропобегов растений чая, высота которых достигала в среднем 25,7 мм (табл. 1, рис. 1).
1. Влияние питательных сред и фитогормонов на рост и развитие Camelia sinensis (L.) в культуре in vitro
|
Питательная среда |
Регулятор роста (концентрация) |
Формирование микропобегов |
Продолжительность культивирования, мес |
|
|
число, шт. |
| высота, мм |
|||
|
MS |
6-БАП (2,0 мг/л) Зеатин (0,5 мг/л) Аденин (0,5 мг/л) ПУК (0,5 мг/л) |
22 |
23,8±0,3 |
1,5-2 |
|
Среда Гамборга (Г 5 ) |
6-БАП (2,5 мг/л) ГК3 (2,0 мг/л) НУК (0,5 мг/л) |
5 |
18,4±0,2 |
2-2,5 |
|
WPM |
6-БАП (3,0 мг/л) Аденин (0,9 мг/л) |
32 |
25,7±0,4 |
1 |
Примечание. MS — среда Мурасиге-Скуга, WPM — Woody Plant Medium (см. раздел «Методика»), 6-БАП — 6-бензиламинопурин, ПУК — а -нафтилуксусная кислота, ГК 3 — гибберелловая кислота.
2. Влияние фитогормонов на рост и укоренение микрорастений чая Camelia sinensis (L.) в культуре in vitro
|
Среда (фитогормон) |
Формирование микрорастений |
Частота % |
|
число, шт. | высота, мм |
контаминации | ризогенеза |
|
MS (ИМК 1,0 мг/л) |
60 |
10,0±0,5 |
3,3 |
0 |
|
1 / 2 MS (ИМК 1,0 мг/л, ИУК 0,5 мг/л) |
60 |
60,0±0,9 |
6,7 |
0 |
|
1 / 2 MS (ИМК 1,0 мг/л, НУК 2,0 мг/л) |
60 |
20,5±0,8 |
3,3 |
81,0 |
Примечание. MS и V2MS — среда Мурасиге-Скуга соответственно с полным и половинным набором минеральных солей, ИМК, ИУК и НУК — соответственно индолил-3-масляная, индолил-3-уксусная и а -нафтилуксусная кислота.
Коэффициент размножения с 3-го составил 1:4.
пассажа возрастал. В среднем он

3,0 мг/л) и аденином (0,9 мг/л) (слева — сорт Колхида, справа — местная популяция).

Рис. 1. Развитие микропобегов чая Camelia sinensis (L.) через 1 мес культивирования in vitro на питательной среде WPM (Woody Plant Medium) с 6-бензиламинопурином (6-БАП,
Оптимальной для укоренения размноженных микрорастений чая (независимо от сортовых особенностей) была питательная среда 1 / 2 MS (с половинным набором минеральных солей), дополненная фиторегуляторами индолил-3-масляной кислотой (ИМК, 1,0 мг/л) и а -нафтилуксусной кислотой (НУК, 2,0 мг/л) (табл. 2, рис. 2).

Рис. 2. Ризогенез у микрорастений чая Camelia sinensis (L.) in vitro на полной питательной среде Мурасиге-Скуга (MS) с добавлением индолил-3-масляной (1,0 мг/л) и а -нафтилуксусной кислоты (2,0 мг/л) (слева — сорт Колхида, справа — местная популяция).
На этой питательной среде через 2,5 мес растения-регенеранты достигли в среднем высоты 20,5±0,8 мм, при этом было получено до 81,0 % укорененных микрорастений чая. Наличие в питательной среде повышенной концентрации ауксинов (ИМК 1,0 мг/л и НУК 2,0 мг/л) способствовало развитию мощной корневой системы. От базального каллуса отрастали 2-3 основных корня длиной 2,5-3,0 см, от которых отходили боковые проводящие корни длиной 1,5-2,0 см с множеством корневых волосков. Весь процесс микроразмножения (от высадки первичного экспланта на питательную среду до укоренения микрорастений) занимал 6 мес.
Известно, что культивирование in vitro вегетативных органов древесных плодовых культур сопряжено с рядом проблем, таких как сложность получения стерильной культуры, низкие коэффициенты размноже- ния и укоренения, низкая жизнеспособность микропобегов (33-36). Повышение эффективности размножения и надежности сохранения in vitro сортов коллекции цитрусовых возможно за счет оптимизации состава питательных сред и использования техники микропрививки. Исследования по оптимизации протоколов микроразмножения и сохранения генетических ресурсов цитрусовых культур выполняются в институте с 2009 года.
При анатомическом контроле приживаемости тканей у микропри-витых растений исследования показали, что через 10-20 сут между микропривоем и подвоем образовывалась общая сосудистая система и меристемы трогались в рост (рис. 3). У таких сортов, как Ударник, Бесколю-чий, Новоафонский, Мейер, приживаемость меристем составила соответственно 65,8; 73,3; 75,2 и 81,6 %. По результатам дисперсионного анализа, доля влияния сорта на приживаемость полученных от него меристем составила лишь 4,8 %, в то время как на влияние источника привоя приходилось 92,4 %; представленные данные достоверны (F ф акт > F05).
А Б В

Рис 3 . Приживаемость микропривоя (отмечены стрелками) при микропрививке лимона Citrus limon (L.) Burm сорта Новоафонский на лимон Мейера ( Citrus х meyeri Meyer) in vitro: А, Б — образование общей проводящей системы (через 10 сут), В — начало роста (через 20 сут). Увеличение х400 (Б).
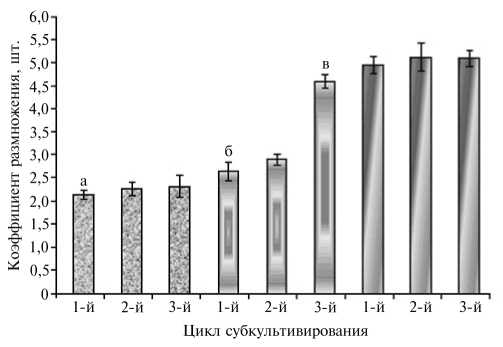
Рис. 4. Коэффициент размножения микропобегов лимона Citrus limon (L.) Burm in vitro в зависимости от их источника и цикла субкультивирования: а — побеги из почек, б — микро-привитые побеги, в — сеянцы.
В целом микропобеги привоя характеризовались более быстрым ростом, чем побеги, полученные из почек взрослых растений. После 3-го цикла микропрививки коэффициент размножения микрочеренков в 2 раза превышал аналогичный показатель для микропобегов из пазушных почек растений-доноров и составил 4,6 шт/побег (рис. 4). При этом коэффициент размножения микропобегов из почек взрос- лых растений после 3-го пассажа существенно не повышался. Таким образом, при перепрививках активируются ростовые процессы благодаря фи- энологическому омоложению. Следовательно, подобный характер морфогенеза открывает большие возможности для массового размножения и оздоровления генотипов лимона.
При отработке этапов клонального микроразмножения высокодекоративных сортов C . japonica одной из наиболее сложных задач (как и для многих других древесных растений) было получение стерильной культуры. Из шести испытанных протоколов лучшие результаты давало последовательное применение K2MnO4 (насыщенный раствор), 70 % этанола, 0,2 % новодеза и 5 % пероксида водорода в течение соответственно 30, 1, 20 и 1 мин (37). В этом случае на начальном этапе доля стерильных эксплантов составила 40-42 %, то есть оказалась на 10-15 % выше, чем в других вариантах. Кроме того, при первичном культивировании отмечали положительное действие тетрациклина в концентрации 500-1000 мг/л, добавление которого в питательную среду WPM обеспечивало более высокий (от 29,9 до 45,4 %) выход сохранившихся в культуре in vitro стерильных эксплантов (38). Для пазушных и апикальных меристем C. japonica оптимальным сроком введения в культуру in vitro был конец марта—середина мая, для побегов с пазушными и апикальными почками — конец мая— начало сентября.
При культивировании C . japonica на WPM с высокой концентрацией 6-БАП (2,5-3,0 мг/л) в основании микрочеренков и микропобегов формировался компактный светло-зеленый каллус. Помещая его фрагменты на питательную среду с пониженным содержанием 6-БАП (2 мг/л) и ИУК (0,5 мг/л), через 30 сут наблюдали появление морфогенных зон в каллусной ткани. На такой же питательной среде культивировали микропобеги камелии. Их активный рост происходил у 54,5 % эксплантов. Необходимо отметить, что в культуре ткани C . japonica адвентивные побеги, как, например, у C . sinensis , не развивались . Как следствие, клональное микроразмножение было возможно только за счет увеличения числа междоузлий. У C . japonica коэффициент размножения составил 1:3.
При культивировании in vitro различных частей чешуи луковицы у эндемика L . caucasicum показали, что индукция морфогенеза была неодинакова: через 48 сут в стерильных условиях из базальной и медиальной частей развивались преимущественно адвентивные побеги, реже происходил каллусо- и ризогенез, тогда как в апикальных частях преобладал каллусогенез (табл. 3).
3. Развитие эксплантов Lilium caucasicum Miscz. ex Grossh. из разных частей чешуи луковицы на полной среде MS с добавлением НУК (1 мг/л) и 6-БАП (3 мг/л) через 48 сут после введения в культуру in vitro
|
Использованная часть чешуи |
Число эксплантов, шт. ( X ± х ) |
||||
|
всего |
с ризогенезом |
с индукцией адвентивных почек |
с каллусогенезом |
без развития |
|
|
Базальная 45 13,0±1,07 20,0±0,53 12,0±0,92 0 Медиальная 45 13,0±1,92 15,0±1,60 9,0±0,92 8,0±1,07 Апикальная 45 2,0±0,53 3,0±0,92 7,0±1,07 33,0±0,92 Примечание. MS — среда Мурасиге-Скуга, НУК — а -нафтилуксусная кислота, 6-БАП — 6-бен-зиламинопурин. |
|||||
Медиальные части чешуй формировали корни с той же частотой, что и базальные, тогда как развитие по интересующему нас типу (с образованием адвентивных почек и каллусов) отмечалось значительно реже (рис. 5). Реакция апикальных частей на индукцию была менее выраженной, причем изменения эксплантов происходили в их базальной части и проявлялись преимущественно дедифференцировкой клеток и развитием каллусной ткани. Впоследствии при переносе каллусов на среду MS с ауксином 2,4-Д (2 мг/л) наблюдали формирование морфогенных зон и развитие микролуковичек в очагах интенсивного органогенеза (см. рис. 5).


Рис. 5. Адвентивные побеги (слева) и каллусогенез (справа) у эксплантов эндемика Lilium caucasicum Miscz. ex Grossh., полученных из медиальной части чешуи луковицы, на полной среде Мурасиге-Скуга с добавлением а -нафтилук-сусной кислоты (1 мг/л) и 6-бен-зиламинопурина (3 мг/л) .
Итак, для клональ ного микроразмножения Camelia sinensis (L.) Kuntze в качестве эксплантов лучше использовать апикальные и латеральные меристемы размером 0,30,5 см, отобранные с мая по октябрь. Пассирование эксплантов на среде WPM (Woody Plant Media) с цитокининами 6-бензиламинопурином (6-БАП, 3,0 мг/л) и аденином (0,9 мг/л) способствовало индукции многочисленных адвентивных микропобегов. При этом коэффициент размножения составил 1:4. Активный рост микропобегов у C. japonica L. также отмечали на питательной среде WPM с фиторегуляторами — 6-БАП (2 мг/л) и индо-лил-3-уксусной кислотой (ИУК, 0,5 мг/л) при коэффициенте размножения 1:3. У сортов Citrus limon (L.) Burm in vitro целесообразно использовать микропрививку, обеспечивающую надежное сохранение генотипов и увеличение коэффициента размножения в 2 раза. У лилии кавказской Lilium caucasicum Miscz. ex Grossh. (эндемик) индукция адвентивных почек активно происходила из базальной части чешуи луковицы и составила 44,5 %. Проведенное изучение факторов, влияющих на органогенез в культуре in vitro у субтропических и декоративных растений, пополняет знания о морфогенезе в целом и позволяет разработать биотехнологическую методоло гию получения, сохранения и размножения ценных генотипов.


