МикроРНК: взгляд клинициста на состояние проблемы. Часть 3: микроРНК и подходы к лечению сердечно-сосудистых заболеваний
Автор: Миронова О.Ю., Бердышева М.В., Деева Е.С., Елфимова Е.М.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзор
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Сердечно-сосудистые заболевания являются одной из наиболее частых причин смерти как в развивающихся, так и в развитых странах мира. Несмотря на улучшение первичной профилактики, распространенность сердечно-сосудистых заболеваний в последние годы продолжает расти. Следовательно, крайне важно как глубоко изучить молекулярную патофизиологию сердечно-сосудистых заболеваний, так и найти новые методы для ранней и надлежащей профилактики, диагностики и лечения данных заболеваний. В последнее десятилетие большой объём исследований направлен на изучение микроРНК в качестве потенциальных диагностических биомаркеров, а также на их роль в лечении сердечно-сосудистых заболеваний. МикроРНК представляют собой эндогенные небольшие (21-23 нуклеотида) рибонуклеотиды, участвующие в регуляции процесса синтеза белка из аминокислот на базе матричной РНК. МикроРНК участвуют в регуляции экспрессии большинства (>60%) генов, кодирующих белки, в основном за счет ее подавления, модулируют многочисленные сигнальные пути и клеточные процессы и участвуют в межклеточной коммуникации. Наряду с этим доказана немаловажная роль микроРНК в сердечно-сосудистой системе: участие в регуляции таких процессов, как ангиогенез, сократимость клеток сердца, контроль метаболизма липидов, скорость развития фиброза и атеросклероза, что дает возможность использовать микроРНК в качестве терапевтических средств. Так, в статье рассмотрен вопрос наличия нескольких подходов к лечению с участием микроРНК: гиперэкспрессия экзогенной микроРНК для снижения экспрессии генов с нежелательными свойствами, гиперэкспрессия ингибиторов микроРНК, использование «ложных» микроРНК или «губок», которые действуют как конкурентные ингибиторы. Также рассмотрено использование вирусов с положительной (смысловой) цепью РНК, напоминающие эндогенные мРНК.Особое внимание автора уделено важной роли микроРНК в ряде сердечно-сосудистых заболеваний: продемонстрирована терапия на основе микроРНК в лечении таких заболеваний, как сердечная недостаточность, дислипидемия, острый коронарный синдром, артериальная гипертензия, а также артериальная гипертензия, обусловленная СОАС. Рассмотрены исследования, доказывающие положительное влияние микроРНК на замедление развития атеросклероза, что может позволить использовать их в качестве новых терапевтических средств, которые могут привести к оптимизации подходов к лечению сердечно-сосудистых заболеваний. Особенно активно ведется разработка препаратов на основе РНК-интерференции (РНКи), которые используют недавно открытые пути эндогенных коротких интерферирующих РНК и становятся универсальными инструментами для эффективного подавления экспрессии белка. Так, использование некоторых препаратов на основе РНК-интерференции в ряде клинических исследований показало значительное снижение уровня холестерина-не-ЛПВП и триглицеридов при лечении дислипидемии и NT-proBNP при лечении наследственного транстиретинового амилоидоза. В данной статье затронут вопрос такой немаловажной проблемы, как инфаркт миокарда. Так, гипертрофия и фиброз сердца в значительной степени способствуют утолщению и повышению жесткости стенок желудочков, приводя к ремоделированию сердца и ухудшая прогноз. С этой целью может использоваться биосовместимый пластырь с микроиглами (МИ) с антифиброзной активностью на основе микроРНК для предотвращения чрезмерного сердечного фиброза после инфаркта миокарда. Суммируя вышесказанное, безусловно, стоит отметить, что данная проблема мало изучена и требует дальнейших исследований. Выявление безопасной и эффективной стратегии терапии на основе микроРНК остается сложной задачей, однако рассмотренные новые подходы обладают огромным потенциалом для лечения сердечно-сосудистых заболеваний.
Микрорнк, мрнк, биомаркер, сердечно-сосудистые заболевания, прогноз, терапия
Короткий адрес: https://sciup.org/143180666
IDR: 143180666 | УДК: 615.038 | DOI: 10.38109/2225-1685-2023-3-82-88
Текст обзорной статьи МикроРНК: взгляд клинициста на состояние проблемы. Часть 3: микроРНК и подходы к лечению сердечно-сосудистых заболеваний
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Некоммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: https://creativecommons. org/licenses/by-nc-sa/4.0/
УДК 615.038
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
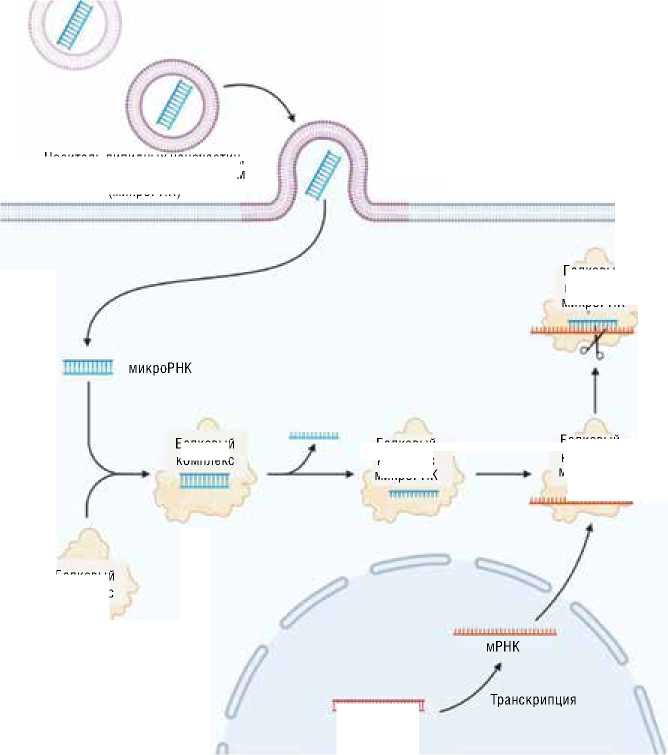
Экспрессируемые микроРНК играют важную роль в развитии различных заболеваний человека. Изучение мишеней микроРНК и способов влияния на них открывает широкие горизонты для обнаружения новых подходов к лечению и профилактике. Лекарственные препараты на основе микроРНК используются для восстановления или снижения уровня микроРНК или для ингибирования взаимодействия микроРНК с ее мишенями. Так, данные препараты могут быть направлены на несколько мРНК одновременно, а значит могут и влиять на трансляцию множества генов, лежащих в основе сердечно-сосудистых заболеваний. Поскольку средства, направленные на РНК, по своей природе нестабильны и не способны проникать через клеточные мембраны из-за их отрицательного заряда, применяются различные химические модификации для улуч- шения их фармакокинетики и фармакодинамики. Существует ряд подходов к лечению с использованием микроРНК. Во-первых, это гиперэкспрессия экзогенной микроРНК для снижения экспрессии генов с нежелательными свойствами. Эта концепция доставки микроРНК липидными частицами в органы-мишени продемонстрирована на рисунке 1.
Во-вторых, это гиперэкспрессия ингибиторов микроРНК для предотвращения негативных эффектов микроРНК, обусловливающих развитие заболевания. Большинство исследований в области терапии с помощью микроРНК используют второй подход [2,3]. Ингибиторами являются, как правило, антисмысловые олигонуклеотиды (АСО) или антимикроРНК олигонуклеотиды (АМО), которые являются короткими комплементарными антисмысловыми молекулами (антисмысловые РНК (англ. Antisense RNA) — одноцепочечные РНК,
Носитель липидных наночастиц, заполненный олигонуклеотидом (микроРНК)
Белковый комплекс
Белковый комплекс микроРНК
МИКРОРНК СИСТЕМА ДОСТАВКИ НАНОЧАСТИЦ
МикроРНК могут связываться с несколькими мРНК и влиять на трансляцию нескольких мишеней мРНК. Малые интерферирующие РНК высокоспецифичны к одной мРНК-мишени.
Белковый комплекс
Геномная ДНК
Рисунок 1. Доставка лекарств на основе микроРНК в ткани-мишени. МикроРНК доставляется липидными частицами, которые могут быть включены клетками-мишенями посредством эндоцитоза. Доставленный олигонуклеотид может быть поглощен комплексом сайленсинга, индуцированный РНК, рибонуклеопротеиновым комплексом (мультибелковый комплекс, участвующий в подавлении экспрессии генов). Введенная РНК служит шаблоном для RISC (комплекс сайлесинга, индуцированный РНК (англ. RNA-induced silencing complex), в результате активности которого РНК присоединяется к комплементарной мРНК и вызывает разрезание мРНК белком Argonaute), для связывания дополнительного внутриклеточного транскрипта мРНК. Как только комплементарная мРНК связывается с RISC, комплекс вызывает расщепление и деградацию цепи мРНК-мишени [1].
Белковый комплекс микроРНК
РАСЩЕПЛЕННАЯ МИКРОРНК
Белковый комплекс микроРНК
1 Hl 11 И Инн
Figure 1. Delivery of miRNA-based drugs to target tissues. MicroRNA is delivered by lipid particles, which are turned on by target cells through endocytosis. The delivered oligonucleotide can be taken up by an RNA-induced silencing complex (RISC), a ribonucleoprotein complex. The introduced RNA serves as a template for RISC to bind an additional intracellular mRNA transcript. Once the complementary mRNA binds to RISC, a complex causes cleavage and degradation the fragments of target mRNA [1].
Примечание/Note: мРНК – матричная рибонуклеиновая кислота (mRNA – messenger ribonucleic acid), Микро РНК – малые некодирующие молекулы рибонуклеиновой кислоты (MicroRNA – small non-coding ribonucleic acid molecules), ДНК – дезоксирибонуклеиновая кислота (DNA – deoxyribonucleic acid)
84 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 3, 2023
которые комплементарны мРНК, транскрибируемой в клетке, или гену-мишени), связывающимися с микроРНК. Для повышения стабильности и специфичности АМО были разработаны антагомиры (cинтeтичeские молекулы, комплементарные определенной микроРНК, которые способны инактивировать её, представляющие собой конъюгаты 2’-О-метил холестерола [4]. Третье поколение АМО представлено «закрытыми» аминокислотами (ЗАК), в структуре которых рибоза одного или нескольких нуклеотидов содержит дополнительный метиленовый мостик, «закрывающий» аминокислоту в конформации, стабилизирующей двойные цепи c микроРНК [5]. Другим способом является использование «ложных» микроРНК или «губок», которые действуют как конкурентные ингибиторы. Эти микроРНК-«губки» представляют собой экспрессированные трансгены, содержащие несколько последовательных связывающих сайтов (места взаимодействия микроРНК с мРНК) к интересующей микроРНК [6]. Преимуществом использования микроРНК-«губок» является возможность блокировать несколько микроРНК и способность экспрессироваться генетически модифицированными клетками в отличие от искусственно синтезированных антагомиров и ЗАК.
Еще одним способом является использование вирусов с положительной цепью РНК, которые напоминают эндогенные мРНК и, следовательно, могут напрямую связываться и регулироваться микроРНК. Однако вирусная инфекция может привести к секвестрации эндогенных микроРНК или изменению их экспрессии, что аналогичным образом может привести к про- или противовирусным эффектам.
Накоплено большое количество материала, свидетельствующее о том, что описанная терапия является эффективной. Тем не менее, терапевтический эффект использования микроРНК может зависеть от ряда факторов: взаимодействия с липопротеиновыми частицами, липопротеиновыми рецепторами и трансмембранными белками.
Идентификация микроРНК как важных регуляторов не только отдельных генов, но и целых генных сетей, открывает большие перспективы в терапии различных заболеваний. Изначально антагомиры показали себя как эффективные и специфичные сайленсеры эндогенной микроРНК у мышей [7]. Химическая модификация и конъюгация с холестерином стабилизируют и облегчают перемещение антагомиров в кровеносном русле. Ингибиторный эффект антагомиров является достаточно длительным, что можно объяснить долгим периодом полужизни эндогенных микроРНК [8]. Однако данный длительный эффект микроРНК, который приводит к нокдауну мРНК (снижению экспрессии), сохраняющемуся в течение не- скольких месяцев, может явиться и ограничением методики. Новые разработки, такие как обратимое подавление микроРНК с использованием коротких синтетических высокоаффинных олигонуклеотидов, могут позволить лучше модулировать эффекты лекарств с микроРНК [9].
Вышеописанные механизмы кратко представлены в таблице 1.
Сердечная недостаточность
В сфере лечения сердечно-сосудистых заболеваний недавно было начато первое клиническое исследование первой фазы на основе синтетического антисмыслового олигонуклеотида в качестве фармакологического ингибитора микроРНК-132 (CDR132L). У пациентов, страдающих сердечной недостаточностью, определялся повышенный уровень микроРНК-132, которая участвует в процессах фиброза и ремоделирования сердца [12]. В данном исследовании T a ube! J и соавт. изучали влияние введения ингибитора микроРНК-132 на сердечно-сосудистую систему. CDR132L вводился в рандомизированном исследовании, в которое были включены 28 пациентов — 30-80 лет с хронической СН 1-3-го класса по NYHA с ФВЛЖ от ≥ 30% до <50% [12]. В ходе данного исследования авторы отметили снижение мозгового натрийуретического гормона (NT-proBNP) в группе лечения и значительное сужение комплекса QRS, которое авторы интерпретировали как благоприятное влияние антагомира на развитие фиброза сердца. Таким образом, результаты показали дозозависимое, статистически значимое снижение микроРНК-132 под действием антисмыслового ингибитора в плазме, что уже было продемонстрировано в доклинических исследованиях на животных [13,14].
Артериальная гипертензия
На настоящий момент количество гипотензивных препаратов крайне обширно. Однако спектр используемых лекарственных средств для лечения АГ нуждается в расширении за счет препаратов с новым механизмом действия. Так, в последнее время появилось исследование, посвящённое изучению антисмыслового олигонуклеотида к ангиотензиногену.
IONIS-AGT-LRx – это специфический АСО, предназначенный для связывания с мРНК ангиотензиногена [15]. Препарат представлен подкожной инъекцией. Гибридизация IONIS-AGT-LRx с мРНК ангиотензиногеном приводит к зависимому от РНКазы H1 расщеплению мРНК, тем самым предотвращая образование белка ангиотензиногена.
В ходе предварительных анализов в группе активного лечения наблюдалось клинически значимое снижение САД ( - 12 мм рт. ст.; 95% ДИ: [ - 21; - 4] мм рт. ст.) и ДАД ( - 6 мм рт. ст.; 95% ДИ: от - 11 до - 1 мм рт. ст.) [15]. Результаты продемонстри-
1. Гиперэкспрессия экзогенной микроРНК
Таблица 1. Краткое изложение возможных методов лечения с помощью микроРНК
Table 1. Summary of possible treatments using microRNA
Метод лечения с использованием микроРНК Получаемый эффект
Поглощение олигонуклеотида мультибелковым комплексом, участвующим в подавлении экспрессии генов, с последующим присоединением к комплементарной мРНК и расщеплением цепи мРНК-мишени, что приводит к снижению экспрессии генов с нежелательными свойствами
2. Гиперэкспрессия ингибиторов микроРНК
Связывание ингибиторов микроРНК с микроРНК, обуславливающих развитие заболевания
Наличие последовательных связывающих сайтов с возможностью связыва-
3. Использование микроРНК-«губок»
ния и блокировки нескольких микроРНК
4. Использование вирусов с положительной Связывание и регулирование микроРНК с последующим про- или противо-цепью РНК, напоминающих эндогенные мРНК вирусным эффектом
ровали хорошую переносимость IONIS-AGT-LRx с отсутствием нежелательных побочных эффектов, таких как почечная недостаточность, гиперкалиемия или гипотензия.
Другим механизмом потенциального влияния на АД является РНК-интерференция.
Зилебезиран представляет собой подкожный РНК-интерференционный (RNAi) терапевтический препарат, нацеленный на экспрессируемый печенью ангиотензиноген (AGT) [16]. В исследовании фазы 1 пациенты с АГ были рандомизированы два к одному (2:1) на группу пациентов, получающих 80 мг IONIS-AGT-LRx или группу плацебо. Пациенты также были стратифицированы по уровню ангиотензиногена в плазме ( ≤ 30 мкг/мл против >30 мкг/мл). Все пациенты получали еженедельные подкожные инъекции в клинике в течение 6 недель с нагрузочной дозой, вводимой на 3-й день, затем наблюдались в течение 12 недель в период после лечения. Первичной конечной точкой эффективности было сравнение процентного изменения ангиотензиногена в плазме от исходного уровня до 7-й недели исследования (43-й день) между 80 мг IONIS-AGT-LRx и плацебо. IONIS-AGT-LRx приводил к значительному снижению ангиотензиногена в плазме у пациентов с АГ, а также был более выражен в дополнительном исследовании у пациентов, которые уже принимали по крайней мере 2
препарата, 1 из которых был иАПФ или БРА. Эффект наступил довольно быстро с уменьшением вдвое концентрации в плазме ангиотензиногена, отмеченным в первые 8 дней. В экспериментальном исследовании наблюдалось большее количество пациентов (84 пациента с артериальной гипертензией), достигших определенных пороговых значений снижения (<5, <10 и <15 мм рт. ст.) и достигших САД ≤ 140 мм рт. ст. и ДАД ≤ 90 мм рт. ст. [16].
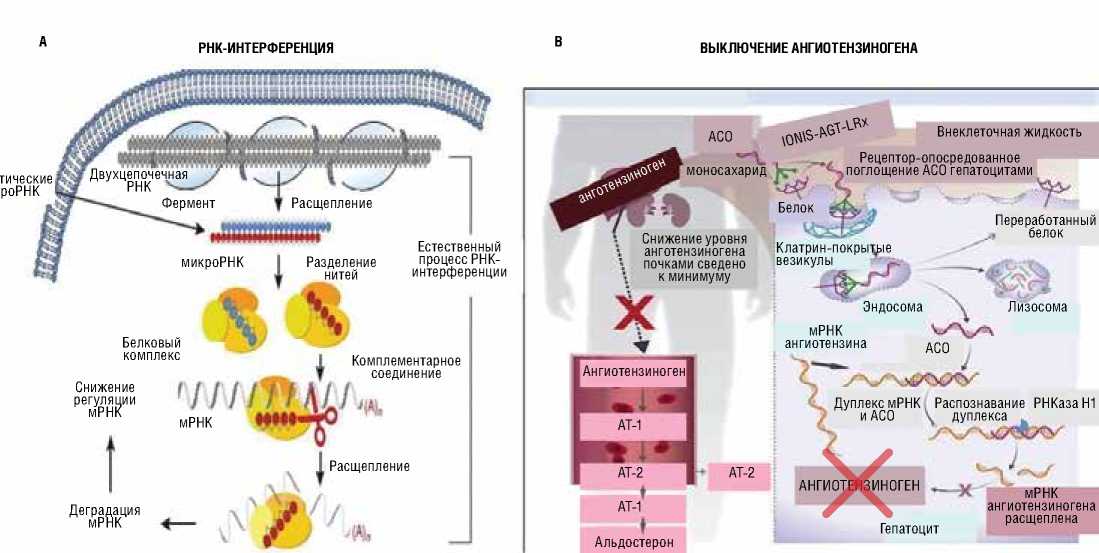
Описанные выше механизмы влияния на АД продемонстрированы на рисунке 2.
Cиндром обсруктивного апноэ сна
Синдром обструктивного апноэ во сне (СОАС) является распространенным нарушением дыхания, связанным со сном, и важной причиной вторичной гипертензии. Lirong He и соавт. в своем исследовании изучали роль микроРНК-126a-3p в АГ, обусловленной СОАС, и участие HIF-1 α (фактор, индуцируемый гипоксией 1-альфа) в ее патогенезе [18]. Крыс Sprague Dawley подвергали воздействию хронической прерывистой гипоксии в течение 8 недель, чтобы вызвать АГ, обусловленную СОАС. Результаты данного исследования показали, что у крыс наблюдалось снижение экспрессии микроРНК-126a-3p и увеличение экспрессии фактора, индуцируемого гипоксией 1-альфа. Введение рекомбинантного аденоассоциированного вируса,
A
B
РНК-ИНТЕРФЕРЕНЦИЯ
ВЫКЛЮЧЕНИЕ АНГИОТЕНЗИНОГЕНА
Я-^
Внеклеточная жидкость
АСО моносахарид
Расщепление
Белок микроРНК
Лизосома
АСО
Ангиотензиноген
АТ-1
Расщепление
АТ-2
АТ-2
АТ-1
ация
Гепатоцит
Альдостерон
Разделение нитей
Снижение уровня анготензиногена почками сведено к минимуму
Белковый комплекс
Комплементарное соединение
Клатрин-покрытые везикулы
Естественный процесс РНК-интерференции
Рецептор-опосредованное поглощение АСО гепатоцитами
Переработанный белок мРНК ангиотензиногена расщеплена
Снижение регуляции
/Х/ХКРСЫХУ'
Дуплекс мРНК Распознавание РНКаза Н1 и АСО \ дуплекса
> yx/xiiTObsy
АНГИОТЕНЗИНОГЕН
Двухцепочечная РНК
Фермент
Эндосома мРНК ангиотензина
Рисунок 2. Различия в подходах к блокированию ангиотензиногена в печени [17]
А – модель РНК-интерференции, используемая для блокирования выработки ангиотензиногена в печени. В – ингибирование антисмысловым нуклеотидом, используемая для блокирования выработки ангиотензиногена в печени.
Figure 2. Differences in approaches to blocking angiotensinogen in the liver [17]
A – a model of RNA interference used to block the production of angiotensinogen in the liver. B – inhibition by antisense nucleotide, used to block the production of angiotensinogen in the liver.
Примечание/Note: IONIS-AGT-LRx - исследуемый препарат (IONIS-AGT-LRx - investigational drug), АСО – антисмысловые нуклеотиды (ASN – antisense nucleotides), АТ-1 – ангиотензин-1 (AT-1 – angiotensin-1), АТ-2 – ангиотензин-2 (AT-2 – angiotensin-2), Микро РНК – малые некодирующие молекулы рибонуклеиновой кислоты (MicroRNA – small non-coding ribonucleic acid molecules), мРНК – матричная рибонуклеиновая кислота (mRNA – messenger ribonucleic acid), РНКаза Н1 – рибонуклеаза Н1 (RNase H1 – ribonuclease H1)
86 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 3, 2023
экспрессирующего микроРНК-126a-3p (rAAV-miR-126a), снижало систолическое артериальное давление, подавляло окси-дативный стресс, замедляло воспаление и ремоделирование сосудов сердца и брюшной аорты. Более того, механизм был связан с его целенаправленным подавлением фактора, индуцируемого гипоксией 1-альфа. Эти данные свидетельствуют о том, что микроРНК-126a-3p может быть новой потенциальной терапевтической мишенью для лечения АГ на фоне СОАС [18].
Дислипидемия
Гиполипидемическая терапия является ключевым звеном снижения сердечно-сосудистого риска для первичной и вторичной профилактики. Одной из потенциальных терапевтических мишеней является ANGPTL3 – вырабатываемый печенью белок, который ингибирует липазы, включая липопротеинли-пазу, и замедляет метаболизм липопротеинов, богатых триглицеридами.
Вупанорсен, антисмысловой олигонуклеотид второго поколения, конъюгированный с N-ацетилгалактозамином, был изучен с возрастающими дозами (80, 120, 160 мг каждые 4 недели, или 60, 80, 120 или 160 мг каждые 2 недели) у 286 пациентов, которые были рандомизированы следующим образом: 242 пациента получали вупанорсен, а 44 – плацебо [19]. Средний возраст составил 64 года, 44% составляли женщины, медиана ХС-не-ЛПВП составила 132,4 мг/дл, а медиана триглицеридов составила 216,2 мг/дл. По сравнению с плацебо прием вупанорсена привел к значительному снижению относительно исходного уровня ХС-не-ЛПВП от 22,0% при приеме 60 мг каждые 2 недели до 27,7% при приеме 80 мг каждые 2 недели. Наблюдалось дозозависимое снижение уровня триглицеридов, которое варьировалось от 41,3% до 56,8%. Влияние на уровень ХС-не-ЛПНП и АпоВ было более скромным (7,9-16,0% и 6,0-15,1%, соответственно) и без четкой зависимости «доза-эффект». Уровни ANGPTL3 были снижены дозозависимым образом на 69,9-95,2% [19].
Наследственный транстиретиновыйамилоидоз (ATTR-амилоидоз)
Наследственный транстиретиновый амилоидоз – это муль-тисистемное заболевание накопления, которое проявляется прогрессирующей полиневропатией и/или кардиомиопатией.
В исследовании P. Garcia Pavia и соавт. рассматривали влияние вутрисирана на 164 пациентов [20]. Вутрисиран – экспериментальный препарат, разработанный на основе механизма РНК-интерференции. После 18 месяцев лечения вутрисираном значительно снизился уровень NT-proBNP (натрийуретического гормона) по сравнению с плацебо и продемонстрирована тенденция к улучшению эхокардиографических параметров (включая разницу в сердечном выбросе, P=0,043). Сцинтиграфия миокарда с 99mTc была проведена у 64 пациентов, получавших вутрисиран в начале лечения, у 35 (54,7%) из которых была установлена степень Перуджини ≥ 2 (шкала оценки Пе-руджини визуально сравнивает накопление препарата клетками миокарда и костными структурами (ребрами)). Из обследованных пациентов у 28,1% (16/57) наблюдалось улучшение по шкале Перуджини, у 68,4% (39/57) изменений не было, а у 3,5% (2/57) ухудшение по шкале Перуджини. Из обследованных пациентов с исходной степенью Перуджини ≥ 2 (степень 2 – интенсивность накопления сравнима с костными структурами и является характерной для ATTR амилоидоза) доля пациентов с улучшением отношения интенсивности счета в области сердца по отношению к контралатеральной стороне и нормализацией общего объема ЛЖ составила 76,9% (20/26) и 100%
(25/25), соответственно. При лечении вутрисираном не было выявлено никаких проблем с сердечной безопасностью [20].
Инфаркт миокарда
Ремоделирование сердца вследствие развития фиброза после инфаркта миокарда (ИМ) является важным фактором неблагоприятного прогноза, повышающим риск смертности от сердечной недостаточности. Таким образом, предотвращение фиброза или его замедление является важнейшей задачей. В исследовании Jianping Yuan и соавт. исследовалось влияние пластыря с микроиглами (МИ-пластырь) на основе желатина для загрузки экзосом, содержащих микроРНК-29b, с анти-фиброзной активностью для предотвращения чрезмерного фиброза сердца после ИМ [21]. Экзосомы выделяют из мезенхимальных стволовых клеток пуповины человека и загружают имитаторами микроРНК-29b с помощью электропорации (метод создания пор в бислойной липидной мембране под действием высокоинтенсивного короткоимпульсного электрического поля), которые могут быть эффективно внедрены в фибробласты сердца для усиления экспрессии микроРНК-29b и подавления экспрессии белков, связанных с фиброзом. После имплантации в сердце с ИМ мыши пластырь с микроиглами может увеличить удержание нагруженных экзосом в некротизированном миокарде, что приводит к снижению воспаления, уменьшению размера инфаркта, ингибированию фиброза и улучшению сердечной функции [21]. В этом исследовании MИ-пластырь рассматривался как платформа для локальной доставки экзосом, содержащих антифибротические биомолекулы, для профилактики фиброза сердца, демонстрируя потенциал лечения ИМ в клинической практике.
ЗАКЛЮЧЕНИЕ
Проводимые в последние годы исследования с использованием РНК демонстрируют огромный потенциал в лечении различных заболеваний, включая в том числе и ССЗ. Понимание регуляции, опосредованной микроРНК, выявление новых мишеней микроРНК позволят нам не только лучше понимать патофизиологические процессы, протекающие в сердечнососудистой системе, но и разработать новые подходы к этиотропной терапии различных заболеваний.
Можно надеяться, что разработка и исследование новых терапевтических препаратов на основе микроРНК, а также способов их доставки позволит найти новый тонкий и персонализированный подход в лечении не только патологии определённых органов и тканей, но и определенного типа клеток путем конъюгации со специфическими антителами или посредством других механизмов.
Список литературы МикроРНК: взгляд клинициста на состояние проблемы. Часть 3: микроРНК и подходы к лечению сердечно-сосудистых заболеваний
- Kennel PJ, Schulze PC. A Review on the Evolving Roles of MiRNA-Based Technologies in Diagnosing and Treating Heart Failure. Cells. 2021 Nov 16;10(11):3191. PMID: 34831414;PMCID: PMC8617680. https://doi.org/10.3390/cells10113191
- Lima CR, Geraldo MV, Fuziwara CS, Kimura ET, Santos MF. MiRNA-146b-5p upregulates migration and invasion of different Papillary Thyroid Carcinoma cells. BMC Cancer. 2016 Feb 16;16:108. PMID: 26883911;PMCID: PMC4754828. https://doi.org/10.1186/s12885-016-2146-z
- Li JY, Wei X, Sun Q, Zhao XQ, Zheng CY, Bai CX, Du J, Zhang Z, Zhu LG, Jia YS. MicroRNA-449b-5p promotes the progression of osteoporosis by inhibiting osteogenic differentiation of BMSCs via targeting Satb2. Eur Rev Med Pharmacol Sci. 2019 Aug;23(15):6394-6403. PMID: 31378877.https://doi.org/10.26355/eurrev_201908_18519
- Krutzfeldt J., Rajewsky N., Brach R. et al. Silencing of microRNAs in vivo with “antagomirs”. Nature 2005;43:685-689. https://doi.org/10.1038/nature04303
- Kurreck J. Antisense technologes. Improvement through novel chemical modifications. Eur J Biochem 2003;270:1628-1644. https://doi.org/10.1046/j.1432-1033.2003.03555.x
- Ebert M. S., Neison J. R., Sharp P. A. McroRNA sponges: competitive inhibitors of small RNAs in mammalian cells. Nat Methods 2007;4:721726. https://doi.org/10.1038/nmeth1079
- Krutzfeldt J., Rajewsky N., Braich R., Rajeev K. G., Tuschl T, Manoharan M. et al. Silencing of microRNAs in vivo with “antagomirs”. Nature 2005;438:685-689. https://doi.org/10.1038/nature04303
- Kim V. N. MicroRNA biogenesis: coordinated cropping and dicing. Nat Rev Mol Cell Biol 2005;6:376-385. https://doi.org/10.1038/nrm1644
- Zlatev I, Castoreno A, Brown CR, Qin J, Waldron S, Schlegel MK, Degaonkar R, Shulga-Morskaya S, Xu H, Gupta S, Matsuda S, Akinc A, Rajeev KG, Manoharan M, Maier MA, Jadhav V. Reversal of siRNAmediated gene silencing in vivo. Nat Biotechnol 2018;36:509-511. https://doi.org/10.1038/nbt.4136
- Chicago Chen, S., Huang, Y., Liu, R., Lin, Z., Huang, B., Ai, W., He, J., Gao, Y., Xie, P.»Exosomal miR-152-5p/ARHGAP6/ROCK axis regulates apoptosis and fibrosis in cardiomyocytes». Experimental and Therapeutic Medicine 25, no. 4 (2023): 165. https://doi.org/10.3892/etm.2023.11864
- Zhang X, Gao Y, Wu H, Mao Y, Qi Y. LncRNA HOX transcript antisense RNA mitigates cardiac function injury in chronic heart failure via regulating microRNA-30a-5p to target KDM3A. J Cell Mol Med. 2022 Mar;26(5):1473-1485. Epub 2022 Jan 26. PMID: 35083842;PMCID: PMC8899154. https://doi.org/10.1111/jcmm.17160
- Täubel J, Hauke W, Rump S, Viereck J, Batkai S, Poetzsch J, Rode L, Weigt H, Genschel C, Lorch U, Theek C, Levin AA, Bauersachs J, Solomon SD, Thum T. Novel antisense therapy targeting microRNA-132 in patients with heart failure: results of a first-in-human Phase 1b randomized, double-blind, placebo-controlled study. Eur Heart J. 2021 Jan 7;42(2):178-188. PMID: 33245749;PMCID: PMC7954267. https://doi.org/10.1093/eurheartj/ehaa898
- Foinquinos A, Batkai S, Genschel C, Viereck , Rump S, Gyöngyösi M, Traxler D, Riesenhuber M, Spannbauer A, Lukovic D, Weber N, Zlabinger K, Hašimbegović E, Winkler J, Fiedler J, Dangwal S, Fischer M, Roche J. D L, Wojciechowski D, Kraft T, Garamvölgyi R, Neitzel S, Chatterjee S, Yin X , Bär C , Mayr M , Xiao K , Thum T. Preclinical development of a miR-132 inhibitor for heart failure treatment. Nat Commun 2020;11:633. https://doi.org/10.1038/s41467-020-14349-2
- Batkai S, Genschel C, Viereck J, Rump S, Bär C, Borchert T, Traxler D, Riesenhuber M, Spannbauer A, Lukovic D, Zlabinger K, Hašimbegović E, Winkler J, Garamvölgyi R, Neitzel S, Gyöngyösi M, Thum T. CDR132L improves systolic and diastolic function in a large animal model of chronic heart failure. Eur J Heart 2021;42:192-201. https://doi.org/10.1093/eurheartj/ehaa791
- Morgan ES, Tami Y, Hu K, Brambatti M, Mullick AE, Geary RS, et al. Antisense Inhibition of Angiotensinogen With IONIS-AGT-L(Rx): Results of Phase 1 and Phase 2 Studies. JACC Basic Transl Sci. 2021;6:485-96. https://doi.org/10.1016/j.jacbts.2021.04.004
- Huang STJ, Casey S, Leung PM, Webb DJ, Desai AS, Cheng Y, et al. Durable Reductions in Circulating Angiotensinogen and Blood Pressure Six Months After Single Doses of ALN-AGT, an RNA Interference Therapeutic Targeting Hepatic Angiotensinogen Synthesis, in Hypertensive Patients. Circulation. 2021;144:A10974 https://doi.org/10.1161/circ.144.suppl_1.10974.
- Salvador, V.D., Bakris, G.L. Novel antihypertensive agents for resistant hypertension: what does the future hold? Hypertens Res 45, 1918-1928 (2022). https://doi.org/10.1038/s41440-022-01025-9
- He L, Liao X, Zhu G, Kuang J. miR-126a-3p targets HIF-1α and alleviates obstructive sleep apnea syndrome with hypertension. Hum Cell. 2020 Oct;33(4):1036-1045. Epub 2020 Aug 10. PMID: 32779153.https://doi.org/10.1007/s13577-020-00404-z
- Bergmark BA, Marston NA, Bramson CR, Curto M, Ramos V, Jevne A, Kuder JF, Park JG, Murphy SA, Verma S, Wojakowski W, Terra SG, Sabatine MS, Wiviott SD; TRANSLATE-TIMI 70 Investigators. Effect of Vupanorsen on Non-High-Density Lipoprotein Cholesterol Levels in Statin-Treated Patients With Elevated Cholesterol: TRANSLATE-TIMI 70. Circulation. 2022 May 3;145(18):1377-1386. Epub 2022 Apr 3. PMID: 35369705;PMCID: PMC9047643. https://doi.org/10.1161/CIRCULATIONAHA.122.059266
- P. Garcia Pavia, J.D. Gillmore, P. Kale, J.L. Berk, M.S. Maurer, I. Conceição, M. Dicarli, S. Solomon, C. Chen, S. Arum, J. Vest, M. Grogan, C. Hababou, HELIOS-A: 18-month exploratory cardiac results from the phase 3 study of vutrisiran in patients with hereditary transthyretin-mediated amyloidosis, ISSN 1878-6480, https://doi.org/10.1093/eurheartjsupp/suac121.654
- Yuan J, Yang H, Liu C, Shao L, Zhang H, Lu K, Wang J, Wang Y, Yu Q, Zhang Y, Yu Y, Shen Z. Microneedle Patch Loaded with Exosomes Containing MicroRNA-29b Prevents Cardiac Fibrosis after Myocardial Infarction. Adv Healthc Mater. 2023 Feb 5:e2202959. Epub ahead of print. PMID: 36739582.https://doi.org/10.1002/adhm.202202959


