Микросателлитная нестабильность как уникальная характеристика опухолей и предиктор эффективности иммунотерапии
Автор: Трякин А. А., Федянин М. Ю., Цуканов А. С., Шелыгин Ю. А., Покатаев И. А., Игнатова Е. О., Хакимова Г. Г., Фролова М. А., Тюляндин С. А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 4 т.9, 2019 года.
Бесплатный доступ
Дефицит системы репарации неспаренных оснований представляет собой уникальное молекулярное нарушение, встречающееся в большинстве видах опухолей и проводящее к формированию в них микросателлитной нестабильности (MSI). Возникновение гипермутированного фенотипа и связанная с ним высокая иммуногенность обуславливает в целом более благоприятный прогноз данных опухолей, а также высокую чувствительность к иммунотерапии ингибиторами контрольных точек иммунного ответа. В данной обзорной статье представлены современные представления по диагностике, прогностической и предиктивной значимости MSI при различных опухолях, а также об эффективности их иммунотерапии.
Дефицит системы неспаренных оснований, микросателлитная нестабильность, иммунотерапия, ниволумаб, пембролизумаб, ипилимумаб
Короткий адрес: https://sciup.org/140249286
IDR: 140249286 | DOI: 10.18027/2224-5057-2019-9-4-59-69
Текст научной статьи Микросателлитная нестабильность как уникальная характеристика опухолей и предиктор эффективности иммунотерапии
Регистрация в 2017 году пембролизумаба для лечения опухолей с дефицитом системы репарации неспаренных оснований (mismatch repair-deficient, dMMR) стала одним из самых знаковых событий в онкологии последних лет. Впервые в истории препарат был зарегистрирован вне нозологии, а по типу молекулярного нарушения в опухоли. Высокая эффективность иммунотерапии всколыхнула интерес к данному молекулярному нарушению, о существовании которого большинство онкологов до недавнего времени имело крайне поверхностное представление.
Целью данного обзора является освещение особенностей диагностики, прогноза и лечения опухолей с dMMR.
СИСТЕМА РЕПАРАЦИИ НЕСПАРЕННЫХ ОСНОВАНИЙ И НАРУШЕНИЯ
ЕЕ МЕХАНИЗМА РАБОТЫ.
МИКРОСАТЕЛЛИТНАЯ НЕСТАБИЛЬНОСТЬ.
Система MMR является одной из составляющих сложного механизма поддержания стабильности генома клетки. Ее функция заключается в устранении ошибок репликации ДНК, возникающих при делении клеток, в ситуациях, когда во время построения новой нити происходит ошибочная вставка некомплиментарного нуклеотида (например, вместо гуанина к цитозину встраивается тимин), в результате чего возникает несоответствие (mismatch). Система MMR включает в себя белки MSH2 и MSH6, формирующие первый гетеродимер, отвечающий за поиск ошибок в ДНК, а также белки MLH1 и PMS2, составляющие второй гетеродимер, который в месте обнаруженной ошибки комплексом MS2/MSH6 присоединяется к нему. В результате этого происходит активация экзонуклеазы, которая вырезает участок с ошибкой. Далее ДНК-полимераза правильно достраивает эту нить ДНК [1].
Молекулярные нарушения в функционировании хотя бы одного из белков MMR, а также в гене EPCAM (делеция 3´- конца которого вызывает эпигенетическое гиперметилирование промотора гена MSH2), приводит к прекращению работы всей системы. Наследственный синдром, известный как синдром Линча, обусловлен мутацией в одном из генов MLH1, MSH2, MSH6, PMS2, а также гена EPCAM [2]. Выключение второго функционирующего аллеля происходит в результате второго события (соматическая мутация, потеря гетерозиготности, метилирование промоторного участка) уже непосредственно в самих клетках органа-мишени.
Микросателлитная нестабильность (microsatellite instability — MSI) в опухоли является отражением дефицита системы MMR. Микросателлиты — короткие некодирующие последовательности в ДНК, состоящие из повторяющихся последовательностей нуклеотидов. Они могут быть мо-нонуклеотидные (например, ААААА), динуклеотидные (например, АСАСАСАС) и далее вплоть до пента- и сек-стануклеотидных. Функция микросателлитов до конца не ясна. Микросателлитные повторы у каждого индивидуума консервативны и индивидуальны. Дефицит белков MMR приводит к тому, что в опухоли накапливается большое число ошибок в микросателлитах, что приводит к формированию MSI фенотипа.
Нарушения в системе репарации неспаренных оснований ДНК приводят к образованию мутаций со сдвигом рамки считывания, что характеризуется ранним появлением стоп-кодонов и инактивацией разных генов [8]. Полноэкзомное секвенирование показало, что среднее число мутаций в опухолях с MSI составило 1782 на опухоль, тогда как в опухоли без дефицита системы MMR это значение составляло 73 [9,10]. Рост числа мутаций сопровождается увеличением числа опухолевых неоантигенов, распознаваемых иммунной системой. Опухоли с MSI характеризуются высокой инфильтрацией лимфоцитов, представленных преимущественно CD8 и активированными Th1 клетками, принадлежащих к кластеру координаторного иммунного ответа [11–13].
Опухолевые клетки с MSI защищаются от воздействия иммунной системы повышенной экспрессией лигандов иммунных чекпойнтов (PD-L1, CTLA-4, LAG-3 и IDO), при этом данные лиганды экспрессируются не на опухолевых клетках, а на миелоидных клетках по фронту инвазии опухоли [14]. Такой характер экспрессии лигандов к иммунным чекпойнтам, возможно, говорит о существовании других сложных иммунологических путей и о том, что сам PD-L1 следует рассматривать в качестве иммунологического маркера, а не просто компонента комплекса PD-1/PD-L1 [15].
ДИАГНОСТИКА ДЕФИЦИТА СИСТЕМЫ MMR
Диагностика дефицита системы MMR классически строится на двух основных тестах — иммуногистохимическом (ИГХ) и ПЦР. В первом случае в клетках опухоли производится оценка экспрессии 4 генов: MLH1, MSH2, MSH6, PMS2. Любой из 4 возможных вариантов отсутствия экспрессии данных генов — MSH6, PMS2, MLH1/PMS2, MSH2/MSH6 — не только свидетельствует о дефиците системы MMR, но и позволяет предположить, в каком гене имеется наследственная мутация, если у больного предполагается синдром Линча.
ПЦР диагностика MSI построена на выявлении специфических последовательностей микросателлитов. В 2004 г. Национальный раковый институт США принял стандартную панель из 5 последовательностей, включающую 2 мононуклеотидных последовательности (BAT-25, BAT-26) и три динулеотидных последовательности (D2S123, D5S346, D17S250) (19), которые сравниваются в опухоли и здоровой ткани (как правило, лимфоциты крови). При этом панель, которая включает все 5 мононуклеотидных повторов, является более чувствительной в выявлении опухолей с микросателлитной нестабильностью [2,19]. Заключение о высоком уровне MSI (MSI-H) делается при наличии несоответствия в двух и более маркерах, а несоответствие в одном маркере раньше толковалось как MSI-low. Изменения произошли в 2018 году, когда на консенсусе ESMO по диагностике дефицита MMR было принято решение считать несуществующим статус MSI-low [20]. В случае получения такого результата необходимо провести повторное тестирование с помощью другого метода (например, ИГХ или секвенирование).
Чувствительность обеих методик в выявлении дефицита MMR составляет около 93% при близкой к 100% специфичности [21–23]. В отдельных ситуациях ИГХ тест может оказаться ложноотрицательным в случаях некоторых миссенсмутаций или метилирования промотера MLH1 [19]. ПЦР диагностика MSI, в свою очередь, может не идентифицировать часть больных с мутациями MSH6 и MSH2 [23,24]. По этой причине оба метода являются дополняющими друг друга, вторая методика может применяться в случае негативного результата при наличии клинических данных за синдром Линча.
В последние годы появилась возможность диагностики MSI при помощи мультигенных NGS панелей (Illumina MiSeq, MSK-IMPACT, Foundation One, MSIsensor и др.). Массовое параллельное секвенирование позволяет получить информацию не только о наличии молекулярных нарушениях в сотнях исследованных генов, но и статусе MSI и мутационной нагрузке в опухоли (tumor mutational burden — TMB). Конкордантность данных платформ и ПЦР диагностики составляет 96–100% [25,26].
МИКРОСАТЕЛЛИТНАЯ НЕСТАБИЛЬНОСТЬ КАК УНИКАЛЬНАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ
И ПРЕДИКТОР ЭФФЕКТИВНОСТИ ИММУНОТЕРАПИИ
Следующим обязательным шагом после диагностики MSI в опухоли является исключение или подтверждение наследственного характера нарушений (синдрома Линча). Для этого исследуется ДНК лимфоцитов крови на предмет наличия мутаций в генах MLH1, MSH2, MSH6, PMS2. Мутация в опухоли гена BRAF никогда не встречается при синдроме Линча и свидетельствует о спорадическом характере поражения системы MMR.
ЧАСТОТА MSI ПРИ РАЗЛИЧНЫХ ОПУХОЛЯХ. ПРОГНОСТИЧЕСКАЯ И ПРЕДИКТИВНАЯ РОЛЬ MSI
У пациентов КРР с II–III стадиями заболевания MSI ассоциирована с лучшими показателями выживаемости без прогрессирования заболевания (ВБП) и общей выживаемостью ОВ. Монотерапия фторипиримидинами у больных с MSI не улучшает отдаленные результаты при II стадии (что дает возможность отказаться от адъювантной терапии в большинстве случаев), однако пациенты с III стадией все же выигрывают от применения режимов с оксалиплатином [28–30].
В то же время прогностическое значение MSI при IV стадии заболевания у больных КРР остается противоречивой. В совместном анализе 4 рандомизированных ис- следований (CAIRO, CAIRO2, COIN, FOCUS) больные с MSI характеризовалась худшей ОВ (HR 1,33). Однако после исключения пациентов с mutBRAF (34% больных в группе MSI), являющегося известным негативным прогностическим фактором, достоверные различия в показателях выживаемости между wtBRAF/MSI и wtBRAF/MSS группами были потеряны [32]. В другом анализе базы данных ACCENT, включившей 7 рандомизированных исследований по адъювантной химиотерапии, была изучена выживаемость после прогрессирования 2630 пациентов с исходной III стадией заболевания. Пациенты с MSI характеризовались лучшими показателями выживаемости вне зависимости от наличия или отсутствия мутации BRAF [33]. Предиктивное значение MSI в выборе таргетной терапии у пациентов с распространенным КРР была недавно продемонстрирована в исследовании CALGB/SWOG 80405 (сравнение в первой линии терапии режимов FOLFOX/FOLFIRI с добавлением бевацизумаба или цетуксимаба). Оказалось, что у пациентов с MSI отмечалась достоверно большая ОВ в группе бевацизумаба (медиана 30 мес.) по сравнению с цетуксимабом (медиана 11,9 мес.), в то время как для MSS опухолей оба препарата были равноэффективными [34]. Интересно, что предиктивное значение MSI не зависело от локализации первичной опухоли (право- или левосторонняя).
Прогностическая роль MSI при других опухолях остаётся малоизученной в виду малого числа больных. Так, до сих пор остается не ясным прогностическое значение MSI у больных раком эндометрия. Метаанализ 23 небольших ретроспективных исследований не выявил достоверных различий в ОВ, хотя и отмечалась тенденция к худшим показателям в группе MSI (HR 2.0, p=0,11) [35]. Эти результаты не были подтверждены в более поздней проспективной работе. Так, в исследовании III фазы PROTEC-3, в котором пациентки с I–III стадией и высоким риском рецидива получали одну послеоперационную химиолучевую терапию (ПОРТ) или ПОРТ с последующими 4 курсами паклитаксел + карбоплатин. Опухоли с MSI характеризовались промежуточным прогнозом. В целом, исследование показало выигрыш от добавления химиотерапии при III стадии заболевания, однако у пациенток с MSI адъювантная химиотерапия не улучшала отдаленные результаты [36].
Обобщая результаты вышеуказанных исследований, можно говорить о, как минимум, не худшем прогнозе пациентов с MSI возможности отказа от проведения адъювантной химиотерапии у части из них.
ИММУНОТЕРАПИЯ В ЛЕЧЕНИИ ОПУХОЛЕЙ С МИКРОСАТЕЛЛИТНОЙ НЕСТАБИЛЬНОСТЬЮ
Появление ингибиторов контрольных точек иммунного ответа (анти-PD1/PD-L1 и анти-CTLA моноклональных антител) стало революционной вехой в лекарственной терапии многих злокачественных опухолей. Понимание
Таблица 1. Результаты исследований эффективности иммунотерапии при опухолях с MSI
|
Исследование |
Вариант опухоли, число больных |
Терапия (доза, интервал) |
ЧОО |
ВБП, (медиана, мес.) |
ОВ |
|
Le DT. (38) |
различные, n=86 |
П 10 мг/кг, 3 нед. |
53% |
нд, 53% (2 года) |
64% (2 года) |
|
Le DT. (39) |
КРР, 2+ линии, n=63 |
П 200 мг, 3 нед. |
28% |
нд, 41% (2 года) |
76% (2 года) |
|
CheckMate-142 |
КРР, 2+ линия, n=74 (40) |
Н 3 мг/кг |
31% |
нд, 50% (1 год) |
73 % (1 год) |
|
КРР, 2+ линия, n=119 (41) |
Н 3 мг/кг + И 1 мг/кг, 3 нед. |
55% |
нд, 71 % (1 год) |
83% (1 год) |
|
|
КРР, 1-я линия, n=45 (42) |
Н 3 мг/ кг-3 нед. + И 1 мг/кг-6 нед. |
60% |
нд, 79% (1 год) |
85 % (1 год) |
|
|
NCT01633970 (43) |
КРР, 2+ линии, n=40 |
А 1200 мг + бевацизумаб 7,5 мг/кг — 3 нед. |
40% |
нд, (1,5–21,9 мес.) |
нд, (2,6–23,7 мес.) |
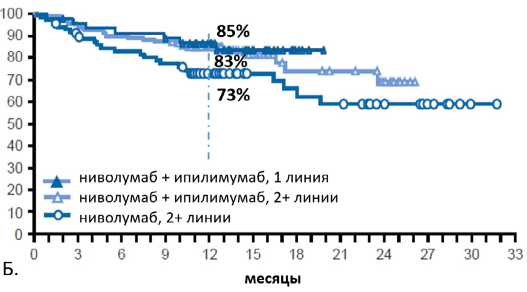
*А — атезолизумаб, Н — ниволумаб, П — пембролизумаб, И — ипилимумаб роли опухолевых неоантигенов, уровня инфильтрирующих опухоль лимфоцитов и ее мутационной нагрузки в реализации иммунного ответа привело к исследованию иммунотерапии в опухолях с MSI. В пилотном исследовании, включившем 48 пациентов с различными первичными опухолями, частота объективного ответа монотерапии пембролизумабом составила 60–62% при опухолях с MSI и 0% при MSS КРР [38]. Схожая высокая эффективность пембролизумаба в лечении опухолей с MSI вне зависимости от нозологического варианта была позже подтверждена этой же группой авторов на большем числе ранее предлеченных больных (n=86) с 12 видами опухолей [38]. Частота объективного ответа составила 53 %, контроль болезни — 77%, а медианы ВБП и ОВ не были достигнуты. Длительные ремиссии наблюдались вне зависимости от нозологического варианта опухоли. У 20 пациентов с сохраняющейся резидуальной опухолью была выполнена ее биопсия, показавшая у 12 (60%) из них наличие только элементов воспаления, но не опухолевых клеток. Результаты данных исследований послужили основой для беспрецедентного в истории онкологии регистрации FDA препарата (пембролизумаба) в мае 2017 не по нозологического принципу, а по типу молекулярного нарушения (любые опухоли с MSI).
Колоректальный рак
Самым большим исследованием, изучавшем иммунотерапию при MSI метастатическом КРР, явилось исследование CheckMate-142 (табл. 1, рис. 1). Оно состояло из трех параллельных (нерандомизированных) рукавов: ни-волумаб 3 мг/кг каждые 2 недели (до прогрессирования) [40], ниволумаб 3 мг/кг + ипилимумаб 1 мг/кг каждые 3 недели (4 введения, далее монотерапия ниволумаба до прогрессирования) [41], ниволумаб 3 мг/кг каждые 2 недели + ипилимумаб 1 мг/кг каждые 6 недели (до прогрессирования) [42].
В первых двух когортах иммунотерапия применялась у ранее предлеченных пациентов — свыше двух линий химиотерапии уже получили 54% и 40% соответственно. Несмотря на это, объективный ответ в группе ниволумаба удалось достичь у 31 %, в течение 1 года без признаков прогрессирования оставалась половина пациентов. Добавление к ниволумабу ипилимумаба позволило повысить частоту объективного ответа до 55%, а 1-годичную
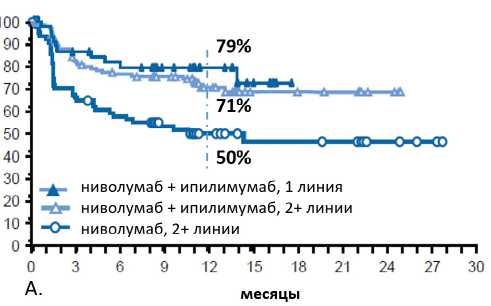
Рисунок 1. Выживаемость без прогрессирования (рис. 1А) и общая выживаемость (рис. 1Б) больных КРР в исследовании CheckMate-142.
МИКРОСАТЕЛЛИТНАЯ НЕСТАБИЛЬНОСТЬ КАК УНИКАЛЬНАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ
И ПРЕДИКТОР ЭФФЕКТИВНОСТИ ИММУНОТЕРАПИИ
ВБП до 71 %. Ценой этому, однако, явилось повышение частоты нежелательных явлений 3–4 степени, связанных с лечением, с 20% (обычной для монотерапии анти-PD антител) до 32%.
В третьей когорте изучалась комбинация ниволумаба с ипилимумабом в первой линии терапии, причем ипили-мумаб применялся каждые 6 недель вместо обычных 3-недельных интервалов (42). Уменьшение дозы ипилимумаба не привело к снижению эффективности по сравнению со стандартными дозами, однако позволило существенно редуцировать частоту нежелательных явлений 3–4 степени, связанных с лечением, до 16% — уровня, сравнимого с монотерапией анти-PD1 антителами.
Высокая эффективность иммунотерапии послужила основой для проведения пилотного исследования, где пациенты с I–III стадиями резектабельного рака ободочной кишки получили 6 недель терапии комбинацией ниволумаб + ипилимумаб, после чего были радикально прооперированы. У 4 из 7 пациентов с MSI был достигнут полный лечебный патоморфоз, у остальных 3 пациентов доля жизнеспособных опухолевых клеток не превышала 2% [45]. В то же время у всех 8 больных с MSS опухолями отсутствовали признаки лечебного патоморфоза.
На сегодняшний день иммунотерапия является опцией выбора у пациентов метастатическим КРР с MSI, начиная со второй линии терапии, а также может применяться у пациентов, не подлежащих химиотерапии и в первой линии [46]. Возможными опциями являются комбинация ниволумаба и ипилимумаба (предпочтительнее), монотерапия ниволумабом или пембролизумабом.
В недалеком будущем, возможно, у больных КРР с MSI иммунотерапия займет и более передовые позиции. Так, в настоящее время ожидаются результаты рандомизированного исследования SWOG 1610, сравнивающего больных с MSI, получавших в качестве первой линии режимы FOLFOX + бевацизумаб, FOLFOX + бевацизу-маб + атезолизумаб и монотерапию атезолизумабом. Продолжаются и два исследования (ATOMIC и POLEM), изучающие роль анти-PD1 антител в качестве адъювантной терапии.
во второй линии терапии он не смог превзойти еженедельный паклитаксел [49]. Оказалось неэффективным и добавление пембролизумаба к химиотерапии в первой линии (KEYNOTE-062, [50]).
РАК ЭНДОМЕТРИЯ
В отличие от колоректального рака, данные об эффективности иммунотерапии при раке эндометрия базируются на небольших исследованиях I–II фазы и описании отдельных клинических случаев. Так, в пилотном исследовании с пембролизумабом принимало участие 15 больных эндометриоидным раком тела матки с MSI, было достигну-то 3 полных и 5 частичных ответов, все были продолжительными [37]. В другом исследовании с авелу-мабом, включившем 33 пациентки, 6-месячный контроль болезни был достигнуту 40% больных с dMMR, тогда как при pMMR эффективность иммунотерапии была невысока (объективный ответ у 1 из 17 пациенток) [53].
Другим особым вариантом рака эндометрия, высокочувствительным к терапии ингибиторами контрольных точек иммунного ответа, являются опухоли с мутацией по-лимеразы-ε (POLE). Выключение данного гена встречается в 10% эндометриоидных опухолей и также сопровождается накоплением большого числа мутаций в опухоли, что, по-видимому, и обусловливает эффективность анти-PD1 антител [54].
При отсутствии нарушений системы MMR и POLE мутации эффективность иммунотерапии ограничена. В исследовании I фазы атезолизумаб получали 15 больных раком эндометрием (одна пациентка с MSI, остальные с MSS или неизвестным фенотипом), объективный ответ был достигнут лишь у двух (13 %) пациенток (включая одну с MSI) [55].
КОМБИНИРОВАННАЯ ТЕРАПИЯ МУЛЬТИКИНАЗНЫМИ ИНГИБИТОРАМИ ТИРОЗИНКИНАЗ И АНТИ-PD1 МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Добавление мультикиназных ингибиторов (прежде всего, с антиангиогенной активностью) к анти-PD1 антителам позволяет модифицировать иммунный ответ, что проявляется синергичным эффектом даже при опухолях с MSS. Так, высокую эффективность показала комбинация ленватиниба с пембролизумабом при раке эндометрия. Среди 94 пациенток без MSI частота объективного ответа составила 38,3%, медиана выживаемости до прогрессирования — 7,4 мес., медиана длительности ответов не была достигнута [56]. На основании этих результатов комбинация ленватиниба и пембролизумаба получила в 2019 году «прорывную» регистрацию FDA.
СВОДНЫЙ АНАЛИЗ ЭФФЕКТИВНОСТИ ПЕМБРОЛИЗУМАБА ПРИ РАЗЛИЧНЫХ ОПУХОЛЯХ С MSI
Рисунок 2. Частота объективного ответа при использовании пембролизумаба у пациентов с MSI в зависимости от типа опухоли
ПРЕДИКТОРЫ ЭФФЕКТИВНОСТИ ИММУНОТЕРАПИИ У ПАЦИЕНТОВ С MSI
Несмотря на высокую эффективность иммунотерапии при опухолях с MSI, около половины больных, не имеют значимой пользы от ее применения, что делает актуальным поиск предиктивных факторов. Поданализ исследования CheckMate 142 не выявил существенных различий в ЧОО между спорадическим нарушением системы MMR (29%) и наследственным (синдром Линча, 33%) [40], тогда как при использовании комбинации ниволумаба и ипилимумаба в первой линии ЧОО оказалась выше у больных синдромом Линча (71%) по сравнению со спорадическими опухолями (48%) [41]. По данным исследования CheckMate 142, не влияли на эффективность иммунотерапии и такие параметры, как мутационный статус BRAF и KRAS, уровень экспрессии PD-L1.
Гетерогенность опухоли и, как следствие, дискордант-ность статуса первичной опухоли и метастазов — хорошо известные события. Например, при КРР с увеличением числа линий химиотерапии дискордантность в статусе RAS, BRAF и PIK3CA может достигать 29,2% [59].
Частота несоответствия в статусе MSI изучена плохо. Внутриопухолевая гетерогенность встречается не чаще 5% [60], тогда как несоответствие статуса между первичной опухолью и метастазами изучено недостаточно. В одной из работ у всех 137 пациентов с КРР статус MSI в первичной опухоли и метастазах совпадал [61], в другом исследовании несоответствие составило 35% [62]. Столь высокая частота несоответствия может быть объяснена методологическими особенностями: гетерогенность оценивалась не между MSI и MSS (как принято в настоящее время), а между MSI-high, MSI-low и MSS. Еще большая частота дискордантности была отмечена в другом исследовании, где применялась ИГХ. Так, из 7 больных КРР с dMMR в первичной опухоли у 4 (57%) в отдаленных метастазах был pMMR фенотип, а из 54 пациентов с pMMR в первичной опухоли у 10 (23%) в метастазах определялся dMMR фенотип [63].
Причиной первичной резистентности может быть и банальная ошибка лабораторной диагностики. Ретроспективный анализ исследования во Франции выявил, что первичная резистентность (прогрессия в течение первых 6–8 недель) к иммунотерапии отмечалась у 5 из 38% па-
МИКРОСАТЕЛЛИТНАЯ НЕСТАБИЛЬНОСТЬ КАК УНИКАЛЬНАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ
И ПРЕДИКТОР ЭФФЕКТИВНОСТИ ИММУНОТЕРАПИИ
Рак желчных
Колоректальный рак
Эндометриоидный рак протоков
Median (95% Cl), mo
24.3 (G.5-NR)
Median (95% Cl), mo
NR (27.2-NR)
Median (95% Cl), mo
NR (26.3-NR)
кишечника
Рак поджелудочной железы
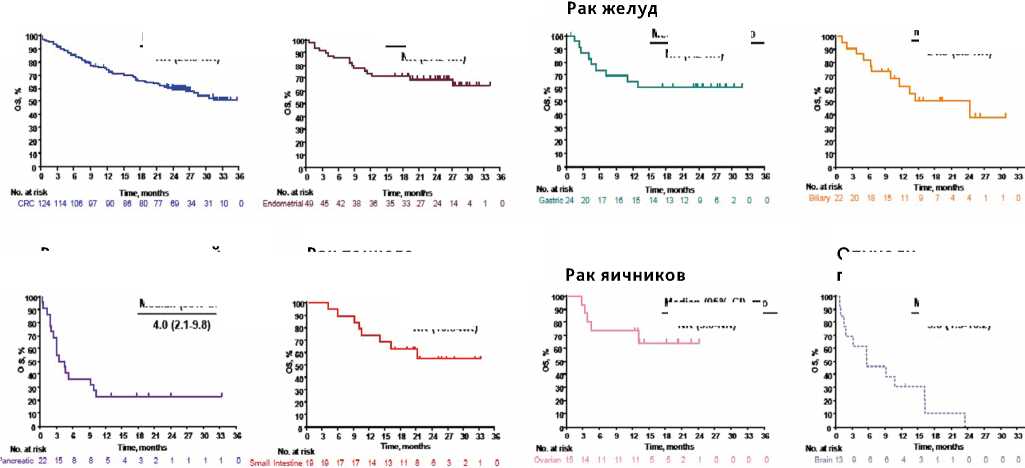
Рисунок 3. Общая выживаемость больных с MSI при использовании пембролизумаба с различными типами опухоли
M edian (95% Cl), mo NR (7.2-NR)
Median (95% Cl), mo
Рак тонкого
Median (95% Cl), mo NR (1O.6-NR)
Median (95% Cl), mo
NR (3.8-NR)
Опухолиголовного мозга
Median (95% Cl), mo
5.6 (1.5-16.2)
циентов с MSI КРР. Повторный анализ в центральной лаборатории выявил отсутствие MSI в 3 из этих 5 случаев [64].
Известным фактором, предсказывающим чувствительность к ингибиторам контрольных точек иммунного ответа, является мутационная нагрузка в опухоли (tumor mutational burden — TMB). Ранний мета-анализ исследований выявил четкую корреляцию между большей TMB и ЧОО при использовании монотерапии анти-PD1 или анти-PD-L1 антителами [65], частично подтверждённый и в более поздней работе: TMB ассоциировалась с лучшей выживаемостью на иммунотерапии при большинстве опухолей, за исключением рака молочной железы, глиом и рака почки [66]. К сожалению, в данных работах не был отдельно проанализирован статус MSI. Таким образом, опухоли с MSI, имея достоверно большую TMB, могли и обусловливать часть большего успеха иммунотерапии в группе TMB-high. Значение TMB у пациентов с MSI было впервые проанализировано в небольшой рестропективной работе, включившей 22 пациентов с MSI КРР, получавших пембролизумаб. За границу был взят уровень TMB 37–41 мутаций на мегабазу, разделивший пациентов в группы с TMB-high (13 больных имели более 41 мутаций) и TMB-low (9 больных в диапазоне от 37 до 41 мутаций на мегабазу). TMB четко предсказывал эффективность иммунотерапии: 12-месячная ВБП составила 90% и 0% соответственно, а медиана ВБП не достигла и 2 месяцев, соответственно [67].
Список литературы Микросателлитная нестабильность как уникальная характеристика опухолей и предиктор эффективности иммунотерапии
- GM., Li. Mechanisms and functions of DNA mismatch repair. Cell Res 2008; 18: 85 - 98.
- Цуканов А. С., Шелыгин Ю. А., Семенов Д. А., с соавт. Синдром Линча. Современное состояние проблемы. Медицинкая генетика, 2017. Т. 16. № 2. С 11 - 18.
- Bonadona V, Bonaïti B, Olschwang S, et al. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. JAMA 2011;30:2304 - 10.
- Alarcon F, Lasset C, Carayol J, et al. Estimating cancer risk in HNPCC by the BRL method. Eur J Hum Genet 2007;15:831 - 6.
- Barrow E, Robinson L, Alduaij W, et al. Cumulative lifetime incidence of extracolonic cancers in Lynch syndrome: a report of 121 families with proven mutations. Clin Genet 2009;75:141 - 9.
- Engel C, Loeffler M, Steinke V, et al. Risks of less common cancers in proven mutation carriers with lynch syndrome. J Clin Oncol 2012;30: 4409 - 15.
- Latham A., Srinivasan P, Kemel Y, et al. Microsatellite Instability Is Associated With the Presence of Lynch Syndrome Pan-Cancer. J Clin Oncol 2019, 37 (4): 286 - 299.
- Boland C. R., Goel A. Microsatellite instability in colorectal cancer. Gastroenterology 2010;138 (6):2073 - 87.
- Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017; 357: 409 - 413.
- Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372: 2509 - 2520.
- Dolcetti R, Viel A, Doglioni C, et al. High prevalence of activated intraepithelial cytotoxic T lymphocytes and increased neoplastic cell apoptosis in colorectal carcinomas with microsatellite instability. Am J Pathol 1999; 154: 1805 - 1813.
- Llosa NJ, Cruise M, Tam A, et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints. Cancer Discov 2015; 5: 43 - 51.
- Lal N, Beggs AD, Willcox BE, et al. An immunogenomic stratification of colorectal cancer: Implications for development of targeted immunotherapy. Oncoimmunology. 2015 Apr 2;4 (3):e976052.
- Llosa N. J., Cruise M., Tam A. et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints. Cancer Discov 2015;5 (1):43 - 51.
- Fusi A., Festino L., Botti G. et al. PD-L1 expression as a potential predictive biomarker. Lancet Oncol 2015;16 (13):1285 - 7.
- Guinney J, Dienstmann R, Wang X, et al. The consensus molecular subtypes of colorectal cancer. Nat Med. 2015 Nov;21 (11):1350 - 6.
- Network., Cancer Genome Atlas Research. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 513, 202 - 209 (2014).
- Kandoth C, Schultz N, Cherniack AD, et al. Integrated genomic characterization of endometrial carcinoma. Nature 497:67 - 73, 2013.
- Umar A, Boland CR, Terdiman JP, et al. Revised bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 2004; 96: 261 - 268.
- C Luchini, F Bibeau, M J L Ligtenberg, et al. ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1 / PD-L1 expression and tumour mutational burden: a systematic review-based approach. Ann Oncol 2019, 30 (8): 1232 - 1243.
- Colle R, Cohen R, Cochereau D, et al. Immunotherapy and patients treated for cancer with microsatellite instability. Bull Cancer 2017; 104: 42 - 51.
- J., Shia. Evolving approach and clinical significance of detecting DNA mismatch repair deficiency in colorectal carcinoma. Semin Diagn Pathol 2015; 32: 352 - 361.
- TA., Mills AM and Longacre. Lynch syndrome screening in the gynecologic tract: current state of the art. Am J Surg Pathol 2016; 40: e35-44.
- Mills AM, Sloan EA, Thomas M, et al. Clinicopathologic comparison of lynch syndrome-associated and "Lynch-like" endometrial carcinomas identified on universal screening using mismatch repair protein immunohistochemistry. Am J Surg Pathol 2016; 40: 155 - 165.
- Gan C, Love C, Beshay V, et al. Applicability of next generation sequencing technology in microsatellite instability testing. Genes 2015; 6: 46 - 59.
- Vanderwalde A, Spetzler D, Xiao N, et al. Microsatellite instability status determined by next-generation sequencing and compared with PD-L1 and tumor mutational burden in 11,348 patients. Cancer Med 2018; 7: 746 - 756.
- Hause RJ, Pritchard CC, Shendure J, Salipante SJ. Classification and characterization of microsatellite instability across 18 cancer types. Nat Med. 2016 Nov;22 (11):1342 - 1350.
- Zaanan A, Shi Q, Taieb J, et al. Role of Deficient DNA Mismatch Repair Status in Patients With Stage III Colon Cancer Treated With FOLFOX Adjuvant Chemotherapy: A Pooled Analysis From 2 Randomized Clinical Trials. JAMA Oncol. 2018 Mar 1;4 (3):379 - 383.
- Sargent DJ, Shi Q, Yothers G., et al. Prognostic impact of deficient mismatch repair (dMMR) in 7,803 stage II / III colon cancer (CC) patients (pts): A pooled individual pt data analysis of 17 adjuvant trials in the ACCENT database. 10.1200 / jco. 2014.32.15_suppl. 3507 Journal of Clinical Oncology 32, no. 15_suppl (May 20 2014) 3507 - 3507.
- DOI: 10.1200/jco.2014.32.15_suppl.3507JournalofClinicalOncology32
- André T, de Gramont A, Vernerey D, et al. Adjuvant Fluorouracil, Leucovorin, and Oxaliplatin in Stage II to III Colon Cancer: Updated 10-Year Survival and Outcomes According to BRAF Mutation and Mismatch Repair Status of the MOSAIC Study. J Clin Oncol. 2015 Dec 10;33 (35):4176 - 87.
- Pietrantonio F, Raimondi A, Choi YY. MSI-GC-01: Individual patient data (IPD) meta-analysis of microsatellite instability (MSI) and gastric cancer (GC) from four randomized clinical trials (RCTs). 10.1200 / JCO. 2019.37.4_suppl. 66 Journal of Clinical Oncology 37, no. 4_suppl (February 1 2019) 66 - 66.
- DOI: 10.1200/JCO.2019.37.4_suppl.66JournalofClinicalOncology37
- Venderbosch S, Nagtegaal ID, Maughan TS et al. Mismatch repair statusand BRAF mutation status in metastatic colorectal cancer patients: apooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies. Clin Cancer Res 2014; 20 (20): 5322 - 5330.
- Taieb J, Shi Q, Pederson L, et al. Prognosis of microsatellite instability and / or mismatch repair deficiency stage III colon cancer patients after disease recurrence following adjuvant treatment: results of an accent pooled analysis of 7 studies. Ann Oncol. 2019 Jul 3. pii: mdz208. 10.1093 / annonc / mdz208. [Epub ahead of print].
- DOI: 10.1093/annonc/mdz208
- Innocenti F, Ou FS, Qu X, et al. Mutational Analysis of Patients With Colorectal Cancer in CALGB / SWOG 80405 Identifies New Roles of Microsatellite Instability and Tumor Mutational Burden for Patient Outcome. J Clin Oncol. 2019 May 10;37 (14):1217 - 1227.
- Diaz-Padilla I, Romero N, Amir E. Mismatch repair status and clinical outcome in endometrial cancer: a systematic review and meta-analysis. Crit Rev Oncol Hematol 2013,88 (1):154 - 167.
- C. L. Creutzberg, A. Leon-Castillo, S. M. de Boer, et al. Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: impact on adjuvant therapy. Annals of Oncology (2019) 30 (suppl_5): v851-v934. 10.1093 / annonc / mdz394.
- DOI: 10.1093/annonc/mdz394
- Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med. 2015;372:2509 - 2520.
- Le DT, Durham JN, Smith KN, et al. Mismatch-repair deficiency predicts response of solid tumors to PD-1 blockade. Science. 2017 Jul 28; 357 (6349): 409 - 413.
- Le D, Kavan P, Kim T, et al. Safety and antitumor activity of pembrolizumab in patients with advanced microsatellite instability - high (MSI-H) colorectal cancer: KEYNOTE-164. Ann Oncol. 2018;29 (suppl 5):abstr 0 - 021.
- Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair deficient / microsatellite instability - high colorectal cancer (CheckMate 142): results of an open-label, multicentre, phase 2 study. Lancet Oncol. 2017 Sep; 18 (9): 1182 - 1191.
- Overman MJ, Lonardi S, KYM W, et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair-deficient / microsatellite instability-high metastatic colorectal cancer. J Clin Oncol. 2018;36 (8):773 - 9.
- H-J J Lenz, E Van Cutsem, M L Limon, et al. Durable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line therapy in microsatellite instability-high / mismatch repair deficient (MSI-H / dMMR) metastatic colorectal cancer (mCRC). Ann Oncol, 2018, 29 (8), mdy424.019, https://doi.org / 10.1093 / annonc / mdy424.019.
- DOI: 10.1093/annonc/mdy424.019
- Hochster HS, Bendell JC, Cleary JM et al. Efficacy and safety of atezolizumab (atezo) and bevacizumab (bev) in a phase Ib study of microsatellite nstability (MSI) - high metastatic colorectal cancer (mCRC). Presented at: AmericanSociety of Clinical Oncology Gastrointestinal Cancers Symposium; January 19 - 21, 2017; San Francisco, CA. 2017; abstract 673.
- Eng C, Kim TW, Bendell J, et al. Atezolizumab with or without cobimetinib versus regorafenib in previously treated metastatic colorectal cancer (IMblaze370): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol. 2019 Jun;20 (6):849 - 861.
- Chalabi M, Fanchi LF, Van den Berg JG, et al. Neoadjuvant ipilimumab plus nivolumab in early stage colon cancer. Ann Oncol. 2018;29 (suppl 8):abstr LBA37.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Colon Cancer. Version 2.2019. https:// www.nccn.org / professionals / physician_gls / pdf / colon. pdf.
- Kang YK, Boku N, Satoh T, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017 Dec 2;390 (10111):2461 - 2471.
- Fuchs CS, Doi T, Jang RW, et al. Safety and Efficacy of Pembrolizumab Monotherapy in Patients With Previously Treated Advanced Gastric and Gastroesophageal Junction Cancer: Phase 2 Clinical KEYNOTE-059 Trial. JAMA Oncol. 2018 May 10;4 (5):e180013.
- Shitara K, Özgüroğlu M, Bang YJ, et al. Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. Lancet. 2018 Jul 14;392 (10142):123 - 133.
- Tabernero J, Van Cutsem E, Bang Y, et al. Pembrolizumab with or without chemotherapy versus chemotherapy for advanced gastric or gastroesophageal junction (G / GEJ) adenocarcinoma: The phase III KEYNOTE-062 study. J Clin Oncol 2019,37, (suppl; abstr LBA4007).
- Janjigian YY, Bendell J, Calvo E, et al. CheckMate-032 Study: Efficacy and Safety of Nivolumab and Nivolumab Plus Ipilimumab in Patients With Metastatic Esophagogastric Cancer. J Clin Oncol 2018;36:2836 - 44.
- Kim ST, Cristescu R, Bass AJ, et al. Comprehensive molecular characterization of clinical responses to PD-1 inhibition in metastatic gastric cancer. Nature Medicine 2018, 24 (9):1449 - 1458.
- Konstantinopoulos PA, Luo W, Liu JF, et al. Phase II Study of Avelumab in Patients With Mismatch Repair Deficient and Mismatch Repair Proficient Recurrent / Persistent Endometrial Cancer. J Clin Oncol. 2019 Oct 20;37 (30):2786 - 2794.
- Santin AD, Bellone S, Buza N, et al. Regression of Chemotherapy-Resistant Polymerase (POLE) Ultra-Mutated and MSH6 Hyper-Mutated Endometrial Tumors with Nivolumab. Clin Cancer Res. 2016 Dec 1;22 (23):5682 - 5687.
- Fleming G, Emens L, Eder J, et al. Clinical activity, safety and biomarker results from a phase Ia study of atezolizumab (atezo) in advanced / recurrent endometrial cancer (rEC). J Clin Oncol 2017, 35 (15): 5585 - 5585.
- Makker V., Taylor M. H., Aghajanian C., et al. Lenvatinib (LEN) and Pembrolizumab (PEMBRO) in Advanced Endometrial Cancer (EC). Annals of Oncology (2019) 30 (suppl_5): v403-v434. 10.1093 / annonc / mdz250.
- DOI: 10.1093/annonc/mdz250
- Fukuoka S, Hara H, Takahashi N, et al. Regorafenib plus nivolumab in patients with advanced gastric (GC) or colorectal cancer (CRC): An open-label, dose-finding, and dose-expansion phase 1b trial (REGONIVO, EPOC1603). J Clin Oncol 2019, 37 (15) _suppl: abstr. 2522, 10.1200 / JCO. 2019.37.15_suppl. 2522.
- DOI: 10.1200/JCO.2019.37.15_suppl.2522
- Diaz L. A., Le D., Maio M., et al. Pembrolizumab in microsatellite instability high cancers: updated analysis of the phase 2 KEYNOTE-164 and KEYNOTE-158 studies. Annals of Oncology (2019) 30 (suppl_5): v475-v532. 10.1093 / annonc / mdz253.
- DOI: 10.1093/annonc/mdz253
- Федянин М. Ю., Строгонова А. М., Сендерович А. И., с соавт. Изучение конкордантности мутационного статуса генов KRAS, NRAS, BRAF, PIK3CA между первичной опухолью и метастазами рака толстой кишки. Злокачественные опухоли. 2017; (2):6 - 13.
- Chapusot C, Martin L, Bouvier AM, et al. Microsatellite instability and intratumoural heterogeneity in 100 right-sided sporadic colon carcinomas. Br J Canc 2002;87:400e4.
- Fujiyoshi K, Yamamoto G, Takahashi A, et al. High concordance rate of KRAS / BRAF mutations and MSI-H between primary colorectal cancer and corresponding metastases. Oncol Rep. 2017 Feb;37 (2):785 - 792.
- Sagaert X, Tejpar S, Desmedt L, et al. Intratumoral heterogeneity in colorectal cancer: Can histology be used as a guidance for molecular testing? Journal of Clinical Oncology 35, no. 4_suppl (February 1 2017) 611 - 611.
- Jung J, Kang 1, Lee YJ, Kim E, et al. Comparison of the Mismatch Repair System between Primary and Metastatic Colorectal Cancers Using Immunohistochemistry. J Pathol Transl Med. 2017 Mar;51 (2):129 - 136.
- Cohen R, Hain E, Buhard O, et al. Association of Primary Resistance to Immune Checkpoint Inhibitors in Metastatic Colorectal Cancer With Misdiagnosis of Microsatellite Instability or Mismatch Repair Deficiency Status. JAMA Oncol. 2019 Apr 1;5 (4):551 - 555.
- Yarchoan M, Hopkins A, Jaffee EM. Tumor Mutational Burden and Response Rate to PD-1 Inhibition. N Engl J Med. 2017 Dec 21;377 (25):2500 - 2501.
- Samstein R, Lee CH, Shoushtari A, et al. Tumor mutational load predicts survival after immunotherapy across multiple cancer types. Nature Genetics, 2019,51:202 - 206.
- Schrock AB, Ouyang C, Sandhu J, et al. Tumor mutational burden is predictive of response to immune checkpoint inhibitors in MSI-high metastatic colorectal cancer. Ann Oncol. 2019 Apr 30. pii: mdz134. 10.1093 / annonc / mdz134.
- DOI: 10.1093/annonc/mdz134


