Микроскопический контроль процесса остеоинтеграции имплантатов
Автор: Тимченко Павел Евгеньевич, Захаров Валерий Павлович, Волова Лариса Теодоровна, Болтовская Виолетта Викторовна, Тимченко Елена Владимировна
Журнал: Компьютерная оптика @computer-optics
Рубрика: Наномасштабные изображения
Статья в выпуске: 2 т.35, 2011 года.
Бесплатный доступ
Экспериментально показано, что метод конфокальной флуоресцентной микроскопии обеспечивает динамический контроль процесса интеграции различных типов клеток в костный имплантат с разрешением не хуже 400 нм. Предложена оптическая методика оценки качества костных имплантатов и технологии их изготовления.
Конфокальная микроскопия, флуоресценция, остеоинтеграция, контраст, разрешение
Короткий адрес: https://sciup.org/14059003
IDR: 14059003
Текст научной статьи Микроскопический контроль процесса остеоинтеграции имплантатов
Заместительное восстановление (регенерация) органо-тканевых участков в поражённой области организма является одной из важных проблем современной медицины [1]. Она затрагивает практически все области костной хирургии: травматологию, челюстно-лицевую хирургию, хирургическую стоматологию, ортопедию, оториноларингологию и нейрохирургию, - где необходимо восстановить утраченную структуру и/или функцию органа методами остеосинтеза или костной пластики [2]. Однако активное практическое применение имплантатов породило новую проблему. Внедрение синтезированных материалов в поражённую область организма приводит к нарушению гомеостаза, последствием которого является плохая интеграция эксплантата и даже его отторжение, неспособность длительного функционирования внедряемой синтетической матрицы. Вероятность развития данных эффектов связана как с методикой остеоинтеграции имплантата, так и корректным определением завершённости данного процесса.
Данные явления сложно прогнозировать на этапе изготовления имплантата, следовательно, для обеспечения качества операции трансплантации необходим динамический контроль процесса остеоинтеграции, который, в свою очередь, должен быть неразрушающим и обеспечивать разрешение на клеточном уровне [3]. Традиционные методы электромиографии и ультрасонографии не обладают требуемым разрешением [4], необходим переход к оптическим методам. Учитывая, что биологическая ткань является сильно рассеивающей средой, методы широкопольной микроскопии оказываются неэффективными [5]. Данную проблему можно преодолеть, переходя к методу конфокальной микроскопии, который обеспечивает увеличение контраста изображения за счёт применения сфокусированного излучения и диафрагмирования рассеянного излучения в плоскости наблюдения. Такое увеличение контрастности приводит к возможности разрешения объектов, имеющих разницу в интенсивности до 200: 1, и их локализации как в плоскости объекта, так и вдоль оптической оси. Дальнейшее увеличение контраста возможно за счёт эффекта флуоресценции, используя либо естественные флуорофоры биологической ткани, либо специ- альные окрашивающие вещества. Следует отметить, что метод флуоресцентной микроскопии обладает более низким разрешением по сравнению с электронной или атомно-силовой микроскопией. Однако в отличие от последних он позволяет наблюдать за внутренней микроструктурой живых клеток и даже небольшими организмами. Благодаря этому флуоресцентная микроскопия оказалась оптимальным методом для изучения механизмов функционирования организмов на клеточном, субклеточном и молекулярном уровнях [6- 8].
Действительно, изменение клеточных характеристик под действием различных факторов как негативного (например, повышение температуры при хирургическом вмешательстве), так и позитивного характера (покрытия имплантатов, стимулирующие остеоинтеграцию, шероховатость) сопровождается изменением оптических характеристик тканей, что позволяет использовать данный факт для контроля динамики их состояния.
Целью работы является диагностика костных имплантатов и контроль процесса их остеоинтеграции с помощью метода конфокальной флуоресцентной микроскопии.
Материалы и методы исследования
В качестве объектов исследования были выбраны лиофилизированные биоимплантаты, изготовленные на сублимационной установке ALPHA2-4LSC из соединительных тканей человека по технологии «Лио-пласт»®, согласно ТУ-9398-001-01963143-2004. Данные имплантаты сохраняют свои первоначальные качества от 3 до 5 лет и удобны для транспортировки и хранения.
Экспериментальный стенд [9] был реализован на базе конфокального оптического микроскопа и лазерного комбайна фирмы ANDOR (скорость сканирования до 25 слоёв в секунду). На рис. 1 приведена блок-схема установки. Стенд обеспечивал два режима микросъёмки: режим конфокальной микроскопии в видимом свете и режим лазерной флуоресценции. В первом случае в качестве источника излучения использовался широкополосный источник (галогеновая лампа), а во втором – лазерные излучатели мощностью 100 мВт на длинах волн 488 нм и 561 нм.
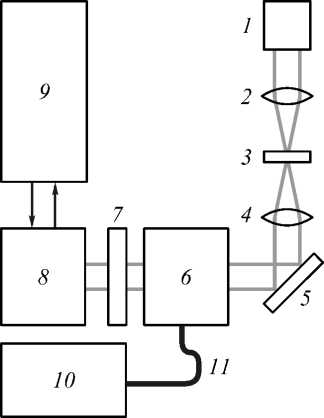
Рис. 1. Установка флуоресцентной конфокальной микроскопии: 1 – источник видимого света (галогеновая лампа), 2 – коллиматор, 3 – объект, 4 – объектив, 5 – поворотное зеркало, 6 – конфокальный сканирующий блок, 7 – блок фильтров, 8 – камера, 9 – компьютер, 10 – лазерный блок, 11 – волоконный ввод
В режиме конфокальной микроскопии свет от галогеновой лампы 1 (видимый диапазон) через блок фильтров поступает на систему фокусировки 2, которая фокусирует излучение на объекте 3. Прошедшее через объект (рассеянное вперед) излучение собирается объективом (20× или 40×) 4 и через систему зеркал и призм 5 вводится в сканирующий конфокальный блок 6. Сканирующий конфокальный блок построен по принципу Нипкова [10]: вращающиеся диски с микродиафрагмами, реализующими конфокальный метод. Перемещение фокальной плоскости (выделение анализируемого слоя ткани) осуществляется за счёт управляемого с компьютера пьезоэлектрического z-микросканера с установленным на нём объектом исследования. Спектральная фильтрация излучения осуществляется в блоке 7, реализованном в виде системы сменных фильтров, установленных на вращающейся турели. Спектральная фильтрация позволяет повысить контрастность регистрируемого изображения. После блока 7 излучение вводится в камеру 8 (1024×1024, время экспозиции 40 мс - 10 мин.). Для снижения темновых токов (в среднем на 3 порядка) матрица камеры охлаждается до температуры –75oC.
В режиме флуоресценции галогеновая лампа выключена. Вместо неё используется либо 4-модульный блок лазеров 10 (в настоящей работе использовались каналы излучения с длинами волн 488 нм и 561 нм), либо ртутная лампа. В обоих случаях используется волоконный ввод 11, а мощность каждого источника независимо управляется с компьютера (с шагом 0,1%). Фокусировка и согласование падающего излучения осуществляется в блоке 6 при помощи вращающегося диска с микролинзами, синхронизованного с диском Нипкова.
Результаты исследований
Динамика развития остеобластов была исследована в модельной среде (в чашке Петри). Наблюдения проводились в течение нескольких суток с регистрацией изображений (в том числе серийных) в режиме конфокальной микроскопии. Характерный микроснимок остеобластов в модельной среде представлен на рис. 2. Размер микроснимка 370×370 мкм, достигнутое разрешение составляет 400 нм на пиксель.
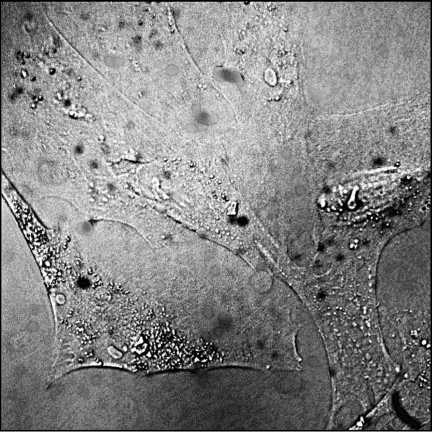
Рис. 2. Остеобласты в модельной среде в чашки Петри (размер снимка 370×370мкм)
Полученные результаты позволили детально описать динамику развития остеобластов в модельной среде: через 2 часа после пересева большая часть их пристаёт ко дну чашки Петри и распластывается по нему; через сутки формируется неполный равномерный монослой, в котором клетки соединены своими отростками; на вторые сутки количество клеток увеличивается, отростками клетки соединяются друг с другом (рис. 2); дальнейший рост количества клеток приводит к формированию равномерного монослоя; на 6 сутки образуется полный монослой, а на 7 сутки происходит насыщение и процесс переходит в стационарную фазу. Развитие остеобластов в модельной среде характеризуется своими особенностями: клетки имеют значительно большую длину (50– 100 мкм) и площадь сечения, чем в естественной среде, и образуют монослой. Вследствие этого изображение имеет низкую величину контраста – не более 0,2-0,3. Основное рассеяние даёт мембрана клетки и её ворсинки, что не позволяет должным образом визуализировать внутреннюю структуру клетки.
Переход в режим флуоресценции позволяет выделять не только клетки, но обеспечить и визуализацию ядра и органелл клетки. Для реализации режима флуоресценции нами был использован флуорофор, который при введении в среду концентрировался в цитоплазме клеток и возбуждался на длине волны 561 нм (рис. 3). В силу того, что флуорофор концен- трируется преимущественно в клетках, интенсивность фонового излучения на длине волны флуоресценции минимальна и контрастность изображения превышает 0,9. Хорошо видны отростки клеток, ядра, а также деление клеток (показано стрелкой). В отличие от красителей, традиционно используемых в гистологии, данный флуорофор не токсичен и позволяет детально исследовать динамику процессов. Так, для случая развития остеобластов в модельной среде измеренная скорость движения остеобластов составила 7- 8 мкм/час .
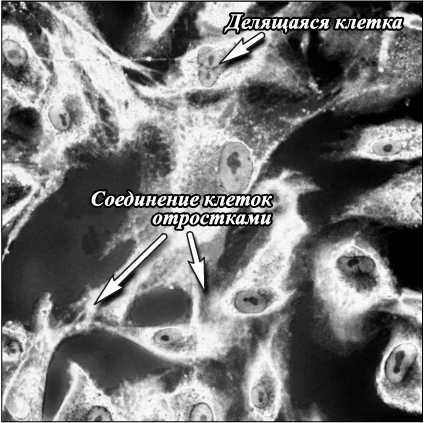
Рис. 3. Остеобласты в модельной среде в чашки Петри, 4 день (флюоресценция, размер снимка 370×370 мкм)
Отработанные на модельных средах режимы позволили перейти к исследованию интеграции остеобластов в костном имплантате. На рис. 4 представлен характерный микроснимок имплантата с остеобластами, полученный в режиме флуоресценции. Имплантат благодаря своей пористости тоже впитывает флуорофор, однако, несмотря на это, контраст изображения остаётся достаточно высоким (порядка 0,5 - 0,6) для уверенной визуализации остеобластов.
Анализ полученных микроснимков позволяет сделать вывод, что остеобласты активно интегрируют в костный имплантат (рис . 4), расселяясь преимущественно по его поверхности и формируя «колонии» вблизи выхода пор имплантата на его поверхность. Уже на восьмой день плотность активных остеобластов составляет 500-700 клеток/мм2.
Несомненным достоинством данного метода является возможность выявления именно активных остеобластов и возможность оценки скорости заселения остеобластами различных имплантатов в реальном масштабе времени. Это позволяет использовать данный метод для контроля и оптимизации условий изготовления и применения имплантатов.
Заключение
Показано, что метод конфокальной микроскопии позволяет осуществлять динамический контроль процесса интеграции различных типов клеток в костный имплантат с разрешением не хуже 400 нм. Данный метод позволит проводить дооперационное тестирование и контроль различных имплантатов с прогнозирования его качества.
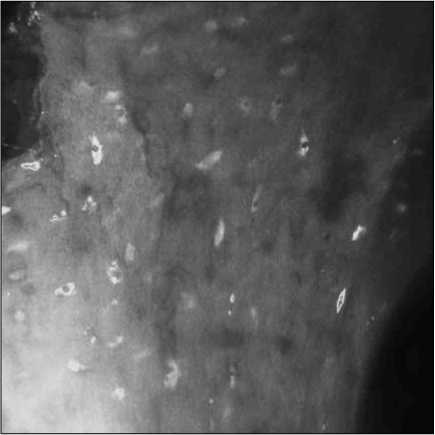
Рис. 4. Микроснимки интеграции остеобластов в костный имплантат спустя 8 дней (флуоресценция, размер снимка 370×370 мкм)
Работа выполнена при поддержке федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009 - 2013 годы .


