Микроскопический полиангиит как междисциплинарная проблема (обзор литературы и описание клинического случая)
Автор: Муркамилов И.Т., Айтбаев К.А., Юсупов Ф.А., Райимжанов З.Р., Юсупова З.Ф., Юсупова Т.Ф., Хакимов Ш.Ш., Нурматов Т.А., Солижонов Ж.И., Ыманкулов Д.С.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 8 т.10, 2024 года.
Бесплатный доступ
Микроскопический полиангиит представляет собой некротизирующий васкулит, при котором отмечается системное поражение капилляров, венул и артериол. Средний возраст пациентов на момент верификации составляет 42 (51-65) лет. У пациентов с микроскопическим полиангиитом почти всегда выявляются антитела к цитоплазме нейтрофилов. Антитела к миелопероксидазе встречаются чаще, чем антитела к протеиназе-3. Болезнь наиболее часто характеризуется такими признаками как поражение мелких сосудов почек, легких, а также высокой частотой развития терминальной стадии хронической болезни почек и смертностью. У пациентов отмечается низкий риск обострения и невысокая частота артериальной гипертензии, несмотря на почечное поражение. В статье рассматривается клинический спектр поражения органов при микроскопическом полиангиите и приводится описание клинического случая у 39-летней женщины с явлениями поражения почек, легких и сердца на фоне сопутствующей бронхоэктатической болезни. При иммуноферментном исследовании обнаружены высокие титры антител к миелопероксидазе. У пациентки Р., 39 лет, диагноз микроскопический полиангиит установлен 31.08.2021 г., смерть наступила 28.06.2024 г., продолжительность заболевания составила 35 месяцев (147 недель, 3 года).
Микроскопический полиангиит, бронхоэктатическая болезнь, почечная недостаточность, гемодиализ, сердечная недостаточность, фракция выброса левого желудочка
Короткий адрес: https://sciup.org/14131030
IDR: 14131030 | УДК: 616.616-002:616.06:616.12 | DOI: 10.33619/2414-2948/105/26
Текст обзорной статьи Микроскопический полиангиит как междисциплинарная проблема (обзор литературы и описание клинического случая)
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.616-002:616.06:616.12
В структуре системных васкулитов (СВ) особое место занимает микроскопический полиангиит (МПА), распространенность которого в общей популяции ежегодно растет. Еще в 1926 г. известный клиницист-нефролог Е. М. Тареев в своих трудах детально изложил патогенетический и клинический полиморфизм СВ [1].
В настоящее время всестороннее изучение природы СВ, включая МПА, осуществляется в клинике ревматологии, нефрологии и профпатологии им. Е. М. Тареева (директор — член-корреспондент РАН, д-р мед. наук, профессор С. В. Моисеев), научно-исследовательском институте ревматологии имени В.А. Насоновой (директор – член-корреспондент РАН, д-р мед. наук, профессор А. М. Лила), а также научно-исследовательском институте ревматологии СЗГМУ имени И. И. Мечникова (директор – академик РАН, д-р мед. наук, профессор В. И. Мазуров).
Материалы и методы
Проведен литературный поиск в базах данных РИНЦ, MEDLINE/PubMed и Scopus по ключевым словам: «АНЦА», «Системные васкулиты» и «Микроскопический полиангиит» для идентификации оригинальных и обзорных статей, в которых обсуждаются клиникопатогенетические, диагностические и прогностические аспекты микроскопического полиангиита (МПА). Во второй части литературного обзора представлено описание клинического случая пациента с МПА. По накопленным данным, при МПА часто встречается легочный капиллярит и некротический гломерулонефрит [2, 3-7].
В настоящее время МПА диагностируется в несколько раз чаще, чем узелковый полиартериит и гранулематоз Вегенера. МПА в большинстве случаев начинается остро и протекает тяжелее, чем другие системные васкулиты [1]. Как показывают накопленные данные, у мужчин и женщин МПА возникает с одинаковой частотой и дебютирует, как правило, в среднем и пожилом возрасте [2, 3]. Ранее считалось, что МПА чаще диагностируется среди лиц мужского пола. Причина развития МПА все еще не установлена, и ученые склоняются к мультифакторной природе возникновения заболевания.
Кроме того, обсуждается роль генетических факторов и их комбинации с факторами окружающей среды в развитии васкулитов, а также инфекции с участием золотистого стафилококка или вируса гепатита [8]. Определенный вклад в развитие МПА вносят также гиперчувствительность к различным антигенам: яды, химикаты, лекарственные препараты, микроорганизмы и эндогенные антигены. Имеется свидетельство развития МПА у 17летнего подростка после перенесенной коронавирусной инфекции [9].
Сведений о распространенности МПА в Кыргызской Республике нет, хотя страна является одним из экологически опасных регионов планеты по радиоактивному фону. На сравнительно небольшой территории (199,9 тыс. км²) находится 49 урановых хвостохранилищ и 80 отвалов горных пород, в которых захоронено около 70 млн м³ высокотоксичных радиоактивных отходов, что составляет примерно 14 м³ на каждого жителя республики. В зонах геохимических провинций Кыргызской Республики проживает около 100 тыс. человек, и у этой категории населения регистрируются выраженные нарушения в системе клеточного и гуморального иммунитета.
Согласно проведенным исследованиям, МПА представляет собой некротизирующий васкулит либо с отсутствием, либо с незначительным количеством иммунных депозитов с преимущественным поражением капилляров, венул, артериол, т.е. мелких сосудов [1,2-7]. В ряде случаев в патологический процесс могут вовлекаться артерии мелкого и среднего калибра. Хотя сообщение о МПА в зарубежной литературе впервые встречается в трудах J. Davson, J. Ball и R. Platt в 1948 г. [11, 12], тем не менее, данное заболевание, как особая патоморфологическая форма узелкового полиартериита, упоминается в работе F. Wohlwill в 1923 г. [13].
В 1985 г., после детального изучения более 100 клинических случаев, МПА получил нозологическую самостоятельность в структуре СВ, а в конце 1980-х годов была установлена его связь с антинейтрофильными цитоплазматическими антителами (АНЦА).
Антинейтрофильные цитоплазматические антитела (АНЦА) были открыты в 1982 году и представляют собой аутоантитела против внутриклеточных антигенов нейтрофилов. АНЦА напрямую связаны с васкулитами мелких сосудов и обнаруживаются у пациентов с малоиммунными васкулитами мелких сосудов, хотя в 10-20% случаев малоиммунных гломерулонефритов их обнаружить не удается. С 1996 года в клинических лабораториях внедрены стандарты лабораторного тестирования, которые позволяют выявлять два типа свечения при инкубации сыворотки с фиксированными в этаноле нейтрофилами, характерные для определенных АНЦА. В результате были идентифицированы два типа антинейтрофильных цитоплазматических антител: цитоплазматическая АНЦА (ц-АНЦА), направленная против протеиназы-3 нейтрофилов и моноцитов, и перинуклеарная АНЦА (п-АНЦА), направленная против миелопероксидазы.
В клинике иммунологии необходимо исследовать антитела к протеиназе-3 (ц-АНЦА) и миелопероксидазе (п-АНЦА) методом иммуноферментного анализа. Следует отметить, что выявление АНЦА в сыворотке почти всегда свидетельствует о наличии васкулита мелких сосудов. В случае микроскопического полиангиита (МПА) п-АНЦА обнаруживается в 4080% случаев. Исследователи отмечают, что протеиназа-3 содержится в гранулах нейтрофилов и в качестве фермента усиливает противомикробное действие нейтрофилов, а также индуцирует апоптоз эндотелиальных клеток. Миелопероксидаза, являясь лизосомальным ферментом нейтрофилов, обладает бактерицидным действием и стимулирует продукцию внутриклеточных оксидантов [14].
С патогенетической точки зрения следует отметить, что при МПА активация системы комплемента, вызванная ц-АНЦА и п-АНЦА, может различаться, что приводит к их разной патогенности. Для МПА характерны некротизирующий гломерулонефрит, геморрагический альвеолит и отсутствие гранулематозного воспаления. Как отмечается, МПА обычно начинается остро и протекает злокачественно [2].
В клинической картине доминируют поражения почек и легких. С патогенетической точки зрения наблюдается неконтролируемая дегрануляция нейтрофилов и их окислительный взрыв. Важную роль в развитии воспаления сосудов играет стимуляция адгезии нейтрофилов к эндотелию, его повреждение, развитие микротромбозов и гиперкоагуляции [15].
При этом апоптоз эндотелиальных клеток при МПА происходит локально и преимущественно в мелких сосудах, тогда как оксиданты, высвобождаясь в кровоток, действуют системно [16].
Одновременно с этим накапливаются активные формы кислорода в просвете сосудов, что усиливает протромботические эффекты, такие как активация системы свертывания крови, агрегация тромбоцитов, дегрануляция тучных клеток и продукция тканевого фактора в стенке сосуда [17].
Исследования показывают, что С3-комплемент активно взаимодействует с системой свертывания крови [18, 19], что значительно повышает протромботический фон. Таким образом, высокий уровень C3-компонента комплемента можно рассматривать как независимый фактор риска тромбоза у пациентов с системными васкулитами, включая МПА [20].
Кроме того, в литературе указано, что при МПА активированные антителами к цитоплазматическим антигенам нейтрофилы после праймирования воспалительными цитокинами экспрессируют тканевой фактор микрочастицами нейтрофилов и внеклеточными нейтрофильными ловушками, что увеличивает продукцию тромбина и способствует тромбозу [21].
Клиническая картина МПА зависит от активности патологического процесса, вовлеченности в неё почек и легких, локализации сосудов, а также сопутствующих заболеваний. Общими (неспецифическими) симптомами МПА являются: лихорадка, снижение массы тела, общая мышечная слабость, миалгии, изолированные артралгии, артрит и т.д.
Почки при МПА. Поражение почек наблюдается у большинства пациентов с МПА, причем у каждого второго выявляются высокие титры антител к протеиназе-3. Спектр поражения почек варьируется от микроскопической гематурии до нефротической протеинурии [22].
Следует отметить, что наличие антител к протеиназе-3 зачастую связано с более тяжелым течением заболевания, быстрым снижением фильтрационной функции почек и развитием диализ-зависимого острого повреждения почек (ОПП). Хроническая болезнь почек при МПА встречается у 61% пациентов [23].
По данным исследования [15], при МПА на аутопсии выявляются гистологические признаки экстракапиллярного продуктивного гломерулонефрита, вакуольной дистрофии и некроза эпителия канальцев. Согласно зарубежным исследованиям, иммунофлюоресценция ткани почек при МПА не обнаруживает иммунных депозитов, что характерно для малоиммунного гломерулонефрита [24].
Гистопатологические изменения в почках включают фибриноидный некроз капилляров клубочков и артериол, а также формирование экстракапиллярных эпителиальных, фибринозно-эпителиальных и фиброзных полулуний [15].
Легкие при МПА. Поражение легких при микроскопическом полиангиите (МПА) отмечается в 23% случаев (с диапазоном от 35% до 73%) и в основном сопровождается развитием некротизирующего альвеолита, реже — ограниченного легочного фиброза [25].
Начало заболевания часто сопровождается респираторными симптомами [26], особенно в период бактериально-вирусной инфекции. Клинические проявления включают боли в грудной клетке, одышку, кашель и кровохарканье. Рентгенологическое обследование выявляет инфильтраты без распада, часто сопровождающиеся плевральной реакцией. Описан случай субплеврального кровоизлияния с ателектазом легких [15].
При МПА возможно появление булл в легких и развитие двустороннего диффузного эндобронхита [25].
В случаях вялотекущей формы МПА наблюдается картина пневмофиброза и хронической дыхательной недостаточности. Ранее сообщалось, что при идиопатическом легочном фиброзе у 1,7–25,7% пациентов впоследствии диагностировался МПА [27, 28].
Некоторые работы отмечают, что клинические варианты поражения легких при МПА могут включать аллергическую бронхиальную астму, эозинофильную пневмонию и гиперэозинофильный синдром [15].
Поражение легких при МПА протекает тяжело, особенно при наличии антител к протеиназе-3. У половины пациентов болезнь осложняется легочным кровотечением, и каждый второй случай становится фатальным. При аутопсии таких пациентов часто обнаруживается септальный капиллярит в сочетании с нейтрофильными инфильтрациями [29]. В случаях гиперпродукции антител к миелопероксидазе описаны случаи фиброзирующего альвеолита. Например, недавно описан случай 79-летней пациентки с интерстициальным фиброзом легких, который стал основным проявлением МПА и ассоциировался с гиперпродукцией антител к миелопероксидазе и ревматоидному фактору [30].
Следует отметить, что при МПА с преимущественным поражением легких и гиперпродукцией антител к миелопероксидазе и ревматоидному фактору прогноз неблагоприятен. В недавней публикации указывается, что легочный капиллярит регистрируется в 50% случаев МПА. Важно также помнить, что поражение респираторного тракта при МПА может протекать бессимптомно [5].
Сердце при МПА. В недавно опубликованной работе описан случай МПА, протекающего с ранним поражением лёгких (интерстициальный тип поражения, кровохарканье) и почек (прогрессирующее течение гломерулонефрита). Клиническая картина дополнялась проявлениями антифосфолипидного синдрома и редким осложнением в виде неинфекционного тромботического эндокардита аортального клапана, что привело к формированию сочетанного клапанного порока [31]. Предыдущие исследования показывают, что при МПА поражение эндокарда и клапанов наблюдается в 64% случаев [32]. В одном из опубликованных исследований отмечается, что поражение сердечно-сосудистой системы при МПА составляет 35% и проявляется в виде коронариита и перикардита [23].
Риск тромбоэмболических осложнений при МПА возрастает при наличии у пациента антител к миелопероксидазе [33].
Кожные проявления МПА характеризуются геморрагическими и/или язвенногеморрагическими высыпаниями, преимущественно на коже конечностей. Реже встречаются livedo reticularis, некрозы кожи и подлежащих мягких тканей. Отдельные исследователи сообщают о кожных петехиальных высыпаниях на конечностях [25].
В одном наблюдении у пожилой пациентки с МПА была зафиксирована гангрена пальцев левой стопы и правой кисти [15]. В ранее проведенном нами исследовании описаны изменения цвета кожи, вазоспазм и паралич сосудов по типу Рейно у пациентки с МПА [34].
В трудах В. А. Насоновой упоминается, что при МПА могут наблюдаться изменения верхних дыхательных путей в виде атрофии слизистой оболочки носа и некротического ринита (без деструкции и с обратимым характером развития) [2].
Мышцы при МПА. Практически во всех клинических наблюдениях отмечается, потеря массы тела у пациентов с МПА. Поражение мышц при МПА всегда сочетается с вовлечением в патологический процесс суставов, частота которого составляет 38-65% [35].
Органы зрения при МПА. При МПА у каждого третьего пациента развиваются поражения глаз в виде эписклерита и кератоконъюнктивита, которые чаще регистрируются при наличии антител к протеиназе-3. Как показано в исследовании, поражение глаз регистрируется у 25% пациентов с МПА и практически носят обратимый характер [31].
Нервная система при МПА. Поражение периферической нервной системы наблюдается у 30-35% пациентов с МПА. Нередко это поражение выходит на передний план, проявляясь асимметричным сенсорно-моторным множественным мононевритом [36,37]. В другом исследовании отмечено, что поражение центральной нервной системы в виде церебрального васкулита встречается у 22% пациентов с МПА [23].
Наиболее распространенным вариантом поражения нервной системы при МПА является ишемическая полинейропатия, регистрируемая в 65% случаев [23].
В одном из исследований [15] описан случай тяжелого течения МПА у пожилой пациентки с ожирением III степени и периферической сенсомоторной нейропатией. В другом случае была зафиксирована транзиторная ишемическая атака в системе левой среднемозговой артерии у 38-летнего пациента с МПА [31].
Желудочно-кишечный тракт при МПА. Желудочно-кишечный тракт при МПА часто страдает вследствие некротического васкулита мелких сосудов кишечника, что приводит к
Бюллетень науки и практики / Bulletin of Science and Practice Т. 10. №8 2024 болям и диарее, а в некоторых случаях к язвенно-некротическим изменениям слизистой кишечника. У пациентов с МПА также нередко обнаруживается гепатомегалия и повышенная активность печеночных трансаминаз. Хотя поражения слизистой желудка и кишечника при МПА встречаются относительно редко, следует отметить, что применение глюкокортикоидов, цитостатиков и нестероидных противовоспалительных препаратов при МПА создает предпосылки для развития язвенно-некротических изменений слизистой оболочки желудка и кишечника [31].
У лиц старших возрастных групп МПА часто сопровождается гипертонической болезнью, сахарным диабетом 2 типа, хронической сердечной недостаточностью, остеоартритом и мочекаменной болезнью. В редких случаях (до начала МПА у пациента) отмечается бронхоэктаз. В работе Н. Ф. Фроловой с соавторами описан случай МПА, первым клиническим проявлением которого стало поражение суставов, характеризовавшееся преимущественно артралгиями. Как отмечают исследователи, гиперпродукция ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду (АЦЦП) дала основание предполагать ревматоидный артрит (РА). Через два года от начала заболевания у пациентки развилась тяжелая почечная недостаточность. Примечательно, что диагноз МПА был подтвержден с помощью нефробиопсии, выявившей иммунонегативный гломерулонефрит с полулуниями. Также в биохимическом анализе крови у пациентки были обнаружены АНЦА. При десятилетнем наблюдении отсутствовали рентгенологические изменения костей, типичные для РА [39].
Этот случай вновь подтверждает, что полиморфизм и развитие МПА в пожилом возрасте требуют тщательного дифференциально-диагностического поиска.
Клинико-патогенетическое изучение особенностей проявлений, течения, а также исходов МПА имеет важное значение для совершенствования диагностики заболевания в условиях терапевтического стационара и разработки рациональной тактики ведения пациентов. Как показано в таблице, диагностика МПА в клинической практике основывается на положениях ACR (American College of Rheumatology) и EULAR (European League Against Rheumatism), дополненное в 2022 г.
КЛАССИФИКАЦИОННЫЕ КРИТЕРИИ МИКРОСКОПИЧЕСКОГО ПОЛИАНГИИТА (ACR/EULAR, 2022) [40]
|
Клинические критерии |
Балл |
|
Поражение носа: кровянистое отделяемое, язвы, корочки, заложенность, нарушение носового дыхания, дефект или перфорация носовой перегородки |
- 3 |
|
Лабораторные, инструментальные и морфологические критерии |
|
|
Положительный результат анализа на п-АНЦА или МПО-АНЦА |
+6 |
|
Легочный фиброз или интерстициальное заболевание легких по данным визуализации органов грудной клетки |
+3 |
|
Малоиммунный гломерулонефрит по данным биопсии почки |
+3 |
|
Положительный результат анализа на ц-АНЦА или протеиназа-3 - АНЦА |
-1 |
|
Число эозинофилов в периферической крови ≥1×109/л |
-4 |
Примечание. Следует сложить баллы по всем критериям, которые есть у пациента. Суммарный балл ≥5 позволяет классифицировать заболевание как микроскопический полиангиит [40]
Как утверждают эксперты в области изучения СВ, при использовании указанных критериев (табл.) необходимо учесть, что классификационные критерии можно применять для классификации заболевания как микроскопического полиангиита, если: у пациента диагностирован васкулит мелких и средних сосудов; у пациента исключены альтернативные диагнозы заболеваний, которые могут имитировать васкулит.
Многообразие вариантов клинического течения МПА ставит перед врачами непростую задачу ранней диагностики и применения иммуносупрессивной терапии. При планировании лечения пациентов с МПА врач должен учитывать как сопутствующие заболевания, так и вариант дебюта МПА, оценивая степень поражения различных органов [23]. Важно отметить, что по сравнению с хорошо изученными почечными проявлениями МПА, особенности поражения легких и сердца остаются недостаточно охарактеризованными. В качестве примера поражения почек, легких и сердца при АНЦА-ассоциированном васкулите приводим клинический случай нашей пациентки Р., 39 лет.
Клиническое наблюдение
Пациентка поступила в отделение пульмонологии с жалобами на: кашель и кровохарканье; одышку, усиливающиеся при минимальной физической нагрузке; симметричные отёки голеней и стоп; нестабильность артериального давления (АД); сердцебиение; выраженную мышечную слабость; отёк лица; боли в суставах.
История настоящего заболевания: со слов пациентки кашлевой синдром отмечает с детства, кашель с выделением слизисто-гнойной мокроты, неоднократно получала стационарное лечение по месту жительства с клиническим диагнозом хронический бронхит. С января 2021 г отмечает снижение аппетита, общую мышечную слабость. В апреле того же года обнаружила мочу красного цвета, в связи с чем обратилась к терапевту и урологу по месту жительства. Рекомендованное лечение не привело к значительному клиническому эффекту. В связи с сохранением кашля (малопродуктивный) и одышки осмотрена пульмонологом. При проведении бронхоскопии были верифицированы эндоскопические признаки бронхоэктатической болезни.
В результате обследования выявлены признаки анемии (гемоглобин (Hb) 99 г/л) и протеинурии (суточная экскреция белка с мочой, 3400 мг). Биохимический анализ крови: креатинин 104 мкмоль/л, кальций 2,16 ммоль/л, фосфор 1,24 ммоль/л. Скорость клубочковой фильтрации (СКФ), рассчитанная по методикам CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) и MDRD (Modification of Diet in Renal Disease) составила 56 мл/мин и 53 мл/мин, соответственно. Клиренс креатинина по способу Cockroft-Gault 61 мл/мин. Гастроскопия: картина хронического неатрофического гастрита и дуоденогастрального рефлюкса.
Несмотря на проводимую терапию состояние пациентки прогрессивно ухудшалось. При очередном обследовании (май 2021 г.) выявлено снижение фильтрационной функции почек: сывороточный креатинин 237 мкмоль/л, СКФ по методике CKD-EPI и MDRD составила 22 мл/мин и 21 мл/мин, соответственно. Клиренс креатинина по способу Cockroft-Gault 28 мл/мин. Спустя один месяц явления почечной недостаточности стали нарастать: концентрация Hb 85 г/л, сывороточный креатинин 344 мкмоль/л, СКФ по методике CKD-EPI и MDRD составила 14 мл/мин и 14 мл/мин, соответственно. Клиренс креатинина по способу Cockroft-Gault 19 мл/мин. В связи с развитием диализ-зависимой стадии почечной недостаточности пациентка вновь осмотрена нефрологами. При обследовании (31.08.2021 г): в клиническом анализе мочи — макроскопическая гематурия, суточная экскреция белка с мочой 3470 мг. Биохимический анализ крови: общий белок 57,32 г/л, общий холестерин 3,32 ммоль/л, обнаружены лабораторные признаки гипокальциемии, гиперфосфатемии, вторичного гиперпаратиреоза. Иммуноферментное исследование: высокие титры антител к миелопероксидазе. Нефробиопсия не проведена. Решено подготовить пациентку к заместительной почечной терапии (формирование артериовенозного соустья на малоработающем предплечье). Динамика наблюдения в проводимой терапии: концентрация Hb 80 г/л, сывороточный креатинин 669 мкмоль/л, СКФ по методике CKD-EPI и MDRD 6 мл/мин и 6 мл/мин, соответственно. Клиренс креатинина по способу Cockroft-Gault 10 мл/мин. В этой связи пациентке начата процедура программного гемодиализа.
Необходимо отметить, что с самого начала заболевания у пациентки АД не было повышенным. Несмотря на проводимую терапию с учетом гемодиализа заметного улучшения в клиническом статусе пациентки не наблюдалось. В этой связи пациентка вновь обратилась к нефрологу в октябре 2022 г. При обследовании выявлено снижение глобальной функции левого желудочка (ЛЖ), симптомы легочной гипертензии. Начата терапия (эритропоэтин, бета-блокаторы, препараты железа, корректоры метаболизма) от сердечной недостаточности на фоне программного гемодиализа. В декабре 2023 г. пациентка прошла обследование на предмет выявления активности МПА.
Данные объективного осмотра: общее состояние тяжелое. Пониженного питания, рост 165 см, вес 44 кг, индекс массы тела 16,1 кг/м2. Сатурация кислорода на атмосферном воздухе 91% в покое. Кожа и видимые слизистые бледной окраски, выраженный акроцианоз на фоне диффузного цианоза. Отёк голеней и стоп, над лёгкими перкуторно легочной звук, дыхание жесткое, влажные хрипы в нижних отделах. ЧДД 26 в 1 минуту. Границы относительной сердечной тупости расширены влево на 2 см, вправо на 1,5 см. Тоны сердца ослаблены, ритмичные, выслушивается систолический шум на верхушке и в проекции клапанов аорты. Частота сердечных сокращений 110 в 1 минуту, АД 100/80 мм рт. ст. Живот безболезненный, нижний край печени у рёберной дуги, селезёнка не пальпируется. Периферические лимфатические узлы не увеличены. Суставы без экссудативновоспалительных изменений, движения во всех суставах в полном объёме.
ЭхоКГ от 11.12.2023 г. Стенки аорты уплотнены, контуры ровные, отмечается очаговое уплотнение створок аортального клапана. Раскрытие аортального клапана полное, систолический градиент давления 5,1 мм рт. ст., регургитация не выявлена. Митральный клапан – створки в противофазе, отмечается очаговое уплотнение створок. Диастолический градиент давления 2,6 мм рт. ст., объем митральной регургитации соответствовал I степени. Систолический градиент давления в легочной артерии 4,2 мм рт. ст., регургитация минимальная. Уровень систолического легочного АД 45 мм рт. ст., наблюдается расширение правого предсердия. Толщина межжелудочковой перегородки 0,9 см, толщина задней стенки ЛЖ 0,9 см, фракция выброса ЛЖ 24% (Simpson / метод дисков), размер левого предсердия 5,1 см, конечный систолический размер ЛЖ 5,8 см, конечный диастолический размер ЛЖ 7,0 см, конечный систолический объем ЛЖ 165 мл (18-68), конечный диастолический объем ЛЖ 256 мл (59-157), правый желудочек 2,2 см, толщина передней стенки правого желудочка 0,4 см, систолическое легочное давление 44 мм рт. ст. Регистрируется гипокинез стенок ЛЖ. Частота сердечных сокращений во время исследования 88 уд./мин.
Ультразвуковое допплерографическое исследование каротидных и феморальных артерий: кровоток прослеживается, признаков структурных и функциональных изменений сосудов не выявлено. Со стороны венозных сосудов верхних и нижних конечностей признаков тромбоза не обнаружено.
Периферический анализ крови: Hb 116 г/л, эритроциты 3,68х1012/л, гематокрит 36,8%, тромбоциты 169,5х109/л, лейкоциты 10,0х109/л, нейтрофилы 74,0% (47-72), нейтрофилы 7,44х109/л (2,04-5,8), эозинофилы 6,0% (1-5), лимфоциты 11,2% (19-37), лимфоциты 1,127х109/л (1,2-3,0), скорость оседания эритроцитов (СОЭ) 10 мм/час. Генотипирование HLA (Human Leukocyte Antigens): антиген HLA B27 главного комплекса гистосовместимости I класса не обнаружен. Ревматоидный фактор < 20,0 МЕ/мл (до 30). Витаминный статус: витамин D, 25-гидрокси (кальциферол) 47,60 нг/мл (30-100), витамин В12 (цианокобаламин) 152,5 пмоль/л (25,1-165,0), витамин В9 (фолиевая кислота) 7,4 нг/мл на фоне приема фолиевой кислоты (3,1-20,5). Гомоцистеин 12,11 мкмоль/л (3,4-20,4). Цистатин С 8,04мг/л (0,40-0,99). Бета-2-микроглобулин в сыворотке крови 52,47 мг/л (0,97-2,64). Хлориды 102 ммоль/л (98-110), активность сывороточной лактатдегидрогеназы составила 135 МЕ/л (125220). Цитокиновый профиль: интерлейкин-6 44,72 пг/мл (до 10), интерлейкин-10 36,1пг/мл (до 31), фактор некроза опухоли – альфа 0,18 пг/мл (до 6). Иммуноглобулин Е 2,70 МЕ/мл (<87), Д-димер 0,452 мг FEU/л (0-0,55). С-реактивный белок 7,6 мг/л (до 5).
Компьютерная томография органов грудной клетки (5.12.2023г): множественные мешотчатые бронхоэктазы в проекции S4, S5, S7 и S9 сегментов правого легкого и S4, S5, S7, S8, S9 и S10 сегментов левого легкого. Также обнаружено умеренное увеличение внутригрудных лимфатических узлов.
ЭхоКГ от 10.05.2024 г. (рис.1,2), проведённая в связи с нарастанием одышки: толщина межжелудочковой перегородки 0,9 см, толщина задней стенки ЛЖ 0,9 см, фракция выброса ЛЖ 15% (Simpson / метод дисков), размер левого предсердия 5,0 см, конечный систолический размер ЛЖ 5,9 см, конечный диастолический размер ЛЖ 6,6 см, конечный систолический объем ЛЖ 179 мл (18-68), конечный диастолический объем ЛЖ 229 мл (59157), правый желудочек 3,1 см, толщина передней стенки правого желудочка 0,7 см, систолическое легочное давление 44 мм рт. ст. Гипокинез стенок ЛЖ, эхонегативное пространство за задней стенкой ЛЖ 0,4 см в систолу, за задней стенкой правого желудочка 0,2 см. Эпизоды аритмии, частота сердечных сокращений во время исследования 108 уд./мин.
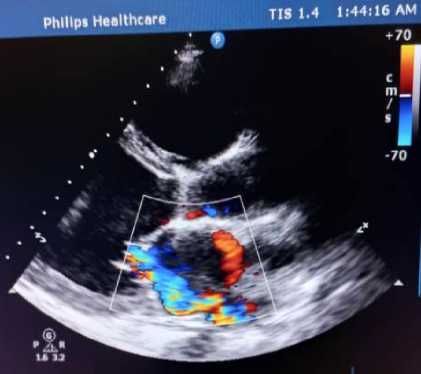
Рисунок 1. Эхокардиография пациентки Р., 39 лет. (от 10.05.2024 г)
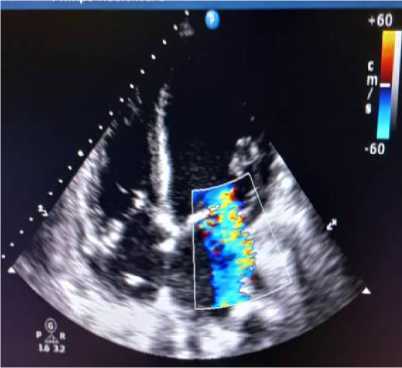
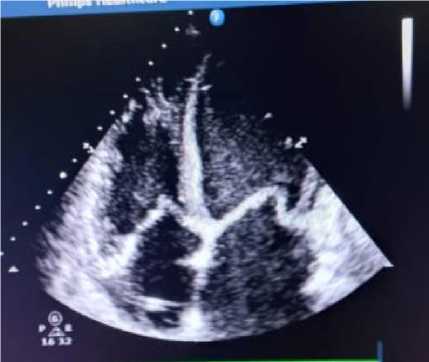
Рисунок 2. Эхокардиография пациентки Р., 39 лет. (от 10.05.2024 г)
Клинический диагноз: микроскопический полиангиит, хроническое течение с преимущественным поражением почек (некротический подострый гломерулонефрит, хроническая болезнь почек, 5Д стадия), легких (некротический альвеолит, хроническая дыхательная недостаточность II-III степени), сердца (аритмический вариант миокардита, выпотной перикардит, сердечная недостаточность IV (NYHA, New York Heart Association), сосудов (смешанная легочная гипертензия). Бронхоэктатическая болезнь, тяжелое течение.
Хронический неатрофический гастрит. Дуоденогастральный рефлюкс. 28.06.2024 г., несмотря на проводимую терапию, пациентка умерла от застойной сердечной недостаточности на фоне программного гемодиализа.
Обсуждение
Микроскопический полиангиит является заболеванием, связанным с высокой смертностью и значительным сокращением продолжительности жизни пациентов. В нашем клиническом наблюдении МПА проявлялся поражением почек и легких. Несмотря на почечную дисфункцию, развитие артериальной гипертензии не наблюдалось. Ввиду частых обострений бронхоэктатической болезни цитостатическая терапия не была назначена, а застойная сердечная недостаточность стала препятствием для применения глюкокортикоидов. На наш взгляд, прогрессирование сердечной недостаточности было связано с терминальной почечной недостаточностью.
Хотя у нашей пациентки были невысокие показатели СОЭ, лейкоцитоза, С-реактивного белка и лактатдегидрогеназы, наблюдалось увеличение сывороточной концентрации интерлейкина-6. Это свидетельствует о том, что дисбаланс воспалительных цитокинов обусловлен как МПА, так и обострением бронхоэктатической болезни. Известно, что повышенные сывороточные концентрации цистатина С и бета-2-микроглобулина могут служить предвестниками плохой выживаемости при МПА, что подтвердилось в нашем наблюдении.
Таким образом, ведение пациентов с МПА требует как междисциплинарного, так и индивидуального подхода. Необходимо регулярно оценивать активность МПА и повреждение органов при каждом посещении клиники. Хотя обострения при МПА случаются нечасто, терапевтические вмешательства зависят от вовлеченности органов в патологический процесс, сопутствующих заболеваний и риска прогрессирующего повреждения органов.
В литературе указывается, что у 95-97% больных МПА выявляются АНЦА, причем антитела к миелопероксидазе встречаются чаще, чем антитела к протеиназе-3. Этот факт подтвердился и в нашем случае, где у пациентки Р., 39 лет, были выявлены антитела к миелопероксидазе. В прогностическом плане МПА характеризуется более высокой частотой развития терминальной стадии хронической болезни почек и смертностью по сравнению с другими АНЦА-ассоциированными васкулитами, что также было подтверждено в нашем клиническом наблюдении.
Отличительной особенностью нашего случая является то, что заболевание было диагностировано на стадии терминальной хронической болезни почек, а респираторные проявления МПА сочетались с частыми обострениями бронхоэктатической болезни. Поражение сердца, вероятно, было вызвано почечными факторами риска кардиоваскулярных нарушений, хотя артериальная гипертензия и тяжелая анемия, обычно сопутствующие терминальной стадии хронической болезни почек, у нашей пациентки отсутствовали. Остаточный диурез не превышал 400-450 мл в сутки на фоне терапии антагонистами минералокортикоидных рецепторов.
Диагноз МПА был установлен у пациентки 31.08.2021 г., а смерть наступила 28.06.2024 г., что составило 35 месяцев (147 недель, 3 года) продолжительности заболевания. Наше наблюдение подтвердило ухудшение почечной выживаемости и сокращение продолжительности жизни при МПА.
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.
Список литературы Микроскопический полиангиит как междисциплинарная проблема (обзор литературы и описание клинического случая)
- Тареев Е. М. К клинике узелкового периартериита // Русская клиника. 1926. Т. 28. С. 157-68.
- Насонова В.А. Ревматические болезни. М.: Медицина, 1997. 520 с.
- Семенкова Е. Н. Системные васкулиты. М.: Медицина, 1988.
- Бекетова Т. В. Алгоритм диагностики системных васкулитов, ассоциированных с антинейтрофильными цитоплазматическими антителами // Терапевтический архив.2018.Т. 90. №.5. С. 13-21. https://doi.org/10.26442/terarkh201890513-21
- Бекетова Т. В. Микроскопический полиангиит, ассоциированный с антинейтрофильными цитоплазматическими антителами: особенности клинического течения // Терапевтический архив. 2015. Т. 87. №.5. С. 33-46.
- Бекетова Т. В. АНЦА-ассоциированные системные васкулиты: вопросы диагностики // Терапия. 2024. Т. 10. №. 1. С. 126-136. https://dx.doi.org/10.18565/therapy.2024.1.126-136
- Щеголева Е. М., Буланов Н. М., Новиков П. И., Моисеев С. В. Клинические особенности поражения почек при микроскопическом полиангиите // Терапевтический архив. 2018. Т. 90. №.6. С. 55-58.
- Гусева Г. Р. Клинический случай нетипичного течения системного васкулита // Справочник врача общей практики. 2019. №.10. С. 62-73. https://doi.org/10.33920/med-10-1910-08
- Балыкова Л. А., Солдатов О. М., Раздолькина Т. И., Верещагина В. С., Ширманкина М. В., Краснопольская А. В., Московская Е. Ф. АНЦА-ассоциированный васкулит с рецидивирующим тромбозом у подростка после новой коронавирусной инфекции // Российский вестник перинатологии и педиатрии. 2023. Т. 68. №.6. С. 112-120. https://doi.org/10.21508/1027-4065-2023-68-6-112-120
- Бердибаева А. Б., Быковченко Ю. Г., Жунушов А. Т., Тухватшин Р.Р. Воздействие урановых хвостохранилищ на биосферные объекты в Кыргызстане // Медицина Кыргызстана. 2014. №.2. С. 132-134.
- Davson J., Ball J., Platt R. The kidney in periarteritis nodosa // QJM: An International Journal of Medicine. 1948. V. 17. №3. P. 175-202.
- Davson H., Duke-Elder W. S. The distribution of reducing substances between the intra-ocular fluids and blood plasma, and the kinetics of penetration of various sugars into these fluids // The Journal of Physiology. 1948. V. 107. №2. P. 141. https://doi.org/10.1113/jphysiol.1948.sp004257
- Wohlwill F. Über die nur mikroskopisch erkennbare Form der Periarteriitis nodosa // Virchows Archiv für pathologische Anatomie und Physiologie und für klinische Medizin. 1923. V. 246. №1. P. 377-411. https://doi.org/10.1007/BF01947911
- Рязанцева Л. Т. Миелопероксидаза: структурно-функциональные модификации и роль субъединичных контактов // Вестник Воронежского государственного технического университета. 2009. Т. 5. №.9. С. 85-88.
- Коган Е. А., Салтыков Б. Б., Раденска-Лоповок С. Г., Атанов П. В.. Микроскопический полиангиит // Архив патологии. 2020. Т. 82. №5. С. 63-66. https://doi.org/10.17116/patol20208205163
- Gutmann C., Siow R., Gwozdz A. M., Saha P., Smith A Reactive oxygen species in venous thrombosis // International Journal of Molecular Sciences. 2020. V. 21. №6. P. 1918. https://doi.org/10.3390/ijms21061918
- Харламова Е. Н., Решетняк Т. М., Тарасова Г. М. Факторы риска тромбозов при АНЦА-ассоциированных васкулитах // Современная ревматология. 2023. Т. 17. №.2. С. 93–99. https://doi.org/10.14412/1996-7012-2023-2-93-99
- Nørgaard I., Nielsen S. F., Nordestgaard B. G. Complement C3 and high risk of venous thromboembolism: 80517 individuals from the Copenhagen general population study // Clinical chemistry. 2016. V. 62. №3. P. 525-534. https://doi.org/10.1373/clinchem.2015.251314
- Oikonomopoulou K., Ricklin D., Ward P. A., Lambris J. D. Interactions between coagulation and complement—their role in inflammation // Seminars in immunopathology. Springer-Verlag, 2012. V. 34. P. 151-165. https://doi.org/10.1007/s00281-011-0280-x
- Antovic A., Svensson E., Lövström B., Illescas V. B., Nordin A., Börjesson O., Gunnarsson I. Venous thromboembolism in anti-neutrophil cytoplasmic antibody-associated vasculitis: an underlying prothrombotic condition? // Rheumatology Advances in Practice. 2020. V. 4. №2. P. rkaa056. https://doi.org/10.1093/rap/rkaa056
- Huang Y. M., Wang H., Wang C., Chen M., Zhao M. H. Promotion of Hypercoagulability in Antineutrophil Cytoplasmic Antibody–Associated Vasculitis by C5a‐Induced Tissue Factor–Expressing Microparticles and Neutrophil Extracellular Traps // Arthritis & Rheumatology. 2015. V. 67. №10. P. 2780-2790. https://doi.org/10.1002/art.39239
- Моисеев С., Бобкова И., Чеботарева Н., Буланов Н. Нефротический синдром: причины и дифференциальный диагноз (Ч. 1) // Клиническая фармакология и терапия. 2023. Т. 32. №.4. С. 5-15.
- Чудинов А. Л., Беляева И. Б., Мазуров В. И., Инамова О. В. Анализ особенностей клинического течения, осложнений и причин летальности в дебюте первичных некротизирующих системных васкулитов // Российский семейный врач. 2023. Т. 27. №.1. С. 41–49. https://doi.org/10.17816/RFD115270
- Rahne T., Plontke S., Keysser G. Vasculitis and the ear: a literature review // Curr Opin Rheumatol. 2020. Т. 32. №.1. С. 47-52. https://doi.org/1010.1097/BOR.0000000000000665
- Кароли Н. А., Волошинова Е. В., Никитина Н. М., Ребров А. П. Особенности диагностики микроскопического полиангиита // Клиническая медицина. 2019. Т. 97. №.3. С. 286-292. http://dx.doi.org/10.34651/0023-2149-2019-97-3-286-292
- Бурлуцкая А. В., Савельева Н. В., Таран Н. С. ANCA-ассоциированный васкулит у подростка 14 лет: клинический случай // Кубанский научный медицинский вестник. 2020. Т. 27. №.5. С. 184-194. https://doi.org/10.25207/1608-6228-2020-27-5-184-194
- Nozu T., Kondo M., Suzuki K., Tamaoki J., Nagai A. A comparison of the clinical features of ANCA-positive and ANCA-negative idiopathic pulmonary fibrosis patients // Respiration. 2009. Т. 77. №.4. С. 407-415. https://doi.org/10.1159/000183754
- Huang H., Wang Y. X., Jiang C. G., Liu J., Li J., Xu K., Xu Z. J. A retrospective study of microscopic polyangiitis patients presenting with pulmonary fibrosis in China // BMC pulmonary medicine. 2014. V. 14. P. 1-6. https://doi.org/10.1186/1471-2466-14-8
- Gokhale Y., Rathod R., Trivedi T., Awadh N. T., Deshmukh U., Jadhav L., Pawar A. Pulmonary Renal Syndrome: Experience from Tertiary Centre in Mumbai // The Journal of the Association of Physicians of India. 2018. V. 66. №7. P. 13-17.
- Бекетова Т. В., Головина О. А., Авдеева А. С. Клинико-иммунологические варианты АНЦА ассоциированного системного васкулита: в фокусе интерстициальный фиброз легких при микроскопическом полиангиите с гиперпродукцией антител к миелопероксидазе и ревматоидного фактора. Собственное наблюдение и обзор литературы // Научно-практическая ревматология. 2023. Т. 61. №.1. С. 62–69. https://doi.org/10.47360/1995-4484-2023-62-69
- Ягода А. В., Гладких Н. Н., Корой П. В., Бородина Л. В. Клинический случай микро скопического полиартериита, осложнённого асептическим тромбэндокардитом с поражением аортального клапана // Медицинский вестник Северного Кавказа. 2023. Т. 18. №.1. С. 81-85. https://doi.org/10.14300/mnnc.2023.18020
- Синяченко О. В., Ермолаева М. В., Седая Л. В., Бевзенко Т. Б., Малахова Ж. В. Поражение сердца при системных васкулитах, ассоциированных с антинейтрофильными цитоплазматическими антителами // Український кардiологiчний журнал. 2016. №.1. С. 75-80.
- Liapi M., Jayne D., Merkel P. A., Segelmark M., Mohammad A. J. Venous thromboembolism in ANCA-associated vasculitis: a population-based cohort study // Rheumatology. 2021. V. 60. №10. P. 4616-4623. https://doi.org/10.1093/rheumatology/ keab057
- Муркамилов И. Т., Айтбаев К. А., Кудайбергенова И. О., Фомин В. В., Юсупов Ф. А. (Микроскопический полиангиит: диагностические и терапевтические подходы к лечению (обзор литературы и описание клинического случая) // The scientific heritage. 2020. №48-2. С. 26-34.
- Savage C. O. S., Winearls C. G., Evans, D. J., Rees A. J., Lockwood C. M. Microscopic polyarteritis: presentation, pathology and prognosis // QJM: An International Journal of Medicine. 1985. V. 56. №2. P. 467-483. https://doi.org/10.1093/oxfordjournals.qjmed.a067893
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Кудайбергенова И. О., Юсупов Ф. А., Муркамилова Ж. А., Бекетова Т. В. Микроскопический полиангиит: современные представления и возможности терапии // Научно-практическая ревматология. 2021. Т. 59. №.5. С. 608–614. https://doi.org/10.47360/1995-4484-2021-608-614
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Юсупова Т. Ф., Юсупова З. Ф., Юсупов Ф. А., Ибрагимова Т. М. Системные васкулиты: современный взгляд на проблему // Клиническая медицина. 2024. Т. 102. №.3. С. 230-240. https://doi.org/10.30629/0023-2149-2024-102-3-230-240
- Базина И. Б., Козырев О. А., Денисова Т. П., Кречикова Д. Г., Асафьева О. Ю. Сложности диагностики микроскопического полиангиита // Врач. 2020. Т. 31. №.8. С. 87–88. https://doi.org/10.29296/25877305-2020-08-14
- Фролова Н. Ф., Корсакова Л. В., Столяревич Е. С., Никонорова Н. О., Бекетова Т. В. Дебют АНЦА-ассоциированного системного васкулита под маской ревматоидного артрита // Научно-практическая ревматология. 2015. Т. 53. №.6. С. 653–656. http://dx.doi.org/10.14412/1995-4484-2015-653-656
- Буланов Н. М., Новиков П. И., Литвинова М. А., Моисеев С. В. Эволюция классификации системных васкулитов: от эпонимов к современным критериям // Терапевтический архив. 2022. Т. 94. №.5. С. 704–708. https://doi.org/10.26442/00403660.2022.05.201503
- Щеголева Е. М., Буланов Н. М., Виноградова Е. С., Зыкова А. С., Новиков П. И., Моисеев С. В. Варианты течения и исходы микроскопического полиангиита // Клиническая фармакология и терапия. 2018. Т. 27. №.3. С. 35-40.


