Микроспорогенез у сортов Pyrus, Malus, Cerasus, Microcerasus и их гибридов
Автор: Яндовка Л.Ф., Папихин Р.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические основы и приемы селекции
Статья в выпуске: 1 т.47, 2012 года.
Бесплатный доступ
Изучены особенности микроспорогенеза у видов Pyrus communis, Malus domestica, Cerasus vulgaris, Microcerasus tomentosa, Cerasus avium, а также у их межвидовых и межродовых гибридов. Описаны типичные и нетипичные нарушения микроспорогенеза. Первые были обнаружены у всех изученных растений, вторые - в основном у гибридов. Нетипичные нарушения становились причиной низкой фертильности пыльцевых зерен.
Микроспорогенез, фертильность и жизнеспособность пыльцы
Короткий адрес: https://sciup.org/142133272
IDR: 142133272 | УДК: 634:631.522/.524:631.527.5:576.354.4
Текст научной статьи Микроспорогенез у сортов Pyrus, Malus, Cerasus, Microcerasus и их гибридов
Создание новых сортов, которые объединяют в себе хозяйственно ценные признаки культурных растений, относящихся к разным видам и родам, представляет особый интерес для селекционеров. Многим отечественным исследователям удалось преодолеть нескрещиваемость видов и получить плодовитые отдаленные гибриды (1-5). Наибольшую трудность при селекционном использовании межвидовых и межродовых гибридов представляет стерильность их пыльцы. Для разработки эффективных методов преодоления стерильности при отдаленной гибридизации растений необходимо знать особенности формирования генеративных органов, опыления, оплодотворения и развития семезачатка.
Формирование генеративных органов характеризуется наличием критических периодов (6-11). Термин «критические периоды» впервые был введен П.И. Броуновым в 1897 году (12). В развитии пыльника предложено выделить три периода: премейотический, мейотический и пост-мейотический (13). Эта периодизация была использована при разработке общих положений теории критических периодов в онтогенезе. Наиболее важный этап в развитии пыльника — микроспорогенез (мейотический период). Существуют работы по изучению процессов микроспорогенеза и развития пыльцевого зерна у родов Pyrus , Malus , Cerasus и Microcerasus. Типичные нарушения у сортов вишни, груши и яблони описаны многими авторами (14-19). Также имеются данные о фертильности и жизнеспособности пыльцы у представителей этих родов плодовых растений (20, 21).
Целью нашей работы стало изучение особенностей микроспорогенеза у сортов яблони домашней, груши обыкновенной, вишни обыкновенной, вишни войлочной и черешни, а также у их межвидовых и межродовых гибридов в условиях Тамбовской области.
Методика . Исследования проводили в 2003-2008 годах. Объектами служили растения яблони домашней ( Malus domestica Borkh.) — сорт Пепин шафранный [Ренет орлеанский х (Пепин английский х китайка)] селекции И.В. Мичурина; груши обыкновенной ( Pyrus communis ) — сорт Тонковетка народной селекции; яблоне-грушевых гибридов — № 818 (Malus baccata х смесь пыльцы южных сортов груши) селекции Т.А. Горшковой, № 839/67 (Китайка х Деканка зимняя + Кюре) селекции Г.А. Курсакова; груше-яблоневого гибрида — № 01 (Тонковетка х смесь пыльцы яблони) селекции С.Ф. Черненко; вишни обыкновенной ( Cerasus vulgaris ) — сорта Владимирская народной селекции, Интенсивная (Алый Парус х Долорес);
черешни ( Cerasus avium ) — сорт Итальянка (Слава Жукова х Бигарро); вишне-черешневых гибридов — сорт Фея (Коралл х Премьера); вишнечеремуховых гибридов — сорт Харитоновская (Жуковская х Алмаз) селекции ВНИИГиСПР им. И.В. Мичурина; вишни войлочной ( Microcerasus tomentosa ) из насаждений Всероссийского НИИ генетики и селекции плодовых растений им. И.В. Мичурина (ВНИИГиСПР им. И.В. Мичурина, г. Мичуринск, Тамбовская обл.).
Процесс мейоза исследовали на временных давленых препаратах с фиксацией в жидкости Карнуа (была приготовлена по сокращенной прописи), окрашенных ацетогематоксилином (22). Качество пыльцы оценивали с помощью окрашивания в ацетокармине, ее жизнеспособность — посредством проращивания на искусственной питательной среде (23). Препараты просматривали под микроскопом Carl Zeiss Jenamed (Германия), для фотодокументирования использовали цифровую камеру DCM-500 с программным обеспечением ScopePhoto.
Статистическую обработку данных проводили в программе Microsoft Excel.
Результаты . Процесс формирования микроспор у всех изученных растений в условиях Тамбовской области обычно начинался во II декаде апреля. В годы с высокими значениями эффективных температур мейоз в микроспороцитах проходил раньше — в первых числах апреля. В целом микроспорогенез у видов протекал сходно. В некоторых случаях наблюдалась асинхронность в делениях микроспороцитов в одном и том же цветке — от профазы I до телофазы II.
Изучение точек роста с помощью давленых препаратов показало, что в соматических клетках растений (2 n ) имеется 34 хромосомы у яблони домашней, груши обыкновенной, яблоне-грушевых и груше-яблоневых гибридов; 32 хромосомы — у вишни обыкновенной, вишне-черешневых и виш-не-черемуховых гибридов; 16 хромосом — у черешни и вишни войлочной.
У исследуемых растений обнаружены нарушения в распределении хроматина в I и II делениях мейоза, а также при цитокинезе в процессе образования диад и тетрад микроспор. У растений с генетически сбалансированными генотипами нарушений было меньше.
Вследствие генетических различий между скрещиваемыми геномами у гибридных растений часть хромосом не конъюгировала в профазе I деления. В результате наряду с бивалентами образовывались униваленты. У яблоне-грушевых гибридов число бивалентов колебалось от 12,0 до 17,0, унивалентов — от 0 до 10,0, тривалентов и тетравалентов не обнаружили. У вишне-черешневого гибрида соотношение бивалентов и унивалентов составляло 14,9:2,1; у вишне-черемухового гибрида — 15,0:2,0. Наибольшей гомологией хромосом у яблоне-грушевых форм характеризовался гибрид № 839/67 — 16,2:1,4. Значительное число образующихся бивалентов свидетельствует о высокой вероятности синтеза между гомологичными хромосомами яблони и груши. Наименьшая конъюгация хромосом наблюдалась у гибрида № 818 (13,8:3,7).
В хромосомных ассоциациях груше-яблоневого гибрида № 01 число бивалентов и унивалентов в среднем составляло соответственно 15,5 и 2,4. В некоторых микроспороцитах этого гибрида встречалось до 10 унивалентов. Наряду с аномальными клетками имелись клетки с правильной конъюгацией хромосом (17 бивалентов). Различить принадлежность хромосом гибридов к тому или иному исходному виду было невозможно из-за большого сходства. Трудно судить о том, какие хромосомы вступали в синапсис. Хромосомные ассоциации гибридов вишни обыкновенной харак- теризовались соотношением 15,6:0,7, у черешни оно составляло 15,8:0,2.
Микроспорогенез у всех исследованных видов и их гибридов в ряде случаев проходил с нарушениями. В зависимости от частоты нарушения разделили на две группы — типичные (часто встречающиеся) и нетипичные (редкие).
Типичные нарушения в разном сочетании были найдены у всех изученных растений (рис. 1). В метафазе I (M I) обнаруживались униваленты и биваленты, лежащие вне метафазных пластинок. В анафазе I (A I) при расхождении хромосом к полюсам наблюдали отставшие и забежавшие униваленты , асинхронное и численно неравномерное расхождение хромосом к полюсам. Отставшие при расхождении отдельные хромосомы или их группы в телофазе I (T I) формировали в материнских клетках микроспор различающиеся по размерам микроядра (обычно 1-2) либо подтягивались к полюсам. Наиболее частым нарушением в метафазе II (М II) была дезориентация и аномальное расположение хромосом за пределами метафазных пластинок, отмечалась также неравная величина групп хромосом. В анафазе II (А II) наблюдали задержку хромосом в экваториальной области, отставание и забегание вперед, выбросы хроматина за пределы веретена деления, неравномерное распределение хромосом. На стадии телофазы II (Т II) были обнаружены клетки с разным числом ядер (больше или меньше 4), клетки с микроядрами , образовавшимися в результате ошибок при распределении хромосом между дочерними ядрами на предыдущих стадиях мейоза. Достаточно часто вокруг микроядер обособлялся участок цитоплазмы и формировались микроспоры (как правило, меньшего размера). Происходили нарушения на стадии образования тетрад (формирование пентад, гексад, гептад, наличие одного или двух микроядер в одной из микроспор тетрады). В связи с нарушениями в процессе редукционного деления ядерный материал в конце мейоза распределялся неравномерно. Величина и форма микроспор в тетрадах часто различались.
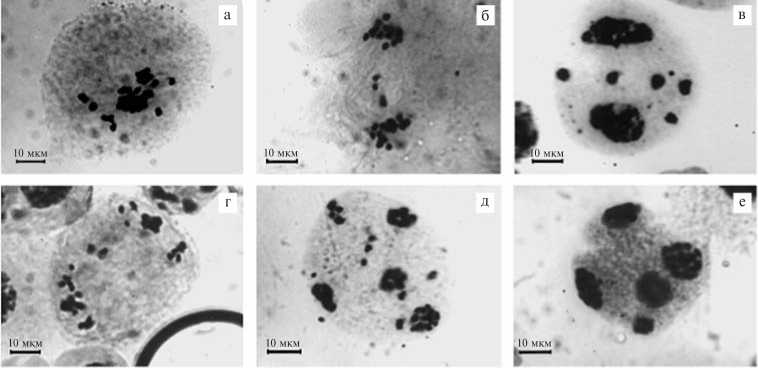
Рис. 1. Типичные нарушения микроспорогенеза у отдаленных гибридов плодовых растений: а — выбросы и отставание хромосом в метафазе I; б — отставание хромосом в анафазе I; в — образование микроядер в телофазе I; г — отставание и выбросы хроматид в анафазе II; д — формирование большего числа ядер в телофазе II; е — формирование пентады (окрашивание ацетогематоксилином, увеличение *1200).
Нетипичные нарушения мейоза наиболее часто обнаруживались у гибридов. Отмечался цитомиксис (перемещение отдельных хромосом или целых ядер из одного микроспороцита в другой или из одной микроспоры в 54
другую). Причина возникновения цитомиксиса, по мнению В .А. Поддуб-ной-Арнольди (19), — нарушение физиологического состояния ядра и цитоплазмы под влиянием гибридизации или неблагоприятных условий окружающей среды; автор указывает на патологическую сущность этого явления. В результате цитомиксиса образуются гаметы с недостаточным или избыточным числом хромосом и их фрагментов. Цитомиксис был обнаружен у гибридов вишни обыкновенной (П I, М II, стадия образования тетрад), черешни (П I, А II, Т II), яблоне-грушевого гибрида № 839/67 (М I), груше-яблоневого гибрида № 01 (A I). Частота клеток с цитомик-сисом у разных по происхождению растений различалась. У генетически сбалансированных генотипов, например у сорта Владимирская, цитомиксис не обнаружили, у гибрида № 839/67 его отмечали в 8,6, у гибридов вишни обыкновенной — в 3,6 % клеток.
Из других нетипичных нарушений следует отметить появление на стадии А I выбросов бивалентов за пределы веретена деления, образова ние мостов между не разошедшимися к полюсам хромосомами. У гибридных растений эти нарушения встречались чаще. На стадии Т I было выявлено наличие трех и более микроядер разной величины у вишни обыкновенной и яблоне-грушевого гибрида № 839/67. В анафазе II хро мосомные мосты и неравные по числу группы хромосом обнаруживали у черешни, вишни обыкновенной, яблоне-грушевых и груше-яблоневых гибридов. Большое число микроядер (до 8-9) на стадии Т II отмечали у многих растений. На стадии образования тетрад могло формироваться иное число микроспор: диады, триады (яблоне-грушевые и груше-яблоневые гибриды, вишня войлочная, вишня обыкновенная, черешня) и октады (виш-не-черешневые гибриды).
so. Частота нарушений на раз-
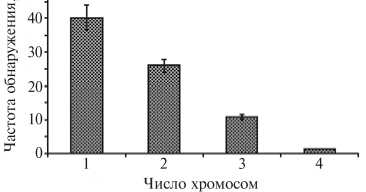
Рис. 2. Частота обнаружения хромосом вне экваториальной пластинки в метафазе I у яблоне-грушевого гибрида № 818.
ных стадиях мейоза у изученных видов и их гибридов оказалась неодинаковой. Наиболее высокой она была у гибридных растений (табл.). Характерная особенность метафазы первого деления мейоза — наличие одной-четырех хромосом, отстающих в прометафазном движении или выброшенных в цитоплазму за пределы метафазной пластинки. У вишни обыкновенной генетически сбаланси рованного сорта Владимирская частота выброшенных и отстающих хромосом составляла 17,7, частота нарушений в М I у вишне-черешневого гибрида Фея равнялась 41,4, у сорта Тонковетка груши обыкновенной — 6,4, у отдаленных межродовых гибридов яблони и груши — 39,6-89,5 %. Число хромосом вне экваториальной пластинки могло доходить до четырех (рис. 2). У гибрида № 818 число микроспороцитов с одной хромосомой вне экваториальной пластинки составляло 40,1, с двумя хромосомами — 26,0, с тремя — 10,7, с четырьмя — 1,2 %. У груше-яблоневого гибрида № 01 в М I наблюдали также разделение метафазной пластинки (16,9 %) на несколько групп (чаще на две). Подобное нарушение в процесе мейоза может служить предпосылкой образования несбалансированных гамет. У генетически сбалансированных растений подобного явления не обнаружено.
В А I, как и на предыдущих стадиях мейоза, частота клеток с нарушениями у гибридов была выше. Так, у вишни сорта Владимирская в АI
Частота хромосомных нарушений на разных стадиях микроспорогенеза у Pyrus communis , Malus domestica , Cerasus vulgaris, Microcerasus to-mentosa, Cerasus avium и их гибридов
При просмотре анафазных клеток первого деления у груше-яблоневого и яблоне-грушевого гибридов выяснилось, что большинство клеток (от 15,3 до 34,3 %) были аномальными из-за преждевременно разошедшихся хро мосом. Отставание хромосом в А I у гибридов также встречалось довольно часто (60-70 % от общего числа аномальных клеток). Обычно отставали 25 хромосом. Значительно реже наблюдали хромосомы, выброшенные в цитоплазму (10,8 %).
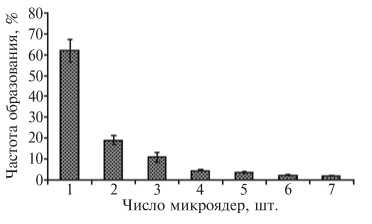
Рис. 3. Частота образования разного числа микроядр в телофазе I у яблоне-грушевого гибрида № 839/67.
Предпосылкой образования микроядер в Т I служили частые отставания и выбросы хромосом в цитоплазму на предшествующих стадиях мейоза. Микроядра в Т I у гибридов встречались чаще, чем у сбалансированных генотипов, их число могло достигать семи (рис. 3). Неодинаковую величину ядер зафиксировали только у груше-яб-лоневого гибрида № 01 и сортов вишни обыкновенной Фея и Ха-ритоновская; у черешни в двух клетках также была обнаружена неравная величина ядер.
Второе деление мейоза в ряде случаев тоже протекало с аномалиями. Материнские клетки микроспор в М II с группами, неравноценными по числу составляющих их хромосом, наиболее часто встречались у гибридных растений. В каждой группе число хроматид составляло 12-27. Выбросы хроматид в цитоплазму у гибридов обнаруживались в 21,3 % случаев. Клетки с хромосомными мостами встречались с частотой 0,6 % от общего числа нарушений.
Нарушения в анафазе II приводили к возникновению в телофазе II большого числа материнских клеток с микроядрами, образовавшимися из выброшенных или отставших хромосом. В Т II у генетически сбалансированных форм в аномальных мейоцитах обнаруживали не более двух микроядер, в то время как у гибридов — до 7-8. Выброшенные на начальных стадиях мейоза хроматиды в телофазе II в некоторых случаях обособлялись в группы и формировали дополнительные ядра. У видовых форм дополнительных ядер не наблюдали. У гибридных генотипов, например яблоне-грушевого гибрида № 818 и вишне-черешневого гибрида Фея, обнаружили до 8 ядер. У формы № 01, помимо четырехъядерных, образовывались трехъядерные (6,2 %) и двухъядерные (2,0 %) мейоциты. Такое соотношение клеток у гибрида № 01 указывает на генотипическую склонность этой формы к образованию нередуцированных гамет, что считается весьма ценным свойством для дальнейшего использования в селекции. Средний процент нарушений по всем стадиям мейоза у генетически сбалансированных растений был значительно меньше, чем у гибридных форм (см. табл.).
Следствием нарушений на разных стадиях мейоза у исследованных растений стало аномальное формирование и развитие тетрад. Размеры микроспор и ядер в клетках варьировали, нередко обнаруживались микронуклеусы и добавочные ядра, формирующиеся в телофазе второго деления. Частота нарушений на стадии образования тетрад у гибридов была выше, чем у сортов (см. табл.).
Показателем морфологической полноценности микроспор служит фертильность пыльцы. На морфологическую сформированность и жизне- способность пыльцевых зерен влияют разные факторы (24). Основной из них — происхождение растений. В наших опытах наибольшую фертильность пыльцы, определяемую ацетокарминовым методом, имели генетически сбалансированные генотипы. У вишни сорта Владимирская этот показатель составлял 74,5, у вишни войлочной — 89,3, у яблони сорта Пепин шафранный — 87,9, у груши сорта Тонковетка — 72,2 %. Доля морфологически сформированных пыльцевых зерен у гибридов была ниже: у сорта Харитоновская — 66,4, у сорта Фея — 65,2 %. У яблоне-грушевых гибридов № 839/67 и № 818 доля окрашенной пыльцы была ниже — 2,1 %, фертильность груше-яблоневого гибрида № 01 равнялась 16,1 %.
Жизнеспособность пыльцы, определяемая ее проращиванием на искусственной питательной среде, составляла у вишни сорта Владимирская 43,7, у вишни войлочной — 42,9, у яблони сорта Пепин шафранный — 87,9, у груши сорта Тонковетка — 72,2, у сорта Харитоновская — 9,9, у сорта Фея — 18,9 %. Пыльца межродовых гибридов семечковых растений прорастала плохо. Так, у формы № 01 ее жизнеспособность составляла 8,3, у № 839/67 — 6,9, пыльца гибрида № 818 не прорастала.
Таким образом, у растений видов Pyrus communis , Malus domestica , Cerasus vulgaris , Microcerasus tomentosa , Cerasus avium и их гибридов выявлены типичные и нетипичные нарушения микроспорогенеза. Типичные нарушения, которые имеются у всех изученных растений, связаны с распределением хроматина (неспособность большинства хромосом конъюгировать друг с другом, формирование унивалентов, отставания, забегания, выбросы хромосом за пределы веретена деления и неравномерное расхождение хромосом к полюсам, приводящее к образованию микроядер и нарушениям при образовании тетрад микроспор). Нетипичные нарушения мейоза наиболее часты у гибридов. Результатом таких нарушений становится образование гамет с числом хромосом, не соответствующим гаплоидному, и формирование пыльцы с пониженной фертильностью. Выявлены гибридные генотипы, способные формировать некоторое количество фертильных пыльцевых зерен. Они могут быть использованы в селекционной работе с целью объединения в потомстве хозяйственно ценных признаков растений, относящихся к разным видам и родам. Особенности протекания микроспорогенеза могут стать дополнительным признаком к общепринятым характеристикам представителей видов и их гибридов.
Л И Т Е Р А Т У Р А
-
1. Г о р ш к о в а Т.А. Яблоне-грушевые гибриды. Бюлл. научно-технической информации ЦГЛ им. И.В. Мичурина. Мичуринск, 1956, 1: 13-18.
-
2. П а п и х и н Р.В., М у р а т о в а С.А. Получение межродовых гибридов плодовых семечковых растений с применением метода культуры тканей и полиплоидизации in vitro. С.-х. биол., 2011, 5: 63-68.
-
3. К у р с а к о в Г.А. Отдаленная гибридизация плодовых растений. М., 1986.
-
4. М и ч у р и н И.В. Сочинения. Т. I-IV. М., 1948.
-
5. Р у д е н к о И.С. Отдаленная гибридизация и полиплоидия у плодовых растений. Кишинев, 1978.
-
6. Ж у к о в О.С., Х а р и т о н о в а Е.Н. Селекция вишни. М., 1988.
-
7. Б е р е з е н к о Н.П., Т р е т я к К.Д., 3 а в г о р о д н я я В.Г. Эмбриогенез и осыпание цветков и завязей у некоторых сортов вишни. Мат. Всес. совещания эмбриологов растений. Кишинев, 1986: 180.
-
8. К о з л о в а Н.А. Некоторые морфологические особенности развития генеративных органов и семян у вишни латвийской низкой ( Cerasus fruticosa ). II. Ботанический журнал, 1959, 45(1): 84-89.
-
9. С в е т л о в П.Г. Теория критических периодов и ее значение для понимания принципов действия среды на онтогенез. М.-Л., 1960: 263-285.
-
10. С к а з к и н Ф.Д. Критический период у растений по отношению к недостатку воды в почве. Л., 1971.
-
11. С п и ц ы н И.П. Генетика, цитология, эмбриология вишни. Экология. Тамбов, 1994.
-
12. Б р о у н о в П.И. Значение сельскохозяйственно-меорологических наблюдений и краткое руководство для проведения их. СПб, 1897.
-
13. К а м е л и н а О.П. Сравнительная эмбриология цветковых растений. Пыльник. Л., 1981, т. 1: 18-21.
-
14. Д е б и с к а е в а С.Ю. Фертильность пыльцы сортов черешни. В сб. науч. тр. СевероКавказского НИИ горного и предгорног о садоводства: Интенсификация садоводства. Нальчик, 1995, вып. 5: 90-93.
-
15. Н а з а р о в а М.Н., С и м о н о в а О.А. Мейоз при микроспорогенезе и качество пыльцы у вишни войлочной. I. В сб. науч. тр.: Отдаленная гибридизация и полиплоидия в селекции растений. Воронеж, 1989.
-
16. П а х о м о в а Н.П. Микроспорогенез межродового гибрида Malus baccata Borkh. х Pyrus communis L. Тр. ЦГЛ им. И.В. Мичурина (Мичуринск), 1971, т. 12: 210-221.
-
17. X а р и т о н о в а Е.Н. Цитологические исследования косточковых. Тр. ЦГЛ им. Мичурина. Мичуринск, 1971, т. 12: 188-204.
-
18. F u r u c a w a Y., B u c o v a c M.J. Embryo sac development in sour cherry during the pollination period as related to fruit set. Hort. Sci., 1989, 24(6): 1005-1008.
-
19. С е д о в Е.Н., С е д ы ш е в а Г.А., С е р о в а З.Н., Г о р б а ч е в а Н.Г. Доноры для создания триплоидных и иммунных к парше сортов яблони. Вест. Саратовского гос-агроуниверситета им. И.В. Вавилова, 2010, 7: 35-38.
-
20. М а ш к и н С.И. Цитогенетический анализ спонтанных и искусственных гибридов и аллополиплоидов Cerasus . II. Генетика, 1994, 30(прил.): 98.
-
21. Р о м а н о в а Н.П., Ш е л а б о т и н Г.П., Л е о н ч е н к о В.Г., X а н и н а Н.П., Н и к о л ь с к и й Б.В., Р а с т о р г у е в С.Л., Т у р о в с к и й И.И. Методические рекомендации по применению цитологических методов в плодоводстве. М., 1988.
-
22. Т о п и л ь с к а я Л.А., Л у ч н и к о в а С.В., Ч у в а ш и н а Н.П. Изучение соматических и мейотических хромосом смородины на ацетогематоксилиновых давленых препаратах. Бюл. научно-технической информации ЦГЛ им. И.В. Мичурина (Мичуринск), 1975, 22: 58-61.
-
23. Я н д о в к а Л.Ф., Ш а м р о в И.И. Фертильность пыльцы Cerasus vulgaris и Cerasus tomentosa ( Rosaceae ). Ботанический журнал, 2006, 91(2): 206-218.
-
24. T a b a c a r u C.D., S t e f u r e a c T.J. L'embryogenese chez certaines sortes de griottiers ( Prunus cer. L.). Rev. Roum. Biol. Ser. Biol. Veget., 1986, 31(1): 19-22.
-
1 ФГБОУ ВПО Тамбовский государственный университет Поступила в редакцию
им. Г.Р. Державина, Медицинский институт, 27 января 2009 года
392000 г. Тамбов, ул. Интернациональная, 33, e-mail: yandovkaTGU@mail.ru ;
-
2ФГБОУ ВПО Мичуринский государственный
аграрный университет,
393770 Тамбовская обл., г. Мичуринск, ул. Интернациональная, 101,
MICROSPOROGENESIS IN THE Pyrus , Malus , Cerasus , Microcerasus VARIETIES AND THEIR HYBRIDS
L.F. Yandovka1, R.V. Papikhin2
S u m m a r y
The features of microsporogenesis were studied in Pyrus communis , Malus domestica , Cerasus vulgaris , Microcerasus tomentosa , Cerasus avium species and their interspecific and intergeneric hybrids. The typical and non-typical abnormalities in microsporogenesis were described. The typical — were found in all studied plants, the non-typical — in hybrids, as rule. The non-typical abnormalities caused the low fertility of pollen grains.
Научные собрания

МЕЖДУНАРОДНЫЙ КОНГРЕСС ПО КАРТОФЕЛЕВОДСТВУ (WPC)
(27-30 мая 2012 года, г. Эдинбург, Шотландия)
Лозунг Конгресса — «Думать глобально.
Побеждать локально». Событие сфокуси ровано на ключевых фундаментальных проблемах производства, переработки и потребления картофеля и их практическом решении.
Информация:


