Минералообразование в цианобактериальном мате источника Горячинск
Автор: Цыренова Дулма Доржиевна, Бархутова Дарима Дондоковна, Лазарева Елена Владимировна, Брянская Алла Викторовна
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Было изучено минералообразование в природном и лабораторном мате источника Горячинск. В природном мате обнаружены пирит кубической формы, кремнезем, сульфат бария с примесями стронция. В лабораторном - отложения фосфата кальция, кварца, кристаллов оксида железа и карбоната кальция. В лабораторном цианобактериальном сообществе минералообразование происходило интенсивнее, чему способствовали подобранный состав среды, содержание основных элементов и температура культивирования.
Минералообразование, цианобактериальное сообщество
Короткий адрес: https://sciup.org/148181824
IDR: 148181824 | УДК: 549+576.809.51(571.54)
Текст научной статьи Минералообразование в цианобактериальном мате источника Горячинск
Целью данного эксперимента явилось выявление отложения минералов в природном и лабораторном цианобактериальном сообществе в зависимости от состава растворов и структуры сообщества.
Объект и методы исследования
Источник Горячинск расположен в Прибайкальском районе Республики Бурятия (Россия) [1]. Термальный источник выходит на поверхность на восточном берегу оз. Байкал в 1,5 км от береговой линии, в широкой долине между Котковским и Туркинским хребтами. Температура сульфатной натриевой воды достигает 42-43 oС, рН – 8.9-9.0, минерализация – 0.50-0.65 г/дм3. Разгрузка терм происходит в верхней части небольшого песчаного оврага, промытого горячей водой. Самоизливающий-ся выход источника находится в закрытом павильоне, из которого вода поступает в бетонный каптажный колодец (размер 15х4 м, глубина 1.2 м, выход № 1) и далее самотеком в ванные помещения. Избыток ее стекает в пруд размером 100х80 м, образованный небольшой дамбой, из него часть воды попадает в Байкал. Рядом с каптажным колодцем имеется второй выход, закрытый павильоном, вода из него также сбрасывается в пруд. В овраге вдоль зоны разрывных нарушений на протяжении 180 м имеется ряд мелких источников, часть из которых имеет периодическое функционирование. Пробы микробных матов были отобраны из 3 станций в марте 2011 г.
Для изучения отложения минералов микробные маты упаковывались с сохранением структуры, а в лабораторных условиях разделялись на слои и сушились. Изучение качественного состава минеральных фаз проводилось при помощи сканирующего электронного микроскопа Leo Oxford 1430VP (Германия) и светового Axioskop 2 Plus (Германия). Видовую принадлежность цианобактерий определяли по отечественным определителям [2, 3].
Для проведения лабораторного эксперимента по изучению отложения минералов в цианобактериальных матах использовали модифицированную среду Кастенхольца для термофилов (г/дм3): NaHCO 3 – 0.6, NaCl – 0.008, K 2 HPO 4 – 0.1, NaNO 3 – 0.1, Na 2 SiO 4 – 0.2, FeCl 3 – 0.028, Na 2 SO 4 – 0.05. Содержание в среде MgSO 4 и CaCl 2 было различным: в эксперименте №1 использовали следующие концентрации MgSO 4 – 0,002, CaCl 2 – 0,005; №2 – MgSO 4 – 0,003, CaCl 2 – 0,010; №3 – MgSO 4 – 0,004, CaCl 2 – 0,020; №4 – MgSO 4 – 0,010, CaCl 2 – 0,050; №5 – MgSO 4 и CaCl 2 не добавляли.
В начале эксперимента определяли рН и Еh в каждой из сред на приборе Анион 4100 (Россия). Отбирали по 1 см2 микробного мата (очищенного от песка, отмершей биомассы), переносили в колбу с 20 мл среды с различным содержанием Ca и Mg. Выращивание лабораторного цианобактериального сообщества проводили в течение одной недели в термостате при температуре 40 оС. Для каждого экс- перимента ставили контроль без микробного мата. В течение эксперимента каждый день обновляли культивируемую среду: сливали по 10 мл среды из каждого эксперимента и добавляли 10 мл свежей среды. Длительность эксперимента составляла 8 суток.
Результаты и обсуждение
Минералообразование в природном цианобактериальном сообществе
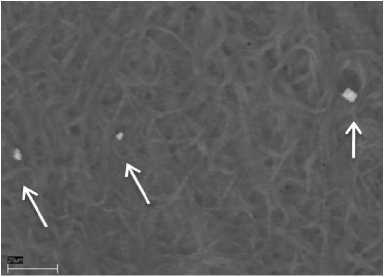
В результате просмотра природного цианобактериального мата источника Горячинск было обнаружено образование следующих минералов: пирита кубической формы, кремнезема, сульфата бария с примесями стронция.
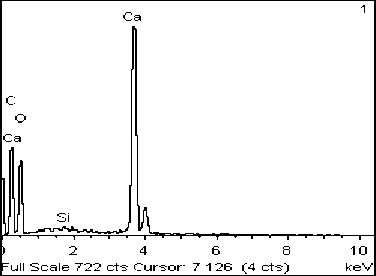
Пирит. В микробных матах станций 1 и 2 обнаружено отложение кубического пирита внутри водорослевой клетки, размер которого не превышает 1 мкм (рис. 1). Также среди микробных сообществ обнаружено накопление сферолитов пирита, размер которых не более 5 мкм в поперечнике (рис. 2А, В).
Кремнезем (SiO 2 ) обнаружен на станции 1 на поверхности микробного сообщества в виде однородной ровной пленки (отечности) (рис. 2). Сульфат бария с примесью стронция. На ст. 2 обнаружены обломочные материалы сульфата бария с примесью стронция (рис. 3).

Рис. 1. Фото (сканирующий микроскоп): А – отложение кристаллов пирита в микробном сообществе источник Горячинск, ст. 1; Б – его элементный состав

А
Б
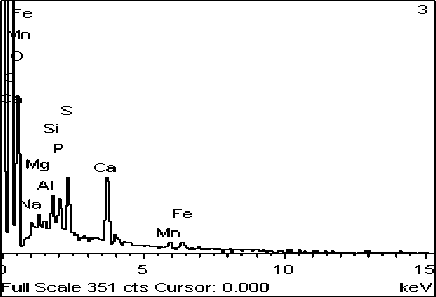
Рис. 2. Фото (сканирующий микроскоп): А – отложение кристаллов кремнезема (Q) и сферолита пирита (СП); Б – элементный состав кварца, В – элементный состав сферолитов пирита

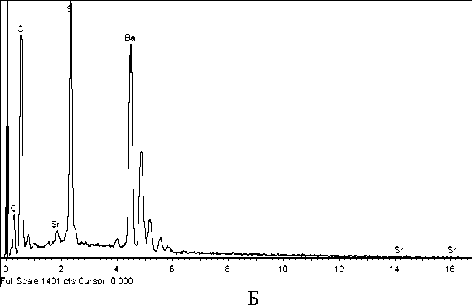
Рис. 3. Фото (сканирующий микроскоп): А – отложение сульфата бария с примесью стронция; Б – его элементный состав
А Б
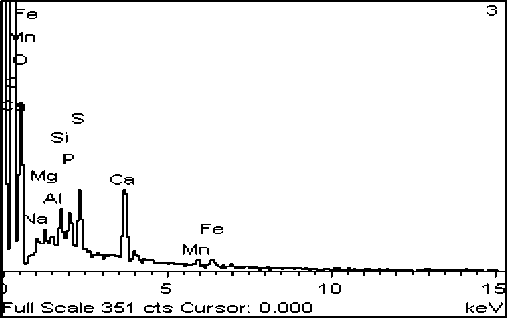
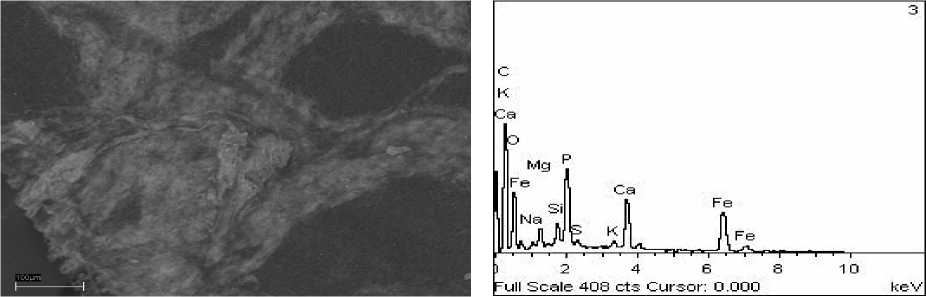
Рис. 4. Фото (сканирующий микроскоп): А – отложение Ca3(PO4)2, Б – его элементный состав
Минералообразование в лабораторном цианобактериальном сообществе
Просмотр выросшего в конце эксперимента цианобактериального сообщества показал следующее. В эксперименте №1 ([Ca2+]=5 мг/дм3, [Mg2+]=2 мг/дм3) наблюдалось отложение большого количества фосфатов кальция с небольшими примесями Mg и K в виде белых хлопьевидных выделений (рис. 4). Концентрации карбоната слишком малы, поэтому происходило отложение не карбоната кальция, а фосфата.
А

В
Г Д
Е
Ж
А
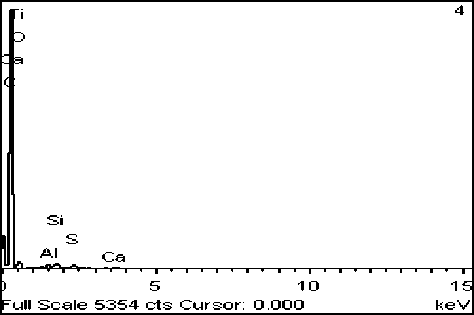
Рис. 6. Фото (сканирующий микроскоп): А – отложение карбоната кальция, Б – его элементный состав
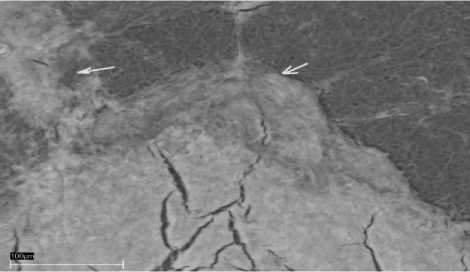
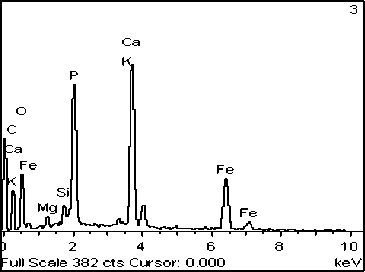
Рис. 5. Фото (сканирующий микроскоп): А – отложение Ca3(PO4)2, Б – его элементный состав, В – кристаллы оксида железа и кварца (Q), Г, Д – элементный состав кремнезема и оксида железа, соответственно Е – кристаллы карбоната кальция, Ж – элементный состав карбоната кальция
Б
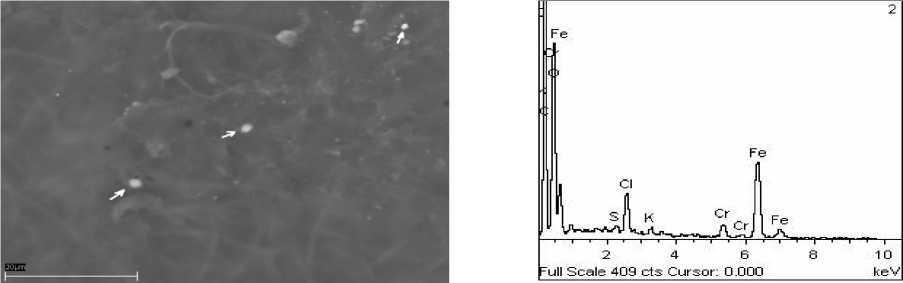
А Б
Рис. 7. Фото (сканирующий микроскоп): А – отложение оксида железа, Б – его элементный состав
Время, сутки
А
Б
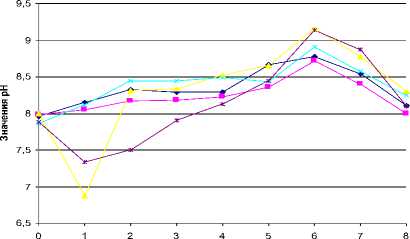
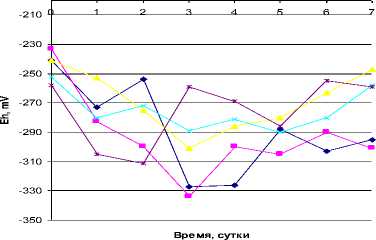
Рис. 8. Кривые роста лабораторного сообщества при различных значениях рН (А) и Eh (Б). Значения 1-5 – нумерация образцов (экспериментов)
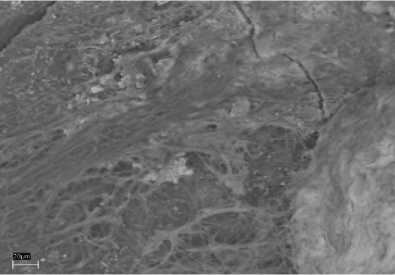
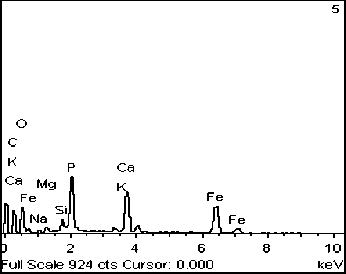
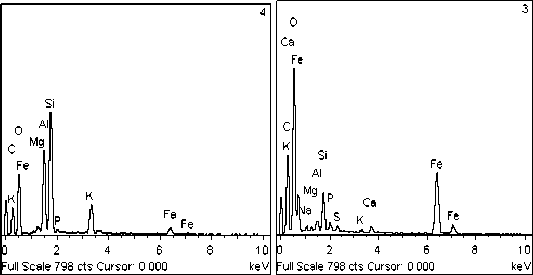
Эксперимент №2 ([Ca2+]=10 мг/дм3, [Mg2+]=3 мг/дм3). В данном сообществе также отлагается фосфат кальция, но уже в меньших количествах (рис. 5А, Б). Обнаружен кварц в виде отечной формы (рис. 5В, Г) и кристаллы оксида железа октаэдрической формы, размеры которого не превышают 5 мкм в длину (рис. 5В, Д). Помимо этих минералов наблюдается отложение карбоната кальция в виде микроскопических выделений неправильной формы (рис. 5Е, Ж).
Эксперимент №3 ([Ca2+]=20 мг/дм3, [Mg2+]=4 мг/дм3). Фосфатов кальция как визуально, так и экспериментально становится меньше. Наблюдается накопление карбоната кальция.
Эксперимент №4 ([Ca2+]=50 мг/дм3, [Mg2+]=10 мг/дм3). При максимальной концентрации кальция в среде наблюдается отложение карбоната кальция с примесями фосфора в достаточном количестве (рис. 6). Отложение других минералов не наблюдалось.
Эксперимент №5 (без содержания в среде Ca и Mg). В данном эксперименте наблюдается отложение оксида железа в виде микроскопических скоплений неопределенной формы из состава среды (рис. 7).
Результаты ежедневных измерений значений рН и Eh в экспериментах показали, что изменение этих параметров существенно влияет на рост и развитие микробных сообществ.
Из рис. 8А видно, что в процессе эксперимента значения рН возрастали. Начальное значение рН во всех экспериментах было примерно одинаковым и составляло 7.9. На 2-е сутки при увеличении рН до 8.1-8.45 начинается рост сообщества. Пик роста приходится на 6-е сутки и рН 8.7–9.2. На 8-е сутки с понижением рН начинается фаза отмирания.
Изменение окислительно-восстановительного потенциала также повлияло на рост лабораторного сообщества (рис. 8Б). Изначально в среде существовала восстановительная реакция (-230 – -260 мВ). При изменении значений данного параметра с -250 до -280 мВ наблюдается начало роста сообщества. Максимум роста наблюдается на 3-е сутки с достижением значений Eh -290 – -330 мВ. Далее с уменьшением восстановительной реакции рост цианобактериального сообщества прекращается.
В результате проведенного исследования было определено отложение минералов в природном и лабораторном мате источника Горячинск. В лабораторном цианобактериальном сообществе по срав- нению с природным минералообразование происходило интенсивнее. Этому способствовали подобранный состав среды, содержание основных элементов и температура культивирования. С увеличением содержания кальция и магния в среде отложение минералов фосфата кальция уменьшается, а карбоната кальция увеличивается. Активный рост лабораторного сообщества наблюдается при щелочных значениях рН и восстановительной реакции среды.


