Минимально инвазивное экстракорпоральное кровообращение у коморбидных больных
Автор: Ревишвили А.Ш., Корнелюк Р.А., Плотников Г.П., Берикашвили Л.Б., Комков И.П., Малышенко Е.С., Земсков В.М., Попов В.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 3 т.27, 2023 года.
Бесплатный доступ
Актуальность. С увеличением выраженности коморбидного фона значимо возрастает риск осложнений искусственного кровообращения. Комплекс повреждающих факторов процедуры запускает системный воспалительный ответ, что в ряде случаев сопровождается поражением органов-мишеней, переводя хронические органные дисфункции в острые. В некоторых исследованиях применения систем минимально инвазивного экстракорпорального кровообращения (англ. Minimal invasive Extra-Corporeal Circulation, MiECC) показано преимущество в сравнении с традиционными экстракорпоральными контурами, но разнообразие минимально инвазивных систем, разнородность пациентов и исходов не позволяют с уверенностью экстраполировать эти данные на возрастных коморбидных пациентов. Цель. Сравнить выраженность системного воспаления и результаты лечения у коморбидных кардиохирургических пациентов, оперированных в условиях искусственного кровообращения с классическим и минимально инвазивным экстракорпоральным контуром. Методы. Ретроспективное когортное исследование 760 пациентов, последовательно получивших в 2019-2022 гг. плановые кардиохирургические вмешательства. Критерии включения: коморбидный статус (индекс коморбидности Чарлсон с поправкой на возраст не менее 6); искусственное кровообращение длительностью не менее 90 мин. Критерии исключения: экстренное оперативное вмешательство, отказ от участия в исследовании. Критериям включения соответствовали 68 пациентов. По методу экстракорпорального кровообращения сформировали две исследуемые группы - с классическим экстракорпоральным контуром (n = 51) и с минимально инвазивным (n = 17). Контрольные точки - до начала искусственного кровообращения и через 24 ч после операции (лактат; креатинин; индекс оксигенации, уровень гемолиза). Для маркеров системного воспалительного ответа - через 1 ч после начала искусственного кровообращения и 24 ч после его окончания (интерлейкин-6; интерлейкин-10; прокальцитонин; С-реактивный белок; растворимая форма триггерного рецептора, экспрессируемого на миелоидных клетках (англ. soluble Triggering Receptor Expressed on Myeloid cells-1, sTREM-1)). Оценивали респираторные, почечные осложнения, дренажную кровопотерю, нарушения системы гемостаза, потребность в симпатомиметиках, длительность пребывания в отделении реанимации и интенсивной терапии и стационаре. Результаты. Группы статистически значимо не различались по гендерно-антропометрическим характеристикам, характеру оперативных вмешательств и основным параметрам перфузии. В группе с классическим экстракорпоральным кровообращением наблюдались значимо более высокие дозы вазоконстрикторной поддержки (норадреналин), а также снижение темпа диуреза, частоты легочного повреждения, повышение уровня лактата и гемолиза. Маркеры системного воспалительного ответа также достоверно выше. Заключение. Применение систем минимально инвазивного экстракорпорального кровообращения по сравнению с классическим искусственным кровообращением существенно не влияет на частоту органных дисфункций, однако уменьшает выраженность системного воспалительного ответа и иммунной супрессии, которые являются триггерными механизмами развития полиорганной недостаточности. Это может быть особенно актуально для пациентов с хроническими органными дисфункциями. Для систем минимально инвазивного экстракорпорального кровообращения, с учетом высокой стоимости и нецелевого воздействия на плейотропные факторы развития системной воспалительной реакции, необходимо определить спектр показаний.
Искусственное кровообращение, коморбидный пациент, минимально инвазивный экстракорпоральный контур
Короткий адрес: https://sciup.org/142239093
IDR: 142239093 | DOI: 10.21688/1681-3472-2023-3-62-73
Текст научной статьи Минимально инвазивное экстракорпоральное кровообращение у коморбидных больных
Цитировать: Ревишвили А.Ш., Корнелюк Р.А., Плотников Г.П., Берикашвили Л.Б., Комков И.П., Малышенко Е.С., Земсков В.М., Попов В.А. Минимально инвазивное экстракорпоральное кровообращение у коморбидных больных. Патология кровообращения и кардиохирургия. 2023;27(3):62-73. https://
А.Ш. Ревишвили, Р.А. Корнелюк, Г.П. Плотников, Л.Б. Берикашвили,
В последние десятилетия наблюдается тенденция снижения смертности при кардиохирургических вмешательствах [1]. Тем не менее по-прежнему могут развиваться осложнения, приводящие к длительной персистирующей полиорганной недостаточности, что во многих случаях связано не только с самой хирургией, но и с исходным морбидным статусом пациентов [2; 3]. С увеличением выраженности коморбидного фона возрастает необходимость в персонифицированном подходе на каждом этапе лечения. В условиях, когда рутинным методом пер-фузиологического сопровождения кардиохирургических операций остается традиционное искусственное кровообращение (ИК), риски осложнений у коморбидных больных значимо возрастают. Это связано с целым комплексом повреждающих факторов, сопровождающих ИК и запускающих системный воспалительный ответ: ишемия – реперфузия, контакт с воздухом и чужеродной неэндотелизиро-ванной поверхностью, травма форменных элементов крови и температурные сдвиги на различных участках экстракорпорального контура [4; 5]. Это, в свою очередь, сопровождается поражением органов-мишеней (например, сердечной, почечной и церебральной недостаточностью), что существенно усугубляет исходный коморбидный статус, переводя хронические органные дисфункции в острые и порой необратимые [6].
Таким образом, применение систем минимально инвазивного экстракорпорального крово- обращения (англ. Minimal invasive Extra-Corporeal Circulation, MiECC) видится очень обнадеживающим. Такие системы представляют собой замкнутый контур с биологически инертными поверхностями, контактирующими с кровью, и уменьшенным объемом первичного заполнения; центрифужным насосом; мембранным оксигенатором и теплообменником; венозной ловушкой для пузырьков; системой кардиоплегии и, опционально, системой для аппаратной аутогемотрансфузии. Гибридные модульные системы MiECC IV типа (интегрирующие резервный венозный резервуар с твердой оболочкой) преодолевают проблемы безопасности и непредвиденные сценарии интраоперационной перфузии, поэтому совместимы практически с любой кардиохирургической операцией. Система MiECC объединяет современные технологии ИК в стратегию, направленную на снижение системного воспалительного ответа и улучшение защиты органов-мишеней во время кардиохирургических операций [7].
В метаанализах показано явное преимущество MiECC по сравнению с традиционным ИК за счет снижения 30-дневной смертности, включая такие осложнения, как инсульт, инфаркт миокарда и почечная дисфункция [8–10]. Однако разнообразие систем MiECC, разнородность пациентов и исходов не позволяют с уверенностью экстраполировать эти данные на возрастных коморбидных больных. Тем не менее потенциальная польза малоинвазивных технологий подчеркивает необходимость исследовать возможности MiECC в улучшении результатов
Дизайн исследования
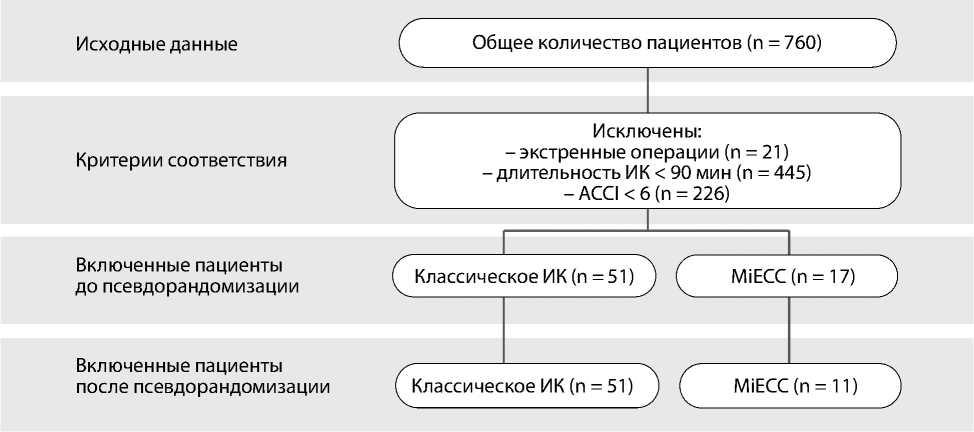
Примечание. ИК — искусственное кровообращение; ACCI — англ. Age-adjusted Charlson Comorbidity Index, индекс коморбидности Чар-лсон с поправкой на возраст; MiECC — англ. Minimal invasive Extra-Corporeal Circulation, минимально инвазивное экстракорпоральное кровообращение.
лечения лиц, подвергшихся кардиохирургическим вмешательствам.
Цель — сравнить результаты лечения, а также выраженность системного воспалительного ответа у коморбидных пациентов, подвергшихся кардиохирургическим операциям в условиях классического ИК и системы минимально инвазивного экстракорпорального кровообращения.
Методы
В ретроспективное когортное исследование, выполненное в рамках научно-исследовательской работы «Разработка минимально инвазивных и гибридных технологий хирургического лечения заболеваний сердца», включены 760 пациентов, последовательно госпитализированных в период 2019–2022 гг. для выполнения плановых кардиохирургических вмешательств. Критерии включения: коморбидный статус (индекс коморбидности Чар-лсон с поправкой на возраст (англ. Age-adjusted Charlson Comorbidity Index, ACCI) ≥ 6) [11; 12]; операция с использованием ИК длительностью ≥ 90 мин. Критерии исключения: экстренное оперативное вмешательство, отказ от участия в исследовании. После первичного анализа медицинской документации критериям включения соответствовали 68 пациентов. После процедуры псевдорандомизации исключили 6 больных (рисунок) .
Все вмешательства выполняла одна операционно-анестезиологическая бригада. Во всех случаях использовали стандартизированное анестезиологическое обеспечение с аналгезией и седацией комбинацией севофлурана и фентанила, миорелаксацией цисатракурия безилатом. По методу экстракорпорального кровообращения пациентов разделили на две исследуемые группы. Первая группа — классическое ИК (группа сравнения (ГС), n = 51), вторая — минимально инвазивное экстракорпоральное кровообращение (MiECC, n = 17). В ГС использовали экстракорпоральный контур с роликовым насосом и первичным заполнением 700 мл полиионного кристаллоидного раствора, 500 мл коллоидного, 200 мл 15% раствора маннитола, 10 000 Ед гепарина; кардиоплегию осуществляли кустодиолом (Dr. F. Koehler Chemie GmbH, Бенсхайм, Германия). В группе MiEСC применяли экстракорпоральный контур III типа с центрифужным насосом и первичным заполнением 500 мл полиионного кристаллоидного раствора, 250 мл коллоидного, 150 мл 15% раствора маннитола, 10 000 Ед гепарина (заполнение венозного резервуара не осуществляли); проводили кардиоплегию кустодиолом. Из соображений безопасности больного предусматривали возможность перехода на контур IV типа с включением в кровообращение твердотельного венозного резервуара.
|
Табл. 1. Клинико-демографическая характеристика |
||||||
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||
|
ГС, n = 51 |
MiEСC, n = 17 |
р |
ГС, n = 51 |
MiEСC, n = 11 |
р |
|
|
Мужской пол, n (%) |
41 (80,4) |
12 (70,6) |
0,5012 |
41 (80,4) |
8 (72,7) |
0,571 |
|
Возраст, лет, |
70 [66,0–72,5] |
70 [66–74] |
0,8006 |
70 [66,0–72,5] |
69 [66–70] |
0,579 |
|
Мe [Q1–Q3] (Min; Max) |
(61; 78) |
(65; 79) |
(61; 78) |
(65; 79) |
||
|
Индекс массы тела, кг/м2 |
29 [23,0–33,5] |
30 [28–34] |
0,3598 |
29 [23,0–33,5] |
30 [28–36] |
0,396 |
|
Мe [Q1–Q3] (Min; Max) |
(15; 46) |
(19; 45) |
(15; 46) |
(19; 39) |
||
|
Функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской ассоциации кардиологов, n (%) |
||||||
|
II |
28 (54,9) |
10 (58,8) |
0,9999 |
28 (54,9) |
8 (72,7) |
0,277 |
|
III |
23 (45,1) |
7 (41,2) |
0,9999 |
23 (45,1) |
3 (27,3) |
0,277 |
|
Коморбидная патология, n (%) |
||||||
|
Индекс коморбидности Чарлсон, |
6 [4–6] |
6 [3–6] |
0,6840 |
6 [4–6] |
6 [3,5–6,0] |
0,5979 |
|
Мe [Q1–Q3] (Min; Max) |
(2; 8) |
(2; 8) |
(2; 8) |
(2; 7) |
||
|
Хроническая болезнь почек не менее 3Б стадии, n (%) |
25 (49) |
7 (41,2) |
0,7797 |
25 (49) |
5 (45,4) |
0,9999 |
|
из них: 3Б стадии |
17 (68) |
5 (71,4) |
0,9999 |
17 (68) |
4 (80) |
0,9999 |
|
4-й стадии |
8 (32) |
2 (28,6) |
0,9999 |
8 (32) |
1 (20) |
0,9999 |
|
Дыхательная недостаточность, n (%) |
30 (58,8) |
12 (70,6) |
0,5654 |
30 (58,8) |
10 (91) |
0,079 |
|
из них: I степени |
9 (30) |
4 (33,3) |
0,7425 |
9 (30) |
2 (20) |
0,540 |
|
II степени |
13 (44,3) |
5 (41,7) |
0,9999 |
13 (43,3) |
5 (50) |
0,714 |
|
III степени |
8 (26,7) |
3 (25) |
0,9999 |
8 (26,7) |
3 (30) |
0,970 |
|
Сахарный диабет, n (%) |
17 (33,3) |
7 (41,1) |
0,5709 |
17 (33,3) |
4 (36,4) |
0,847 |
|
EuroSCORE II, |
5 [4–6] |
5 [4–6] |
0,5091 |
5 [4–6] |
4 [4–6] |
0,700 |
|
Me [Q1–Q3] (Min; Max) |
(2; 8) |
(3; 8) |
(2; 8) |
(3; 6) |
||
Примечание. ГС — группа сравнения с классическим искусственным кровообращением; MiEСС — англ. Minimal invasive ExtraCorporeal Circulation, группа с минимально инвазивным экстракорпоральным контуром.
Для анализа вышеописанных методов экстракорпорального кровообращения исследовали следующие показатели в двух контрольных точках (исходно до начала ИК и через 24 ч после операции): лактат; креатинин; индекс оксигенации (PaO2/FiO2); уровень гемолиза по свободному гемоглобину. Контрольные точки для маркеров системного воспалительного ответа (интерлейкин-6, интерлейкин-10, прокальцитонин, С-реактивный белок, растворимая форма триггерного рецептора, экспрессируемого на миелоидных клетках (англ. soluble Triggering Receptor Expressed on Myeloid cells-1, sTREM-1)) — через 1 ч после начала ИК и 24 ч после его окончания. Оценивали такие клинические данные, как респираторные и почечные осложнения, дренажная кровопотеря в послеоперационном периоде, нарушения системы гемостаза, требующие коррекции и гемотрансфузии, потребность в симпа-томиметиках, длительность пребывания в отделении реанимации и интенсивной терапии и стационаре.
Статистический анализ
Статистический анализ данных осуществляли с помощью программ STATISTICA версии 6 (StatSoft, Inc., Талса, США) и Microsoft Office Excel 2010 (Microsoft, Редмонд, США).
Оценку соответствия нормальному закону распределения проводили с помощью критерия Шапиро – Уилка. Описательная статистика для количественных переменных представлена в виде медианы (Ме) и квартилей первого и третьего порядка (Q1 и Q3), минимальных и максимальных значений. Для сравнения непрерывных переменных с нормальным распределением использовали t-критерий Стьюдента. Для сравнительного анализа частотных характеристик применяли точный критерий Фишера. Межгрупповые сравнения количественных показателей в независимых группах при распределении, отличном от нормального, проводили с использованием U-критерия Манна – Уитни, для зависимых выборок применяли критерий Уилкоксона.
|
Табл. 2. Характер оперативных вмешательств и базовые параметры перфузии |
||||||
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||
|
ГС, n = 51 |
MiEСC, n = 17 |
р |
ГС, n = 51 |
MiEСC, n = 11 |
р |
|
|
Операции, n (%) |
||||||
|
КШ + ПМК + РЧА |
15 (29,4) |
6 (35,3) |
0,7635 |
15 (29,4) |
4 (36,3) |
0,7235 |
|
КШ + ПлМК + РЧА |
16 (31,3) |
3 (17,6) |
0,3590 |
16 (31,3) |
3 (27,3) |
0,9999 |
|
КШ + ПлМК + АЛЖ + РЧА |
3 (5,9) |
1 (5,9) |
0,9999 |
3 (5,9) |
0 |
0,9999 |
|
ПМК + ПАК + РЧА |
11 (21,6) |
1 (5,9) |
0,2692 |
11 (21,6) |
0 |
0,1875 |
|
ПАК + КШ + РЧА |
6 (11,8) |
1 (5,9) |
0,6705 |
6 (11,8) |
1 (9,1) |
0,9999 |
|
КШ + РЧА |
0 |
5 (29,4) |
0,0006 |
0 |
3 (27,3) |
0,0044 |
|
Длительность операции и перфузии, Ме [Q1–Q3] (Min; Max) |
||||||
|
Длительность опера- |
310 [225–340] |
330 [229–340] |
0,4912 |
310 [225–340] |
340 [242,5–350,0] |
0,2572 |
|
ции, мин |
(140; 380) |
(140; 380) |
(140; 380) |
(152; 380) |
||
|
Интраоперационная |
780 [705–850] |
790 [730–830] |
0,7790 |
780 [705–850] |
800 [730–825] |
0,6364 |
|
кровопотеря, мл |
(500; 950) |
(490; 900) |
(500; 950) |
(490; 900) |
||
|
Длительность ИК, мин |
182 [156,0–190,5] (108; 212) |
175 [131–202] (90; 214) |
0,5366 |
182 [156,0–190,5] (108; 212) |
182 [175,0–206,5] (110; 214) |
0,2572 |
|
Длительность пережа- |
142 [112,0–159,5] |
140 [120–162] |
0,9552 |
142 [112,0–159,5] |
140 [132–169] |
0,2980 |
|
тия аорты, мин |
(88; 174) |
(40; 177) |
(88; 174) |
(84; 177) |
||
Примечание. ГС — группа сравнения с классическим искусственным кровообращением; MiEСС — англ. Minimal invasive ExtraCorporeal Circulation, группа с минимально инвазивным экстракорпоральным контуром; КШ — коронарное шунтирование; ПМК — протезирование митрального клапана; РЧА — радиочастотная аблация; ПлМК — пластика митрального клапана; АЛЖ — аневризма левого желудочка; ПАК — протезирование аортального клапана; ИК — искусственное кровообращение.
Табл. 3. Клинические показатели через 24 часа после искусственного кровообращения
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||
|
ГС, n = 51 |
MiEСC, n = 17 |
р |
ГС, n = 51 |
MiEСC, n = 11 |
р |
|
|
Дренажные потери, мл |
310 [250–355] (200; 400) |
310 [290–340] (200; 360) |
0,6943 |
310 [250–355] (200; 400) |
325 [260–350] (200; 360) |
0,817 |
|
Допамин, мкг/кг/мин |
5 [4–7] (2; 12) |
4 [3–5] (3; 7) |
0,0112 |
5 [4–7] (2; 12) |
4 [3–5] (3; 7) |
0,035 |
|
Норадреналин, мкг/кг/мин |
0,05 [0,03–0,09] (0; 0,6) |
0 [0–0,03] (0; 0,05) |
< 0,0001 |
0,05 [0,03–0,09] (0; 0,6) |
0 [0–0,03] (0; 0,05) |
< 0,0001 |
|
Диурез, мл/ч |
60 [50,0–72,5] (35; 120) |
75 [70–95] (60; 115) |
0,0001 |
60 [50,0–72,5] (35; 120) |
90 [70–95] (60; 115) |
0,002 |
Примечание. ГС — группа сравнения с классическим искусственным кровообращением; MiEСС — англ. Minimal invasive Extra-Corporeal Circulation, группа с минимально инвазивным экстракорпоральным контуром. Данные представлены как Мe [Q1–Q3] (Min; Max).
Табл. 4. Маркеры органного повреждения через 24 часа после искусственного кровообращения
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||
|
ГС, n = 51 |
MiEСC, n = 17 |
р |
ГС, n = 51 |
MiEСC, n = 11 |
р |
|
|
Индекс оксигенации |
190 [168–227] (131; 312) |
300 [276–330] (253; 360) |
< 0,0001 |
190 [168–227] (131; 312) |
296 [276–330] (253; 360) |
< 0,0001 |
|
Креатинин, ммоль/л |
149 [130,0–184,5] (102; 310) |
134 [129–154] (102; 256) |
0,1457 |
149 [130,0–184,5] (102; 310) |
142 [118–168] (102; 256) |
0,386 |
|
Лактат, ммоль/л |
3 [2,25–3,75] (1,0; 6,2) |
1,5 [1,2–2,2] (0,5; 3,2) |
< 0,0001 |
3 [2,25–3,75] (1,0; 6,2) |
1,5 [1,2–2,2] (0,5; 3,2) |
< 0,0001 |
|
Свободный гемоглобин, г/л |
2,2 [1,15–3,10] (0,5; 5,2) |
0,9 [0,85–1,10] (0,55; 1,30) |
< 0,0001 |
2,2 [1,15–3,10] (0,5; 5,2) |
0,5 [0,3–0,9] (0,05; 1,00) |
< 0,0001 |
Примечание. ГС — группа сравнения с классическим искусственным кровообращением; MiEСС — англ. Minimal invasive Extra-Corporeal Circulation, группа с минимально инвазивным экстракорпоральным контуром. Данные представлены как Мe [Q1–Q3] (Min; Max).
Критический уровень значимости был установлен на уровне 0,05.
Учитывая возможность влияния конфаундеров, характерную для нерандомизированных исследований, провели псевдорандомизацию (англ. propensity score matching). Для расчета индексов склонности (англ. propensity scores) использовали логистическую регрессию (учитываемые конфаун-деры — пол, возраст, индекс массы тела, показатель по шкале EuroSCORE II, длительность ИК, объем интраоперационной кровопотери, длительность операции, время пережатия аорты), для сопоставления пациентов применяли метод k-ближайших соседей (допуск на совпадение 0,005). Проверили сбалансированность ковариаций в группах внутри страт по индексам склонности, используя стандартизованные разности и графики распределения индексов склонности. Для проведения псевдорандомизации использовали программу SPSS Statistics версии 27.0 (IBM, Армонк, США).
Результаты
При сравнительном анализе исходных характеристик пациентов не выявили статистически значимых различий (табл. 1).
При сравнении видов оперативных вмешательств не наблюдалось существенных межгрупповых различий, по основным параметрам перфузии — продолжительности ИК, длительности пережатия аорты, объему кровопотери — группы также сопоставимы (табл. 2).
Послеоперационная кровопотеря статистически значимо не различалась между исследуемыми группами. В ГС наблюдались достоверно более высокие дозы инотропной и вазоконстрикторной поддержки, причем наиболее выраженные различия фиксировали при использовании норадреналина. Межгрупповое сравнение темпа диуреза демонстрирует достоверные различия при сопоставимых дозировках стимуляции фуросемидом (табл. 3).
Легочное повреждение, оцениваемое по индексу оксигенации, развивалось реже в группе MiECC. Креатинин, как маркер почечного повреждения, не показал достоверных различий между группами. Уровень лактата, косвенно определяющий адекватность баланса доставка/потребление кислорода, был значимо ниже в группе MiECC. Уровень свободного гемоглобина, указывающего на гемолиз, достоверно выше в группе сравнения (табл. 4).
Провоспалительный интерлейкин-6 был достоверно выше относительно исходных значений в обеих группах. Межгрупповое сравнение не показало различий в двух контрольных точках для этого показателя. В свою очередь, противовоспалительный интерлейкин-10 значимо снижался ко второй контрольной точке в ГС, тогда как в группе MiECC его значения не менялись. Межгрупповое сравнение уровней интерлейкина-10 также демонстрирует достоверную разницу спустя 24 ч после ИК. Уровень лейкоцитов, С-реактивного белка, прокальцитонина и sTREM-1 были значимо выше исходных значений в ГС. В группе MiECC достоверно изменялся только уровень прокальцитонина. При этом межгрупповая разница спустя 24 ч после оперативного вмешательства наблюдалась по уровням лейкоцитов и sTREM-1 (табл. 5).
Потребность в мультиорганной поддержке (заместительной почечной терапии и экстракорпоральной мембранной оксигенации) достоверно не различалась между группами. В группе MiECC наблюдались меньшие продолжительность искусственной вентиляции легких и длительность пребывания в отделении реанимации и интенсивной терапии, меньший срок пребывания в стационаре. Сравнение госпитальной летальности различий не показало (табл. 6).
Обсуждение
Цель экстракорпорального кровообращения — поддержание гомеостаза во время операций на сердце, что с успехом выполняется по ряду базовых физиологических параметров. Вместе с тем ИК оказывает и повреждающее действие на различные ткани и системы организма за счет ряда патофизиологических механизмов. Причем с увеличением длительности перфузии растет частота органных дисфункций и геморрагических осложнений. Критическим значением, по мнению ряда авторов, является длительность ИК > 90 мин [13–15]. Таким образом, представленная нами выборка больных репрезентативна по длительности экстракорпорального кровообращения.
В ранних работах описано повышение смертности у лиц с коморбидной патологией после кардиохирургических операций [16; 17]. C.W. Mullan и соавт. в многоцентровом ретроспективном исследовании показали, что в Соединенных Штатах Америки за 10-летний период наблюдения (2005–2014 гг.) возросло количество пациентов с коморбидной патологией, которые были подвергнуты кардиохирургическим вмешательствам. Однако смертность за это же время снизилась, что, возможно, связано как с более ранней диагностикой и улучшением хирургических технологий, так и с популяционными изменениями, что требует новых исследований на современных когортах [18]. В настоящее время
Табл. 5. Концентрация маркеров системного воспаления
|
Показатель |
До псевдорандомизации |
После псевдорандомизации |
||||
|
ГС, n = 51 |
MiEСC, n = 17 |
р |
ГС, n = 51 |
MiEСC, n = 11 |
р |
|
|
Интерлейкин-6, пг/мл |
||||||
|
15,2 |
16,2 |
15,2 |
16,2 |
|||
|
а — 1 ч после ИК |
[11,20–19,75] |
[12,0–19,8] |
0,8044 |
[11,20–19,75] |
[12,1–19,8] |
0,934 |
|
(6,75; 27,30) |
(7,45; 24,40) |
(6,75; 27,30) |
(7,45; 21,70) |
|||
|
32,7 |
27,7 |
32,7 |
27,7 |
|||
|
б — 24 ч |
[29,15–47,70] |
[25,3–41,5] |
0,0920 |
[29,15–47,70] |
[25,3–41,6] |
0,085 |
|
(18,6; 121,2) |
(18,3; 52,1) |
(18,6; 121,2) |
(24,2; 52,1) |
|||
|
р а/б |
< 0,0001 |
< 0,0001 |
< 0,0001 |
0,003 |
||
|
Интерлейкин-10, пг/мл |
||||||
|
10,5 |
10,6 |
10,5 |
10,6 |
|||
|
а — 1 ч после ИК |
[7,95–12,75] |
[6,9–12,6] |
0,8023 |
[7,95–12,75] |
[5,8–15,2] |
0,883 |
|
(3,6; 18,2) |
(3,9; 18,2) |
(3,6; 18,2) |
(3,9; 18,2) |
|||
|
6,9 |
10,2 |
6,9 |
10,2 |
|||
|
б — 24 ч |
[5,100–10,175] |
[8,4–12,3] |
0,0122 |
[5,100–10,175] |
[6,3–12,3] |
0,042 |
|
(2,5; 18,2) |
(5,4; 18,9) |
(2,5; 18,2) |
(5,4; 15,1) |
|||
|
р а/б |
< 0,0001 |
0,9079 |
< 0,0001 |
0,593 |
||
|
Лейкоциты, × 109 |
||||||
|
10,4 |
8,8 |
10,4 |
9,2 |
|||
|
а — 1 ч после ИК |
[9,10–12,75] |
[8,3–9,7] |
0,0063 |
[9,10–12,75] |
[8,3–10,1] |
0,049 |
|
(6,9; 19,1) |
(5,9; 12,4) |
(6,9; 19,1) |
(5,4; 15,1) |
|||
|
12,8 |
8,9 |
12,8 |
9,4 |
|||
|
б — 24 ч |
[10,45–15,65] |
[8,3–10,1] |
< 0,0001 |
[10,45–15,65] |
[7,2–10,2] |
< 0,0001 |
|
(8,8; 22,5) |
(6,6; 12,1) |
(8,8; 22,5) |
(6,6; 12,1) |
|||
|
р а/б |
< 0,0001 |
0,5538 |
< 0,0001 |
0,929 |
||
|
Прокальцитонин, нг/мл |
||||||
|
0,2 |
0,3 |
0,2 |
0,3 |
|||
|
а — 1 ч после ИК |
[0,10–0,75] |
[0,15–1,10] |
0,3178 |
[0,10–0,75] |
[0,15–1,15] |
0,226 |
|
(0,03; 1,40) |
(0,1; 1,3) |
(0,03; 1,40) |
(0,1; 1,3) |
|||
|
1,45 |
1 |
1,45 |
1,1 |
|||
|
б — 24 ч |
[0,9–1,9] |
[0,65–1,75] |
0,1733 |
[0,9–1,9] |
[0,8–2,1] |
0,832 |
|
(0,2; 2,9) |
(0,1; 2,5) |
(0,2; 2,9) |
(0,5; 2,5) |
|||
|
р а/б |
< 0,0001 |
0,0003 |
< 0,0001 |
0,003 |
||
|
С-реактивный белок, мг/л |
||||||
|
5,6 |
5,5 |
5,6 |
7,2 |
|||
|
а — 1 ч после ИК |
[3,9–9,2] |
[4,1–8,4] |
0,9218 |
[3,9–9,2] |
[4,1–10,2] |
0,543 |
|
(2,9; 14,8) |
(2,9; 12,1) |
(2,9; 14,8) |
(3,5; 12,1) |
|||
|
7,8 |
7,5 |
7,8 |
7,8 |
|||
|
б — 24 ч |
[6,00–11,35] |
[4,9–10,6] |
0,4203 |
[6,00–11,35] |
[4,9–11,2] |
0,912 |
|
(3,3; 16,4) |
(3,9; 18,3) |
(3,3; 16,4) |
(3,9; 18,3) |
|||
|
р а/б |
< 0,0001 |
0,2659 |
< 0,0001 |
0,213 |
||
|
sTREM-1, |
пг/мл |
|||||
|
176 |
155 |
176 |
134 |
|||
|
а — 1 ч после ИК |
[154,5–198,0] |
[129–182] |
0,0191 |
[154,5–198,0] |
[114–164] |
0,003 |
|
(115; 405) |
(112; 211) |
(115; 405) |
(112; 182) |
|||
|
184 |
131 |
184 |
131 |
|||
|
б — 24 ч |
[159,0–213,5] |
[120–156] |
< 0,0001 |
[159,0–213,5] |
[120–148] |
< 0,0001 |
|
(118; 335) |
(107,3; 172,0) |
(118; 335) |
(107,3; 172,0) |
|||
|
р а/б |
< 0,0001 |
0,0132 |
< 0,0001 |
0,266 |
||
Список литературы Минимально инвазивное экстракорпоральное кровообращение у коморбидных больных
- Anastasiadis K., Argiriadou H., Deliopoulos A., Antonitsis P. Minimal invasive extracorporeal circulation (MiECC): the state-of-the-art in perfusion. J Thorac Dis. 2019;11(Suppl 10):S1507-S1514. PMID: 31293801; PMCID: PMC6586580. https://doi. org/10.21037/itd.2019.01.66
- Соколова Н.Ю., Голухова Е.З. Коморбидность в прогнозировании отдаленных результатов реваскуляризации миокарда у больных ишемической болезнью сердца. Кардиология и сердечно-сосудистая хирургия. 2018;11(5):22-27. https://doi.org/10.17116/kardio20181105122 Sokolova N.Yu., Golukhova E.Z. Comorbidity in predicting the long-term outcomes of myocardial revascularization in patients with coronary artery disease. Kardiologiya i serdechno-sosudistaya khirurgiya = Russian Journal of Cardiology and Cardiovascular Surgery. 2018;11(5):22-27. (In Russ.) https://doi. org/10.17116/kardio20181105122
- Барбараш О.Л., Cеменов В.Ю., Cамородская И.В., Евсеева М.В., Рожков Н.А., Cумин А.Н., Барбараш Л.С Коморбидная патология у больных ишемической болезнью сердца при коронарном шунтировании: опыт двух кардиохирургических центров. Российский кардиологический журнал. 2017;(3):6-13. https://doi.org/10.15829/1560-4071-2017-3-6-13 Barbarash O.L., Semjonov V.Yu., Samorodskaya I.V., Evseeva M.V., Rozhkov N.A., Sumin A.N., Barbarash L.S. Comorbidity in coronary heart disease patients undergoing bypass grafting: an experience of two surgery centers. Russian Journal of Cardiology. 2017;(3):6-13. (In Russ.) https://doi. org/10.15829/1560-4071-2017-3-6-13
- Yellon D.M., Hausenloy D.J. Myocardial reperfusion injury. N Engl J Med. 2007;357(11):1121-1135. PMID: 17855673. https://doi.org/10.1056/NEJMra071667
- Day J.R.S., Taylor K.M. The systemic inflammatory response syndrome and cardiopulmonary bypass. Int J Surg. 2005;3(2):129-140. PMID: 17462274. https://doi.org/10.1016/i. iisu.2005.04.002
- Angelini G.D., Reeves B.C., Evans J., COMICS investigators. 17. Conventional versus minimally invasive extracorporeal circulation in patients undergoing cardiac surgery: protocol for a randomised controlled trial (COMICS). Perfusion. 2021;36(4):388-394. PMID: 32781894; PMCID: PMC8167910. https://doi.org/10.1177/0267659120946731
- Anastasiadis K., Murkin J., Antonitsis P., Bauer A., Ranucci M., Gygax E., Schaarschmidt J., Fromes Y., Philipp A., Eberle B., Punjabi P., Argiriadou H., Kadner A., Jenni H., Albrecht G., van Boven W., Liebold A., de Somer F., Hausmann H., De-liopoulos A., El-Essawi A., Mazzei V., Biancari F., Fernandez A., Weerwind P., Puehler T., Serrick C., Waanders F., Gunaydin S., Ohri S., Gummert J., Angelini G., Falk V., Carrel T. Use of minimal invasive extracorporeal circulation in cardiac surgery: principles, definitions and potential benefits. A position paper from the Minimal invasive Extra-Corporeal Technologies international Society (MiECTiS). Interact Cardiovasc Thorac Surg. 2016;22(5):647-662. PMID: 26819269; PMCID: PMC4892134. https://doi.org/10.1093/icvts/ivv380
- Biancari F., Rimpilainen R. Meta-analysis of randomised trials comparing the effectiveness of miniaturised versus conventional cardiopulmonary bypass in adult cardiac surgery. Heart. 2009;95(12):964-969. PMID: 19342377. https:// doi.org/10.1136/hrt.2008.158709
- Benedetto U., Ng C., Frati G., Biondi-Zoccai G., Vitulli P., Zeinah M., Raja S.G.; Cardiac Outcomes METa-analysis (COMET) group. Miniaturized extracorporeal circulation versus offpump coronary artery bypass grafting: a meta-analysis of randomized controlled trials. Int J Surg. 2015;14:96-104. PMID: 25560750. https://doi.org/10.1016/_i.ijsu.2014.12.021
- Kowalewski M., Pawliszak W., Kotodziejczak M., Navarese E.P., Anisimowicz L. 30-day mortality reduction with miniaturized extracorporeal circulation as compared to conventional cardiopulmonary bypass for coronary revascularization. Meta-analy-sis of randomized controlled trials. Int J Cardiol. 2015;198:63-65. PMID: 26151717. https://doi.org/10.10167j.ijcard.2015.06.153
- Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373-383. PMID: 3558716. https://doi. org/10.1016/0021-9681(87)90171-8
- Charlson M., Szatrowski T.P., Peterson J., Gold J. Validation of a combined comorbidity index. J Clin Epidemiol. 1994;47(11):1245-1251. PMID: 7722560. https://doi. org/10.1016/0895-4356(94)90129-5
- Belov A., Katkov K., Vinokurov I.A., Stonogin K., Komarov D. Cardiopulmonary bypass duration as predictor of immediate results after cardiac surgery. Khirurgiia (Mosk). 2015;(5):4-13. (Engl., Russ.) https://doi.org/10.17116/hirurgia201554-13
- Salis S., Mazzanti V.V., Merli G., Salvi L., Tedesco C.C., Veglia F., Sisillo E. Cardiopulmonary bypass duration is an independent predictor of morbidity and mortality after cardiac surgery. J Cardiothorac Vasc Anesth. 2008;22(6):814-822. PMID: 18948034. https://doi.org/10.1053/Mvca.2008.08.004
- Adamik B., Kubler A., Gozdzik A., Gozdzik W. Prolonged cardiopulmonary bypass is a risk factor for intestinal ischaemic damage and endotoxaemia. Heart Lung Circ. 2017;26(7):717-723. PMID: 27956161. https://doi.org/10.1016/i.hlc.2016.10.012
- Clough R.A., Leavitt B.J., Morton J.R., Plume S.K., Hernandez F., Nugent W., Lahey S.J., Ross C.S., O'Connor G.T. The effect of comorbid illness on mortality outcomes in cardiac surgery. Arch Surg. 2002;137(4):428-432; discussion 432-433. PMID: 11926947. https://doi.org/10.1001/archsurg.137A428
- Scrutinio D., Giannuzzi P. Comorbidity in patients undergoing coronary artery bypass graft surgery: impact on outcome and implications for cardiac rehabilitation. Eur J Cardiovasc Prev Rehabil. 2008;15(4):379-385. PMID: 18677160. https://doi. org/10.1097/HJR.0b013e3282fd5c6f
- Mullan C.W., Mori M., Pichert M.D., Bin Mahmood S.U., Yousef S., Geirsson A. United States national trends in comorbidity and outcomes of adult cardiac surgery patients. J Card Surg. 2020;35(9):2248-2253. PMID: 33448476. https:// doi.org/10.1111/jocs.14764
- Dessai S.B., Fasal R., Dipin J., Adarsh D., Balasubramanian S. Age-adjusted Charlson comorbidity index and 30-day morbidity in pelvic surgeries. South Asian J Cancer. 2018;7(4):240-243. PMID: 30430092; PMCID: PMC6190402. https://doi.org/10.4103/sajc.sajc 241 17
- Qu W.-F., Zhou P.-Y., Liu W.-R., Tian M.-X., Jin L., Jiang X.-F., Wang H., Tao C.-Y., Fang Y., Zhou Y.-F., Song S.-S., Ding Z.-B., Peng Y.-F., Dai Z., Qiu S.-J., Zhou J., Fan J., Tang Z., Shi Y.-H. Age-adjusted Charlson Comorbidity Index predicts survival in intrahepatic cholangiocarcinoma patients after curative resection. Ann Transl Med. 2020;8(7):487. PMID: 32395531; PMCID: PMC7210176. https://doi.org/10.21037/ atm.2020.03.23
- Minol J.-P., Dimitrova V., Petrov G., Langner R., Boeken U., Rellecke P., Aubin H., Kamiya H., Sixt S., Huhn R., Sugimura Y., Albert A., Lichtenberg A., Akhyari P. The age-adjusted Charlson comorbidity index in minimally invasive mitral valve surgery. Eur J Cardiothorac Surg. 2019;56(6):1124-1130. PMID: 31501891. https://doi.org/10.1093/ejcts/ezz240
- Coyan G.N., Chin H., Shah A., Miguelino A.M., Wang Y., Kilic A., Sultan I., Sciortino C.M., Chu D. Charlson comorbidity index is associated with longer-term mortality and re-admissions following coronary artery bypass grafting. J Surg Res. 2022;275:300-307. PMID: 35313139. https://doi.org/10.1016/j. jss.2022.02.012
- Argiriadou H., Antonitsis P., Gkiouliava A., Papapostolou E., Deliopoulos A., Anastasiadis K. Minimal invasive extracorporeal circulation preserves coagulation integrity. Perfusion. 2022;37(3):257-265. PMID: 33637025. https://doi. org/10.1177/0267659121998544
- Modrau I.S., Halle D.R., Nielsen P.H., Kimose H.H., Greisen J.R., Kremke M., Hvas A.-M. Impact of minimally invasive extracorporeal circulation on coagulation — a randomized trial. Eur J Cardiothorac Surg. 2020;57(6):1145-1153. PMID: 32011717; PMCID: PMC7239600. https://doi.org/10.1093/ejcts/ezaa010
- Anastasiadis K., Asteriou C., Antonitsis P., Argiriadou H., Grosomanidis V., Kyparissa M., Deliopoulos A., Konstantinou D., Tossios P. Enhanced recovery after elective coronary revascularization surgery with minimal versus conventional extracorporeal circulation: a prospective randomized study. J Cardiothorac Vasc Anesth. 2013;27(5):859-864. PMID: 23791499. https://doi.org/10.1053/jjvca.2013.01.010
- Bauer A., Diez C., Schubel J., El-Shouki N., Metz D., Eberle T., Hausmann H. Evaluation of hemodynamic and regional tissue perfusion effects of minimized extracorporeal circulation (MECC). J Extra Corpor Technol. 2010;42(1):30-39. PMID: 20437789; PMCID: PMC4680062.
- Huybregts R.A.J.M., Morariu A.M., Rakhorst G., Spiegelenberg S.R., Romijn H.W.A., de Vroege R., van Oeveren W. Attenuated renal and intestinal injury after use of a mini-cardiopulmonary bypass system. Ann Thorac Surg. 2007;83(5):1760-1766. PMID: 17462395. https://doi. org/10.1016/j.athoracsur.2007.02.016
- Immer F.F., Pirovino C., Gygax E., Englberger L., Tevaearai H., Carrel T.P. Minimal versus conventional cardiopulmonary bypass: assessment of intraoperative myocardial damage in coronary bypass surgery. Eur J Cardiothorac Surg. 2005;28(5):701 -704. PMID: 16221550. https://doi. org/10.1016/j.ejcts.2005.08.019
- Григорьев Е.В., Шукевич Д.Л., Матвеева В.Г., Пугачев С.В., Каменева Е.А., Корнелюк Р.А. Миелоидные супрессорные клетки в патогенезе критических состояний. Патология кровообращения и кардиохирургия. 2016;20(3):20-25. https://doi.org/10.21688/1681-3472-2016-3-20-25 Grigoryev E.V., Shukevich D.L., Matveeva V.G., Pugachev S.V., Kameneva E.A., Kornelyuk R.A. Myeloid suppressor cells in the pathogenesis of critical states. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2016;20(3):20-25. (In Russ.) https://doi.org/10.21688-1681-3472-2016-3-20-25
- Матвеева В.Г., Ханова М.Ю., Ивкин А.А., Корнелюк Р.А., Григорьев Е.В. Иммуносупрессорный профиль пациентов, оперированных по поводу приобретенных пороков сердца в условиях искусственного кровообращения. Вестник интенсивной терапии имени А.И. Салтанова. 2020;(3):74-87. https://doi. org/10.21320/1818-474X-2020-3-74-87 Matveeva V.G., Khanova M.Yu., Ivkin A.A., Kornelyuk R.A., Grigoryev E.V. Immunosuppressive profile of patients operated for acquired heart diseases under artificial circulation. A prospective study. Annals of Critical Care. 2020;(3):74-87. (In Russ.) https://doi.org/10.21320/1818-474X-2020-3-74-87


