Миокард и COVID-19
Автор: Эргашева Зумрад Абдукаюмовна
Журнал: Re-health journal @re-health
Рубрика: Внутренние болезни
Статья в выпуске: 1-1 (17), 2023 года.
Бесплатный доступ
Поскольку новый коронавирус SARS-CoV-2 поражает ряд жизненно важных органов (легкие, сердце, мозг, почки, кишечник, печень), в настоящее время COVID-19 рассматривается как системное заболевание. Вирус SARS-CoV-2 проникает в клетки сердца с использованием общего механизма, включающего мембранный белок «ангиотензинпревращающий фермент 2» (AПФ2). Установлено, что AПФ2 экспрессируется в различных тканях с одними из самых высоких уровней в легких и сердце. AПФ2 превращает ангиотензин I и ангиотензин II в вазодилататоры ангиотензин 1–9 и ангиотензин 1–7 соответственно, что создает противодействие вазоконстрикторному эффекту ангиотензина II.
COVID-19, SARS-CoV-2, сердечно-сосудистые заболевания, аритмии сердца, острые коронарные синдромы, острая сердечная недостаточность, миокардит
Короткий адрес: https://sciup.org/14127491
IDR: 14127491
Текст научной статьи Миокард и COVID-19
Введение. Установлено, что АПФ2 экспрессируется в различных тканях с одними из самых высоких уровней в легких и сердце. AПФ2 превращает ангиотензин I и ангиотензин II в вазодилататоры ангиотензин 1–9 и ангиотензин 1–7 соответственно, что создает противодействие вазоконстрикторному эффекту ангиотензина II. В результате АПФ2 обеспечивает снижение активности ренин-ангиотензиновой системы, играя важную роль в регуляции артериального давления. Ключевым фактором проникновения SARS-CoV-2 в клетки хозяина является белок S (spike), который отвечает за связывание вируса c AПФ2 и слияние с клеткой. Предварительно белок S должен быть расщеплен протеазой клетки-хозяина — трансмембранной сериновой протеазой 2-го типа. Непосредственно после связывания SARSCoV-2 с АПФ2 и проникновения в клетку-хозяина происходит подавление AПФ2 с последующим снижением деградации ангиотензина II, мощного вазоконстриктора, фактора повреждения эндотелия и дисфункции миокарда. Вследствие повышения уровня циркулирующего ангиотензина II происходит его активное связывание с рецепторами ангиотензина II типа 1, что наряду с активацией симпатической нервной системы способствует выраженной вазоконстрикции и повреждению легких, нередко приводя к развитию острого респираторного дистресс-синдрома. АПФ2 может ограничивать нежелательные эффекты ангиотензина II путем преобразования его в ангиотензин 1–7, оказывающий сосудорасширяющее, противовоспалительное, антиоксидантное и антифибротическое действие. Повышение функции AПФ2 способствует ограничению ремоделирования и восстановлению после инфаркта миокарда, улучшает диастолическую функцию левого желудочка за счет уменьшения окислительного стресса, фиброза и гипертрофии миокарда. Между тем клинические наблюдения показывают, что активация противовоспалительного влияния AПФ2 в ответ на провоспалительные стимулы при инфекции SARS-CoV-2 обычно не способна противодействовать усилению воспаления и неблагоприятным кардиореспираторным эффектам, вероятно, из-за блокирования AПФ2 вирусом [7].
Патогенез повреждения миокарда. В настоящее время рассматривается несколько патофизиологических механизмов повреждения миокарда при COVID-19 (рис. 1) [16].
-
1. Непосредственное воздействие коронавируса на кардиомиоциты, благодаря его возможности связываться с рецепторами АСЕ-2 клеток сердечной мышцы.
-
2. Повреждение сердечной мышцы в условиях генерализованного воспаления, которое развивается при COVID-19.
-
3. Гипоксия миокарда в условиях системного воспаления и недостаточной оксигенации
-
4. Электролитный дисбаланс, нередко возникающий при генерализованной воспалительной реакции.
-
5. Нарушения коронарного кровотока.
-
6. Ятрогенные повреждения сердечно-сосудистой системы. Различные противовирусные препараты, глюкокортикостероиды и другие лекарственные препараты, а также методы лечения, направленные на лечение COVID-19, также могут оказывать повреждающее воздействие на миокард [14].
крови.
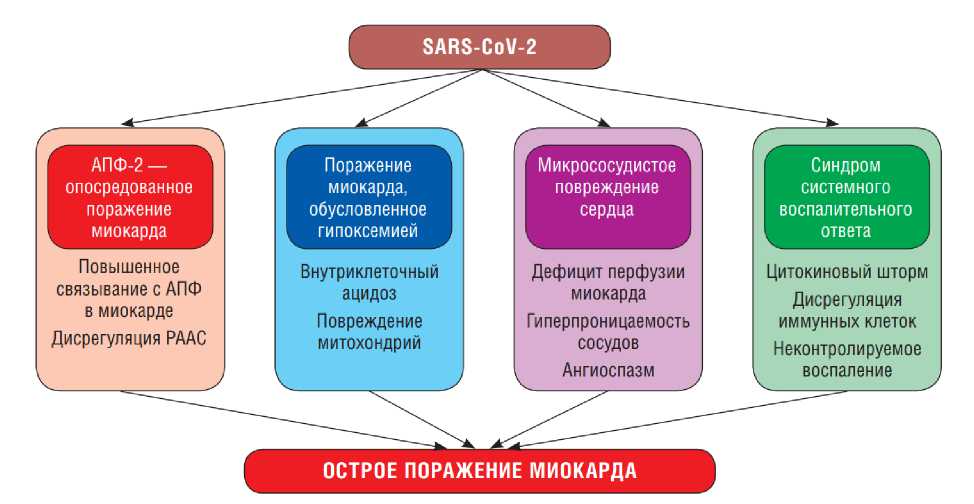
Рис. 1. Возможная схема различных механизмов поражения миокарда при SARS-CoV-2 [16].
Точный патофизиологический механизм повреждения миокарда и трансформации в фульминантном миокардите (ФМ) при SARS-CoV-2 не совсем ясен. При этом не менее чем у 35% пациентов с тяжелым ОРДС в миокарде был обнаружен положительный геном SARS-
CoV, что не исключает вероятность прямого повреждения кардиомиоцитов аналогичным вирусом SARS-CoV-2 и имеет тот же механизм, что и при SARS-CоV, так как они гомологичны по геному. Внедрение вирусной частицы, обладающей тропностью к миокарду, в клетку-мишень — это, очевидно, прямое цитопатогенное действие вируса на кардиомиоциты с включением неспецифических механизмов противовирусной защиты, реализуемых макрофагами и NK-клетками, которое является ведущим фактором повреждения миокарда в острой фазе заболевания. В кардиомиоцитах происходит репликация вирусов, миоцитолиз и активируется синтез микро-РНК (мРНК), что сопровождается развитием гипоксии, апоптоза, гибернации с развитием систолической и диастолической дисфункции [10].
В другом исследовании сообщается, что SARS-CoV может вызвать нестабильность коронарной бляшки и привести к острому коронарному синдрому (ОКС). У пациентов с COVID-19 повышение уровня интерлейкина-6 и D-димера указывало на усиление системного воспаления и реакции коагуляции, оба из которых связаны с нестабильностью бляшек, возникновением ОКС и его осложнений. Среди умерших от COVID-19, о которых доложила Национальная комиссия здравоохранения Китая, у 11,8% больных без сердечнососудистой патологии отмечалось повреждение сердечной мышцы с повышением тропонина I, а также имели место фатальные аритмии. Вероятнее всего, поражение миокарда у таких пациентов обусловлено системным воспалительным ответом и нарушениями в функционировании иммунной системы при прогрессировании заболевания. Предполагается, что в механизме острого повреждения миокарда, вызванного SARS-CoV-2, одну из ключевых ролей играет АПФ-2, который экспрессируется не только в легких, но и в сердечно-сосудистой системе, в частности в сердце. На рис. 2 схематично отображены пути воздействия на сердечно-сосудистую систему SARS-CoV-2 при проникновении в организм инфицированного [16].
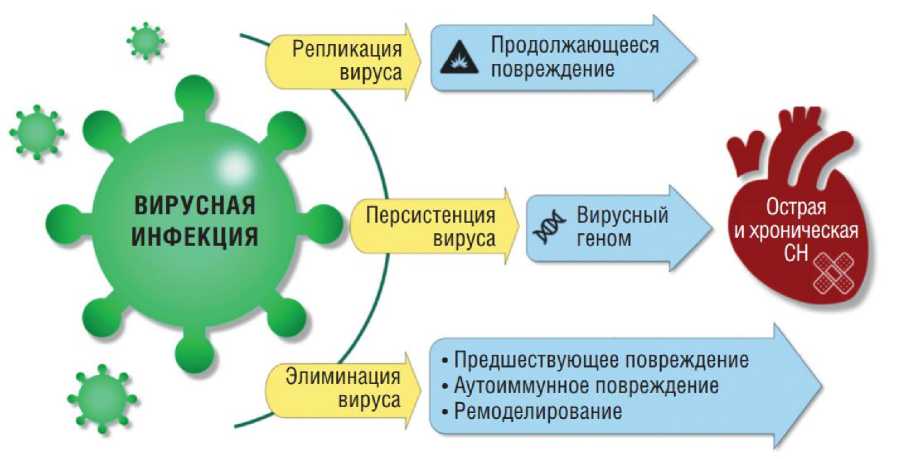
Рис. 2. Схема путей воздействия на сердечно-сосудистую систему SARS-CoV-2 при проникновении в организм инфицированного [16].
Различные патогенетические механизмы поражения сердца при COVID-19 изображены на рис. 3.
Уровень вирусной нагрузки
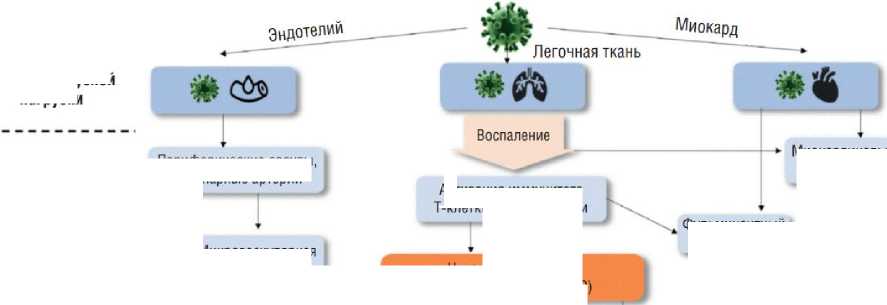
Миокардинальное повреждение
Фульминантный миокардит
Микроваскулярная дисфункция
Уровень клеточных патогенетических изменений
Цитокиновый шторм (IL-6JL7, IL 22, CXCL1O)
Периферические сосуды, коронарные артерии
Активация иммунитета
Т-кпетки Макрофаги
Микроваскулярная эндотелиальная дисфункция
Нестабильность (эрозия, разрыв) атеросклеротической бляшки
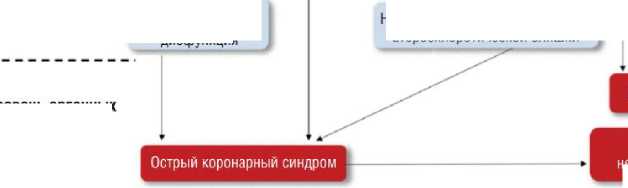
Миокардит
Сердечная недостаточность
Уровень органных поражений
Дисфункция миокарда
Фатальная аритмия
Рис. 3. Внезапная сердечная смерть и фатальные аритмии при инфицировании SARS-CoV-2 [16].
Микроскопические изменения миокарда при COVID-19. Результаты субмикроскопического исследования ткани миокарда умерших от COVID-19 показали, что патоморфологические изменения в виде дисциркуляторных, дистрофических и дисрегенераторных процессов отмечались как в строма-сосудистых, так и паренхиматозных тканевых компонентах миокарда. Микрососуды интерстиция миокарда были несколько расширенными, эритроциты в просвете находятся в деформированном виде. В составе плазмы появляются осмиофильные частицы. Отмечается утолщение эндотелия за счет гипертрофии и гиперхромазии ядра, отека и гиперплазии органелл цитоплазмы.
Отмечается усиленная концентрация микровезикул подклеточной мембраны с увеличением их осмиофильности, что свидетельствует о повышении активности эндотелиальных клеток в отношении вирусной инфекции. Также, отмечается утолщение базальной мембраны за счет накопления в ней осмиофильного вещества. Со стороны периваскулярно расположенных кардиомиоцитов наблюдается расширение матрикса прилежащей к сосудам части саркоплазмы и увеличение количества в ней осмиофильных везикул и зерен. В отдельных случаях в миокарде умерших от COVID-19 обнаружены вирусные частицы, которые находились в основном в интерстиции миокарда, в составе межклеточного вещества в виде умеренно осмиофильных округлой формы частиц. Они находились в функционально пассивной форме или на поверхности вирусных частиц отсутствовали микроворсинки, являющиеся активными рецепторами.
При этом, волокнистые структуры интерстиция были подвергнуты дистрофическим и деструктивным изменениям в виде распада, гомогенизации и повышения осмиофильности фибриллярных структур. В некоторых микрососудах миокарда отмечается формирование тромбов. На электроннограмме представлен капиллярный сосуд, в просвете которого сконцентрированы тромбоциты, фрагменты клазматозных частиц, в центре просвета сосуда умеренно осмиофильная масса за счет сгущения плазменных белков, по периферии сформированы фибриллярные и везикулярные образования фибрина, которые прикрепляются к стенке капилляра. При этом эндотелий стенки капилляра полностью разрушен, лишь у базальной мембраны определяются остатки цитоплазмы. Базальная мембрана утолщена, осмиофильная, местами прервана и сливается с межклеточным веществом интерстиция миокарда. В окружности капилляра соединительнотканные структуры полностью разрушены, фрагментированы и превращены в бесформенные осмиофильные структуры.
Изучение морфологических изменений кардиомиоцитов показало развитие отечных, дистрофических, деструктивных изменений, причем эти изменения наблюдались как в ультраструктурных элементов саркоплазмы, так и саркомерах. В межкардиоцитарном и межмиофибриллярном пространстве саркоплазма отечная, ультраструктурные элементы её фрагментированы и деструктурированы за счет нарушения метаболизма их компонентов. В межмиофибриллярном пространстве отмечается появление разной формы и величины осмиофильных и умеренно осмиофильных включений. Большинство из них по ультраструктуре являются липидными и кальцинозными включениями. В миофибриллярных волокнах саркомеры имеют разную толщину и окрашиваемость, некоторые из них деформированы структурные части саркомера.
Межмиофибриллярное пространство подвергнуто выраженному отеку и разрушению органелл, где митохондрии уплотнены, матрикс осмиофильный за счет распада крист и накопления продуктов кальция в виде осмиофильных включений. Все структурные отделы саркомера деформированы, А-диски сокращены, Н-полоски проявляются более осмиофильно, между Н-полосками I-диск выявляется с трудом, границы саркомеров нечеткие, разрыхлены, деформированы. Между А-дисками Z-линии расширены, разрыхлены, волокнистые филаменты деформированы, некоторые из них осмиофильные. Z-линии местами подвергнуты отеку и гомогенизации. Эти ультраструктурные изменения структурных частей саркомера и межмиофибриллярной саркоплазмы представляются патоморфологическими изменениями некробиоза кардиомиоцитов под действием вирусной интоксикации. Эти некробиотические ультраструктурные изменения на поперечном срезе кардиомиоцита проявлялись выраженным отеком, разрыхлением межмиофибриллярной части матрикса саркоплазмы в виде вакуолизации матрикса, фрагментации органелл. Тонкие и толстые филаменты миофибрилл несколько разрыхлены, местами разрушены, гомогенизированы с нарушением осмиофильности филаментов. Митохондрии разной формы и величины, наружная мембрана деформирована и осмиофильна, кристы разрушены, фрагментированы, увеличено количество осмиофильных зернистых включений [6].
При COVID-19 можно заподозрить 2 типа повреждения миокарда: первичное или вторичное. При первичном повреждении пациенты преимущественно предъявляют сердечные, а не респираторные жалобы. Причиной первичного повреждения может быть острый инфаркт миокарда (тип 1), вирусный миокардит или вызванная стрессом кардиомиопатия. Больные жалуются на боль в груди, в анализах определяются повышенные сердечные ферменты, при ЭхоКГ наблюдают дисфункцию ЛЖ и изменения, связанные с сегментом ST–T на ЭКГ, но с нормальной проходимостью коронарных сосудов на ангиограмме [2].
Поражение миокарда при COVID-19 с патологическим ремоделированием ПЖ, оцениваемое с помощью его эхо-количественной дилатации или дисфункции, является мощным дополнительным прогностическим индикатором у пациентов с COVID -19 наравне с рутинными клиническими и биохимическими маркерами. Хотя его связь с прогнозом при COVID-19 была продемонстрирована, количественные параметры дисфункции ПЖ еще не считаются частью стратификации риска для этих пациентов, что свидетельствует о недостаточном знании параметров ПЖСН при этом заболевании. Необходимы исследования, выясняющие воспалительные пути и свойства тканей миокарда, ответственных за дисфункцию ПЖ у пациентов с тяжелым течением COVID-19, а также того, подвержены ли выжившие после новой коронавирусной инфекции больные с патологическим ремоделированием ПЖ остаточному риску неблагоприятных клинических исходов [13].
Заключение. В условиях существующей угрозы пандемии новой коронавирусной болезни пациенты с исходной сердечно-сосудистой патологией представляют особую группу риска с высокими показателями неблагоприятных исходов. Осложнения со стороны ССС значительно ухудшают тяжесть течения COVID-19, тесно связаны с развитием полиорганных дисфункций и являются основной причиной неблагоприятных исходов. Даже незначительное, но стойкое повышение уровня высокочувствительного тропонина I и фермента NT-proBNP может служить сигналом оповещения о повреждении миокарда, связанным с прямым вирусным воздействием на кардиомиоциты либо с кардиомиопатией или инфарктом, возникшими в процессе генерализованного ответа организма и течения COVID-19-ассоциированных патологических процессов. Наибольшую опасность представляют возникающие при повреждении сердца нарушения ритма и проводимости, которые могут быть предвестниками случаев внезапной смерти [2].
Острое поражение миокарда, развивающееся на фоне новой коронавирусной инфекции (COVID-19), представляет собой следствие совокупности следующих процессов: прямое действие вирусного агента, нарушение баланса между сигнальными путями ангиотензинпревращающего фермента 2, острая системная воспалительная реакция и развитие цитокинового шторма, повышенная активность тромбоцитов и/или гиперкоагуляция, а также токсичность лекарственных препаратов, используемых в клинической практике для лечения инфекционного процесса [5].
Список литературы Миокард и COVID-19
- Андрущенко А. А., Погиба Е. И. СЕРДЦЕ И COVID-19 //Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. – 2022. – №. 2 (56) Special Issue. – С. 5-6.
- Бабаев М. А. и др. Острое повреждение миокарда при коронавирусной болезни 2019 (COVID-19)(разбор клинического случая) //Клиническая и экспериментальная хирургия. – 2020. – Т. 8. – №. 3. – С. 87-94.
- Вахненко Ю. В., Коротких А. В., Багдасарян Е. А. Повреждение миокарда при новой коронавирусной инфекции (обзор литературы) //Бюллетень физиологии и патологии дыхания. – 2021. – №. 82. – С. 129-145.
- Воробьева О. В., Ласточкин А. В. Острый инфаркт миокарда и коронавирусная инфекция (COVID-19) //Инфекционные болезни: Новости. Мнения. Обучение. – 2021. – Т. 10. – №. 1 (36). – С. 93-97.
- Изможерова Н.В., Попов А.А., Цветков A.И., Шамбатов М.А., Антропова И.П., Кадников Л.И., Испавский В.Е. Острое поражение миокарда при новой коронавирусной инфекции (COVID-19). Уральский медицинский журнал. 2021;20(5):98-104.
- Исраилов Р., Эргашева З. Морфологические проявления поражения миокарда при COVID-19 //Международный журнал научной педиатрии. – 2022. – №. 1. – С. 46-52.
- Канорский С. Г. COVID-19 и сердце: прямое и косвенное влияние //Кубанский научный медицинский вестник. – 2021. – Т. 28. – №. 1. – С. 16-31.
- Канорский С. Г. COVID-19 и сердце: прямое и косвенное влияние //Кубанский научный медицинский вестник. – 2021. – Т. 28. – №. 1. – С. 16-31.
- Козлов И. А., Тюрин И. Н. Сердечно-сосудистые осложнения COVID-19 //Вестник анестезиологии и реаниматологии. – 2020. – Т. 17. – №. 4. – С. 14-22.
- Ойноткинова О. Ш. и др. Клинические и морфологические особенности повреждения миокарда и течения фульминантного миокардита на фоне СOVID-19, диагностика и тактика лечения //Вестник Российской академии медицинских наук. – 2020. – Т. 75. – №. S5. – С. 414-425.
- Потешкина Н. Г. и др. Кардиальное повреждение у пациентов с коронавирусной инфекцией COVID-19 //Артериальная гипертензия. – 2020. – Т. 26. – №. 3. – С. 277-287.
- Потешкина Н. Г. и др. Кардиальное повреждение у пациентов с коронавирусной инфекцией COVID-19 //Артериальная гипертензия. – 2020. – Т. 26. – №. 3. – С. 277-287.
- Сабиров И. С., Муркамилов И. Т., Фомин В. В. Поражение миокарда при новой коронавирусной инфекции (COVID-19): в фокусе правый желудочек //The Scientific Heritage. – 2020. – №. 56-2. – С. 52-58.
- Сережина Е. К., Обрезан А. Г. Патофизиологические механизмы и нозологические формы сердечно-сосудистой патологии при COVID-19 //Кардиология. – 2020. – Т. 60. – №. 8. – С. 23-26.
- Скородумова Е. Г. и др. Инфаркт миокарда и COVID‑19 в «нековидном» стационаре: эпидемиология, годичный анализ //Скорая медицинская помощь. – 2022. – Т. 22. – №. 4. – С. 34-38.
- Фисун А. Я. и др. Механизмы поражения сердечно-сосудистой системы при COVID-19//Вестник Российской академии медицинских наук. – 2021. – Т. 76. – №. 3. – С. 287-297.
- Халирахманов А. Ф. и др. Повреждение миокарда у пациентов с COVID 19//Практическая медицина. – 2020. – Т. 18. – №. 1. – С. 62-66.
- Чащин М. Г. и др. Клинико-анамнестическая характеристика пациентов с инфарктом миокарда без подъема сегмента ST, перенесших COVID-19 //Кардиоваскулярная терапия и профилактика. – 2021. – Т. 20. – №. 7. – С. 15-23.


