Миокардиальный мостик - вариант нормальной анатомии или патология? Клинический случай
Автор: Чижова Арина Васильевна, Логинов Максим Олегович, Баширов Ильнур Ирекович, Сулейманов Марсель Мазитович, Щекин Влас Сергеевич, Столяренко Анастасия Павловна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.29, 2021 года.
Бесплатный доступ
Миокардиальные (мышечные) мостики считаются вариантом нормальной анатомии коронарных артерий, однако имеются отдельные сообщения об их клинической значимости: их наличие ассоциировано со стенокардией, инфарктом миокарда, желудочковой тахикардией, а также с внезапной сердечной смертью. В настоящем исследовании на примере клинического случая представлена значимость проблемы, подходы к оценке периоперационного риска и методы выявления факторов риска на предоперационном этапе у пациента с аномальными коронарными артериями. У пациента по результатам коронарной ангиографии в 7-ом сегменте передней межжелудочковой артерии выявлен миокардиальный мостик со стенозированием в систолу до 95%, что на фоне гемморагического шока могло спровоцировать развитие острого коронарного синдрома. Анализ клинического случая, обзор литературы по оценке рисков пациентов с миокардиальными мостиками демонстрирует недостаточную оценку данной морфологической особенности для пациентов не-кардиохирургического профиля. В исследованном случае пациент подвергся плановой ортопедической операции и экстренному хирургическому вмешательству, направленному на остановку кровотечения. Хирургическое вмешательство с сопутствующей травмой, системным воспалительным ответом, анестезией и анальгезией, болью, гипотермией, кровотечением, анемией и нутритивной недостаточностью аналогично экстремальному стресс-тесту. Сочетание данных факторов провоцирует воспалительные, гиперкоагуляционные, стрессовые и гипоксические состояния, которые связаны с периоперационным повышением уровня тропонина, тромбозом артерий и, как следствие, высоким риском смертности. Авторы предполагают, что современные клинические рекомендации по оценке периоперационных рисков требуют доработки. При такой доработке необходимо опираться не только на имеющиеся международные рекомендации, но и на результаты последних мета-анализов, посвященных прогностической роли превентивной реканализации миокарда перед хирургическим вмешательством. Таким образом, резюмируя, можно отметить, что имеющиеся клинические рекомендации и шкалы оценки рисков не содержат готовых решений на все клинические случаи, а могут быть только основой для принятия решения в конкретных ситуациях и не обеспечивают достаточных гарантий успешности операционных вмешательств.
Миокардиальный мостик, кровопотеря, периоперационный период, повреждение миокарда
Короткий адрес: https://sciup.org/143177413
IDR: 143177413 | DOI: 10.20340/mv-mn.2021.29(1).55-61
Текст научной статьи Миокардиальный мостик - вариант нормальной анатомии или патология? Клинический случай
Chizhova AV, Loginov MO, Bashirov II, Suleimanov MM, Shchekin VS, Stolyarenko AP. Myocardial bridge - a variant of normal anatomy or pathology? Case report. Morfologicheskie Vedomosti – Morphological Newsletter. 2021;29(1):55-61. (1):55-61
Введение . Миокардиальный мостик (далее - ММ) — это полоска сердечной мышечной ткани, расположенная над отрезком перикардиальной части коронарной артерии, вызывающая сужение просвета артерии только во время систолы миокарда [1]. Описана данная анатомическая особенность коронарный артерий впервые при аутопсии в 1737 году Рейманом, однако первое прижизненное описание этого феномена сделали к 1960 году Портман и Ивиг по результатам коронарной ангиографии [2]. Несмотря на то, что ММ часто считаются вариантом нормальной анатомии коронарных артерий, имеются отдельные сообщения, что они имеют клиническое значение [3]. Наличие ММ ассоциировано со стенокардией, инфарктом миокарда, желудочковой тахикардией, а также с внезапной сердечной смертью.
Цель исследования - на примере клинического случая пациента представить значимость проблемы, подходы к оценке периоперационного риска и методы выявления факторов риска на предоперационном этапе у пациентов с наличием миокардиальных мостиков.
Материалы и методы исследования . Клинический случай: пациент A., 48 лет, поступил в отделение травматологии и ортопедии Республиканской клинической больницы имени Г.Г. Куватова (Уфа) 20 марта (год не указан по этическим требованиям) с диагнозом «ложный сустав шейки бедренной кости со смещением отломков. Сопутствующие заболевания: гипертоническая болезнь II ст., ст. 1, риск 3. Данные инструментальных и лабораторных методов исследования были следующими: синусовый ритм на электрокардиограмме с частотой сердечных сокращений 74 удара в минуту; по данным трансторакальной эхокардиоскопии наблюдалось уплотнение стенок аорты, сократительная функция миокарда сохранена, диастолическая дисфункция левого желудочка по 1 типу, фракция выброса 67%; по данным ультразвуковой допплерографии патологии магистральных вен нижних конечностей не выявлено. По данным консультации кардиолога диагностирована гипертоническая болезнь II, ст. 1, риск 3. На момент осмотра противопоказаний к оперативному вмешательству не выявлено. 30 марта пациенту было наложено скелетное вытяжение за мыщелки бедра, проводилось низведение бедра на скелетном вытяжении.
3 апреля пациенту в плановом порядке выполнено эндопротезирование левого тазобедренного сустава, по окончанию операции в связи с ухудшением состояния и жалобами на боли в сердце пациент переведен в отделение реанимации, где после консультации кардиолога проведена коронарография, результаты которой представлены на рис. 1. По результатам проведенного исследования был установлен стеноз ветви тупого края первого порядка в проксимальном сегменте 30% (1); наличие в 7-ом сегменте передней межжелудочковой артерии миокардиального мостика со стенозированием в систолу до 90 -95% (2); момент стеноза во 2-ом сегменте правой коронарной артерии составлял до 40% во время систолы (3).
В тот же день пациент был осмотрен кардиологом, который выставил диагноз: «ишемическая болезнь сердца, впервые возникшая стенокардия; аномалия развития коронарных артерий: миокардиальный мостик передней межжелудочковой артерии со стенозированием в систолу до 90-95%; гипертоническая болезнь III ст., ст. 2, риск 4». На следующий день 4 апреля у пациента резко ухудшилось состояние. Появилась слабость во всем теле, головокружение, снижение артериального давления до 90/60 мм. рт. ст., частота сердечных сокращений возросла до 100 ударов/мин, показатель содержания гемоглобина снизился с 112 г/л до 75 г/л. По активному дренажу в течение 30 минут было отмечено выделение до 500 мл крови. В связи с этим пациент был осмотрен дежурным врачом, после чего был транспортирован в экстренном порядке в операционную в связи с продолжающимся кровотечением. В операционной была выполнена следующая операция: ревизия раны, остановка кровотечения тампонированием вертлужной впадины и канала бедренной кости гемостатической губкой. Во время операции проводилась гемотрансфузия, вводились антагонисты гепарина. Операция была завершена успешно. Пациента перевели в отделение реанимации.
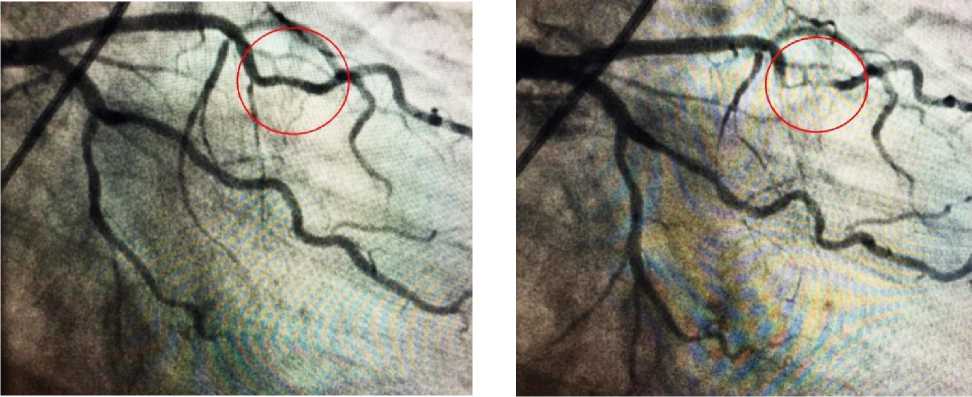
А Б
Рис. 1. Ангиографическая картина миокардиального мостика исследованного случая в диастолу (А) и систолу (Б). Красной круговой линией обозначена зона локализации миокардиального мостика.
Через 8 часов после перевода пациента в отделение реанимации возникла остановка сердечной деятельности, была констатирована фибрилляция желудочков. Пациенту был проведен полный объем реанимационных мероприятий, но без должного эффекта, в связи с чем наступила смерть.
По данным протокола вскрытия обнаружено: сердце размерами 14×10×6 см, массой 390 г, эпикард и перикард серого цвета, тусклые. Околосердечная сумка содержит около 25 мл прозрачной жидкости. Жировая клетчатка умеренно выражена. Полости желудочков не расширены. Полость левого желудочка содержит сгустки крови. Толщина миокарда в области правого желудочка 0,4 см, левого - 1,7 см. Сосочковые мышцы утолщены. Миокард плотный, коричневого цвета, с участками неравномерного кровенаполнения в субэндокардиальных отделах передней и боковой стенок левого желудочка. Предсердножелудочковые отверстия проходимы. Створки клапанов эластичные, серого цвета, тусклые. Внутренняя оболочка коронарных артерий светло-желтого цвета, с единичными атеросклеротическими бляшками с сужением просвета огибающей артерии - ветви левой коронарной артерии до 30% и правой коронарной артерии до 40%. В среднем сегменте передняя межжелудочковая артерия - ветвь левой коронарной артерии уходит вглубь миокарда на глубину 5 мм. Внутренняя оболочка аорты желтого цвета, стенка эластичная, с множественными атеросклеротическими бляшками, преимущественно в брюшном отделе. Легочный ствол выходит из правого желудочка, окружность 8 см, на уровне ΙV грудного позвонка делится на правую и левую легочные артерии. Правая легочная артерия подходит к воротам правого легкого и делится на 3 долевые ветви, левая легочная артерия подходит к воротам левого легкого и делится на 2 ветви. Правая и левая легочные вены, прободая перикард, впадают отдельными отверстиями в левое предсердие. Верхняя полая вена длиной 7 см, образована слиянием правой и левой плечеголовных вен, впадает в правое предсердие. Нижняя полая вена на уровне V поясничных позвонков образуется из слияния левой и правой общих подвздошных вен, впадает в правое предсердие. Воротная вена длиной 5 см, поперечником 1,4 см, сформирована из вен непарных органов, войдя в ворота печени делится на правую и левую ветви. При микроскопическом исследовании сердца поперечно-полосатая исчерченность кардиомиоцитов сохранена, клетки увеличены, ядра клеток гиперхромные, определяются поля разрастания соединительной ткани (рис. 2А). Миокард отечен, имеются участки, в которых мышечные волокна потеряли поперечную исчерченность, ядра плохо различимы, наблюдаются контрактурные повреждения, имеющие вид неоднородных темно-розовых волнистых полос сокращений (рис. 2Б). Сосуды неравномерного кровенаполнения с утолщенными за счет склероза стенками, местами с явлениями стаза.
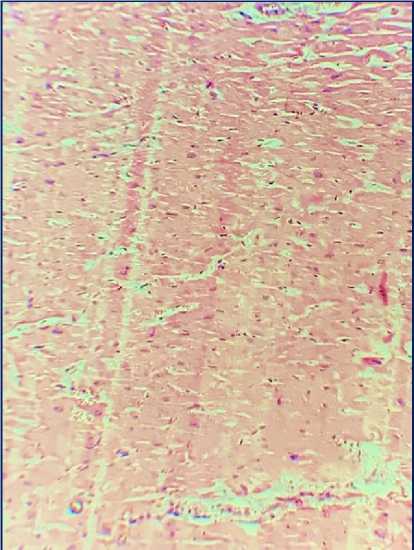
А
Рис. 2. Гистологическая картина миокарда дистальнее 7-го сегмента передней межжелудочковой артерии. Окраска: гематоксилином и эозином. Ув.: х100.
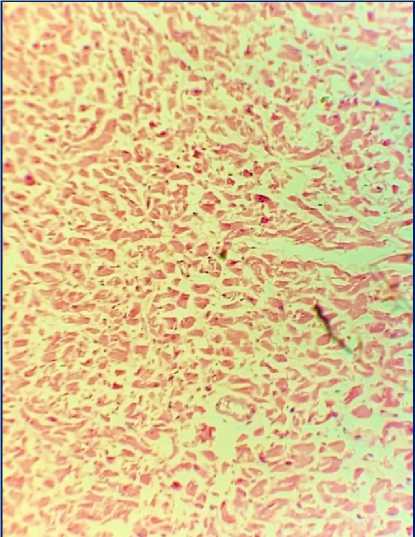
Б
На основе лабораторных исследований и данных аутопсии выставлен диагноз комбинированного основного заболевания. Сочетанные заболевания: 1 - ложный сустав шейки левой бедренной кости со смещением отломков. Операции эндопротезирования правого тазобедренного сустава и ревизия раны, хирургический гемостаз. 2 - малые аномалии развития сердца в среднем сегменте правой коронарной артерии до 80%, в 7-ом сегменте передней межжелудочковой артерии миокардиальный мостик со стенозированием в систолу до 95%. Общее осложнение в виде субэндокардиальных очагов некроза миокарда, инфаркт миокарда 2 типа в области передней и боковой стенки левого желудочка является непосредственной причиной смерти.
Результаты исследования и обсуждение. Ишемия миокарда, инфаркт, внезапная сердечная смерть у детей, подростков и молодых людей очень редко вызываются атеросклерозом, зачастую причиной такой патологии в детском и юном возрасте становятся аномалии коронарных артерий, в том числе и интрамурально расположенные ММ [4]. Следует отметить, что в более старшем возрасте патофизиологические механизмы клинических проявлений ММ связаны с развитием атеросклероза. Установлено, что внутренняя оболочка туннельной части артерии значительно тоньше, чем интима проксимального сегмента артерии [5]. Также были показаны морфологические изменения эндотелиальных клеток, что позволяет предположить, что внутренняя оболочка под ММ может быть защищена гемодинамическими факторами. В некоторых исследованиях сообщается, что экспрессия вазоактивных агентов (эндотелин-1, эндотелиальная синтаза оксида азота, ангиотензин-превращающий фермент) и распространение атеросклеротического процесса в мостике миокарда снижены по сравнению с проксимальным и последующими сегментами артерии [6]. Таким образом, полученные до настоящего времени данные, позволяют предположить, что ММ взаимосвязаны с большим развитием атеросклероза в проксимальном сегменте артерии по сравнению с туннельной частью артерии.
Типичным ангиографическим признаком миокардиального мостика является систолическое сужение эпикардиальной части артерии, которое часто полностью разрешается во время диастолической фазы сердечного цикла. Поскольку только 15% коронарного кровотока обычно происходит во время систолы и ММ является систолическим ангиографическим событием, он приобретает клиническую значимость только в определенных условиях, таких, как тахикардия. Тахикардия может спровоцировать ишемический эффект ММ за счет сокращения диастолической фазы и увеличения значения систолического кровотока [7].
Возвращаясь к клиническому случаю, можно отметить, что пациент подвергся плановой ортопедической операции и экстренному хирургическому вмешательству, направленному на остановку кровотечения. Следует отметить, что тахикардия является одним диагностических критериев надвигающегося геморрагического шока, что и случилось у пациента. Хирургическое вмешательство с сопутствующей травмой, системным воспалительным ответом, анестезией и анальгезией, болью, гипотермией, кровотечением, анемией и нутритивной недостаточностью аналогично экстремальному стресс-тесту. Сочетание этих факторов провоцирует воспалительные, гиперкоагуляционные, стрессовые и гипоксические состояния, которые связаны с периоперационным повышением уровня тропонина, тромбозом артерий и смертностью [8-9]. Увеличенный объем хирургической травмы может инициировать воспалительные и гиперкоагуляционные состояния, провоцировать выработку фактора некроза опухоли-а, IL-1, IL-6 и С-реактивного белка [1011], которые играют непосредственную роль в деструкции атеросклеротических бляшек или развитии коронароспазма [12-15]. Возможным объяснением изменений, произошедших у пациента, может быть тяжелый коронарный спазм. По результатам коронарографии атеросклеротических бляшек в основных коронарных артериях обнаружено не было, регистрировалось временное систолическое сужение просвета коронарной артерии. Наблюдение за пациентом велось консервативно, назначались преимущественно 6-адреноблокаторы и ацетилсалициловая кислота, введения нитратов избегали, поскольку они увеличивают ангиографическую степень систолического сужения и могут привести к ухудшению симптомов [16]. 6-адреноблокаторы уменьшают тахикардию и увеличивают диастолическое время, снижая сократимость и сдавление коронарных артерий, об этом свидетельствует внутривенная инъекция эсмолола во время тахикардии у пациентов с выраженным ММ, показывающая снижение скорости допплеровского кровотока, с возвращением к исходным значениям и нормализацией соотношения диастолической и систолической скорости кровотока в мостиковом сегменте артерии [17]. Ацетилсалициловая кислота может усугубить коронарный спазм, особенно в коронарных артериях без атеросклероза, даже в низких дозах [18]. Повреждение эндотелия, агрегация тромбоцитов и образование тромбов могут происходить в месте фокального сужения артерии, даже если уменьшения транслюминального диаметра недостаточно для существенного изменения скорости кровотока, и, следовательно, ацетилсалициловая кислота могла бы быть эффективным средством в анализируемом случае. В свою очередь состояние гиперкоагуляции обуславливает активность ингибитора активатора плазминогена-1, фактора VIII и реактивность тромбоцитов, это приводит к снижению активности антитромбина III и способствует развитию острого коронарного тромбоза [19]. Повышение уровня гормонов стресса - кортизола и адреналина приводит к относительному дефициту инсулина и увеличению уровня свободных жирных кислот, увеличению потребности миокарда в кислороде, изменению турбулентности движения крови по коронарным артериям, что может спровоцировать острую гипоксию миокарда. Немаловажным является тот факт, что анестезиологическое сопровождение оперативного вмешательства не в состоянии нивелировать все негативные последствия хирургической травмы и снизить последствия системного воспалительного ответа, что и произошло у пациента [20-22]. Предотвратить гипоксическое повреждение миокарда можно было бы с помощью локальной гипотермии сердца [23], но такая клиническая технология пока не разработана.
Заключение . Таким образом, анализ прижизненной и посмертной анатомии сердца пациента, подвергнутого хирургической ортопедической операции, демонстрирует, что миокардиальный мостик может быть выявлен при жизни с помощью коронарной рентгенографии и наличие такой морфофункциональной особенности может спровоцировать у пациентов в периоперационном и послеоперационном периоде коронароспазм с развитие инфаркта миокарда.
Список литературы Миокардиальный мостик - вариант нормальной анатомии или патология? Клинический случай
- Rossi L, Dander B, Nidasio GP et al. Myocardial bridges and ischemic heart disease. Eur Heart J. 1980;1:239-45.
- Faruqui A, Maloy W, Felner J, Schlant R, Logan W, Symbas P. Symptomatic myocardial bridging of coronary artery. Am J Cardiol. 1978;41:1305-10.
- Angelini P, Velasco JA, Flamm S. Coronary anomalies: Incidence, pathophysiology, and clinical relevance. Circulation. 2002;105:2449-54.
- Hill R, Chitwood W, Bashore T et al. Coronary Flow and Regional Function before and after Supraarterial Myotomy for Myocardial Bridging. Ann. Thorac. Surg. 1981;31(2):176-181.
- Risse M, Weiler G. Coronary muscle bridge and its relations to local coronary sclerosis, regional myocardial ischemia and coronary spasm: S morphometric study. J Kardiol. 1985;74:700-5.
- Masuda T, Ishikawa Y, Akasaka Y, Itoh K, Kiguchi H, Ishii T. The effect of myocardial bridging of the coronary artery on vasoactive agents and atherosclerosis localization. J Pathol. 2001;193:408-14.
- Ripa C, Melatini MC, Olivieri F, Antonicelli R. Myocardial bridging: A ‘forgotten’ cause of acute coronary syndrome - a case report. Int J Angiol. 2007;16(3):115-118.
- Vrsalovic M, Vrsalovic Presecki A. Admission C-reactive protein and outcomes in acute aortic dissection: a systematic review. Croat Med J. 2019;60(4):309-315. https://doi.org/10.3325/cmj.2019.60.309.
- Buse G, Manns B, Lamy A, Guyatt G, Polanczyk CA, Chan MTV et al. Troponin T monitoring to detect myocardial injury after noncardiac surgery: a cost-consequence analysis. Can J Surg. 2018;61(3):185-194. https://doi.org/10.1503/cjs.010217.
- Zabelin M, Safonov A. Obstructive resection and colorectal stenting in acute colonic obstruction of tumoral genesis. Healthcare, education and security. 2018;4(16):20-30.
- Michailidou M, Kulvatunyou N, Friese RS, Gries L, Green DJ, Joseph B et al. Time and cost analysis of gallbladder surgery under the acute care surgery model. J Trauma Acute Care Surg. 2014;76(3):710-14. https://doi.org/10.1097/TA.0000000000000117.
- Juan Wang, Guo-Juan Tan, Li-Na Han, Yong-Yi Bai, Miao He, Hong-Bin Liu Novel biomarkers for cardiovascular risk prediction. J Geriatr Cardiol. 2017;14(2):135-50. https://doi.org/10.11909/j.issn.1671-5411.2017.02.008.
- Urakov A, Gurevich K, Kamilov F, Zolotukhin K, Samorodov A, Khaliullin F. Urovni antitrombina III i D-dimerov kak prediktory razvitiya tromboembolii legochnoy arterii u patsientov s trombozom glubokikh ven. Kazanskiy meditsinskiy zhurnal. 2017;98(6):957-962.
- Urakov A, Mustafin I, Samorodov A, Kamilov F, Khaliullin F. The off-label use of drugs for parenteral nutrition as a solvent of substances slightly soluble in water in pharmacological research. Journal of Advanced Pharmaceutical Technology and Research. 2018;9(1):9-14.
- Urakov A, Mustafin I, Nabiullina R, Bashirova L, Mochalov K, Samorodov A, Khaliullin F, Lipatov D, Korunas V, Khalimov A. Thromboelastography as an instrument of preclinical studies of the potential drug. Journal of Applied Pharmaceutical Science. 2020;10(8):105-110.
- Hongo Y, Tada H, Ito K, Yasumura Y, Miyatake K, Yamagishi M. Augmentation of vessel squeezing at coronary-myocardial bridge by nitroglycerin: Study by quantitative coronary angiography and intravascular ultrasound. Am Heart J. 1999;138:345-50.
- Schwarz E, Klues H, vom Dahl J, Klein I, Krebs W, Hanrath P. Functional, angiographic and intracoronary Doppler flow characteristics in symptomatic patients with myocardial bridging: Effect of short-term intravenous beta-blocker medication. J Am Coll Cardiol. 1996;27:1637-45.
- Park J, Rha S, Poddar K, Ramasamy S, Wang L, Choi BG, Kim JB, Shin SY, Choi UJ. Impact of low dose aspirin on acetylcholine-induced coronary artery spasm and 12 month clinical outcome. J Am Coll Cardiol. 2010;55:A47-E452.
- Hansson G, Libby P, Tabas I. Inflammation and plaque vulnerability. J Intern Med. 2015;278(5):483‐493. https://doi.org/10.1111/joim.12406.
- Rahat T, Nguyen T, Latif F. Role of prophylactic coronary revascularisation in improving cardiovascular outcomes during non-cardiac surgery: A narrative review. Neth Heart J. 2016;24(10):563-70. https://doi.org/10.1007/s12471-016-0871-1.
- Samorodov A, Urakov A, Zolotukhin K, Dashkin R, Ismagilov N, Abubakirova A, Pakhomova Z, Mukhametshina Z. Clinical and Pathological Analysis of Sudden Death after Planned Surgery. Creative surgery and oncology. 2020;10(2):154-161. https://doi.org/10.24060/2076-3093-2020-10-2-154-161.
- Samorodov A, Zolotukhin K. Prevention of COVID-19-associated Haemostasis Failure in Patient with Stented Coronary Arteries: a Clinical Case. Creative surgery and oncology. 2020;10(2):137-142.
- https://doi.org/10.24060/2076-3093-2020-10-2-137-142.
- Urakov A. Kholod v zashchitu serdtsa. Uspekhi sovremennogo estestvoznaniya. 2013;11:32-36.


