MIR-155 и MIR-223 как маркеры клинических особенностей течения хронического лимфолейкоза
Автор: Перепечаева М.Л., Горева О.Б., Березина О.В., Поспелова Т.И., Гришанова А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Введение. Хронический лимфолейкоз (ХЛЛ) - заболевание, которое характеризуется высокой межиндивидуальной гетерогенностью как клинического течения, так и молекулярных паттернов экспрессии генов и регуляторных РНК, способных оказывать влияние на патологический процесс. Вовлеченность регуляторных miR-155 и miR-223 в патогенез ХЛЛ в целом известна, но информации о возможных колебаниях экспрессии miR-155 и miR-223 в зависимости от динамики развития патологического процесса и характеристик врачебного вмешательства недостаточно. Цель исследования - изучение уровня экспрессии miR-155 и miR-223 у больных ХЛЛ с разными биологическими, клиническими особенностями и характеристиками проводимой терапии в субстратах периферической крови: плазме, лимфоцитах, внеклеточных везикулах, а также в костном мозге. Материал и методы. При выполнении работы использовались образцы периферической крови и костного мозга 38 пациентов с диагнозом ХЛЛ из Городского гематологического центра ГБУЗ Новосибирской области «Городская клиническая больница № 2» с 2016 по 2017 г. Оценка уровня экспрессии miR-155 и miR-223 проводилась методом ОТ-ПЦР в реальном времени по принципу TaqMan. Оценку значимости различий групп проводили с помощью непараметрического критерия Манна-Уитни либо непараметрического критерия Краскела-Уоллиса с последующим попарным сравнением с помощью критерия Манна-Уитни.
Хлл, mir-155, mir-223, внеклеточные везикулы, лимфоциты, периферическаякровь, костный мозг, течение хлл, прогноз хлл, лечение хлл
Короткий адрес: https://sciup.org/140303749
IDR: 140303749 | УДК: 616.155.392.2-036 | DOI: 10.21294/1814-4861-2024-23-1-75-86
Текст научной статьи MIR-155 и MIR-223 как маркеры клинических особенностей течения хронического лимфолейкоза
МикроРНК (miR) представляют собой эндогенные малые некодирующие регуляторные РНК, вовлеченные в регуляцию широкого спектра биологических процессов, включая канцерогенез [1]. Связь miR с онкологическими заболеваниями может быть опосредована аберрациями последовательностей ДНК, содержащих miR, нарушением контроля их транскрипции, дефектами биогенеза miR, наконец, нарушением регуляции эпигенетических изменений, опосредуемых miR. Зрелые miR опосредуют репрессию своих генов-мишеней, взаимодействуя с их мРНК [2, 3].
Хронический лимфолейкоз (ХЛЛ) – по международной классификации сhronic lymphocytic leukaemia/small lymphocytic lymphoma (CLL/ SLL) [4] – определяют как опухоль из малых В-лимфоцитов, характеризующуюся пролиферацией и накоплением аберрантных лимфоидных клеток в костном мозге, крови, лимфоидных тка- нях [5]. Хронический лимфолейкоз – неизлечимое злокачественное новообразование, на долю которого в западных странах приходится почти треть лейкозов и при котором наблюдается высокая межиндивидуальная клиническая и молекулярная гетерогенность [6–8]. Эта гетерогенность дополнительно усложняется изменением экспрессии генов и событиями эпигенетической регуляции, за которые отвечают регуляторные РНК, включая miR, выступающие в роли онкогенов либо супрессоров опухоли [9, 10].
Известные геномные биомаркеры для определения прогноза или ответа на лечение при ХЛЛ представляют собой мутации генов и хромосомные аберрации (ХА). Самым частым хромосомным нарушением является делеция 13q.14, которая ассоциирована с благоприятным прогнозом заболевания, мутациями в генах вариабельного региона тяжелых цепей иммуноглобулинов (IgVH) и типичной морфологией опухолевых клеток. Трисомия по 12 хромосоме встречается в 7–25 % случаев ХЛЛ, коррелирует с промежуточным прогнозом, атипичной морфологией клеток, яркой экспрессией CD20, хорошим ответом на ритуксимаб. Делеция 11q.22 и делеция 17р.13 встречаются в 3–15 % и 5–12 % соответственно и ассоциированы с отсутствием мутаций в генах IgVH, быстрым прогрессированием заболевания и неблагоприятным исходом. Делеция 17р.13 нарушает функцию белка ТР53 и, наряду с мутациями в гене ТР53, включена в международный прогностический индекс ХЛЛ (МПИ). В МПИ также входят такие показатели, как мутационный статус генов IgVH, стадия по Binet, возраст, уровень бета2-микроглобулина. Определение мутаций в гене ТР53 и мутаций в генах IgVH в реальной клинической практике представляет значительные трудности, в связи с чем расчет МПИ не всегда возможен.
С некоторыми из известных прогностических биомаркеров связывают ряд паттернов miR, например, с малым количеством мутаций в генах IgVH или высоким уровнем экспрессии ZAP-70 в лейкозных клетках [9]. В частности, показана связь с развитием ХЛЛ аберрантной экспрессии miR-155 и miR-223. Например, выявлены более высокие уровни экспрессии miR-223 в лимфоцитах периферической крови пациентов с низким риском прогрессирования ХЛЛ по сравнению с группой высокого риска [10]. Экспрессия miR-223 в мононуклеарах периферической крови ниже у пациентов с ХЛЛ по сравнению со здоровым контролем [11]. Интересно, что экспрессия miR-223 оказалась ниже у курящих пациентов с ХЛЛ, чем у некурящих [11].
В отличие от miR-223, уровень экспрессии miR-155 не связан со статусом IgVH [10], но есть свидетельства, что miR-155 является онкогеном при ХЛЛ [9, 12–14]. Так, при проведении полногеномного секвенирования малых РНК был идентифицирован паттерн дифференциальной регуляции восьми miR при ХЛЛ, среди которых обнаружилась активированная miR-155 [9]. Выявлена повышенная экспрессия miR-155 в сыворотке крови пациентов с ХЛЛ по сравнению со здоровым контролем; miR-155 была обнаружена в циркулирующих микровезикулах больных ХЛЛ [12]. Определены гиперэкспрессия miR-155 в лимфоцитах и в плазме больных ХЛЛ и ее связь с плохим прогнозом и прогрессированием заболевания [14].
Уровень экспрессии пяти miR человека, включая miR-155-5p и miR-223-3p, определен в сыворотке 224 пациентов с ХЛЛ и у 224 здоровых лиц. Среднее время от момента сбора крови до постановки диагноза ХЛЛ составило 10 лет. Активация miR-155-5p связана с последующим риском развития ХЛЛ, хотя прогностическая эффективность была небольшой. Уровень miR-223-3p не был связан с риском развития ХЛЛ [6]. Устойчивость miR в системном кровотоке делает их подходящими диагностическими маркерами [6, 11], и, согласно имеющимся данным, уровень экспрессии miR-155 и miR-223 может быть маркером при ХЛЛ [11, 12].
Целью исследования стало выявление возможных закономерностей различий уровня экспрессии miR-155 и miR-223 между больными с разными биологическими и клиническими особенностями ХЛЛ, характеристиками терапии заболевания, а также в костном мозге и в субстратах крови: плазме, лимфоцитах, внеклеточных везикулах у пациентов с ХЛЛ.
Материал и методы
Использовали образцы клинического материала – периферической крови и костного мозга 38 пациентов, которые с 2016 по 2017 г. получали лечение в Городском гематологическом центре ГБУЗ Новосибирской области «Городская клиническая больница № 2» – клинической базе ФГБУ ВО «Новосибирский государственный медицинский университет» Минздрава РФ. Всем пациентам установлен диагноз ХЛЛ. Диагностика ХЛЛ и показания к терапии определялись в соответствии с международными критериями IWCLL 2008 г. и российскими клиническими рекомендациями по диагностике и лечению лимфопролиферативных заболеваний [15, 16]. Материал для исследования забирали до начала терапии.
Средний возраст больных составил 62,6 ± 8,5 года (43–77 лет). Распределение по полу: 23 мужчины и 15 женщин. Наиболее частым клиническим проявлением был лимфопролиферативный синдром, включающий лимфаденопатию, которая определялась у 21 (55 %) пациента, и спленомегалию – у 20 (53 %) больных ХЛЛ. Показатели гемограммы до начала лечения представлены в табл. 1. Инфильтрация костного мозга аномальными клетками, сопровождающаяся вытеснением здоровых кроветворных клеток и выходом аномальных клеток в кровоток, определяет абсолютный лимфоцитоз, развитие анемического синдрома и тромбоцитопении у пациентов с ХЛЛ. Стадию заболевания определяли по Binet, и среди обследованных пациентов с ХЛЛ стадия A наблюдалась у 13 (34 %), стадия В – у 18 (47 %), стадия С – у 7 (18 %) больных.
Определение хромосомных аберраций проводилось с помощью стандартного цитогенетического исследования и флуоресцентной гибридизации in situ (FISH). Пациенты разделены на 2 группы на основании потенциального влияния на прогноз выявленных хромосомных нарушений. В 1-ю группу вошли 24 (63 %) пациента с трисомией 12 хромосомы, нормальным кариотипом или генетическими аномалиями неопределенного значения, которые не ассоциированы с отчетливым благоприятным или неблагоприятным прогностическим значением, занимая промежуточную позицию. Во 2-ю группу
Таблица 1/Table 1
Показатели гемограммы и миелограммы у больных ХЛЛ
Hemogram and myelogram parameters in patients with CLL
|
Показатель анализа крови/Bloodwork parameter |
Среднее значение/Mean |
Кол-во случаев/Number of cases |
|
Гемоглобин (120–170 г/л)/ Hemoglobin (120–170 g/L) |
140,43 ± 12,13 |
29 (76,32 %) |
|
Анемия легкой степени (Hb=110–90 г/л)/ Mild anemia (Hb=110–90 g/L) |
102,17 ± 6,05 |
6 (15,79 %) |
|
Анемия средней степени (Hb=89–70 г/л)/ Moderate anemia (Hb=89–70 g/L) |
79,00 ± 4,24 |
2 (5,26 %) |
|
Анемия тяжелой степени (Hb<70 г/л)/ Severe anemia (Hb<70 g/L) |
50 |
1 (2,63 %) |
|
Тромбоциты/ (150-400 х 10 9 /л)/ Platelets (150-400 х 10 9 /L) |
140,43 ± 12,13 |
34 (89,47 %) |
|
Тромбоцитопения (Тр<100 х 10 9 /л)/ Thrombocytopenia (Pt<100 х 10 9 /L) |
24,75 ± 7,93 |
4 (10,53 %) |
|
Лейкоциты (Lc=3-9 х 109/л)/ Leukocytes (Lc=3-9 х 10 9 /L) |
5,52 ± 1,58 |
16 (42,11 %) |
|
Лейкоцитоз (Lc=9-30 х 109/л)/ Leukocytosis (Lc=9-30 х 10 9 /L) |
17,45 ± 6,70 |
15 (39,47 %) |
|
Гиперлейкоцитоз (Lc>30 х 109/л)/ Hyperleukocytosis (Lc>30 х 10 9 /L) |
108,09 ± 114,04 |
7 (18,42 %) |
|
Лимфоциты крови (L=19–37 %)/ Blood lymphocytes (L=19–37 %) |
5,26 ± 7,07 |
14 (36,84 %) |
|
Лимфопения (L<19 %)/ Lymphopenia (L<19 %) |
10,75 ± 5,85 |
4 (10,53 %) |
|
Лимфоцитоз (L>37 %)/ Lymphocytosis (L>37 %) |
77,10 ± 18,66 |
20 (52,63 %) |
|
Лимфоциты костного мозга, %/ Bone marrow lymphocytes, % |
70,33 ± 25,00 |
38 (100 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
вошли 13 (34 %) больных с делецией 11q или де-лецией 17p, ассоциированных с неблагоприятным прогнозом заболевания. Один пациент, у которого выявлена изолированная делеция 13q, ассоциированная с благоприятным прогнозом заболевания, в дальнейший анализ не включен.
У всех пациентов определялись показания к началу терапии согласно критериям IWCLL 2008 [15], на основании которых часть больных была включена в группу с показаниями к терапии, в которую вошли 22 (58 %) пациента, и часть – в группу без показаний к терапии – 16 (42 %) человек.
Все пациенты с показаниями к терапии получили 2–8 курсов полихимиотерапии (ПХТ), использовались стандартные протоколы R-COP (ритуксимаб, циклофосфан, винкристин, преднизолон), R-FC или R-FC lite (ритуксимаб, флударабин, циклофосфан), BR (бендамустин, ритуксимаб), R-CHOP или mini R-CHOP (ритуксимаб, цикло-фосфан, доксорубицин, винкристин, преднизолон). При оценке эффективности лечения обследование пациентов проводилось согласно рекомендациям IWCLL 2008 [15].
Венозную кровь забирали в пластиковые пробирки с добавлением ЭДТА. Кровь разводили в 2 раза в PBS. В пробирку, содержащую 3 мл раствора для выделения лимфоцитов (фиколл-урографин, ООО «БиолоТ»), наслаивали кровь, не допуская смешивания жидкостей. Центрифугировали пробирку при 1000 об/мин в течение 40 мин. Лимфоциты отсасывали в сухую коническую центрифужную пробирку, добавляли 2–3 мл холодного PBS, гомогенизировали и центрифугировали при 1000 об/мин 10 мин. Надосадочную жидкость сливали, отмывку повторяли дважды. Выделение мононуклеаров костного мозга проводилось аналогичным образом.
Выделение микровезикул из плазмы крови проводили следующим образом. Кровь центрифугировали в течение 20 мин при 2500 g, затем при тех же условиях центрифугировали полученную плазму. Супернатант в количестве 0,5 мл центрифугировали при 4 °С в течение 40 мин при 13000 g, к полученному осадку добавляли 1 мл фосфатносолевого буфера и центрифугировали еще раз при 4 °С в течение 40 мин при 100000 g. Осадок (фракция микровезикул) ресуспендировали в 0,3 мл фосфатно-солевого буфера.
Суммарную РНК выделяли с помощью набора для выделения РНК Тризол («Ambion», США)
Таблица 2/Table 2
Последовательности олигонуклеотидов для проведения ОТ-ПЦР
Oligonucleotide sequences for reverse-transcription PCR
|
miR |
Тип/Type |
Последовательность (5’→ 3’)/ Sequence (5’→ 3’) |
Ссылка/ References |
|
miR-155 |
Адаптер/Adapter |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACCCCTAT |
[25] |
|
Прямой/Forward |
GCCGCTTAATGCTAATCGTG |
||
|
Зонд/Probe |
[FAM]TTCGCACTGGATACGACACCCCTAT[BHQ1] |
||
|
Адаптер/Adapter |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAACTCAGC |
||
|
miR-223 |
Прямой/Forward |
GCCGCCGTGTATTTGACAA |
[25] |
|
Зонд/Probe |
[FAM]TTCGCACTGGATACGACAACTCAGC[BHQ1] |
||
|
Адаптер/Adapter |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCCATGC |
||
|
Прямой/Forward |
GCCGCATACAGAGAAGATTA |
[26] |
|
|
RNU6-1 |
Зонд/Probe |
[FAM]TTCGCACTGGATACGACGGCCATGC[BHQ1] |
|
|
Обратный (общий)/Reverse (common) |
AGTGCAGGGTCCGAGGTA |
[27] |
Примечание: таблица составлена авторами.
Note: created by the authors.
согласно инструкции производителя. Реакцию обратной транскрипции проводили с помощью обратной транскриптазы M-MuLV–RH «Promega» (США) согласно инструкции производителя с модификациями. В реакции использовалось 8 пкмоль микроРНК-специфичного праймера-адаптора шпилевидной конструкции (последовательности представлены в табл. 2.), 25 е.а. ингибитора РНКаз и 1 нг РНК. Смесь инкубировали в течение 30 мин при 18 ºC, затем в течение 30 мин при 42 ºC и 5 мин при 85 ºC.
Оценка экспрессии генов проводилась при помощи ПЦР в реальном времени по принципу TaqMan на оборудовании iCycler CFX96 real-time PCR detection system (Bio-Rad Laboratories, USA). В качестве гена домашнего хозяйства (эталонного гена) использовалась малая ядерная РНК U6, одна из наиболее часто используемых в этом качестве при анализе miR [17]. Реакцию проводили в следующих условиях: начальная денатурация при 95 °С в течение 3 мин, затем 40 циклов: денатурация при 95 °С в течение 15 с и отжиг при 60 °С в течение 30 с. Каждый образец амплифицировали трижды. Для оценки экспрессии применялся показатель ΔCT. Метод 2-ΔCT используется для относительного количественного анализа данных ПЦР в реальном времени [18]. При данном методе используется информация о CT, полученная из системы при проведении ПЦР в реальном времени, для вычисления относительной экспрессии генов в целевых и эталонных образцах с использованием эталонного гена в качестве нормализатора. ΔCT=CT (ген-мишень) – CT (эталонный ген).
Статистическую обработку проводили с использованием программного пакета для статистической обработки STATISTICA software, MS Excel и GraphPad Prism 10. Характер распределения данных определяли с использованием критерия
Колмогорова–Смирнова с поправкой Лиллифор-са. Проводилась оценка значимости различий групп с помощью непараметрического критерия Манна–Уитни либо непараметрического критерия Краскела–Уоллиса с последующим попарным сравнением с помощью критерия Манна–Уитни. При представлении результатов в виде X ± m показатель вариабельности m представляет собой среднеквадратичное отклонение. Значения уровня экспрессии miR-155 и miR-223 представлены в виде медианы и 1 и 3 квартилей – Me (Q1; Q3).
Результаты
На рис. 1 представлены значения уровня экспрессии miR-155 и miR-223 в субстратах крови (плазма, лимфоциты, внеклеточные везикулы) и костном мозге в общей выборке больных ХЛЛ. Оценка с помощью критерия Краскела–Уоллиса показала значимость различий – p=0,03 для экспрессии miR-155 и р=0,83 для экспрессии miR-223. Попарное сравнение с помощью U-критерия Манна–Уитни выявило, что наибольший уровень экспрессии miR-155 наблюдается в лимфоцитах периферической крови – 225,97 (17,15; 3902,01), где он на порядок выше, чем в плазме крови, – 11,47 (0,36; 156,33; p=0,01) и во внеклеточных везикулах – 6,63 (0,08; 221,32; p=0,01) (рис. 1А). Различий уровня экспрессии miR-223 в исследованных субстратах не выявлено (рис. 1Б).
Исследована возможная связь уровня экспрессии miR-155 и miR-223 со стадией ХЛЛ, отражающей распространенность и прогрессию опухоли, а также медиану общей выживаемости, которая на А стадии не отличается от общепопуляционной, на стадии В составляет 7 лет, на стадии С – 2 года (по Binet). Оценка с помощью критерия Краскела– Уоллиса показала отсутствие достоверных различий в группах пациентов с разными стадиями
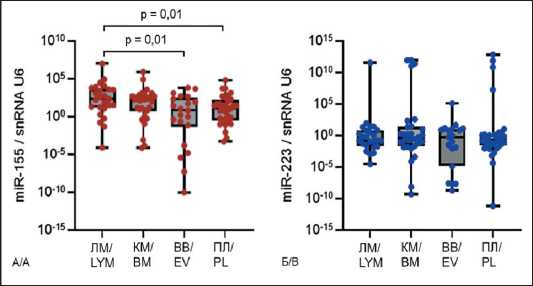
Рис. 1. Относительный уровень экспрессии микроРНК miR-155 (А) и miR-223 (Б) в субстратах крови (плазма, лимфоциты, внеклеточные везикулы) и костном мозге у больных ХЛЛ.
Список литературы MIR-155 и MIR-223 как маркеры клинических особенностей течения хронического лимфолейкоза
- Ratti M., Lampis A., Ghidini M., Salati M., Mirchev M.B., Valeri N., Hahne J.C. MicroRNAs (miRNAs) and Long Non-Coding RNAs (lncRNAs) as New Tools for Cancer Therapy: First Steps from Bench to Bedside. Target Oncol. 2020; 15(3): 261-78. https://doi.org/10.1007/s11523-020-00717-x.
- Aziz F., Chakraborty A., Khan I., Monts J. Relevance of miR-223 as Potential Diagnostic and Prognostic Markers in Cancer. Biology (Basel). 2022; 11(2): 249. https://doi.org/10.3390/biology11020249.
- Pashangzadeh S., Motallebnezhad M., Vafashoar F., Khalvandi A., Mojtabavi N. Implications the Role of miR-155 in the Pathogenesis of Autoimmune Diseases. Front Immunol. 2021; 12. https://doi.org/10.3389/fimmu.2021.669382.
- Alaggio R., Amador C., Anagnostopoulos I., Attygalle A.D., Araujo I.B.O., Berti E., Bhagat G., Borges A.M., Boyer D., Calaminici M., Chadburn A., Chan J.K.C., Cheuk W., Chng W.J., Choi J.K., Chuang S.S., Coupland S.E., Czader M., Dave S.S., de Jong D., Du M.Q., Elenitoba-Johnson K.S., Ferry J., Geyer J., Gratzinger D., Guitart J., Gujral S., Harris M., Harrison C.J., Hartmann S., Hochhaus A., Jansen P.M., Karube K., Kempf W., Khoury J., Kimura H., Klapper W., Kovach A.E., Ku-mar S., Lazar A.J., Lazzi S., Leoncini L., Leung N., Leventaki V., Li X.Q., Lim M.S., Liu W.P., Louissaint A., Marcogliese A., Medeiros L.J., Michal M., Miranda R.N., Mitteldorf C., Montes-Moreno S., Morice W., Nardi V., Naresh K.N., Natkunam Y., Ng S.B., Oschlies I., Ott G., Parrens M., Pulitzer M., Rajkumar S.V., Rawstron A.C., Rech K., Rosenwald A., Said J., Sarkozy C., Sayed S., Saygin C., Schuh A., Sewell W., Siebert R., Sohani A.R., Tooze R., Traverse-Glehen A., Vega F., Vergier B., Wechalekar A.D., Wood B., Xerri L., Xiao W. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022; 36(7): 1720-48. https://doi.org/10.1038/s41375-022-01620-2. Erratum in: Leukemia. 2023; 37(9): 1944-51.
- Nikitin E.A., Byalik T.E., Zaritskii A.Yu., Iseber L., Kaplanov K.D., Lopatkina T.N., Lugovskaya S.A., Mukhortova O.V., Osmanov E.A., Poddubnaya I.V., Samoilova O.S., Stadnik E.A., Falaleeva N.A., Baikov V.V., Kovrigina A.M., Nevol'skikh A.A., Ivanov S.A., Khailova Zh.V., Gevorkyan T.G. Khronicheskii limfotsitarnyi leikoz/limfoma iz malykh limfotsitov. Sovremennaya onkologiya. 2020; 22(3): 24-44. https://doi.org/10.26442/18151434.2020.3.200385.
- Casabonne D., Benavente Y., Seifert J., Costas L., Armesto M., Arestin M., Besson C., Hosnijeh F.S., Duell E.J., Weiderpass E., Masala G., Kaaks R., Canzian F., Chirlaque M.D., Perduca V., Mancini F.R., Pala V., Trichopoulou A., Karakatsani A., La Vecchia C., Sánchez M.J., Tumino R., Gunter M.J., Amiano P., Panico S., Sacerdote C., Schmidt J.A., Boeing H., Schulze M.B., Barricarte A., Riboli E., Olsen A., Tjønneland A., Vermeulen R., Nieters A., Lawrie C.H., de Sanjosé S. Serum levels of hsa-miR-16-5p, hsa-miR-29a-3p, hsa-miR-150-5p, hsa-miR-155-5p and hsa-miR-223-3p and subsequent risk of chronic lymphocytic leukemia in the EPIC study. Int J Cancer. 2020; 147(5): 1315-24. https://doi.org/10.1002/ijc.32894.
- Mikulkova Z., Manukyan G., Turcsanyi P., Kudelka M., Urbanova R., Savara J., Ochodkova E., Brychtova Y., Molinsky J., Simkovic M., Starostka D., Novak J., Janca O., Dihel M., Ryznerova P., Mohammad L., Papajik T., Kriegova E. Deciphering the complex circulating immune cell microenvironment in chronic lymphocytic leukaemia using patient similarity networks. Sci Rep. 2021; 11(1): 322. https://doi.org/10.1038/s41598-020-79121-4.
- Cuthill K.M., Zhang Y., Pepper A., Boelen L., Coulter E., Asquith B., Devereux S., Macallan D.C. Identification of proliferative and non-proliferative subpopulations of leukemic cells in CLL. Leukemia. 2022; 36(9): 2233-41. https://doi.org/10.1038/s41375-022-01656-4.
- Kaur G., Ruhela V., Rani L., Gupta A., Sriram K., Gogia A., Sharma A., Kumar L., Gupta R. RNA-Seq profiling of deregulated miRs in CLL and their impact on clinical outcome. Blood Cancer J. 2020; 10(1): 6. https://doi.org/10.1038/s41408-019-0272-y.
- Grenda A., Filip A.A., Wąsik-Szczepanek E. Inside the chronic lymphocytic leukemia cell: miRNA and chromosomal aberrations. Mol Med Rep. 2022; 25(2): 65. https://doi.org/10.3892/mmr.2022.12581.
- Davari N., Ahmadpour F., Kiani A.A., Azadpour M., Asadi Z.T. Evaluation of microRNA-223 and microRNA-125a expression association with STAT3 and Bcl2 genes in blood leukocytes of CLL patients: a case-control study. BMC Res Notes. 2021; 14(1): 21. https://doi.org/10.1186/s13104-020-05428-0.
- Raeisi F., Mahmoudi E., Dehghani-Samani M., Hosseini S.S.E., Ghahfarrokhi A.M., Arshi A., Forghanparast K., Ghazanfari S. Differential Expression Profile of miR-27b, miR-29a, and miR-155 in Chronic Lymphocytic Leukemia and Breast Cancer Patients. Mol Ther Oncolytics. 2020; 16: 230-7. https://doi.org/10.1016/j.omto.2020.01.004.
- Autore F., Ramassone A., Stirparo L., Pagotto S., Fresa A., Innocenti I., Visone R., Laurenti L. Role of microRNAs in Chronic Lymphocytic Leukemia. Int J Mol Sci. 2023; 24(15): 12471. https://doi.org/10.3390/ijms241512471.
- Anelli L., Zagaria A., Specchia G., Musto P., Albano F. Dysregulation of miRNA in Leukemia: Exploiting miRNA Expression Profiles as Biomarkers. Int J Mol Sci. 2021; 22(13): 7156. https://doi.org/10.3390/ijms22137156.
- Hallek M., Cheson B.D., Catovsky D., Caligaris-Cappio F., Dighiero G., Döhner H., Hillmen P., Keating M.J., Montserrat E., Rai K.R., Kipps T.J.; International Workshop on Chronic Lymphocytic Leukemia. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood. 2008; 111(12): 5446-56. https://doi.org/10.1182/blood-2007-06-093906. Erratum in: Blood. 2008; 112(13): 5259.
- Rossiiskie klinicheskie rekomendatsii po diagnostike i lecheniyu limfoproliferativnykh zabolevanii. Pod red. I.V. Poddubnoi, V.G. Savchenko. M., 2016. 324 s.
- Tang F., Chu L., Shu W., He X., Wang L., Lu M. Selection and validation of reference genes for quantitative expression analysis of miRNAs and mRNAs in Poplar. Plant Methods. 2019; 15: 35. https://doi.org/10.1186/s13007-019-0420-1.
- Li A.L., Chung T.S., Chan Y.N., Chen C.L., Lin S.C., Chiang Y.R., Lin C.H., Chen C.C., Ma N. microRNA expression pattern as an ancillary prognostic signature for radiotherapy. J Transl Med. 2018; 16(1): 341. https://doi.org/10.1186/s12967-018-1711-4.
- Hu J., Huang S., Liu X., Zhang Y., Wei S., Hu X. miR-155: An Important Role in Inflammation Response. J Immunol Res. 2022. https://doi.org/10.1155/2022/7437281.
- Turk A., Calin G.A., Kunej T. MicroRNAs in Leukemias: A Clinically Annotated Compendium. Int J Mol Sci. 2022; 23(7): 3469. https://doi.org/10.3390/ijms23073469.
- Papageorgiou S.G., Kontos C.K., Diamantopoulos M.A., Bouchla A., Glezou E., Bazani E., Pappa V., Scorilas A. MicroRNA-155-5p Overexpression in Peripheral Blood Mononuclear Cells of Chronic Lymphocytic Leukemia Patients Is a Novel, Independent Molecular Biomarker of Poor Prognosis. Dis Markers. 2017. https://doi.org/10.1155/2017/2046545.
- Chen N., Feng L., Lu K., Li P., Lv X., Wang X. STAT6 phosphorylation upregulates microRNA-155 expression and subsequently enhances the pathogenesis of chronic lymphocytic leukemia. Oncol Lett. 2019; 18(1): 95-100. https://doi.org/10.3892/ol.2019.10294.
- Yuan S., Wu Q., Wang Z., Che Y., Zheng S., Chen Y., Zhong X., Shi F. miR-223: An Immune Regulator in Infectious Disorders. Front Immunol. 2021; 12. https://doi.org/10.3389/fimmu.2021.781815.
- Jiao P., Wang X.P., Luoreng Z.M., Yang J., Jia L., Ma Y., Wei D.W. miR-223: An Effective Regulator of Immune Cell Differentiation and Inflammation. Int J Biol Sci. 2021; 17(9): 2308-22. https://doi.org/10.7150/ijbs.59876.
- miRBase: the microRNA database [Internet]. The University of Manchester. [cited 2023 Aug 14]. URL: https://mirbase.org.
- The Nucleotide database [Internet]. National Library of Medicine. [cited 2023 Aug 14]. URL: https://www.ncbi.nlm.nih.gov/nuccore/M14486.
- Kalinina T., Kononchuk V., Alekseenok E., Obukhova D., Sidorov S., Strunkin D., Gulyaeva L. Expression of Estrogen Receptor- and Progesterone Receptor-Regulating MicroRNAs in Breast Cancer. Genes (Basel). 2021; 12(4): 582. https://doi.org/10.3390/genes12040582.


