Mitochondria as a possible place for initial stages of steroid biosynthesis in plants
Автор: Shematorova Elena K., Slovokhotov Ivan Yu., Khaliluev Marat R., Berdichevets Irina N., Baranova Ekaterina N., Babak Olga G., Shpakovski Dmitry G., Spivak Svetlana G., Shpakovski George V.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
With the aim of thorough comparison of steroidogenic systems of plants and animals, transgenic plants of Solanaceae family expressing CYP11A1 cDNA encoding cytochrome P450 SCC of mammalian mitochondria were further analysed. Positive effect of CYP11A1 on resistance of the transgenic tobacco plants to the infection by fungal phytopathogene Botrytis cinerea was for the first time detected. Subtle changes in mitochondria of the transgenic Nicotiana tabacum plants expressing mammalian CYP11A1 cDNA were demonstrated by transmissive electron microscopy. Genetic determinants (cDNAs and genes) encoding main components of the electron transfer chain of plant mitochondria were for the first time cloned and characterized. It was established that plants from the Solanaceae family (tomato, tobacco and potato) contain two different genes with similar exon-intron structures (all contain 8 exons) encoding mitochondrial type ferredoxins (MFDX), and one gene for mitochondrial ferredoxin reductase (MFDXR). The results obtained point out on profound relatedness of electron transfer chains of P450-dependent monooxygenases in mammalian and plant mitochondria and support our previous findings about functional compatability of steroidogenic systems of Plantae and Animalia.
Transgenic plants, nicotiana tabacum l, solanum lycopersicum l, digitalis purpurea l, cyp11a1, cytochrome p450scc, botrytis cinerea, mitochondrial type plant ferredoxins (mfdx), progesterone, electron microscopy
Короткий адрес: https://sciup.org/14323914
IDR: 14323914
Текст научной статьи Mitochondria as a possible place for initial stages of steroid biosynthesis in plants
В последнее десятилетие получен ряд экспериментальных данных об определённой структурной и функциональной консервативности путей биосинтеза биологически активных стероидных соединений в растениях и у животных. Установлено, что основные стадии в процессах биосинтеза и метаболизма стероидных гормонов животных и брассиностероидов растений катализируют цитохромы Р450, в обеих системах функционируют такие ферменты, как стероид-5α-редуктаза (5αR) и 3β-гидроксистероид-дегидрогеназа /∆5-∆4-изомераза (3β-HSD). Также убедительно доказано, что в растениях наряду с брассиностероидами присутствуют такие стероидные гормоны животных, как прогестерон, 17-гидроксипрогестерон, 16-дегидроксипрогесте-рон и андростендион (Simerský et al., 2009; Pauli et al., 2010). Пути биосинтеза этих соединений и их роль в жизнедеятельности растений пока не изучены. На сегодняшний день установленным является лишь то, что прогестерон выполняет важные функции в регуляции процессов роста и развития растений: например, экзогенный прогестерон стимулирует рост и созревание пыльцы растений табака (Ylstra et al., 1995). Совокупность этих данных делает актуальным создание и исследование трансгенных растений, экспрессирующих гены стероидогенных белков животных. С одной стороны эти растения являются удобной моделью для изучения процессов биосинтеза и функций стероидных гормонов животных в растениях. С другой стороны подход, основанный на применении генов белков стероидогенеза животных, может привести к созданию трансгенных растений, обладающих важными для сельского хозяйства свойствами, а в случае лекарственных растений – свойствами, важными для производства медицинских препаратов из растительного сырья. Не исключено также и то, что культура тканей этих трансгенных растений может найти биотехнологическое применение для осуществления трансформации различных стероидных соединений или их наработки.
Ключевую роль в биосинтезе стероидных гормонов животных играет цитохром P450 SCC ( s ide c hain- c leaving), который локализован во внутренней мембране митохондрий клеток стероидогенных тканей и, с участием двух других компонентов митохондриальной электрон-транспортной цепи, адренодоксина и адренодоксинредуктазы, катализирует реакцию отщепления боковой цепи холестерина с превращением его в прегненолон – общий предшественник всех стероидных гормонов животных. Несмотря на то, что похожий белок в растениях пока не найден, известно, что в растениях рода наперстянка ( Digitalis sp. ), по-видимому, также именно в митохондриях, происходит превращение холестерина в прегненолон (Lindemann & Luckner, 1997).
MATERIALS AND METHODS
Методы получения трансгенных растений с помощью агробактериальной трансформации, использованные нами в данной работе, были подробно описаны в предыдущих публикациях (Kartel et al., 2004; Spivak et al., 2009; Khaliluev et al., 2011).
Тестирование трансгенных растений табака, содержащих кДНК гена CYP 11 A 1 , на устойчивость к грибному фитопатогену Botrytis cinerea проводили по методике, вкратце описанной нами ранее (Kartel et al ., 2004). В качестве тест-культуры использовали фитопатогенный гриб вида Botrytis cinerea, вызывающий серую гниль. В провоцирующих условиях изолированные листья среднего возраста и одного размера помещали в чашки Петри на фильтровальную бумагу, увлажненную водой. По 10 мкл суспензии спор возбудителя, содержащей 2000 спор/мл, наносили в 6 точек на лист, после чего чашки с листьями герметично закрывали для создания повышенной влажности и выдерживали в климатокамере при температуре 24°С и 16-ти часовом световом дне. В качестве контроля использовали листья нетрансформированных растений и растений, содержащих только векторную плазмиду (без кДНК CYP11A1 ). Степень поражения листовых пластинок (обратная величина по отношению к устойчивости растения к Botrytis cinerea ) оценивалась в баллах по количеству и размеру некротических пятен на 10-ые сутки после заражения.
Клонирование кДНК и генов митохондриальных ферредоксинов растений семейства Solanaceae. Для выделения тотальной геномной ДНК из листьев томата, картофеля и наперстянки использовали методику, описанную нами ранее для табака (Kartel et al., 2004), и представляющую собой модифицированную методику Эдвардса с соавторами (Edwards et al., 1991), включающую дополнительную экстракцию фенолом.
Суммарную РНК экстрагировали из замороженных и гомогенизированных в жидком азоте листьев растений с помощью TRIzol-метода (Invitrogen) и очищали с использованием набора Qiagen RNeasy MinElute Cleanup kit (Qiagen). Синтез полноразмерных кДНК проводили по методу SMART (Zhu et al ., 2001), используя систему гнездовых SMART-праймеров с различающимися SfiI-сайтами (на 5’- и 3’-концах кДНК) и Long-Distance ПЦР-амплификацию для синтеза второй цепи и получения двухцепочечной кДНК (Barnes, 1994).
Для биоинформационного поиска последовательностей, предположительно кодирующих близкие по структуре к адренодоксину (АDХ) и адренодоксинредуктазе (ADXR) белки из растений семейств Solanaceae (паслёновые) и Scrophulariaceae (норичниковые), использовали подходы, описанные в монографии по биоинформатике растений из серии Methods in Molecular Biology (Edwards D., Editor, 2007). На основании этих данных были сконструированы наборы маловырожденных праймеров и олигонуклеотидных зондов для поиска интересующих нас последовательностей в описанных выше препаратах геномной и комплементарной ДНК. В частности, для клонирования кДНК томата, картофеля и табака, кодирующих ферредоксины митохондриального типа (MFDX) использовали праймеры oYSH16 (5’-GACGAATTССAAATGGTSGGNTTYCA) и oYSH17 (5’-CAGGATCCTCGAGCTARTGHGGYTTNGG). Молекулярное клонирование полученных ПЦР-фрагментов, отбор и анализ клонов проводили с помощью методов последовательных разведений и/или гибридизации нуклеиновых кислот, описанных нами ранее (Shpakovski & Lebedenko, 1997;
Трансмиссионная электронная микроскопия. Растительным материалом для исследований служили асептические проростки Nicotiana tabacum cv. Petit Havana линии SR1 и полученные на основе этого сорта табака две трансгенные линии (TR-2, TR-7) поколения Т4, экспрессирующие кДНК гена CYP11A1 цитохрома P450SCC, выделенную из коры надпочечников быка. Фрагменты срединной части семядолей, полученных от двухнедельных асептических проростков, фиксировали при температуре +4°С в 2,5% растворе глутарового альдегида на 0.1 М фосфатном буфере (рН 7.2) с добавлением 1.5% сахарозы. После отмывки от фиксирующей смеси растительный материал дофиксировали 1.0% раствором четырёхокиси осмия (ОsО4) (Sigma, США), обезвоживали в этаноле повышающейся концентрации (30, 50, 70, 96 и 100%), затем – в окиси пропилена. Образцы заключали в смесь эпоксидных смол Эпона-812 и Аралдита по стандартной методике. Ультратонкие срезы толщиной 30–40 нм получали на ультрамикротоме LKB–V, монтировали на покрытые формваровой подложкой бленды, после чего контрастировали уранилацетатом и цитратом свинца по Рейнольдсу (Reynolds, 1963). Полученные препараты просматривали на электронном микроскопе H-500 (Hitachi, Япония) при ускоряющем напряжении 75 кВ.
RESULTS AND DISCUSSION
Ранее нами в рамках совместного проекта учёных России и Беларуси были получены и детально охарактеризованы трансгенные растения табака Nicotiana tabacum L. (в качестве удобного модельного объекта), экспрессирующие кДНК СYP11A1 цитохрома P450 SCC из коры надпочечников быка (рис. 1) и обладающие повышенной продуктивностью и устойчивостью к грибным фитопатогенам (Shpakovski et al ., 1992; Kartel et al ., 2004; Kartel et al ., 2007). Изучение четырёх поколений этих трансгенных растений показало, что они по сравнению с растениями дикого типа имеют сокращенный период вегетативного развития, выражающийся прежде всего в раннем цветении и созревании семян (рис. 2), увеличенную биомассу и повышенную продуктивность (количество и качество семян), а также повышенный иммунитет к неспецифическому патогену Паслёновых Botrytis cinerea (рис. 3). В отличии от контрольных растений дикого типа в трансгенных растениях обнаружен прегненолон – продукт реакции, катализируемой цитохромом Р450 SCC (CYP11A1).
Установлено, что содержание прогестерона в листьях трансгенных растений существенно (в несколько раз) выше, чем в листьях растений дикого типа (Spivak et al ., 2009; Spivak et al ., 2010).
Очень важным было определить точное место синтеза прегненолона и прогестерона в полученных нами трансгенных растениях табака. У животных первые этапы синтеза стероидных гормонов (отщепление боковой цепи холестерина с превращением его в прегормон прегненолон, и далее – в прогестерон) происходят в митохондриях, на их внутренней мембране (Miller, 2013). Как отмечалось выше, именно там локализован цитохром P450 SCC (CYP11A1) и именно туда доставляется субстрат холестерин. При этом именно перемещение холестерина с наружной на внутреннюю мембрану митохондрий, осуществляемое с помощью особой, многокомпонентной макромолекулярной машины при активном участии белка StAR ( st eroidogenic a cute r egulatory protein), является скорость-лимитирующей стадией в синтезе стероидных гормонов у животных.
В то же время, по всем имеющимся на сегодняшний день данным синтез брассиностероидов (стероидных гормонов растений) происходит на мембранах эндоплазматического ретикулума или, гораздо реже, на плазматической мембране растительных клеток. Несмотря на то, что цитохромы P450 представляют собой едва ли не самое обширное из всех белковых семейств в протеомах растений
(например, на них приходится ~1% кодирующего потенциала арабидопсиса (Nelson et al ., 2004)), существование митохондриальных цитохромов у растений до сих пор не доказано. Тем не менее, основываясь на данных Лузикова с соавторами (Luzikov et al ., 1994) о том, что незрелый цитохром P450 SCC из коры надпочечников быка импортируется в митохондрии растений, где приобретает размеры зрелой формы, аналогично тому, как это происходит в митохондриях клеток животных, при конструировании экспрессионного растительного вектора мы использовали полноразмерную последовательность кДНК CYP11A1 длиной в 1754 п.о. (рис. 1), кодирующую белок-предшественник P450 SСС из коры надпочечников быка с лидерным N -концевым экстрапептидом (Shpakovski et al ., 1992; Spivak et al ., 2009).
Поскольку уникальный только для животных ключевой фермент стероидогенеза CYP11A1 функционирует в митохондриях вместе с FAD-содержащим флавопротеидом ADXR (адренодоксинредуктазой) и [2Fe-2S]-ферредоксином АDХ (адренодоксином), мы изучили, какие белки выполняют функцию этих партнёров цитохрома Р450 SCC в растениях. В результате, впервые охарактеризованы основные компоненты митохондриальной электронтранс-портной цепи растений: клонированы и установлена структура кДНК и генов адренонодоксиноподобных ферредоксинов табака, томата, картофеля из семейства Solanaceae и наперстянки Digitalis purpurea L.
(семейство Scrophulariaceae). Установлено, что у растений из семейства паслёновых имеются два разных гена ферредоксинов митохондриального типа ( MFDX1 и MFDX2 ), имеющие сходную экзон-интронную структуру (содержат по 8 экзонов) и кодирующие предшественники адренодоксино-подобных белков (204-216 aa), различающиеся прежде всего по структуре N -концевого участка белка (кодируется первым и вторым экзонами), соответствующего лидерному пептиду (рис. 4). Определена первичная структура кДНК и генов, кодирующих белки NADPH-оксидоредуктазы (MFDXR) Nicotiana tabacum L., Solanum lycopersicum L. и Solanum tuberosum L. (485 aa), структурно родственные ADXR животных. Полученные результаты указывают на несомненное сходство электронтранспортных цепей P450-зависимых монооксигеназ в митохондриях животных и растений.
Далее, с помощью электронной микроскопии на ультратонких срезах листьев табака мы показали, что в изучаемых нами трансгенных растениях табака, экспрессирующих кДНК гена CYP11A1, изменяется структурная организация митохондрий: они уменьшаются в размерах, теряют характерную округлую форму (становятся более овальными) и приобретают более плотную, гранулированную консистенцию (рис. 5). Это указывает на то, что перенесённый нами в растения цитохром P450SCC животных, по-видимому, также функционирует именно в митохондриях (накапливаясь в митохондриях растений и даже изменяя их структуру). Эти данные – первое свидетельство того, что начальные этапы синтеза стероидных гормонов могут происходить и в растительных митохондриях. Будет интересно определить все белки-участники этого процесса, в частности истинные партнёры цитохрома P450SCC в клетках растений.
Показанная нами на примере СYP11A1 функциональная совместимость стероидогенных систем Plantae и Animalia, открыла перспективу получать трансгенные растения с комбинированными стероидогенными системами таких интересных с точки зрения сельского хозяйства, практической биотехнологии и/или фармакологии видов, как томат, картофель и наперстянка. Первичные трансгенные растения томата Solanum lycopersicum L. и наперстянки Digitalis purpurea L., экспрессирующие кДНК СYP11A1 цитохрома P450 SCC из коры надпочечников животных, уже получены нами методом агробактериальной трансформации (рис. 6). В настоящее время полученные независимые трансгенные линии растений томата и наперстянки успешно адаптированы к почвенным условиям и выращены в защищенном грунте; для некоторых первичных трансгенных линий томата получены плоды с жизнеспособными семенами (рис. 7).
1 cagct gtgggggcag c ATGC TAGCA AGGGGGCTTC CCCTCCGCTC AGCCCTGGTC
56 AAAGCCTGCC CACCCATCCT GAGCTCAGTG GGGGAGGGCT GGGGCCACCA CAGGGTGGGC
116 ACTGGAGAGG GAGCTGGCAT CTCCACAAAG ACCCCTCGCC CCTACAGTGA GATCCCCTCC 176 CCTGGTGACA ATGGCTGGCT TAACCTCTAC CATTTCTGGA GGGAGAAGGG CTCACAGAGA
236 ATCCACTTTC GCCACATCGA GAACTTCCAG AAGTATGGCC CCATTTACAG GGAGAAGCTT
296 GGCAATTTGG AGTCAGTTTA TATCATTCAC CCTGAAGACG TGGCCCATCT CTTCAAGTTC
356 GAGGGATCCT ACCCAGAGAG ATATGACATC CCGCCCTGGC TGGCCTATCA CCGATATTAT
416 CAGAAACCCA TTGGAGTCCT GTTTAAGAAG TCAGGAACCT GGAAGAAAGA CCGGGTGGTC
476 CTGAACACGG AGGTGATGGC TCCAGAGGCA ATAAAGAACT TCATCCCACT GCTGAATCCA
536 GTGTCTCAGG ACTTCGTCAG CCTCCTGCAC AAGCGCATCA AGCAGCAGGG CTCCGGAAAG
596 TTTGTAGGGG ACATCAAGGA AGACCTGTTT CACTTTGCCT TTGAGTCCAT CACCAATGTC
656 ATGTTTGGGG AGCGCCTGGG GATGCTGGAG GAGACAGTGA ACCCCGAGGC CCAGAAGTTC
716 ATTGATGCCG TCTACAAGAT GTTCCACACC AGTGTCCCTC TGCTCAACGT CCCTCCAGAA
776 CTGTACCGTC TATTCAGAAC CAAGACTTGG AGGGACCATG TAGCCGCATG GGACACAATT
836 TTCAATAAAG CTGAAAAATA CACTGAGATC TTCTACCAGG ACCTGAGACG GAAAACAGAA
896 TTTAGGAATT ACCCAGGCAT CCTCTACTGC CTCCTGAAAA GTGAGAAGAT GCTCTTGGAG
956 GATGTCAAGG CCAATATTAC GGAGATGCTG GCAGGGGGTG TGAACACGAC ATCCATGACA
1016 TTGCAATGGC ACTTGTACGA GATGGCACGC AGCCTGAATG TGCAGGAGAT GCTGCGGGAG
1076 GAGGTTCTGA ATGCCCGACG CCAGGCAGAG GGAGACATAA GCAAGATGCT GCAAATGGTC
1136 CCACTTCTCA AAGCTAGCAT CAAGGAGACG CTGAGACTCC ACCCCATCTC CGTGACCCTG
1196 CAGAGATACC CTGAAAGTGA CTTGGTTCTT CAAGATTACC TGATTCCTGC CAAGACACTG
1256 GTGCAAGTGG CCATCTATGC CATGGGCCGA GACCCTGCCT TCTTCTCCAG TCCGGACAAG
1316 TTTGACCCAA CCAGGTGGCT GAGTAAAGAC AAAGACCTCA TCCACTTCCG GAACCTGGGC
1376 TTTGGCTGGG GAGTGCGGCA GTGCGTGGGC CGGCGGATCG CCGAGCTGGA GATGACCCTC
1436 TTCCTCATCC ACATTCTGGA GAACTTCAAG GTTGAAATGC AGCATATCGG TGACGTGGAC
1496 ACCATATTCA ACCTCATCCT GACGCCGGAC AAGCCCATCT TCCTTGTCTT CCGCCCCTTC
1556 AACCAGGACC CGCCCCAGGC G TGAc cggag agggcgggca ctgccctttc caccaatcca
1616 gctagctggg gtgtgggaag acggcccgag ggggtggggc catggaggta cccgcacctc
1676 cattgctcgc tcagtccaca cctcttgcac ctttctggct aggtctgacc agatgaagct
1736 ggcactcagg ggtcagctg
Рисунок 1. Нуклеотидная последовательность полноразмерной кДНК гена CYP11A1 из коры надпочечников быка, использованная нами при создании рекомбинантных плазмид для её экспрессии в растениях. Подчёркнуты стартовый (ATG) и терминирующий (TGA) кодоны и выделенный помимо этого ещё и жирным шрифтом кодон ATC, кодирующий первую аминокислоту (Ile) зрелого белка – цитохрома P450 SCC .
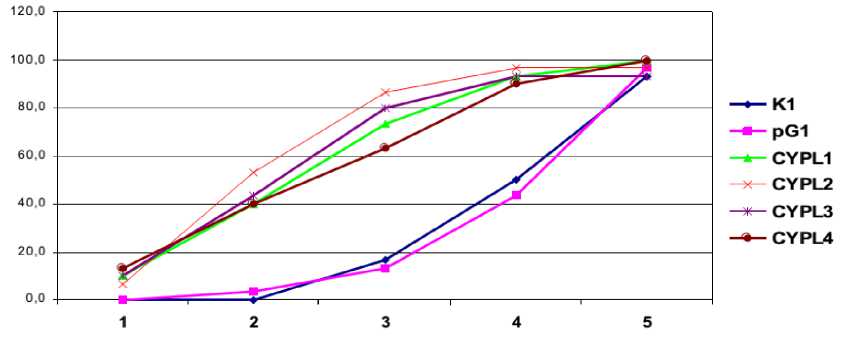
недели с момента начала плодоношения растений
Рисунок 2. Динамика образования семенных коробочек у трансгенных растений табака поколения Т3. CYPL1–CYPL4 – независимые линии трансгенных растений табака, экспрессирующих кДНК CYP11А1 ; К1 – контрольные растения дикого типа, pG1 – растения, трансформированные вектором, не содержащим кДНК CYP11A1 .

Рисунок 3. Результаты биотеста на устойчивость трансгенных растений табака, экспрессирующих кДНК гена CYP11A1 , к грибному фитопатогену Botrytis cinerea (а – поражение листа). 1 – контрольное нетрансгенное растение (поражение листа в 7 баллов); 2 – растение одной из трансгенных линий (поражение листа в 1 балл).
S1-MFDX1:
MVGFHVRRLAHRLTRSSISALLLHDSASAAHVSLLKVGSRSYNTAAKNRTRDLFPSNCSNATSP CNPGTSYGPLSRYQILLGLGHKEYCTTTGNEEKQTTSVTFVDKDGEEKHIKVPVGMSLLEAAHE NDIELEGACEGSLACSTCHVIVMDVDQYNKLEDPTDEENDMLDLAFGLTETSRLGCQVIAKPEL BGIRVALPAATRNFAVDGFKPKPH (216 aa)
S1-MFDX2:
MVGFQNLRLAHRLTGYVSRSTCELLLKIGCRGYCTEISNRVRNLFPLNYISAPLACIPRTSYTD LLRYSSTQGLRHEQFCTTAGNEEMQKISVTFVDKDGEENHIKVPVGMSMLEAAHENDIELEGAC EASLACSTCHVTVMDMEYYNKLEDPTDEENDMLDLAFALTDTSRLGCQVIAKPELDGTRLALPV ATRNFAVDGYKPKPH (207 aa)
Nt-MFDXl:
MVGFHVLRAARRLARCSLSSLLLRGSPSAFGSFLKVGCRRYNTSTRNRAGVLFPSNSLNALSAC TSETSHYPLSRYHFLQRHEQYCTAAGNEEKQTISVTFVDKBGEEKHIKVPVGMSMLEAAHENDI ELEGACEGSLACSTCHVIVMDVBYYNKLEDPTDEENDMLDLAFGLTETSRLGCQVIAKPELDGL RLALPAATRNFAVDGYEPKPH (213 aa)
Nt-MFDX2:
MVGFHVIRIARRFARCSAFGSFLKVGCRSYNTATRNRAGVLFPSNSLNALLACTSGTSHDPLSR CHFSRVLRHEQYCTTAGNEEKQTISVTFVDKDGEEKHTKVPVGMSMLEAAHENDIELEGACEGS LACSTCHVIVMDVDYYNKLEDPTDEENDMLDLAFGLTETSRLGCQVIAKPELDGLRLALPAATR NFAVEGYKPKPH (204 aa)
St-MFDXl:
MVGFHVRRLAHSLTRSSLSSLLLHDSASAAHVSLLKVGSRSYNTAAKNRIRGLFPSNCSNAISP CTPGTSYGPLSRYQILLGLRHKEYCTTTGSEEKQTISVTFVDKDGEEKHIKVPVGMSLLEAAHE NDIELEGACEGSLACSTCHVIVMDVDQYNKLEDPTDEENDMLDLAFGLTETSRLGCQVIAKPEL BGIRVALPAATRNFAVDGFKPKPH (216 aa)
St-MFDX2:
MVGFHNLRLAHRLTGCSLSSLLLHGSASTCELSLKVGCRSYCTGTSNRVRNLFPLNYISAPLAC IPRTSYTHLLRYSSTQGLRHEQFCTTAGNEGEQKISVTFVBKDGEENHIKVPVGMSMLEAAHEN BIELEGACEASLACSTCHLIVMDMEYYNKLEDPTBEENDMLDLAFALTDTSRLGCQVIAKPELB GIRLALPVATRNFAVDGYKPKPH (215 aa)
Рисунок 4. Аминокислотные последовательности митохондриальных ферредоксинов (MFDX) томата (Sl), картофеля (St) и табака (Nt), выведенные нами из установленных первичных структур впервые клонированных и секвенированных полноразмерных кДНК соответствующих генов. Sl – Solanum lycopersicum , Nt – Nicotiana tabacum , St – Solanum tuberosum .
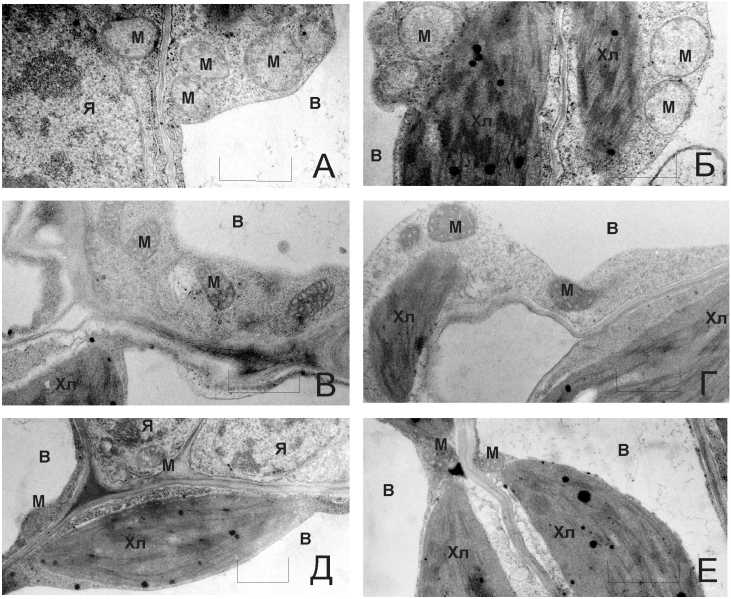
Рисунок 5. Ультраструктурная организация фрагментов клеток губчатой (А, В, Д) и столбчатой (Б, Г, Е) паренхимы семядольного листа растений дикого типа (А, Б) и трансгенных линий табака TR-2 (В, Г) и TR-7 (Д, Е), экспрессирующих кДНК CYP11A1 цитохрома Р450 SCC из коры надпочечников быка. Обозначения: М – митохондрия, Хл – хлоропласт, В – вакуоль, Я – ядро. Масштабная линейка – 0,5 мкм.

А Б
Рисунок 6. Регенерация растений наперстянки Digitalis purpurea L. на среде, содержащей селективный агент – канамицин. А – экспланты листьев растений исходного (дикого) типа. Б – экспланты листьев растений, подвергнутых агробактериальной генетической трансформации.

Рисунок 7. Плоды со зрелыми семенами первичных трансгенных растений томата Solanum lycopersicum L. (сорт Рекордсмен), экспрессирующих кДНК гена CYP11A1 из коры надпочечников быка (линия 7, растение 2 [трансгенная линия 7-2]).
ACKNOWLEDGMENT
Данная работа осуществлялась в рамках совместного российско-белорусского исследовательского проекта при финансовой поддержке Российского (РФФИ) и Белорусского республиканского (БРФФИ) фондов фундаментальных исследований.
Список литературы Mitochondria as a possible place for initial stages of steroid biosynthesis in plants
- Barnes W.M. (1994) PCR amplification of up to 35-kb DNA with high fidelity and high yield from lambda bacteriophage templates. Proc. Natl. Acad. Sci. USA, 91, 2216-2220
- Edwards D., Editor (2007) Plant Bioinformatics (Methods and Protocols) -Totowa, New Jersey.: Humana Press, 552 pp
- Edwards K., Johnstone C., Thompson C. (1991) A simple and rapid method for the preparation of plant genomic DNA for PCR analysis. Nucleic Acids Research, 19, 1349
- Kartel N.A., Shpakovski G.V., Spivak S.G., Brichkova G.G., Yarmolinsky D.G., Berdichevets I.N., Maneshina N.V. (2004) Recombinant plasmid pGBP450f for construction of transgenic plants and the approach for generation of transgenic tobacco plants with higher productivity and resistance to fungal phytopathogens: Patent of the Russian Federation No. 2237717. Bulletin of Innovations 2004. No. 10. (Application No. 2002134424. Priority from December 20, 2002. Registered October 10, 2004)
- Kartel N.A., Spivak S.G., Shpakovski G.V., Maneshina N.V., Brichkova G.G., Yarmolinsky D.G., Berdichevets I.N. (2007) Gene engineering construct expressing cDNA of the mammalian CYP11A1 gene in plants and the approach for generation of transgenic plants with higher productivity and resistance to phytopathogens: Patent of the Republic of Belarus No. 9201. (Application No. а20021122. Priority from December 30, 2002. Registered January 25, 2007)
- Khaliluev M.R., Mamonov A.G., Smirnov A.N., Kharchenko P.N., Dolgov S.V. (2011) Expression of genes encoding chitin-binding proteins (PR-4) and hevein-like antimicrobial peptides in transgenic tomato plants enhanced resistance to Phytophthora infestans. Russ. Agricult. Sci., 4, 297-302
- Lindemann P., Luckner M. (1997) Biosynthesis of pregnane derivatives in somatic embryos of Digitalis lanata. Phytochemistry, 46, 507-513
- Luzikov V.N., Novikova L.A., Spiridonova V.A., Isaeva L.V., Whelan J., Hugosson M., Glazer E. (1994) Design of heterologous mitochondria: import of cattle cytochrome P-450SCC precursors in plant mitochondria. Biochemistry (Moscow) , 59, 1098-1101
- Miller W.L. (2013) Steroid hormone synthesis in mitochondria. Molecular and Cellular Endocrinology, 379, 62-73
- Nelson D.R., Schuler M.A., Paquette S.M., Werck-Reichhart D., Bak S. (2004) Comparative genomics of rice and arabidopsis. Analysis of 727 cytochrome P450 genes and pseudogenes from a monocot and a dicot. Plant Physiology, 135, 756-772
- Pauli G.F., Friesen J.B., Gödecke T., Farnsworth N.R., Glodny B. (2010) Occurrence of progesterone and related animal steroids in two higher plants. Journal of Natural Products, 73, 338-345
- Reynolds E.S. (1963) The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J. Cell Biol., 17, 208-212
- Shpakovski G.V., Lebedenko E.N. (1997) Molecular cloning and characterization of cDNA of the rpc10+ gene encoding the smallest subunit of nuclear RNA polymerases of Schizosaccharomyces pombe. Russian Journal of Bioorganic Chemistry, 23, 441-448
- Shpakovski G.V., Shematorova E.K. (1999) Rpc19 and Rpc40, two alpha-like subunits shared by nuclear RNA polymerases I and III, are interchangeable between the fission and budding yeasts. Current Genetics, 36, 208-214
- Shpakovski G.V., Spivak S.G., Mazanik S.N., Akhrem A.A. (1992) Study of cytochrome P450XIA1 genes structure and their expression in geterologous systems. Proceedings of the II (Second) All-Union Plan-Report Conference on the direction ”Genetic and Cellular Engineering” (November-December 1991, Pushchino-on-Oka), 58-59
- Simerský R., Novák O., Morris D.A., Pouzar V., Strnad M. (2009) Identification and quantification of several mammalian steroid hormones in plants by UPLC-MS/MS. Journal of Plant Growth Regulation, 28, 125-136
- Spivak S.G., Berdichevets I.N., Litvinovskaya R.P., Drach S.V., Kartel N.A., Shpakovski G.V. (2010) Some peculiarities of steroid metabolism in transgenic Nicotiana tabacum plants bearing the CYP11A1 cDNA of cytochrome P450SCC from the bovine adrenal cortex. Russian Journal of Bioorganic Chemistry, 36, 224-232
- Spivak S.G., Berdichevets I.N., Yarmolinsky D.G., Maneshina N.V., Shpakovski G.V., Kartel N.A. (2009) Construction and characteristics of transgenic tobacco Nicotiana tabacum L. plants expressing CYP11A1 cDNA encoding cytochrome P450SCC. Russian Journal of Genetics, 45, 1067-1073
- Ylstra B., Touraev A., Brinkmann A.O., Heberle-Bors E., Tunen A. (1995) Steroid hormones stimulate germination and tube growth of in vitro matured tobacco pollen. Plant Physiology, 107, 639-643
- Zhu Y.Y., Machleder E.M., Chenchik A., Li R., Siebert P.D. (2001) Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques, 30, 892-897


