Митохондриальная дезоксирибонуклеиновая кислота как ранний маркер развития системного воспалительного ответа и органной недостаточности у кардиохирургических пациентов
Автор: Забелина Т.С., Гребенчиков О.А., Скрипкин Ю.В., Яворовский А.Г., Лихванцев В.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология и реаниматология
Статья в выпуске: 1 т.23, 2019 года.
Бесплатный доступ
Цель Изучить значимость определения содержания митохондриальной дезоксирибонуклеиновой кислоты в плазме крови кардиохирургических пациентов в раннем послеоперационном периоде для прогнозирования системного воспалительного ответа и полиорганной недостаточности. Методы Проведено пилотное проспективное обсервационное когортное исследование взаимосвязи уровня митохондриальной дезоксирибонуклеиновой кислоты в плазме крови и частоты развития системного воспалительного ответа, острого почечного повреждения, острой сердечной недостаточности и острого респираторного дистресс-синдрома у 85 кардиохирургических больных. Результаты Уровень митохондриальной дезоксирибонуклеиновой кислоты, измеренный после окончания операции, показал возможность прогнозирования системного воспалительного ответа в течение 1-2 сут. послеоперационного периода (площадь под кривой AUC = 0,74). При определении точки cut-off обнаружено, что митохондриальная дезоксирибонуклеиновая кислота более 0,54 нг/мл с чувствительностью 73,7% и специфичностью 66% свидетельствует о системном воспалительном ответе в раннем послеоперационном периоде. Соотношение шансов получить острое почечное повреждение у пациентов с системным воспалительным ответом или без него составило 3,4 [доверительный интервал (ДИ)1,27-9,08]; p = 0,0149; острой сердечной недостаточности - 5,7 [ДИ 2,20-14,84]; р = 0,0003 и острого респираторного дистресс-синдрома - 3,6 [ДИ 1,01-11,10], р = 0,047. Заключение Выявлена взаимосвязь митохондриальной дезоксирибонуклеиновой кислоты, определенной сразу после операции, и частоты развития системного воспалительного ответа. Подтверждена гипотеза о связи системного воспалительного ответа и частоты возникновения острого почечного повреждения, острой сердечной недостаточности и острого респираторного дистресс-синдрома. Повышенная митохондриальная дезоксирибонуклеиновая кислота является ранним предиктором острой сердечной и почечной недостаточности, острого респираторного дистресс-синдрома в раннем послеоперационом периоде у кардиохирургических больных.
Митохондриальная дезоксирибонуклеиновая кислота, острая почечная недостаточность, послеоперационное осложнение, системный воспалительный ответ
Короткий адрес: https://sciup.org/142230679
IDR: 142230679 | DOI: 10.21688/1681-3472-2019-1-33-41
Текст научной статьи Митохондриальная дезоксирибонуклеиновая кислота как ранний маркер развития системного воспалительного ответа и органной недостаточности у кардиохирургических пациентов
Цитировать: Забелина Т.С., Гребенчиков О.А., Скрипкин Ю.В., Яворовский А.Г., Лихванцев В.В. Митохондриальная дезоксирибонуклеиновая кислота как ранний маркер развития системного воспалительного ответа и органной недостаточности в кардиохирургии. Патология кровообращения и кардиохирургия. 2019;23(1):33-41.
Ежегодно в мире выполняется около 7 млн инвазивных кардиохирургических вмешательств [ 1 ]. Несмотря на высокую эффективность и безопасность методов общей анестезии, частота периоперационных осложнений в кардиохирургии достаточно высокая: по свидетельству F. Ji и соавт. [ 2 ], она может достигать 30%, а по данным H. Cheng [ 3 ], даже превышать 60%. Летальность, ассоциированная с развитием периоперационных осложнений при аортокоронарном шунтировании, составляет 2–3% [ 4 ].
Очевидно, прогнозирование и ранняя диагностика периоперационных осложнений могут существенно облегчить процесс их профилактики и лечения или, по крайней мере, уменьшить выраженность вызываемых повреждений. Экспертное сообщество рекомендует с указанной целью проводить исследования уровня тропонина и NT-proBNP в раннем послеоперационном периоде [ 5, 6 ]. Однако данные тесты эффективны только при прогнозировании осложнений сердечно-сосудистой системы, а не в оценке риска системного воспалительного ответа или острого почечного повреждения (ОПП).
Теоретически таким маркером могла бы быть субстанция, появление которой у пациентов после операций на сердце инициирует последовательность событий, приводящих к полиорганной недостаточности. Молекулярные паттерны, связанные с повреждением (англ. Damage-Associated Molecular Patterns, DAMPs), и митохондриальная дезоксирибонуклеиновая кислота (мтДНК) рассматриваются как наиболее вероятные биологически активные субстанции [ 7 ]. Повышение концентрации мтДНК наблюдается при множестве патологических состояний: сепсисе [ 8 ], легочной эмболии [ 9 ], раке [ 10 ], атеросклерозе [ 11 ]. Повышение концентрации мтДНК в крови пациентов с травмой является прогностическим маркером, коррелирующим с тяжестью травмы и летальностью [ 12–16 ] .
Гипотеза исследования: митохондриальная дезоксирибонуклеиновая кислота является маркером возникновения и интенсивности течения системного воспалительного ответа.
Цель исследования: изучить значимость определения содержания мтДНК в плазме крови кардиохирургических пациентов в раннем послеоперационном периоде для прогнозирования развития системного воспалительного ответа (СВО) и полиорганной недостаточности.
Методы
Общая характеристика больныхи методов исследования
Проведено пилотное проспективное обсервационное когортное исследование взаимосвязи уровня мтДНК в плазме крови и частоты развития СВО, ОПП, острого респираторного дистресс-синдрома и острой сердечной недостаточности у кардиохирургических больных. Исследование получило одобрение этического комитета ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (протокол № 4, 19.01.2017).
Информированное согласие на участие в исследовании подписали 103 больных, госпитализированных в отделение кардиохирургической реанимации ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, однако, в соответствии с сформулированными ниже критериями, в финальный протокол включены только 85 пациентов (рис. 1).
Критерии включения:
-
1) возраст 45–65 лет;
-
2) добровольное информированное согласие;
-
3) виды оперативных вмешательств: протезирование клапанов сердца; аортокоронарное шунтирование с искусственным кровообращением; аортокоронарное шунтирование без искусственного кровообращения.
Критерии невключения:
-
1) морбидное ожирение с индексом массы тела более 35 кг/м2;
-
2) инфаркт или инсульт в предшествующие 6 мес.;
-
3) инфекционное заболевание за месяц до операции;
-
4) почечная недостаточность в анамнезе (исходный уровень креатинина или мочевины в крови выше референсных значений);
-
5) фракция изгнания левого желудочка менее 30%.
Критерии исключения: повторная операция или чрескожное коронарное вмешательство в течение 30 дней после первой операции.
Пациентов разделили на три группы: протезирование клапанов сердца в условиях искусственного кровообращения; аортокоронарное шунтирование без искусственного кровообращения; аортокоронарное шунтирование в условиях искусственного кровообращения.
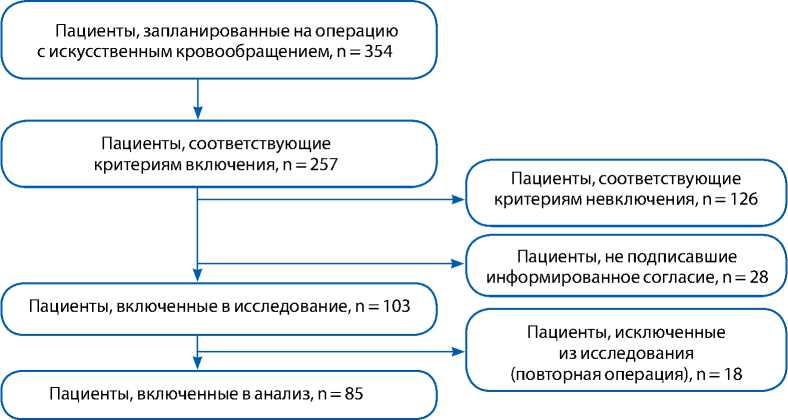
Рис. 1. Схема отбора пациентов
Подготовка, выделение дезоксирибонуклеиновой кислоты из плазмы крови
На периоперационном периоде у пациентов забирали 3 мл периферической венозной крови. Кровь, смешанную с этилендиаминтетраук-сусной кислотой (1,5 мг/мл), центрифугировали в течение 10 мин при 3 000 g. Отобранную плазму дополнительно центрифугировали 10 мин при 10 000 g. Верхнюю порцию плазмы помещали в микроцентрифужную пробирку объемом 0,5 мл и замораживали при –20 °С до выделения ДНК. Для контроля эффективности выделения в каждый образец плазмы объемом 0,4 мл перед процедурой выделения вносили по 10 мкл (1,7 нг/мкл) экзогенной контрольной ДНК на основе плазмиды pBlueScriptSKII(–) размером 8 кб.
Выделение ДНК из 100 мкл плазмы крови выполняли с помощью набора Quick'gDNA Blood MiniPrep (Zymo Research, США) по протоколу производителя. Количественную полимеразную цепную реакцию в реальном времени проводили в амплификаторе iCycler (Bio'Rad, США) со смесью следующего состава: 5 мкл анализируемого образца; 10 мкл смеси Б Eva Green («Синтол», Россия); 0,5 мкл смеси каждого из специфичных праймеров (10 мкМ); 9,5 мкл деионизованной воды. Каждый образец ДНК использовали в качестве матрицы в трех идентичных полимеразных цепных реакциях. Относительное содержание мтДНК определяли с помощью метода полимеразной цепной реакции в реальном времени [16].
Уровень мтДНК в крови определяли на следующих этапах:
-
1) мтДНК1 (базовое значение) — уровень мтДНК в крови после индукции анестезии;
-
2) мтДНК2 — уровень мтДНК в крови после окончания операции;
-
3) мтДНК3 — уровень мтДНК в крови через 12 ч после операции;
-
4) мтДНК4 — уровень мтДНК в крови через 72 ч после операции.
Диагностика исследуемых осложнений
Системный воспалительный ответ определен как наличие двух и более критериев, предложенных American College of Chest Physicians / Society of Critical Care Medicine: температура более 38 или менее 36 °C; частота сердечных сокращений более 90 уд./мин; частота дыхательных движений более 20 в мин или pCO2 менее 32 мм рт. ст.; лейкоцитоз более 12 000 или лейкопения менее 4 000 [ 17 ].
Острое почечное повреждение по критериям RIFLE [18] определено как увеличение сывороточного содержания креатинина в 1,5 раза и более, или снижение скорости клубочковой фильтрации на 25% и более, или снижение темпа мочевыделения менее 0,5 мл/кг × ч в течение 6 ч и более.
Острая сердечная недостаточность определена как потребность в инфузии инотропных препаратов (адреналин, добутамин) в дозе, эквивалентной 5 мкг/кг × мин добутамина или более на протяжении не менее 6 ч после операции.
Шкала вазопрессорно-инотропной поддержки
Суммарную дозу инотропных препаратов и вазопрессоров рассчитывали по формуле: добутамин (мкг/кг × мин) + допамин (мкг/кг × мин) + 100 × адреналин (мкг/кг × мин) [ 19 ]. Острый респираторный дистресс-синдром определялся как наличие очаговых изменений в легочной ткани, возникших в течение недели после хирургического вмешательства и не связанных с задержкой жидкости, а также по степени снижения индекса оксигенации (PaO2/FiO2) [ 20 ].
Статистический анализ
Количественные параметры предварительно анализировались на нормальность распределения тестами Лиллиефорса и Шапиро – Уилка. Для сравнения количественных величин, не имеющих нормального распределения, применялся U-критерий Манна – Уитни.
Для оценки качества предикторов клинических исходов операции использовались логистическая регрессия и ROC-анализ. В логистической регрессии применяли статистику хи-квадрат (разность между функциями правдоподобия нулевой и полной моделей, свидетельствующая о том, насколько значимо независимые переменные модели влияют на зависимую). При ROC-анализе оценивался параметр AUC и определялась точка отсечения по соотношению чувствительности (Se) и специфичности (Sp) критериев: требование баланса между чувствительностью и специфичностью:
Se ~ Sp: Cut off= min |Se – Sp|, где Cut off — пороговое значение, Se — чувствительность, Sp — специфичность.
Для анализа динамики показателей с ненормальным распределением применялся ранговый дисперсионный анализ по Фридману с апостериорным анализом с использованием непараметрического теста Уилкоксона. Средние значения нормально распределенных количественных параметров представлены средним арифметическим со стандартным отклонением (M ± Ϭ ), а ненормально распределенных — медианой с межквартильным интервалом (Me [25–75%]).
Различия принимались статистически значимыми при уровне р<0,05. Для расчетов использовались программы Statistica 10.0 (StatSoft, Inc.) и MedCalc 12.5.0.0 (MedCalc Software bvba). Вводили данные (ко- личество позитивных и негативных исходов в каждой группе (уровень ДНК выше или ниже избранного критерия)) в программу MedCalc, рассчитывающую отношение шансов и 95% доверительный интервал.
Результаты
Общая характеристика больных, включенных в исследование, представлена ниже.
Пациентов, n85
Возраст, лет 61 ± 9
Фракция выброса, % 58 ± 10
Пол, мужской/женский, n60/25
Операция на клапанах, n24
Аортокоронарное шунтирование без искусственного кровообращения, n
Аортокоронарное шунтирование с искус- ственным кровообращением, n
Примечание. Данные представлены как среднее значение ± стандартное отклонение
Базовое значение мтДНК в объединенной популяции больных составило 0,21 [0,15–0,31] нг/мл. К окончанию операции на сердце исследуемый показатель возрос в 3,5 раза, р<0,01. Через 12 ч после операции рост продолжался, уровень мтДНК превысил исходные значения в 4,3 раза (p<0,01). К исходу третьих суток после операции наметилась тенденция к снижению искомого показателя, хотя мтДНК превышала базовый уровень почти в 2 раза, р<0,01. Динамика уровня мтДНК в крови на этапах периоперационного периода в объединенной когорте пациентов представлена ниже.
|
Митохондриальная дезоксирибонуклеиновая кислота в крови |
Медиана |
|
1 нг/мл |
0,21 [0,15–0,31] |
|
2 нг/мл |
0,73 [0,33–0,88] |
|
3 нг/мл |
0,91 [0,57–1,00] |
|
4 нг/мл |
0,40 [0,23–0,55] |
Таким образом, динамика уровня мтДНК подтверждает предположение, что массивный клеточный цитолиз, как следствие выполнения обширных и травматичных операций на сердце, приводит к высвобождению изучаемой субстанции.
Уровень мтДНК в исходе не имел статистически значимых отличий при сравнении подгрупп пациентов, которым выполнены протезирование клапанов
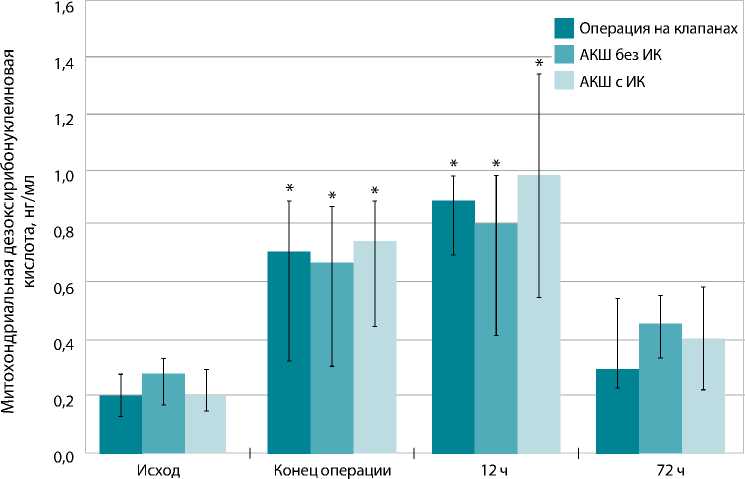
Рис. 2. Митохондриальная дезоксирибонуклеиновая кислота в крови пациентов на этапах исследования
Примечание. Данные представлены в виде медианы. I — межквартильный интервал; * значимое отличие относительно исхода, p<0,05; АКШ — аортокоронарное шунтирование; ИК — искусственное кровообращение
сердца и аортокоронарное шунтирование (АКШ) в условиях искусственного кровообращения или без него (рис. 2).
Далее во всех подгруппах наблюдалась сходная с описанной для общей совокупности пациентов динамика содержания мтДНК. Полное отсутствие статистически значимых межгрупповых отличий на всех выделенных этапах исследования (рис. 2) позволило провести дальнейший анализ без учета подгрупп, в которые попадал каждый из пациентов.
Системный воспалительный ответ в раннем послеоперационном периоде развился у 55% пациентов после операций на клапанах сердца, у 38% пациентов после АКШ без ИК и у 45% пациентов после АКШ с ИК, разница статистически не значима, р>0,1. Средняя частота развития СВО в когорте — 46%.
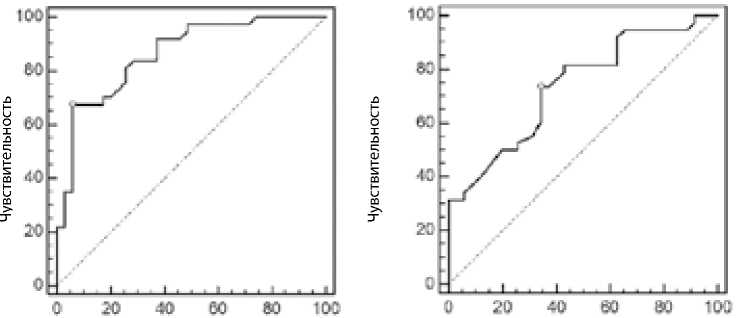
Митохондриальная дезоксирибонуклеиновая кислота, измеренная после окончания операции, показала потенциальную возможность прогнозирования СВО в течение 1–2 сут. послеоперационного периода (площадь под кривой AUC = 0,74). При определении точки cut-off обнаружено, что митохондриальная дезоксирибонуклеиновая кислота более 0,54 нг/мл с чувствительностью 73,7% и специфичностью 66% свидетельствует о системном воспалительном ответе в раннем послеоперационном периоде.
Митохондриальная дезоксирибонуклеиновая кислота, измеренная через 12 ч после операции, показала прогностический уровень (площадь под кривой AUC = 0,86) в отношении риска СВО в течение 1–2 сут. послеоперационного периода. При определении точки cut-off найдено, что митохондриальная дезоксирибонуклеиновая кислота более 0,98 нг/мл с чувствительностью 67,6% и специфичностью 94% доказывает развитие СВО в раннем послеоперационном периоде (рис. 3).
Как и предполагалось, чувствительность и специфичность теста с определением мтДНК для прогнозирования развития СВО увеличивались на третьем этапе исследования. Однако было принципиально выяснить, что и анализ, взятый у пациентов непосредственно после окончания операции, показал прогностические возможности метода.
Острое почечное повреждение развилось у 37% пациентов после операций на клапанах сердца, у 21% пациентов после АКШ без ИК и у 25% пациентов после АКШ с ИК, разница не значима, р>0,1. Средняя частота развития ОПП в когорте — 27%.
По времени возникновения ОПП пациенты распределились следующим образом: сразу после окончания операции у 2 (3%) больных; к исходу первых мтДНК2
мтДНК3
Специфичность
Специфичность
Рис. 3. ROC-кривые для прогнозирования риска системного воспалительного ответа в зависимости от уровня митохондриальной дезоксирибонуклеиновой кислоты в крови
Примечание. мтДНК2 — митохондриальная дезоксирибонуклеиновая кислота после операции, мтДНК3 — митохондриальная дезоксирибонуклеиновая кислота через 12 ч после операции суток — у 8 (12%); на вторые сутки еще у 8 (12%) и, наконец, на третьи сутки — у 3 (4%) больных.
Соотношение шансов получить ОПП у пациентов с СВО и без него составило 3,4 [1,27–9,08], p = 0,0149. Таким образом, подтверждается гипотеза о связи СВО и возникновения острой почечной недостаточности.
Сердечная недостаточность зарегистрирована у 58% пациентов после операций на клапанах сердца, у 21% пациентов после АКШ без ИК и у 43% после АКШ с ИК соответственно, р = 0,08. Средняя частота развития сердечной недостаточности в когорте — 40%. Соотношение шансов получить сердечную недостаточность для пациентов с СВО и без него — 5,7 [2,20–14,84], р = 0,0003.
Острый респираторный дистресс-синдром зарегистрирован у 15% пациентов после операций на клапанах сердца, у 16% пациентов после АКШ без ИК и у 21% после АКШ с ИК соответственно, р>0,05. Средняя частота развития острого респираторного дистресс-синдрома в когорте — 17%. Соотношение шансов получить острый респираторный дистресс-синдром для пациентов с СВО и без него — 3,6 [1,01–11,10], р = 0,047.
Обсуждение
Впервые показано, что определение уровня мтДНК в пробе плазмы крови кардиохирургических пациен- тов, взятой непосредственно после операции, является достаточно точным и надежным предиктором системного воспалительного ответа, острой сердечной, почечной недостаточности и острого респираторного дистресс-синдрома.
Установлено, что мтДНК повышается сразу после окончания операции, достигает пика через 12 ч после вмешательства и снижается к концу 4-х сут. послеоперационного периода.
Ранее C. Qin и соавт. [ 21 ] получили похожий результат. Они выявили взаимосвязь между уровнем мтДНК и уровнем воспалительных цитокинов, таких как фактор некроза опухоли, интерлейкин-6, интерлейкин-8, у кардиохирургических пациентов.
В нашем исследовании на каждом этапе уровень мтДНК в большей степени определяется оперативным вмешательством, чем видом оперативного вмешательства. Более того, малосущественным оказалось и то, используется ли искусственное кровообращение в процессе проведения операции. Таким образом, становится понятным, почему не наблюдается существенных отличий в клинических исходах после АКШ, выполняемого в режиме искусственного кровообращения и без него [ 22 ].
Тест с определением мтДНК продемонстрировал прогностические возможности развития СВО. По соотношению чувствительность/специфичность дан- ный метод не уступает прокальциотониновому тесту [23], но, по-видимому, превосходит по временным характеристикам. Насколько известно, для прокальцитонина не описана возможность прогнозирования СВО по пробе, взятой сразу после операции [24].
Системный воспалительный ответ играет важную роль в процессе возникновения ОПП после кардиохирургических операций [ 25, 26 ] . Данное положение подтверждено и в ходе исследования. Более того, мы показали, что СВО играет важную роль и в процессе развития острой сердечной недостаточности, ОПП и острого респираторного дистресс-синдрома в ранние сроки после кардиохирургических вмешательств.
Международные рекомендации требуют исследования уровня тропонина и NT-proBNP в раннем послеоперационном периоде для прогнозирования возможных осложнений со стороны сердечно-сосудистой системы [ 5, 6 ]. Согласно указанным рекомендациям, увеличение уровня NT-proBNP, определяемое в крови больных сразу после операций, повышает риск острой сердечной недостаточности в 3,5 раза. В соответствии с полученными результатами, тест с определением мтДНК прогностически более значим, чем NT-proBNP и тропонин.
Ранее показано, что повышение концентрации мтДНК в крови пациентов с травмой может являться прогностическим маркером, коррелирующим с тяжестью травмы и летальностью [ 12–16 ] . Аналогичных исследований в отношении периоперационного периода плановых хирургических вмешательств не проводилось.
Ограничения
Работа выполнена в форме пилотного исследования с ограниченной выборкой. Возможно, именно поэтому не удалось выявить межгрупповых отличий в содержании мтДНК в крови пациентов после АКШ и протезирования клапанов сердца.
Заключение о преимуществе во времени перед тестом с определением прокальцитонина носит гипотетический характер, отсутствие возможности проведения количественного анализа прокальцитонина не позволило сделать сравнение в рамках проведенного исследования.
Заключение
В результате исследования выявлена взаимосвязь между уровнем мтДНК, определенным сразу после окончания операции, и частотой развития СВО. Повышенный уровень мтДНК является ранним предиктором острой сердечной и почечной недостаточности и острого респираторного дистресс-синдрома в раннем послеоперационном периоде у кардиохирургических больных.
Финансирование
Работа выполнена в рамках бюджетного финансирования ГБУЗ МО МОНИКИ им. М.Ф. Владимирского по теме НИР 1.6 «Оксидантный стресс в кардиохирургии: новые маркеры — предикторы развития осложнений и патогенетически обоснованная терапия».
Список литературы Митохондриальная дезоксирибонуклеиновая кислота как ранний маркер развития системного воспалительного ответа и органной недостаточности у кардиохирургических пациентов
- Patel M.R., Jneid H., Derdeyn C.P., Klein L.W., Levine G.N., Lookstein R.A., White C.J., Yeqhiazarians Y., Rosenfield K. Arteriotomy closure devices for cardiovascular procedures: a scientific statement from the American Heart Association. Circulation. 2010;122(18):1882-93. PMID: 20921445. http://doi. orq/ DOI: 10.1161/CIR.0b013e3181f9b345
- Ji F., Li Z., Nquyen H., Younq N., Shi P, Fleming N., Liu H. Perioperative dexmedetomidine improves outcomes of cardiac surgery. Circulation. 2013;127(15):1576-84. PMID: 23513068, PMCID: PMC3979354. DOI: 10.1161/CIRCULATIONAHA.112.000936
- Cheng H., Li Z., Younq N., Boyd D., Atkins Z., Ji F., Liu H. The Effect of Dexmedetomidine on Outcomes of Cardiac Surgery in Elderly Patients. J Cardiothorac Vasc Anesth. 2016;30(6):1502-8. PMID: 27435836, PMCID: PMC5010787. 10.1053/i. jvca.2016.02.026 DOI: 10.1053/i.jvca.2016.02.026
- Landoni G., Lomivorotov V.V., Nigro Neto C., Monaco F., Pasyuga V.V., Bradic N., Lembo R., Gazivoda G., Likhvantsev V.V., Lei C., Lozovskiy A., Di Tomasso N., Bukamal N.A.R., Silva F.S., Bautin A.E., Ma J., Crivellari M., Farag A.M.G.A., U valiev N.S., Carollo C., Pieri M., Kunstyr J., Wang C.Y., Belletti A., Hajjar L.A., Grigoryev E.V., Agro F.E., Riha H., El-Tahan M.R., Scandroglio A.M., Elnakera A.M., Baiocchi M., Navalesi P, Shmyrev V.A., Severi L., Hegazy M.A., Crescenzi G., Ponomarev D.N., Brazzi L., Arnoni R., Tarasov D.G., Jovic M., Calabro M.G., Bove T., Bellomo R., Zangrillo A.; MYRIAD Study Group. Volatile anesthetics versus total intravenous anesthesia for cardiac surgery. N Engl J Med. 2019;380(13):1214-25. DOI: 10.1056/NEJMoa1816476 PMID: 30888743
- Kristensen S.D., Knuuti J., Saraste A., Anker S., B0tker H.E., De Hert S., Ford I., Gonzalez Juanatey J.R., Gorenek B., Heyndrickx G.R., Hoeft A., Huber K., lung B., Kjeldsen K.P., Longrois D., Luescher T.F., Pierard L., Pocock S., Price S., Roffi M., Sirnes P.A., Uva M.S., Voudris V., Funck-Brentano C.; Authors/ Task Force Members. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur J Anaesthesiol. 2014;31 (10):517-73. http://doi. org/ DOI: 10.1093/eurheartj/ehu282 PMID: 25127426


