Многосегментарная этапная реконструкция позвоночника васкуляризированным трансплантатом ребра в условиях задней инструментальной фиксации (экспериментальное исследование).Сообщение 1
Автор: Матюшин А.Ф., Карлов А.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2005 года.
Бесплатный доступ
Многосегментарная передняя реконструкция грудного отдела позвоночника и позвоночного канала свободными васкуляризированными трансплантатами из малоберцовой кости при грубых деформациях позвоночника нерациональна. Передний трансплантат-распорка из ребра на питающей ножке применяется редко, поскольку непрочен, искривлен, а метод пластики не имеет экспериментально-теоретического обоснования. На 45 взрослых беспородных собаках выполнено экспериментально-теоретическое обоснование сложного метода этапной реконструкции позвоночника и позвоночного канала. Отрабатывались методы транспозиции спинного мозга и пластики многосегментарного вентрального дефекта позвоночника трансплантатом-распоркой из ребра на питающей ножке в условиях задней инструментальной фиксации. Эффективность реконструкции опорных структур при формировании переднего блока через год после пластики составила 92,8 %. Исход реконструкции зависел от сохранности кровоснабжения трансплантата ребра и выживания его остеогенных клеток. Это обеспечивало быструю консолидацию и органо-типическую трансформацию ребра в мощный регенерат в виде колонны. Реконструкция позвоночного канала в 11,2 % случаев приводила к миелопатии из-за формирования передней грыжи спинного мозга.
Грубые деформации позвоночника, передний опорный трансплантат из ребра на питающей нож-ке, передняя реконструкция позвоночника и позвоночного канала, передняя грыжа спинного мозга
Короткий адрес: https://sciup.org/142120852
IDR: 142120852
Текст научной статьи Многосегментарная этапная реконструкция позвоночника васкуляризированным трансплантатом ребра в условиях задней инструментальной фиксации (экспериментальное исследование).Сообщение 1
В комплексе хирургического лечения грубых, фиксированных и неврологически осложненных деформаций позвоночника приемы декомпрессии или транспозиции спинного мозга (СМ), многосегментарной вентральной костнопластической реконструкции в сочетании с задней инструментальной стабилизацией играют ведущую роль [1, 9-17, 19, 21, 23, 24, 29, 30, 33, 34, 36]. Практика показала, что применение свободных трансплантатов из малой берцовой кости (МБК) при подобных методах реконструкции дает до 60 % осложнений, связанных с разрушением переднего опорного трансплантата [16, 29]. Сохранение или восстановление кровоснабжения в пересаживаемой кости позволило повысить эффективность сложных методов реконструкции вентральных отделов позвоночника до 93-95 % [2, 3, 18, 27], но не все способы васкуляризированной трансплантации отвечают необходимым требованиям. В отличие от пластики трансплантатом из ребра на питающей ножке, свободную васкуляризированную транс- плантацию МБК на грудном и поясничном уровнях нельзя признать рациональной. Нередко в комплексе такой реконструкции формирование искусственного сосудистого анастомоза бывает невозможно или затруднено настолько, что продолжительность операции увеличивается до 22 часов [22, 25, 28, 38-40]. Несмотря на все преимущества, метод комплексной этапной реконструкции позвоночника и позвоночного канала с применением реберного трансплантата на питающей ножке в условиях задней инструмен- тальной фиксации используется крайне редко, поскольку недостаточно отработан и не имеет экспериментально-теоретического обоснования.
Цель проводимой работы экспериментально-теоретическое обоснование и совершенствование метода этапной многосегментарной реконструкции позвоночника и позвоночного канала трансплантатом из ребра на питающей ножке в условиях задней инструментальной фиксации.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено две серии опытов по три группы в каждой на 45 взрослых беспородных собаках со средним возрастом 2,9±1,53 лет, средним весом 13,4±3,92 кг, сроки наблюдения 1 год.
Все хирургические вмешательства осуществлялись в два этапа с перерывом между этапами 25-30 дней. У собак первой серии на первом этапе из заднего доступа позвоночник фиксировали дистрактором с двумя элементами опоры за полдужки Th3/4 и Th13/L1. На втором этапе осуществляли переднее вмешательство. Во второй серии опытов, наоборот, на первом этапе выполняли переднее вмешательство, а заднее вторым этапом (табл. 1).
В первой и четвертой группах скелетирование задних отделов позвоночника Th2-L1 осуществляли слева и дистрактор устанавливали слева; во второй и пятой только справа; в третьей и шестой скелетирование осуществлялось по обеим сторонам от остистых отростков, но дистрактор устанавливался справа. Переднее вмешательство осуществляли с применением трансторакального доступа по 6-му межреберью справа. Тотально удалялось три (у 26 собак) или четыре (у 19 собак) тела позвонка (Th6-Th8 или Th6-Th9), при этом сегментарные сосуды (a. et v. intercostalis posterior) удаляемых тел позвонков, и в том числе питающих транспонируемое ребро, перевязывались. У двух собак каждой группы осуществлялось моделирование передней транспозиции СМ без пересечения его корешков посредством вскрытия позвоночного канала спереди на уровнях Th7-8 или Th8-9 на всю его ширину с удалением перидуральной жировой клетчатки. По ходу доступа из 6-го ребра формировали трансплантат на питающей ножке и размещали его в дефекте. Для этого скелетированные от мягких тканей концы трансплантата вставляли в гнезда, сформированные в телах верхнего и нижнего позвонков, отграничивающих дефект (рис. 5, а).
Регистрировалась продолжительность операции, объем кровопотери и вливаемых жидкостей, а также характер и количество осложне- ний. Животные взвешивались перед каждой рентгенографией. По функциональным тестам у собак оценивался неврологический статус и способность активно передвигаться согласно неврологической классификации I.M. Tarlov (1957) (табл. 2) [35]. По обзорным спондило-граммам с использованием приемов планиметрии осуществлялось измерение углов сколиоза и кифоза (в градусах), изменения длины позвоночника в зоне дефекта (мм), площади рентгеновской тени трансплантата ребра (в мм2) и его ширины (в мм). Производился подсчет относительных изменений (в %) площади рентгеновской тени трансплантата, его ширины и протяженности дефекта по формуле (% = [абсолютное значение через год 100] : мм2 или мм, исходно). Наличие магистральных питающих артерий в перемещенном ребре через год после пластики подтверждалось посмертной артериографией после нагнетания 45-50 % взвеси желтого свинцового сурика в толуоле через устья артерий (a. intercostalis posterior), впадающих в аорту сегментов Th5,6,7,8,9,10,11. По рентгенограммам срезов макропрепаратов толщиной 35 мм изучались форма и структура регенерата, измерялись его размеры и толщина кортикального и губчатого слоев. Детально исследовались зоны сращения и формирование блока.
Для микроскопического исследования из каждого макропрепарата готовились три блока (всего 129 блоков + 12 препаратов поперечных срезов СМ из зоны моделирования транспозиции СМ). Срезы производились на различной глубине и окрашивались пикрофуксином по Ван-Гизону и гематоксилин-эозином. Все данные регистрировались в протоколах и таблицах. Статистическая обработка материала производилась методами вариационной статистики на персональном компьютере класса Pentium IV с применением стандартного табличного редактора Exel 4.0.
Таблица 1
Распределение животных по сериям и группам эксперимента с учетом последовательности этапов и вида доступа
|
№ серий |
Последовательность этапов |
№ групп |
Локализация доступа |
Кол-во |
|
I |
|
1 |
I этап (доступ слева) ЗИФ II этап (доступ справа) ПР |
7 |
|
2 |
I этап (доступ справа) ЗИФ II этап (доступ справа) ПР |
8 |
||
|
3 |
I этап (доступ с обеих сторон) ЗИФ II этап (доступ справа) ПР |
7 |
||
|
II |
|
4 |
I этап (доступ справа) ЗИФ II этап (доступ слева) ПР |
8 |
|
5 |
I этап (доступ справа) ЗИФ II этап (доступ справа) ПР |
8 |
||
|
6 |
I этап (доступ справа) ЗИФ II этап (доступ с обеих сторон)ПР |
7 |
||
|
Всего оперировано |
45 |
|||
ЗИФ – задняя инструментальная фиксация; ПР – передняя реконструкция.
Таблица 2
Классификация I.M. Tarlov (1957) для оценки неврологического статуса у подопытных животных
|
Баллы |
Функциональные проявления субъекта |
|
6 |
Полная двигательная активность |
|
5 |
Походка нормальна, но не способен прыгать |
|
4 |
Способен ходить с небольшими затруднениями |
|
3 |
Способен ходить с большими затруднениями |
|
2 |
Способен поднимать задние конечности и делать шаги |
|
1 |
Способен поднимать задние конечности, но не способен шагать |
|
0 |
Тотальный паралич задних конечностей |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Материалы по научному обоснованию вентрального спондилодеза васкуляризированным ребром встречаются довольно редко, при этом тенденция отставания экспериментально-теоретических исследований от практики сохраняется и по сей день [2, 8, 32, 37]. Существующие модели спондилодеза на непрямоходящих видах животных близки только по биологическим параметрам и не соответствуют биомеханическим. Общеизвестно, что статические и динамические нагрузки на позвоночник у прямоходящих видов с бипедальным способом передвижения и видов с квадрипедальным способом передвижения различны [4, 30]. Примененная нами задняя инструментальная фиксация позвоночника на протяжении позволяет получить более корректные результаты при изучении процессов физиологической и репаративной регенерации трансплантата в стандартных биомеханических условиях относительной стабильности. Кроме того, при широком внедрении современных инструментальных систем для стабилизации позвоночника [20] данная модель наиболее полно отражает статико-динамическую ситуацию, возникающую у пациентов в клинике.
Анатомическая доступность и физиологическая дозволенность методов этапной реконструкции. Всего выполнено 90 плановых операций и дополнительно 11 операций по неотложным показаниям (наложение вторичных швов и герметизация плевральной полости – 6, удаление конструкции 2, удаление конструкции и сана- ция абсцесса 2). При проведении эксперимента общее количество осложнений на 101 выполненную операцию составило 16,8 %. Пали 3 собаки (6,6 %). Две по невыясненным причинам (не вошли в материалы исследования), одна пала на 21-е сутки после пластики от синдрома дыхательных расстройств, который не удалось купировать повторным ушиванием раны грудной клетки (проводились только морфологические исследования). Всего исследовалось 42 завершенных случая.
Переднее вмешательство было травматичнее заднего, о чем свидетельствует тяжесть состояния после операции и бóльшее число осложнений 13,3 % и 22,2 % (с фатальным исходом 2,2 % и 0 %) соответственно. Продолжительность переднего вмешательства почти в два раза превышала продолжительность заднего (104,60 21,92 и 49,67 9,67 минут соответственно) (Р>0,05). По данным литературы, продолжительность операций по реконструкции передних отделов позвоночника свободным васкуляризированным трансплантатом МБК составляет в среднем 12 часов (от 6 до 22 часов) [22, 25, 28, 38]. Это почти в шесть раз больше, чем потребовалось времени для вентральной пластики в нашем эксперименте.
Кровопотеря в момент операции составила 2,63 0,8 мл/кг для переднего вмешательства и 1,12 0,423 мл/кг для заднего (Р>0,05). В связи с чем введение противошоковых кристаллоид- ных растворов потребовалось только при выполнении переднего вмешательства (в среднем 26,08 9,02 мл/кг), (Р>0,05). Все этапы оперативных вмешательств переносились животными удовлетворительно. При отсутствии осложнений после заднего вмешательства собаки были готовы к повторному вмешательству уже через 10-12 дней, а после переднего через 14-18 дней. Двигательная активность животных после двухэтапных вмешательств восстанавливалась почти полностью уже к 45-60 дням (табл. 3). В первую неделю после переднего вмешательства и инструментальной фиксации у животных отмечалась потеря в весе в среднем на 0,165±0,09 кг и 0,21±0,13 кг соответственно (Р>0,05). Однако к концу наблюдения вес животных достоверно увеличился по сравнению с его исходными значениями в среднем на 1,867 0,556 кг, (Р>0,05).
Таблица 3
Таблица суммарной оценки сохранности всех тестируемых функций в баллах и % в контрольные сроки после операции по классификации Tarlov, (1957)
|
Срок наблюдения после операций (дни) |
Сумма оценок в баллах (%) у собак после моделирования транспозиции СМ (n=12) |
Сумма оценок в баллах/% у собак без моделирования транспозиции СМ (n=30) |
|
Исходно |
72 (100 %) |
180 (100 %) |
|
Зв |
56 (77,7 %) |
141 (78,3 %) |
|
Пв |
34 (47,2 %) |
121 (67,2 %) |
|
15 |
34 (47,2 %) |
130 (72,2 %) |
|
30 |
38 (52,7 %) |
134 (74,4 %) |
|
60 |
51 (70,8 %) |
165 (91,6 %) |
|
90 |
58 (80,5 %) |
174 (96,6 %) |
|
120 |
61 (84,7 %) |
176 (97,7 %) |
|
180 |
65 (90,2 %) |
175 (97,2 %) |
|
270 |
64 (88,8 %) |
176 (97,7 %) |
|
365 |
64 (88,8 %) |
177 (98,3 %) |
Оценка неврологического статуса и анатомо-морфологические изменения со стороны СМ и его оболочек. Моделирование передней транспозиции спинного мозга на двух уровнях без пересечения корешков СМ привело к возникновению неврологических расстройств различной степени почти у всех животных, в связи с чем они были выделены в отдельную группу (табл. 3). У большинства собак этой группы функциональные тесты в первый месяц после операции оценивались не более 4 баллов. В период с 45 до 120 суток отмечалось значительное улучшение (до 5-6 баллов) почти у 85 % собак. Последующие изменения в неврологическом статусе у животных данной группы были незначительны. Функциональные тесты, проведенные через год, показали, что суммарная оценка неврологического статуса была хуже исходной на 11,2 % (табл. 3). Главной причиной этого были необратимые неврологические нарушения, выявленные у двух собак и сохранявшиеся в течение всего срока наблюдения (3 балла).
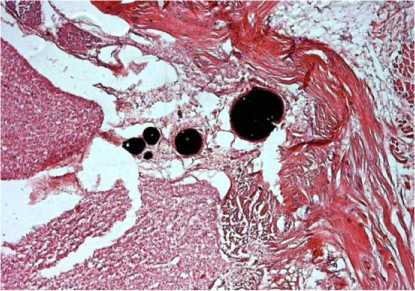
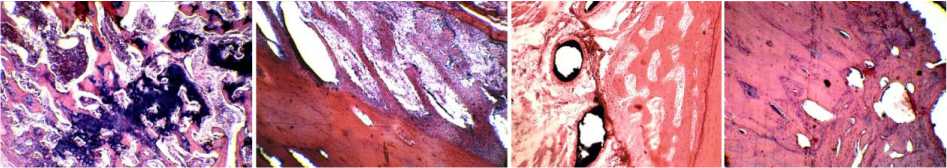
Анатомические исследования у этих собак вы- явили наличие спаек между дуральной оболочкой и мягкотканной муфтой трансплантата (рис. 1, а). Спинной мозг и его оболочки по всему овальному контуру транспозиции втягивались в дефект передней стенки позвоночного канала, образуя выпячивание по типу грыжевого, а по бокам, наоборот, отмечено сужение СМ (рис. 1, б, в). Морфологически в зоне грыжевого выпячивания отмечены признаки асептического воспаления оболочек и фиброзные волокна спаек между СМ, его оболочками и муфтой трансплантата (рис. 1, г).
а б в
г
Рис. 1. На фотографиях: а СМ отведен кверху, на передней поверхности дуральной оболочки видна грубая спйка; б участок СМ со сформировавшейся спинномозговой грыжей, вид сбоку; в участок сужения в зоне спинномозговой грыжи, вид сзади; г микрофото поперечного среза в зоне сформированной СМ грыжи (Об. 15., ок. 4. Гематоксилин-эозин). В правом верхнем углу между мышечной муфтой трансплантата оболочками СМ и собственно СМ видны фиброзные спайки. Под дуральной оболочкой видны артерии СМ, заполненные контрастом
Таким образом, формирование овального отверстия в передней стенке позвоночного канала, отсечение зубчатых связок и удаление жировой клетчатки, выстилающей его переднюю поверхность изнутри, привели к формированию спинномозговой грыжи с соответствующей неврологической симптоматикой. Эти случаи полностью подтверждают предложенный R. Kumar и соавт. (1995) патогенез формирования спинномозговых грыж, основанный на подвижности СМ, давлении пульсирующего ликвора и формировании менингоцеле в зоне дефекта стенки позвоночного канала [26].
В остальных случаях моделирования транспо- зиции СМ была предпринята попытка предотвратить формирование спинномозговой грыжи. Мы перекрывали пространство между муфтой трансплантата и дуральной оболочкой слоем васкуляризированной подкожной жировой клетчатки. Для этого трансплантат ребра на питающей ножке формировали многослойным таким образом, чтобы в его состав входили не только межреберные и частично слой поверхностных мышц грудной клетки, но и подкожная жировая клетчатка. Применение данной методики позволило в дальнейшем избежать грыжеобразования и возникновения необратимых неврологических нарушений.
В группе, где моделирование транспозиции СМ не осуществляли, отмечены лишь преходящие ограничения двигательной активности в течение 45 дней после операций. При суммарной оценке неврологического статуса через год восстановление почти полное, 98,3 % (табл. 3).
Следует отметить, что оценка неврологического статуса у оперированных животных по классификации И.М. Тарлова не всегда позволяет четко дифференцировать причину возникновения двигательных нарушений. В первые месяцы после операции ограничение двигательной активности животных может быть обусловлено действием болевых, биомеханических или иных факторов, а не только неврологическими расстройствами. Кроме того, регистрация имевших место у двух собак чувствительных, трофических нарушений и нарушений функции тазовых органов в данной классификации не предусмотрена. В своих последующих работах мы включили в оценочную таблицу вышеуказанные пункты и усовершенствовали систему бальной оценки, что значительно повысило информативность исследования и точность при обработке результатов.
Изучение артериального кровоснабжения в трансплантате ребра на питающей ножке. Качественное подтверждение сохранности кровоснабжения в перемещенном на питающей ножке регенерате ребра через год после пластики было получено в 35 случаях из 42. Межреберная артерия трансплантата с несколькими ответвлениями прослеживалась на всем его протяжении (рис. 2, д, е). У двух собак из первой группы и у пяти из третьей артериография не выявила сети сосудистого рисунка в зоне рентгеновской тени трансплантата, что качественно подтверждает нарушение их кровоснабжения.
Предложенная Д.С. Брэдфордом методика, формирования сосудистой ножки трансплантата ребра из a. et v. intercostales posterior применяется крайне редко [18]. Осуществление данного приема может быть технически невозможно и/или проходимость сосудов, питающих трансплантат, может быть нарушена в очаге абсцесса [3, 27], при сосудистых аномалиях [41], на участке опухоли [33] или нейрофибромы [38]. С этих позиций метод М.Б. Дрибинского, позволяющий формировать ножку трансплантата из межреберной мышцы, в толще которой находятся одноименные артерия, вена, нерв, а главное сохранена связь с дорсос-пинальной сетью анастомозов, является более надежным [3]. Он позволяет беспрепятственно пересекать заднюю межреберную артерию и вену, питающую перемещаемое ребро непосредственно в патологическом очаге вентральных отделов позвоночника, не опасаясь нарушить кровоснабжение трансплантата [2, 3]. В данном случае компенсация кровоснабжения несвободного трансплантата ребра осуществляется по развитой сети дорсоспи-нальных и межпоперечных анастомозов [2, 5, 6, 8].
В наших исследованиях скелетирование задних отделов позвоночника на значительном протяжении, необходимое для осуществления задней инструментальной фиксации, нарушало целостность данных анастомозов и такой вид компенсации кровотока срабатывал не всегда. Поэтому артериография подтверждала нарушение кровоснабжения ребра в 71,4 % случаев, если скелетирование осуществлялось в сроки за 20-25 дней до вентральной пластики (1 серия) по обеим сторонам от остистых отростков (3 группа), а если только справа, то в 28,5 % случаев (1 группа).
Следует отметить, что нарушение кровотока зарегистрировано не у всех животных первой и третьей групп, кроме того, при осуществлении аналогичных приемов задней фиксации и скелетирования после переднего вмешательства у собак второй серии через год, нарушения кровоснабжения регенерата не выявлено. Это наводит на мысль о том, что либо существуют анатомические вариации существования дорсоспинальных анастомозов, либо в действие включаются иные компенсаторные механизмы кровеносной системы, приводящие к возникновению новых коллатералей. Выяснение этого вопроса крайне важно для клиники и потребует проведения дополнительных исследований, материалы которых мы представим в наших последующих сообщениях.
Комплексная оценка состоятельности формируемого блока. Преимущества пересадки васкуляризированных костных трансплантатов над свободной трансплантацией хорошо известны и заключаются в выживании большинства остеоцитов, сохранении их интеграции и способности первых активно воспроизводить и регулировать процессы репаративной и физиологической регенерации [2, 8, 32, 37, 39, 40].
У собак первой и третьей группы с подтвержденным нарушением кровоснабжения трансплантата установлены однотипные изменения на участке пластики, соответствующие свободной трансплантации костной ткани. Поэтому для удобства сравнения результатов мы объединили данных животных в одну группу с нарушенным кровоснабжением трансплантатов (НКТ). Все остальные рассматривались как группа с сохраненным кровоснабжением трансплантатов (табл. 4).
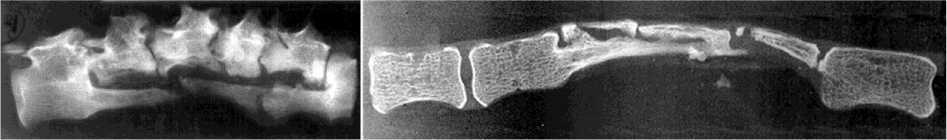
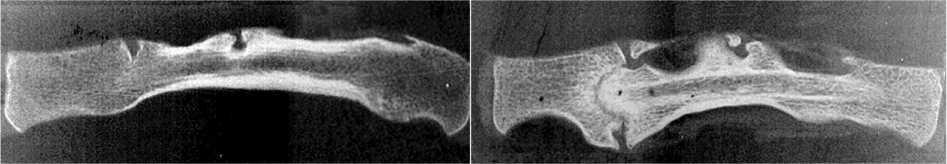
В группе с НКТ формирование блока не состоялось по причине рассасывания, разрушения и фрагментации трансплантата (рис. 3, а, б, в, г). В связи с этим утрачивался эффект упора и несмотря на сохранность задней фиксации прогрессировал угол кифоза и величина телескопического укорочения позвоночника в зоне пластики в большей степени у собак данной группы, чем у остальных (рис. 2, б, г; табл. 4). В группе с НКТ динамика изменений ширины рентгеновской тени трансплантатов, отраженная на графике (рис. 6), указывает на преобладание резорбции кости трансплантата над костеобразованием (табл. 4). Через год после пластики морфологические исследования не выявили наличия сосудов, заполненных контрастным веществом, ни в зоне расположения трансплантата ни в его питающей ножке. В трансплантате наблюдались дистрофические процессы с гибелью большей части клеточных элементов транспонированного ребра и продолжающимся замещением кости фиброзной тканью (рис. 3, д, е, ж).
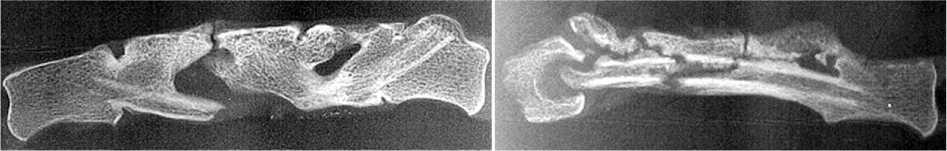
У собак с сохраненным кровоснабжением трансплантатов костеобразование преобладало над резорбцией (рис. 6). Значительно увеличились поперечные размеры перемещенного ребра и общая площадь рентгеновской тени (рис. 2, а, в, д, е; табл. 4). Сформировался мощный регенерат в виде опорной колонны, охватывающей на полюсах тела опорных позвонков (рис. 4, а, б, в, г). Морфологические исследования обнаружили артерии, заполненные контрастной массой (рис. 4, ж). Установлено, что большинство остеогенных клеток трансплантата сохранили свою жизнеспособность и пролиферативную активность. Периостальный остеогенез стал главной причиной увеличения поперечного сечения регенерата. Причем изменение формы ребра происходило из-за неравномерного увеличения поперечных размеров трансплантата на полюсах и в центре колонны вследствие пролиферативной активности периоста на полюсах и стихания периостального остеогенеза в его центральной части (рис. 4, е, ж).
Таблица 4
Сводная таблица количественных и качественных абсолютных и относительных изменений в зоне пластики многосегментарного вентрального дефекта васкуляризированными трансплантатами ребра в условиях задней инструментальной фиксации позвоночника
|
№ групп |
Несращение полюса Тр %, (n из N) |
Дезинтеграция Тр %, (n из N) |
Наличие блока %, (n из N) |
Среднее изменение площади Тр. в (%) |
Среднее изменение ширины Тр. в (%) |
Среднее изменение длины Тр. в (%) |
|
1 |
28,5 % (4 из 14) |
28,5 % (2 из 7) |
42,8 % (3 из 7) |
-4,21 16,1 |
1,86 23,3 |
-16,86 22,6 |
|
3 |
21,4 % (3 из 14) |
71,4 % (5 из 7) |
0 % (0 из 7) |
-19,33 4,2 |
-17,63 19,4 |
-24,13 17,5 |
|
2, 4, 5, 6 |
5,3 % (3 из 56) |
0 % (0 из 28) |
92,8 % (26 из 28) |
36,65 30,1 |
139,21 12,9 |
-5,56 26,1 |
|
Группа с НКТ |
7,1 % (1 из 14) |
100 % (7 из 7) |
0 % (0 из 7) |
-53,33 17,6 |
-42,18 11,4 |
-59,18 8,3 |
|
Изм. (р) |
- |
- |
- |
0,01-0,05 < Р |
0,01-0,05 < Р |
0,01-0,05 < Р |
(n из N) – абсолютное число случаев из общего числа наблюдений; НКТ собаки с нарушенным кровоснабжением трансплантатов;
Тр трансплантат.
а (собака № 63) б (собака № 52)
в (собака № 64) г (собака № 71)
д (собака № 52) е (собака № 63) ж (собака № 71)
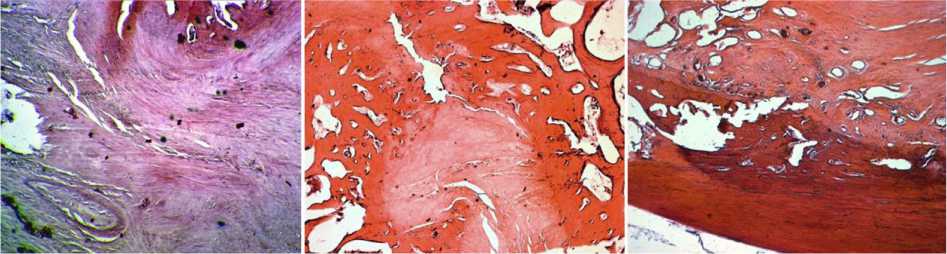
Рис. 3. Рентгенограммы (а, б, в, г) сагиттальных срезов макропрепаратов позвоночника в зоне пластики трансплантатами с нарушенным кровоснабжением, год после пластики: а консолидация на полюсах и фрагментация трансплантата; б резорбция полюса трансплантата; в резорбция центральной части трансплантата; г разрушение полюса трансплантата и тела опорного позвонка. Микрофото (д, е, ж), об. 15. Ок. 4. Гематоксилин-эозин: д замещение кости трансплантата фиброзной тканью, в левом нижнем углу видна облитерированная a. intercostalis трансплантата; е, ж участки продолжающегося замещения кости трансплантата фиброзной тканью
в (№ 121)
а (№ 121)
б (№ 68)
г (№ 68) д (№ 121) е (№ 121)
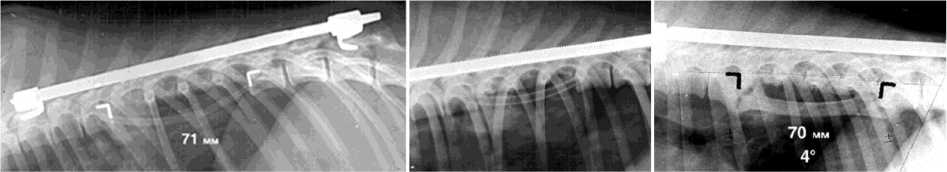
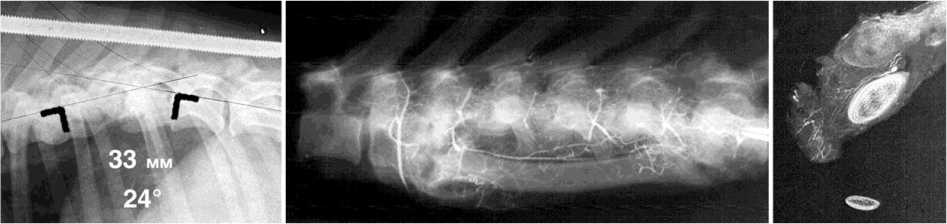
Рис. 2. Фотоспондилограммы собак № 121 и № 68. Первые сутки после реконструкции: а дефект Т7-Т10 длиной 71 мм у собаки № 121 и б дефект Т7-Т9 41 мм у собаки № 68; в через год после пластики у собаки № 121 регенерат ребра уве личился в поперечнике и трансформировался в колонну, длина позвоночника в зоне дефекта уменьшилась на 1 мм, кифоз 4º; г через год после пластики траснплантатом с нарушенным кровоснабжением собака № 68, центральная часть ребра разрушена, длина позвоночника в зоне дефекта уменьшилась на 8 мм, кифоз 24º; д, е артериограмма макропрепарата собаки № 121 через год после реконструкции и поперечного среза макропрепарата через зону пластики. В проекции регенерата ребра прослеживается межреберная артерия регенерата ребра и ее ветви
а (собака № 65) б (собака № 65)
в (собака № 49)
г (собака № 76)
д (собака № 76)
е (собака № 65)
ж (собака № 76)
з (собака № 49)
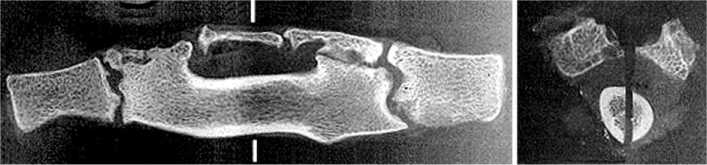
Рис. 4. Рентгенограммы сагиттальных и фронтальных срезов макропрепаратов позвоночника через реберный регенерат с сохраненным кровоснабжением, год после пластики (а, б, в, г): а, б блок за счет формирования мощного регенерата и фиброзной консолидации на полюсах; в блок с костной консолидацией; г блок с признаками костно хрящевой консолидации. Микрофото (д, е, ж, з), год после пластики (Об. 15. Ок. 4. Гематоксилин-эозин): д зона костно-хрящевой консолидации полюс-тело; е зона периостального остеогенеза на полюсе регенерата; ж зона периостального остеогенеза в центре регенерата, видны артерии регенерата ребра, заполненные контрастом; з участок костной консолидации полюс-тело
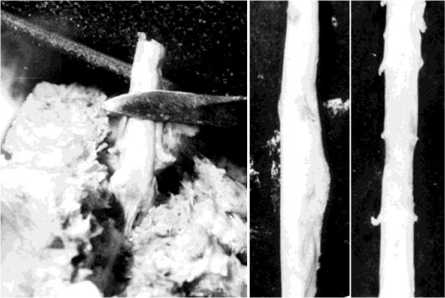
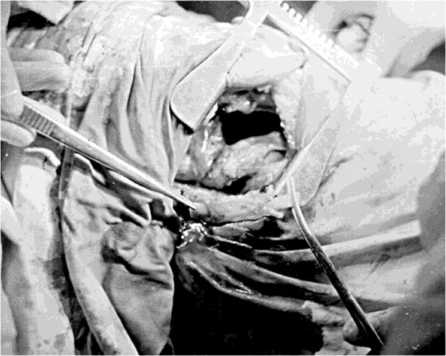
Однако следует отметить, что в некоторых случаях поперечные размеры регенерата увеличивались в два и более раз, тогда как площадь его рентгеновской тени изменялась незначительно, в пределах от 10 % до 50 %. Данный факт объяснялся тем, что происходило укорочение трансплантата за счет разрушения и рассасывания его полюсов. Это дополнительно приводило и к прогрессированию кифоза с укорочением позвоночника. Причиной, приведшей к таким последствиям, стало то, что во время подготовки трансплантата к пластике его полюса скелетировали от мягких тканей и надкостницы на 1-1,5 см по всему периметру, для последующего внедрения в тела опорных позвонков (рис. 5, а). Данный факт заставил нас уменьшить протяженность скелетирования полюсов до 0,30,6 см, что позволило избежать значительного разрушения полюсов ребра.
а
б
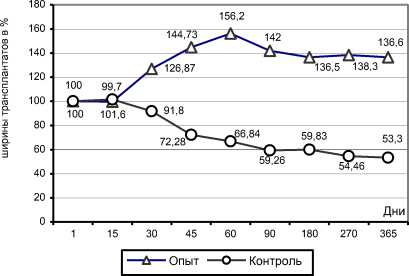
Рис. 6. Сравнительный график динамики изменения относительных средних значений величин ширины рентгеновской тени трансплантата (в %) у собак с сохраненным (опыт) и нарушенным (контроль) кровоснабжением трансплантатов в зависимости от срока наблюдения
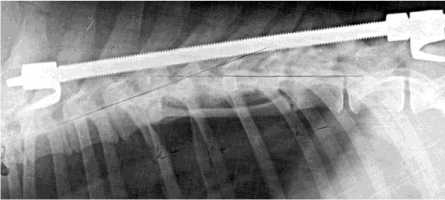
В трех случаях через 2 месяца после удаления конструкции (2 – нагноение, 1 несостоя тельность конструкции) зарегистрировано дополнительное увеличение площади рентгеновской тени и поперечных размеров регенерата (рис. 5, б, в). Причиной этого могло стать не что иное, как увеличение функциональных нагрузок на трансплантат после устранения задней фиксации.
Опорная функция трансплантата сохранялась лучше в группе с сохраненным кровоснабжением трансплантатов. Возникшие после пластики кифоз и телескопическое укорочение позвоночника в зоне дефекта за период наблюдения 45-365 дней после пластики были меньше, чем у группы с нарушенным кровоснабжением трансплантата (табл. 5), (рис. 4, а, б, в, г). У всех собак сколиотический компонент деформации возникал сразу после переднего вмешательства и постепенно регрессировал начиная с 15 суток после пластики независимо от групповой принадлежности (табл. 5).
Таблица 5 Показатели прогрессирования компонентов деформации позвоночника (абсолютные угол кифоза и сколиоза в градусах и относительное укорочение позвоночника в %) через год после пластики
в
Рис. 5. а Фотография операционной раны. Трансплантат ребра на питающей ножке выведен в раневую апертуру. Полюса трансплантата ребра скелетированы для размещения в телах опорных позвонков; б фотоспондилограмма собаки № 119 реберный регенерат в условиях задней фиксации; в фо-тоспондилограмма той же собаки через 2 месяца после удаления фиксатора. Увеличились поперечные размеры и изменилась форма регенерата
|
№ групп |
Кол-во наблюдений |
Телескопическое укорочение |
Кифоз |
Сколиоз |
|
1 |
7 |
12,35 3,6 % |
13,45 4,3о |
11,32 6,3о |
|
3 |
7 |
18,11 6,7 % |
15,21 5,8о |
9,65 4,3о |
|
2, 4, 5, 6 |
28 |
5,26 1,6 % |
11,38 4,9о |
10,29 5,2о |
|
НКТ |
7 |
21,18 6,5 % |
19,18 4,2о |
9,54 6,4о |
|
Р |
0,01-0,05<Р |
0,01-0,05<Р |
0,61-0,05<Р |
По истечении одного года нами выявлены четыре вида консолидации полюсов трансплантатов с телами опорных позвонков: костная (рис. 4, в, з), фиброзная (рис. 3, е; 4, а), костно- и фиброзно-хрящевая (рис. 4, г, д). Высокий процент 91,2 % случаев костной консолидации полюсов трансплантатов с телами позвонков
(табл. 4) в группе с нарушенным кровоснабжением не являлся определяющим для формирования блоков, поскольку происходило разрушение, дезинтеграция и фрагментация ребра в центральной его части (рис. 3, а, в). Это косвенно подтверждало, что процессы костеобразования в зоне материнского ложа у полюсов трансплантата компенсировали резорбцию и разрушающие действие силовых импульсов, тогда как в центре ребра, наиболее удаленном от материнского ложа наоборот интенсивность костеобразования была слабее.
Возникновение деформации позвоночника и разрушение полюсов трансплантатов (табл. 5) указывает на то, что задняя фиксация лишь частично ограничивала нагрузки на зону пластики, при этом процессы репаративной и физиологической регенерации не успевали компенсировать разрушающее действие.
Отсутствие блока зарегистрировано в случаях несращения полюсов трансплантата при значительном рассасывании последних с укорочением регенерата и замещением кости фиброзной тканью (рис. 3, г, ж). При этом объем движений при сгибании макропрепарата превышал 15º и мог достигать 45º.
ВЫВОДЫ
-
1. Скелетирование задних отделов позвоночника на протяжении Т3-L1 справа или по обеим сторонам от остистых отростков приводит к нарушению кровоснабжения реберного трансплантата соответственно в 28,5 % и 71,4 % случаев, если пластика осуществлялась после заднего вмешательства (во второй этап), а при формировании трансплантата пересекали питающую его заднюю межреберную артерию и вену в зоне соответствующего удаляемого тела позвонка.
-
2. При осуществлении передней реконструкции трансплантатом-распоркой из ребра на питающей ножке на первом этапе, последующее одно- и двустороннее скелетирование задних отделов позвоночника с целью его задней фиксации не приводят к нарушению кровоснабжения трансплантата.
-
3. В трансплантатах с нарушенным кровоснабжением наблюдались дистрофические процессы с гибелью большей части клеточных элементов транспонированного ребра и замещением кости фиброзной тканью. Преобладала резорбция кости над костеобразованием, уменьшались поперечные размеры и площадь рентгеновской тени трансплантата. Формирование блока не происходило из-за фрагментации и дезинтеграции ребра. Несмотря на заднюю ин-
- струментальную фиксацию, деформация позвоночника, кифоз и укорочение были больше, чем в группе собак с подтвержденным кровоснабжением трансплантата.
-
4. При сохраненном кровоснабжении через год в трансплантате выживает большинство остеогенных клеток. В условиях инструментальной фиксации трансплантат ребра на питающей ножке способен к репаративной и физиологической регенерации (консолидация, гипертрофия, ремоделирование и органо-типическая перестройка), что приводит к формированию блока в 92,8 % случаев. Регенерат трансплантата имеет форму колонны за счет неравномерной пролиферативной активности периоста большей на полюсах и меньшей в центре с формированием на полюсах опорного контура, соответствующего опорному контуру тел позвонков.
-
5. Возобновление функциональных нагрузок на регенерат васкуляризированного трансплантата ребра приводит к увеличению его поперечных размеров.
-
6. Моделирование передней транспозиции спинного мозга приводит к образованию передней спинномозговой грыжи. Предотвратить ее образование возможно посредством перекрытия отверстия жировой клетчаткой васкуляризированного трансплантата.


