Множественные перфорации кишечника на фоне терапии бевацизумабом. Обзор литературы и клинический случай
Автор: Тягунов А.Е., Ермаков И.В., Тавадов А.В., Куценко И.И., Курбанов Г.И., Сажин А.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические случаи
Статья в выпуске: 3 (81), 2022 года.
Бесплатный доступ
Введение. Биологические агенты, такие как бевацизумаб, обладающие анти-VEGF (vascular endothelial growth factor - фактор роста эндотелия сосудов), отдельно или в комбинации с химиотерапией увеличивают риск перфорации кишечника. На запрос в eLibrary “бевацизумаб” получено 202 публикации, но не обнаружено сообщений о перфорации кишечника на фоне лечения данным препаратом. Клинический случай. Приводим клиническое наблюдение хирургического лечения пациента с перфорацией опухоли поперечно-ободочной кишки, с рецидивирующими перфорациями двенадцатиперстной и тощей кишки на фоне терапии бевацизумабом. Обсуждение. Перфорация кишечника вследствие некроза опухоли и прямого повреждающего действия на кишечную стенку указывается как возможное осложнение терапии бевацизумабом. Почечноклеточный и генерализованный колоректальный рак, неудаленная первичная опухоль, терапия высокими дозами бевацизумаба (5 мг/кг), колоноскопия в течение 1 месяца после начала терапии, предшествующая лучевая терапия являются факторами риска перфорации. Рассмотрены результаты операций и неоперативного лечения перфораций желудочно-кишечного тракта на фоне терапии бевацизумабом. Выводы. Публикация данного клинического случая позволит врачам подходить к лечению пациентов, получающих специфическую противоопухолевую терапию, более информированными о возможных осложнениях.
Бевацизумаб, таргетная терапия, рак ободочной кишки, перфорация, перитонит
Короткий адрес: https://sciup.org/142236578
IDR: 142236578 | УДК: 616.34-007.251 | DOI: 10.17238/2072-3180-2022-3-66-73
Текст научной статьи Множественные перфорации кишечника на фоне терапии бевацизумабом. Обзор литературы и клинический случай
Колоректальный рак на сегодняшний день по распространенности занимает 3 место среди онкологических заболеваний. На долю рака ободочной кишки приходится до 9,2 % всех новых выявленных случаев рака [1]. Ежегодно только в США регистрируется около 104 270 новых случаев рака ободочной кишки [2]. В России на долю злокачественных новообразований ободочной кишки приходится примерно 6,8 %. В общей структуре смертности от онкологических заболеваний рак ободочной кишки занимает 4 место [3]. Ежегодная смертность достигает 8 % [2]. Примерно у 35 % пациентов на этапе первичной диагностики выявляются отдаленные метастазы, что, главным образом, определяет выживаемость этих пациентов. Общая трехлетняя и пятилетняя выживаемость у данной группы пациентов имеет тенденции к увеличению и составляет 20,7 % и 10,5 % соответственно [4].
Согласно действующим рекомендациям, при потенциально резектабельных метастатических очагах колоректального рака рекомендуется проведение индукционной химиотерапии с таргетными препаратами [5]. Индукционная комбинированная химиотерапия в режиме FOLFIRI в комбинации с бевацизума-бом при генерализованном колоректальном раке увеличивает медиану общей выживаемости с 15,6 месяца до 20,3 месяца, а в режиме FOLFOXIRI в комбинации с бевацизумабом с 24,5 месяца до 28,9 месяца, однако сопровождалась увеличением частоты побочных эффектов 3 и 4 степени, в среднем на 10%. Из них наиболее частые: лейкопения, диарея, артериальная гипертензия, протеинурия, тромбозы и тромбоэмболии [6, 7]. К редким осложнениям терапии бевацизумабом относят перфорации желудочно-кишечного тракта, которые, по данным литературы, встречаются у 1,5–4,7 % пациентов, но могут достигать 11,3 % [6, 8, 9, 10].
После публикации в 1995 г. первого в мировой практике наблюдения перфорации желудочно-кишечного тракта на сегодняшний день описаны небольшие клинические серии [11]. Российские публикации в eLibrary по проблеме не представлены. Приводим клинический разбор случая множественных перфораций кишечника на фоне терапии бевацизумабом.
-
– writing the text, Tavadov A.V., Kutsenko I.I. – collection of material,
Клинический случай
Пациент, 57 лет. В июне 2021 г. у пациента диагностирована высокодифференцированная аденокарцинома печеночного изгиба ободочной кишки сТ4аN1M1 (hep) согласно классификации TNM-8 (2017 г.). С 26.07.21 г по 28.09.21 г. пациенту проведено 4 курса индукционной химиотерапии по схеме: FOLFOXIRI + бевацизумаб (оксалиплатин 100 мг, кальция фолинат 400 мг, иринотекан 300 мг, фторурацила 6000 мг, бе-вацизумаб 385 мг). Второй курс химиотерапии сопровождался желудочно-кишечным кровотечением из язвы 12 перстной кишки (консервативная терапия). В октябре 2021 г. пациент поступил в одну из больниц г. Москвы с жалобами на боли в животе и лихорадку до 39,8 Со. При обследовании у пациента выявлена прикрытая микроперфорация опухоли печеночного изгиба с формированием параколического инфильтрата, по поводу чего проводилось консервативное лечение. К концу первой недели стационарного лечения у пациента получен положительный ПЦР тест на SARS COV-19, в связи с чем для дальнейшего лечения пациент был переведен в ГКБ № 40 ДЗМ “Коммунарка”. При госпитализации пациент предъявлял жалобы на боли в животе, тошноту, повышение температуры тела до 39,8 Со. В анализе крови: лейкоциты 16,63 х 109/л, тромбоциты 363,0 х 109/л, гемоглобин 101 г/л, С-реактивный белок 293,70 мг/л, креатинин 61 мкмоль/л, билирубин общий 7,6 мкмоль/л, билирубин прямой 2,4 мкмоль/л. Компьютерная томография органов грудной клетки: вирусная пневмония КТ-1. Компьютерная томография органов брюшной полости: картина образования печеночного угла ободочной кишки, с признаками перфорации, формирования распространенного калового перитонита (рис. 1); реактивного утолщения стенок восходящей ободочной кишки; уровней жидкости в просвете тонкой и поперечно-ободочной кишки, мультифокального полисегментарного поражения печени вторичного генеза. Пациенту определены показания к экстренной операции.
Под эндотрахеальным наркозом выполнена диагностическая лапароскопия, во время которой во всех отделах брюшной полости обнаружен гнойный выпот. В правом подреберье выявлен рыхлый инфильтрат, при разделении которого отмечено поступление гноя и кишечного содержимого. Принято решение о конверсии. Выполнена срединная лапаротомия. Правая по- ловина и поперечно-ободочная кишка мобилизованы. При этом вскрыта забрюшинная флегмона, содержащая 300 мл гноя и кишечного содержимого. Выполнена обструктивная резекция поперечно-ободочной кишки. Развернутый послеоперационный диагноз: Перфорация опухоли поперечно-ободочной кишки. Параколическая флегмона забрюшинного пространства. Диффузный гнойно-фибринозный перитонит. Mангеймский индекс перитонита 36 баллов.
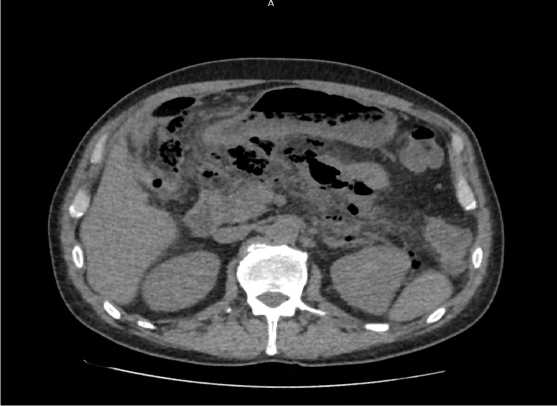
Рис. 1. Образование печеночного угла ободочной кишки, с признаками перфорации, флегмоны и перитонита
Fig. 1. Formation of the hepatic angle of the colon, with signs of perforation; phlegmon and peritonitis
Пациент экстубирован в первые сутки после операции. Через 48 часов выполнена программная санационная релапаротомия, во время которой установлен текущий перитонит с появлением желчного выпота. Источник желчного выпота – точечная (около 1 мм) перфорация по передней поверхности вертикальной ветви двенадцатиперстной кишки, на 2 см дистальнее бульбодуоденального перехода. Дефект ушит двухрядным швом. Брюшная полость санирована, дренирована. Пациент в первые сутки экстубирован.
В дальнейшем послеоперационный период осложнился многочисленными перфорациями различных отделов кишечника: двенадцатиперстной кишки выше ранее ушитой перфорации, тощей кишки в проекции связки Трейтца, дистальной культи толстой кишки, что потребовало неоднократных санирующих вмешательств, попыток ушивания перфораций, наложения еюностомы. Предпринимались попытки консервативного закрытия дефектов с помощью активной внутрипросветной аспирации. Пациент перенес 11 операций. При этом ковид-пневмония, установленная у пациента, в течение двух недель стационарного лечения полностью регрессировала. На 33-и сутки стационарного лечения на фоне текущего перитонита и сепсиса наступила смерть пациента.
Гистологическое исследование операционного материала: высокодифференцированная аденокарцинома колоректального типа поперечно-ободочной кишки pT4aN2cM1, L1, V1, Pn1, R0, G1. Опухоль прорастает все слои кишечной стенки, врастая в подлежащую жировую клетчатку, с выраженными некротическими и воспалительными изменениями. На серозной оболочке наложения фибрина, диффузная нейтрофильная инфильтрация. Подлежащая жировая клетчатка диффузно инфильтрирована нейтрофилами, некротизирована. В стенке удаленного участка тонкой кишки выявлен сквозной округлый дефект с плотными валикообразными краями.
Обсуждение
За последние 20 лет произошел значительный прогресс в лечении генерализованного колоректального рака. Общая выживаемость, которая при терапии 5-фторурацилом не превышала 11–12 месяцев, на сегодняшний день приближается к трем годам, а пятилетняя выживаемость достигает 20% [5]. Во многом полученные результаты связаны с добавлением к комбинированной химиотерапии таргетных препаратов, обладающих анти-VEGF действием, в частности бевацизумаба [7]. Однако на фоне эффективности такой терапии возросла частота побочных эффектов. При добавлении к терапии бевацизумаба примерно у 10 % пациентов наблюдаются связанные осложнения: свищи – 3,5 %, тромбоэмболические осложнения – 2,8 %, кровоизлияния – 1,9 %, перфорация кишечника и артериальный тромбоз – 1 % [12]. Частота раневых осложнений среди пациентов, получавших бевацизумаб, в послеоперационном периоде была также выше – 13 % против 3,4 % [13]. Увеличение частоты послеоперационных осложнений связывают с “антинеоангиогенезом” бевацизумаба и нарушением микроциркуляции в ране [14].
На сегодняшний день редким жизнеугрожающим осложнением терапии бевацизумабом является перфорация желудочно-кишечного тракта, которая развивается примерно у 4,1 %–11,3 % пациентов [9, 10]. Сообщается об увеличении риска перфорации как самой опухоли, так и интактных участков кишечной стенки, а также зоны анастомозов [9, 15]. Необходимо отметить дозозависимый риск наступления перфорации. В мета-анализе, проведенном Hapani S., относительный риск развития перфорации для пациентов с колоректальным раком был одним из самых высоких и составил 1,61 (95 % ДИ 0,76–3,38; р=0,21) при терапии бевацизумабом в схеме 2,5 мг/кг. Терапия бевацизумабом в дозировке 5 мг/кг и более увеличивала риск перфорации до 2,67 (95 % ДИ 1,26–7,63; р=0,024) [16]. В представленном клиническом случае пациенту проводилась терапия бевацизумабом в дозе 5 мг/кг (385 мг).
К возможным причинам перфорации на фоне терапии анти-VEGF препаратами относят нарушение питания кишечной стенки и перфорацию опухоли в результате прямого противоопухолевого эффекта. В данном случае на первой операции перфорация желудочно-кишечного тракта наблюдалась в первичной опухоли вследствие прямого воздействия бевацизумаба. Последующие перфорации развивались вне опухоли и были обусловлены, по-видимому, нарушением (ишемией) питания кишечной стенки. Ишемию кишечной стенки связывают с уменьшением количества сосудов, что подтверждено экспериментальными исследованиями [14]. Другой возможный механизм ишемии и развития перфорации связан с подавлением VEGF-опосредованного высвобождения оксида азота, который сопряжен с сосудистым спазмом [17]. Установлена связь бевацизумаба с артериальными тромбоэмболическими событиями, как одного из возможных факторов ишемии и перфорации кишечника [18, 19]. Опосредованно, механизм перфорации может быть связан с замедленным заживлением ран и язв желудочно-кишечного тракта при приеме препарата [8], а также появлением стрессовых язв у пациентов, принимающих глюкокортикостероиды или НПВС [20]. Как показывает мировой опыт, перфорации могут возникнуть в любой части желудочно-кишечного тракта [11, 16]. Наиболее часто перфорация возникает в толстой кишке, реже в тонкой кишке и желудке [11, 21].
Сегодня к факторам риска развития перфорации при применении препарата относят почечноклеточный и генерализованный колоректальный рак, неудаленную первичную опухоль, терапию высокими дозами бевацизумаба (5 мг/кг), колоноскопию, проведенную в течение 1 месяца после начала терапии, предшествующую лучевую терапию [16], прием глюкокортикостероидов или НПВС [20]. Имеются данные, что терапия бевацизумабом увеличивает риск перфорации опухолей ободочной кишки, подвергнутых стентированию [22]. Однако эти данные не подтверждаются всеми авторами [23]. Несмотря на противоречивые данные, для снижения риска развития осложнений на фоне приема бевацизумаба сегодня рекомендуется отложить оперативное вмешательство на 28–60 дней с момента последнего приема препарата [24].
Ранняя диагностика перфорации кишечника имеет ключевое значение в судьбе пациентов. Наиболее точно перфорация и перитонит могут быть установлены с помощью компьютерной томографии [25]. При этом определение распространенности перитонита имеет значение для выбора оптимального лечения у пациентов с “запущенным” онкологическим заболеванием [15]. В нашем случае диагноз был установлен по данным компьютерной томографии, а показания к экстренной операции определены с учетом клинической картины и лабораторных данных.
Лечение бевацизумаб-ассоциированных перфораций требует отмены препарата [15]. В условиях экстренной хирургии данная рекомендации обычно формально соблюдается, однако период полувыведения препарата составляет около 20 суток [26], и отмена препарата не решает полностью проблемы регенерации тканей. Большинство сообщений исключают возможность формирования первичного анастомоза в условиях лечения бевацизумабом. Самой распространенной операцией является отключающая стома [27]. Ушивание перфораций рассматриваются как одна из возможных опций, однако эффективность их низкая. Имеются единичные сообщения об успехе ушивания дефектов. Об успешном ушивании двух перфораций тонкой кишки, развившихся на фоне лечения бевацизумабом рака молочной железы с перитонеальным карциноматозом, сообщила группа авторов из Японии [28].
Как ни удивительно, но неоперативное лечение отграниченных инфицированных жидкостных скоплений вследствие перфорации ЖКТ на фоне приема бевацизумаба указывается в качестве допустимой опции [8]. В исследовании Badgwell B.D., опубликованном в 2008 году, проанализированы результаты лечения 24 пациентов с перфорацией. Из 17 (79 %) пациентов, подвергнутых неоперативному лечению, лишь 1 (5,9 %) пациент потребовал выполнения резекционного вмешательства, которое осложнилось несостоятельностью анастомоза, раневой инфекцией, свищами. У остальных 7 (29,1 %) пациентов сразу было использовано дренирование жидкостных скоплений. Послеоперационная летальность составила 12,5 %. Авторы объяснили консервативный подход настороженностью хирургов в отношении операций на фоне приема бевацизума-ба, и в итоге были получены доказательства допустимости неоперативного лечения. Неоперативное лечение включает голод, полное парентеральное питание и антибактериальную терапию. Однако отношение к неоперативному лечению на сегодняшний день можно охарактеризовать как сдержанное. В РФ неоперативный подход при наличии свободного газа в брюшной полости может быть расценен как неоказание помощи. Из-за риска уголовного преследования неоперативное лечение во всех областях хирургии применяется редко [29]. Дежурная бригада хирургов не рассматривала возможность неоперативного лечения нашего пациента, несмотря на его возможную пользу. Согласно данным мировой литературы, операция на фоне приема препарата сопряжена с высокой частотой осложнений и послеоперационной летальностью, которая достигает 50 % [15].
Среди возможных причин перфорации опухоли авторы не рассматривают коронавирусную инфекцию (COVID-19), хотя по данной проблеме опубликованы десятки сообщений [30]. В представленном случае клиническая картина прикрытой перфорации развилась у пациента за несколько недель до положительного теста на COVID-19 и первоначально была исключена. Так же не установлено значение коронавирусной инфекции в танатогенезе, т.к. исходные изменения в легких – КТ-1 – подверглись полному обратному развитию.
Выводы / Заключение
Несмотря на установленные в целом механизмы бевацизу-маб-индуцированной кишечной перфорации, знаний о лучшем способе прогнозирования и лечения этого потенциально смертельного осложнения недостаточно. Вероятно, в будущем экстренные хирурги будут чаще сталкиваться с такими пациентами. Решение о публикации данного клинического наблюдения принято, несмотря на неблагоприятный исход, и авторы надеются, что это позволит врачам подходить к лечению пациентов, получающих специфическую противоопухолевую терапию, более информированными о возможных осложнениях и подходах к методам лечения.
Список литературы Множественные перфорации кишечника на фоне терапии бевацизумабом. Обзор литературы и клинический случай
- Bray F., Ferlay J., Soerjomataram I., Siegel R. L., Torre L. A., Jemal A. Global cancer statistics. GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. American Cancer Society Journal, 2018, № 68 (6), рр. 394-424. https://doi.org/10.3322/caac.21492
- Siegel R. L., Miller K. D., Fuchs H. E., Jemal A. Cancer Statistics. American Cancer Society Journal, 2021, № 71 (1), рр. 733. https://doi.org/10.3322/caac.21654
- Каприн А. Д. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность) / А. Д. Каприн, В. В. Старинский, А. О. Шахзадова. - М.: МНИОИ им П.А. Герцена, 2020. - 251 с.
- Wang J., Li S., Liu Y., Zhang C., Li H., Lai B. Metastatic patterns and survival outcomes in patients with stage IV colon cancer: A population-based analysis. Cancer medicine, 2020, № 9 (1), рр. 361-373. https://doi.org/10.1002/cam4.2673
- Федянин М. Ю. Практические рекомендации по лекарственному лечению рака ободочной кишки и ректосигмоидного соединения / М. Ю. Федянин [и др.] // Злокачественные опухоли: Практические рекомендации RUSSCO. - 2021. - № 3. - С. 331-372. https://doi.org/10.18027/2224-5057-2021-11-3s2-22
- Hurwitz H., Fehrenbacher L., Novotny W., Cartwright T., Hainsworth J., Heim W., Berlin J., Baron A., Griffing S., Holmgren E., Ferrara N., Fyfe G., Rogers B., Ross R., Kabbinavar F. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. The New England Journal of Medicine, 2004, № 350 (23), рр. 2335-2342. https://doi.org/10.1056/NEJMoa032691
- Cremolini C., Antoniotti C., Stein A., Bendell J., Gruenberger T., Rossini D., Masi G., Ongaro E., Hurwitz H., Falcone A., Schmoll H. J., Maio M. D. Individual Patient Data Meta-Analysis of FOLFOXIRI Plus Bevacizumab Versus Doublets Plus Bevacizumab as Initial Therapy of Unresectable Metastatic Colorectal Cancer. Journal of Clinical Oncology, 2020, (JCO200), рр. 1-12. https://doi.org/10.1200/JCO.20.01225
- Badgwell B. D., Camp E. R., Feig B., Wolff R. A., Eng C., Ellis L. M., Cormier J. N. Management of bevacizumab-associated bowel perforation: a case series and review of the literature. Annals of oncology, 2008, № 19 (3), рр. 577-582. https://doi.org/10.1093/annonc/mdm508
- Ganapathi A. M., Westmoreland T., Tyler D., Mantyh C. R. Bevacizumab-associated fistula formation in postoperative colorectal cancer patients. Journal of the American College of Surgeons, 2012, № 214 (4), рр. 582-590. https://doi.org/10.1016/j.jamcollsurg.2011.12.030
- Redondo A., Colombo N., McCormack M., Dreosti L., Nogueira-Rodrigues A., Scambia G., Lorusso D., Joly F., Schenker M., Ruff P., Estevez-Diz M., Irahara N., Donica M., Gonzalez-Martín A. Primary results from CECILIA, a global single-arm phase II study evaluating bevacizumab, carboplatin and paclitaxel for advanced cervical cancer. Gynecologic Oncology, 2020, № 159 (1), рр. 142-149. https://doi.org/10.1016/j.ygyno.2020.07.026
- Wichelmann T. A., Abdulmujeeb S., Ehrenpreis E. D. Bevacizumab and gastrointestinal perforations: a review from the FDA Adverse Event Reporting System (FAERS) database. Aliment Pharmacol Ther., 2021, № 54 (10), pp. 1290-1297. https://doi.org/10.1111/apt.16601.
- Bonifazi M., Rossi M., Moja L., Scigliano V. D., Franchi M., La Vecchia C., Zocchetti C., & Negri E. Bevacizumab in clinical practice: prescribing appropriateness relative to national indications and safety. The oncologist., 2012, № 17 (1), рр. 117-124. https://doi.org/10.1634/theoncologist.2011-0184
- Scappaticci F. A., Fehrenbacher L., Cartwright T., Hainsworth J. D., Heim W., Berlin J., Kabbinavar F., Novotny W., Sarkar S., Hurwitz H. Surgical wound healing complications in metastatic colorectal cancer patients treated with bevacizumab. Journal Surgical of Oncology, 2005, № 91 (3), рр. 173-80. https://doi.org/10.1002/jso.20301
- Kamba T., Tam B. Y., Hashizume H., Haskell A., Sennino B., Mancuso M. R., Norberg S. M., O’Brien S. M., Davis R. B., Gowen L. C., Anderson K. D., Thurston G., Joho S., Springer M. L., Kuo C. J., McDonald D. M. VEGF-dependent plasticity of fenestrated capillaries in the normal adult microvasculature. American journal of physiology. Heart and circulatory physiology, 2006, № 290 (2), рр. 560-576. https://doi.org/10.1152/ajpheart.00133.2005
- Borofsky S. E., Levine M. S., Rubesin S. E., Tanyi J. L., Chu C. S., Lev-Toaff A. S. Bevacizumab-induced perforation of the gastrointestinal tract: clinical and radiographic findings in 11 patients. Abdominal Radiology, 2013, № 38 (2), рр. 265-72. https://doi.org/10.1007/s00261-012-9913-3. PMID:22627832
- Hapani S., Chu D., Wu S. Risk of gastrointestinal perforation in patients with cancer treated with bevacizumab: a meta-analysis. Lancet Oncology, 2009, № 10 (6), рр. 559-568. https://doi.org/10.1016/S1470-2045(09)70112-3
- Wang Y., Fei D., Vanderlaan M., Song A. Biological activity of bevacizumab, a humanized anti-VEGF antibody in vitro. Angiogenesis, 2004, № 7 (4), рр. 335-345. https://doi.org/10.1007/s10456-004-8272-2
- Heinzerling J. H., Huerta S. Bowel perforation from bevacizumab for the treatment of metastatic colon cancer: incidence, etiology, and management. Current Surgery, 2006, № 63 (5), рр. 334-337. https://doi.org/10.1016/j.cursur.2006.06.002
- Schellhaas E., Loddenkemper C., Schmittel A., Buhr H. J., Pohlen U. Bowel perforation in non-small cell lung cancer after bevacizumab therapy. Investigational new drugs., 2009, № 27 (2), рр. 184-187. https://doi.org/10.1007/s10637-008-9162-z
- Torosian M. H., Turnbull A. D. Emergency laparotomy for spontaneous intestinal and colonic perforations in cancer patients receiving corticosteroids and chemotherapy. Journal of clinical oncology. 1988, 6 (2), рр. 291-296. https://doi.org/10.1200/JCO.1988.6.2.291
- Baek S. Y., Lee S. H., Lee S. H. Bevacizumab induced intestinal perforation in patients with colorectal cancer. Korean Journal of Clinical Oncology, 2019, № 15 (1), рр. 15-18. https://doi.org/10.14216/kjco.19004
- Manes G., de Bellis M., Fuccio L., Repici A., Masci E., Ardizzone S., Mangiavillano B., Carlino A., Rossi G. B., Occhipinti P., Cennamo V. Endoscopic palliation in patients with incurable malignant colorectal obstruction by means of self-expanding metal stent: analysis of results and predictors of outcomes in a large multicenter series. Archives of surgery, 2011, № 146 (10), рр. 1157-1162. https://doi.org/10.1001/archsurg.2011.233
- Pacheco-Barcia V., Mondéjar R., Martínez-Sáez O., Longo F., Moreno J. A., Rogado J., Donnay O., Santander C., Carrato A., Colomer R. Safety and Oncological Outcomes of Bevacizumab Therapy in Patients with Advanced Colorectal Cancer and Self-expandable Metal Stents. Clinical Colorectal Cancer, 2019, № 18 (3), рр. e287-e293. https://doi.org/10.1016/j.clcc.2019.05.009
- Gordon C. R., Rojavin Y., Patel M., Zins J. E., Grana G., Kann B., Simons R., Atabek U. A review on bevacizumab and surgical wound healing: an important warning to all surgeons. Annals of plastic surgery, 2009, № 62 (6), рр. 707-709. https://doi.org/10.1097/SAP.0b013e3181828141
- Ogata K., Takamori H., Umezaki N., Yagi T., Ogawa K., Ozaki N., Hayashi H., Tanaka H., Ikuta Y., https://doi.org/K. Gastrointestinal perforation during regorafenib administration in a case with hepatic metastases of colon cancer. Journal of Chemother., 2017, № 29 (5), рр. 314-316. https://doi.org/10.1080/1120009X.2016.1183290
- Akkouche A., Sidéris L., Leblanc G., Leclerc Y. E., Vafiadis P., Dubé P. Complications after colorectal anastomosis in a patient with metastatic rectal cancer treated with systemic chemotherapy and bevacizumab. Canadian Journal of Surgery, 2008, № 51 (3), рр. E52-E53.
- Bong J. W., Lee J. L., Kim C. W., Yoon Y. S., Park I. J., Lim S. B., Yu C. S., Kim T. W., Kim J. C. Risk Factors and Adequate Management for Complications of Bevacizumab Treatment Requiring Surgical Intervention in Patients with Metastatic Colorectal Cancer. Clinical colorectal cancer, 2018, № 17 (4), рр. e639-e645. https://doi.org/10.1016/j.clcc.2018.06.005
- Fujii Y., Hirahara N., Kaji S., Taniura T., Hyakudomi R., Yamamoto T., Tajima Y. Bevacizumab-induced intestinal perforation in a patient with inoperable breast cancer: a case report and review of the literature. Journal of Medical Case Reports, 2018, № 12 (1), рр. 84. https://doi.org/10.1186/s13256-018-1619-x
- Панкратов А. А. Консервативное ведение абдоминальной травмы: целесообразность, эффективность, безопасность / А. А. Панкратов [и др.] // Анналы хирургии. - 2017. - № 3. - С. 150-154. URL: https://cyberleninka.ru/article/n/konservativnoe-vedenie-abdominalnoy-travmy-tselesoobraznost-effektivnost-bezopasnost?ysclid=la89ofvdo5382546562
- Nakatsutsumi K., Endo A., Okuzawa H., Onishi I., Koyanagi A., Nagaoka E., Morishita K., Aiboshi J., Otomo Y. Colon perforation as a complication of COVID-19: a case report. Surg Case Rep., 2021, № 7 (1), рр. 175. https://doi.org/10.1186/s40792-021-01261-0


