Модель атома
Автор: Плахута В.В.
Журнал: Доклады независимых авторов @dna-izdatelstwo
Рубрика: Физика
Статья в выпуске: 57, 2023 года.
Бесплатный доступ
Теорию строения атома можно построить на базе законов классической физики, на основе фактов полученных опытным путём. Для этого не надо прибегать к экзотическим постулатам, противоречащим известным законам, и искажающим здравый смысл. В спорных случаях, при отсутствии достоверных опытных данных, обычно высказывается предположение, не противоречащее признанным основным законам в науке. При написании этой статьи автор руководствовался этими правилами. Предлагаемая теория является альтернативой квантовой физике.
Короткий адрес: https://sciup.org/148326039
IDR: 148326039
Текст научной статьи Модель атома
Теорию строения атома можно построить на базе законов классической физики, на основе фактов полученных опытным путём. Для этого не надо прибегать к экзотическим постулатам, противоречащим известным законам, и искажающим здравый смысл. В спорных случаях, при отсутствии достоверных опытных данных, обычно высказывается предположение, не противоречащее признанным основным законам в науке. При написании этой статьи автор руководствовался этими правилами. Предлагаемая теория является альтернативой квантовой физике.
Модель атома в современной науке представлена в виде планетарной системы. Такая модель представлялась по аналогии системам в космосе. Впервые такую модель предложил Э. Резерфорд. В дальнейшем планетарную модель атома развивали и совершенствовали различные ученые. Однако до сих пор эта модель имеет множество принципиальных противоречий и недостатков. Она противоречива с точки зрения классической науки. Были попытки предложить другую модель атома, но они совершенно неубедительны, никем не признаны и не обсуждаются.
Многочисленные опыты показывают, что пространство атома почти пустое, а вся масса атома сосредоточена в центре, в ядре атома. Взамен планетарной модели атома, автор предлагает другую, свою модель. Представим электрон в форме тороида, вместо шарика как его обычно представляют. Тогда электроны тороиды в виде колец заполнят весь объём атома. Очевидно, что такие кольца, чтобы заполнить весь объём, будут очень тонкие. Но это нас не должно смущать. Представим, что эти кольца гибкие, и могут принимать разную форму и размеры. Ничего необычного в этом нет. Протон представим в виде шарика или эллипсоида. При сближении протона с электроном, протон окажется внутри тороида. Под действием электростатических сил, тороид в виде кольца сожмётся и охватит протон. Никакой аннигиляции при этом не произойдёт. Каждый участник сохранит свой заряд. Конструкция, когда протон опоясан электроном в виде кольца, и будет представлять собой нейтрон. На большом расстоянии от нейтрона он будет представляться как нейтральная частица не имеющего заряда, а вблизи он будет проявлять свой положительный или отрицательный заряд, в зависимости от того с какой стороны к нему приближаться. Опыты Хофштадтера показали, что у нейтрона есть зоны с разными зарядами. При движении нейтрона вблизи атомного ядра, он может притягиваться к ядру или отталкиваться от него, в зависимости от того, какой стороной нейтрон находится в данный момент к ядру.
Нейтрон предложенной конструкции, находящийся внутри ядра, будет проявлять свои электростатические свойства, и оказывать цементирующие, укрепляющие прочность ядра, свойства. Электростатические силы на малых расстояниях, в маленьком объеме ядра, будут иметь огромную величину. Внутри ядра действуют, не какие- то придуманные, мифические ядерные силы, а известные электростатические силы.
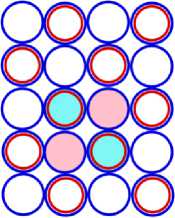
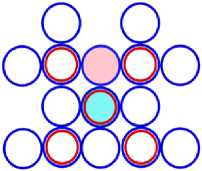
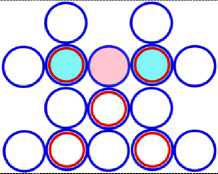
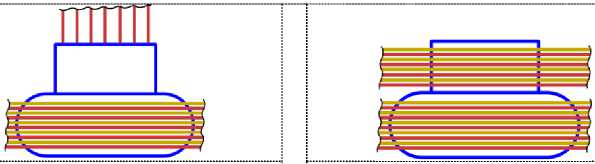
На рис.1 и в следующих рисунках схем ядер показаны нейтроны и протоны в сечении. Нарисованные синим цветом окружности представляют собой протоны. Красным цветом показаны электроны, которые в виде колец охватывают протоны. На рис.2, при виде сверху, они представлены в виде красных полосок. Таким образом, две окружности слева, совместно с электронами, являются нейтронами. На рис.1 показан электрон, принявший такую форму, как показано, под действием электростатических сил. Та часть кольца электрона, что находится между двумя протонами, примет вид прямой линии. Часть электрона, имеющая отрицательный заряд, чтобы находится на одинаковом расстоянии от центров протонов, имеющих положительный заряд, будет иметь вид в виде прямой линии, как это показано на рис.1. Это возможно при условии, как говорилось выше, что электрон в виде кольца может изменять свой размер и форму. На рис.2 показаны протоны, находящиеся на большом расстоянии от нейтронов L >> R . В этом случае, заряд протона и заряд электрона будет действовать как заряды, находящиеся в центре протона. И независимо от того какой стороной повёрнут нейтрон к протону, он будет проявлять себя как нейтральная частица.
Как показано на рис.1 между двумя протонами находится электрон, часть кольца которого представлена как прямая линия. Предполагая, что заряд электрона равномерно распределён по всему кольцу, то в той части кольца, что имеет вид прямой линии, величина заряда будет равна примерно половине заряда электрона (e /2). Как показывают опыты, заряд протона равномерно распределён по всему его объёму. В этом случае, при расчётах величин взаимодействии между протонами и электроном, можно поступать, как если бы заряды протонов находились в центрах протонов. Тогда протоны, с одинаковыми положительными зарядами, будут отталкиваться друг от друга в ядре дейтрона. И вместе с тем, оба протона будут притягиваться к прямолинейной ветви части кольца , имеющий отрицательный заряд. Вычислим силу притяжения протона к нейтрону, при их соприкосновении (в дейтроне), по закону Кулона. В соответствии с рис.1 величина силы отталкивания протонов будет равна:
Fi = k e2/ 4R2, где k — коэффициент пропорциональности в выражении закона Кулона в системе СИ, e - элементарный заряд, R - радиус протона.
Величина силы притяжения протона к прямолинейной ветви части электрона будет равна:
F 2 = k e2 / 2R 2 .
Величиной силы притяжения протона к криволинейной ветви части кольца можно пренебречь, как более удалённой от протона, с целью упрощения расчёта, так как наш расчёт приближенный. Тогда сила притяжения протона к нейтрону, при их соприкосновении (в дейтроне), будет равна:
F = F 2 - F i = k e2 / 4R2.
Подставив известные значения величин в системе СИ, получим:
F = 9*10 9 *(1,6*10-19) 2 / 4* (1,4*10-15)2 = 29,2 = 30 Н.
Таким образом, сила притяжения между протоном и нейтроном при их соприкосновении равна примерно 30 ньютонам. Так как размеры этих частиц весьма малые, то это огромная величина. Определим приблизительно величину давления на единицу площади протона при соприкосновении его с нейтроном (в дейтроне).
F / S = F / n R2 =30/ 3,14* (1,4*10-15)2 = 5*1030 Н / м2.
При удалении нейтрона от протона сила притяжения резко уменьшается. В пределах атома, в соответствии свыше приведённой формулой, она уменьшится на 5 порядков. А фактически она уменьшится значительно больше, потому что форма электрона будет меняться.
Определим потенциальную энергию U системы соединения протона с нейтроном (дейтрона). Потенциальная энергия системы неподвижных зарядов, создающих электростатическое поле, равна энергии взаимодействия этих зарядов.
В нашем случае потенциальная энергия будет равна работе по отрыву протона от нейтрона. Элементарная работа δU совершаемая силой F, действующей на точечный электрический заряд е , находящийся в электростатическом поле, равна:
δU = F dl, где dl - элементарное перемещение заряда. Полную работу U, при перемещении протона с зарядом е из точки R в бесконечность, найдем, проинтегрировав это выражение.
U = r J ” F dl = r J ” k e2dR / 4R2 = ke2 / 4R
Подставив численные значения величин в системе СИ, получим:
U = 9*109 (1,6*10-19)2/ 4* 1,4*10-15 ≈ 4,1* 10 – 14 Дж ≈ 25 МэВ Энергия связи ядра дейтрона, рассчитанная по дефекту массы, равна 2,23 МэВ. Это почти в 12 раз меньше вычисленного нами значения. Ошибка в пределах одного порядка. Мы не учли, что зависимость силы взаимодействия зарядов не квадратичная от расстояния, а имеет более высокую степень. Не учтено, что фактически сила проявляет себя только на малых расстояниях, а также что при отрыве протона от нейтрона, сила притяжения кольца к протону уменьшается. В результате, кольцо сильнее стягивается к нейтрону в процессе отрыва протона, что также уменьшает силу притяжения протона. Учитывая, что проведённый нами расчёт приблизительный, совпадение свидетельствует, что мы на правильном пути.
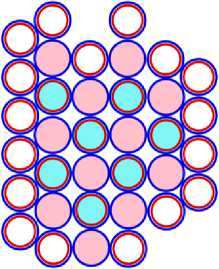
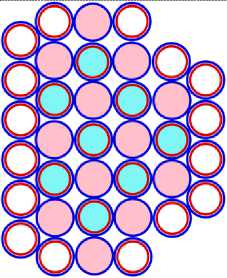
Изображая частицы: протоны, нейтроны и электроны, как это показано на рис.1, можно построить схемы атомных ядер (САЯ) для элементов всей таблицы периодической системы Менделеева. САЯ изотопов водорода показаны: дейтерия на рис. 1.1; трития на рис. 1.2 и изотопа 1Н4 на рис. 1.3. САЯ изотопа водорода 1Н7, с известным максимальным числом нейтронов, на рис.1.4. Следующий элемент таблицы Менделеева это - гелий. У гелия имеется два стабильных изотопа 2Не3 и 2Не4, САЯ для них показаны на рис. 2.1 и рис. 2.2. Известен изотоп гелия 2Не10 с максимальным числом нейтронов равных 8. На рис. 2.3 изображение его САЯ. Литий будет следующим элементом таблицы Менделеева. Литий имеет 2 стабильных изотопа 3Li6 и 3Li7. Их САЯ показаны на рис. 3.1 и рис. 3.2. На рис. 3.3 показана САЯ изотопа лития 3Li13, в котором максимально возможное количество нейтронов равное 10. Минимальное количество нейтронов равное 1, которое может иметь ядро изотопа лития, его САЯ показано на рис. 3.4. Следующий по порядку в таблице Менделеева элемент - это бериллий. На рис. 4.1 САЯ единственного стабильного изотопа бериллия 4Ве9. САЯ изотопа бериллия 4Ве5, в котором один нейтрон рис. 4.2. Максимальное количество нейтронов в ядре бериллия может быть равно 12. Рис. 4.3 его САЯ. Следующий элемент - это бор. Он имеет два стабильных изотопа 5В10 и 5В11. Их САЯ показаны на рис. 5.1 и рис. 5.2. САЯ бора с минимальным количеством нейтронов, равных 2, показана на рис. 5.3. САЯ бора с максимальным количеством нейтронов, равных 16 показана на рис. 5.5. Ядро имеет вытянутую форму. На рис. 5.4 сделана попытка более компактно расположить нуклиды в ядре атома изотопа бора с известным максимальным числом количества нейтронов. Удалось разместить только 15 нейтронов. Для шестнадцатого нейтрона места не находится. Из этого следует что ядро, возможно, имеет вытянутую форму, как показано на рис. 5.5. Стабильные изотопы бора, очевидно, имеют также удлинённую форму, смотри рис. 5.1 и рис. 5.2. Возможно, этим объясняется способность бора в большей степени к захвату нейтронов. Следующий элемент в таблице, это углерод. Он имеет два стабильных изотопа 6С12 и 6С13. На рис. 6.1 и рис. 6.2 показаны их САЯ. На рис. 6.3 САЯ изотопа углерода 6С22 с известным максимальным числом нейтронов. САЯ изотопа углерода 6 С8, с минимальным числом нейтронов, это рис. 6.4. Следующий элемент таблицы - это азот. Азот имеет два стабильных изотопа 7N14 и 7N15. Их САЯ показаны на рис. 7.1 и рис. 7.2.САЯ изотопа азота, с минимальным числом нейтронов 7N10, это рис. 7.3. Максимальное количество нейтронов равное 18 может быть у изотопа азота 7N25. Его САЯ показана на рис. 7.4. За азотом в таблице следует кислород. У него имеются три стабильных изотопа 8О16, 8О17 и 8О18. На рис. 8.1, рис. 8.2 и рис. 8.3 изображены их САЯ. САЯ кислорода 8О11,с минимальным количеством нейтронов, изображена на рис. 8.4. На рис. 8.5 САЯ кислорода 8О28 с известным максимальным количеством нейтронов равным 20. За кислородом в таблице расположен фтор. Единственным стабильным изотопом фтора является 9F19. САЯ этого изотопа показана на рис. 9.1. Минимальное количество нейтронов имеется в изотопе фтора 9F13. Его САЯ на рис. 9.2. Изотоп фтора с максимальным количеством нейтронов это 9F31. Его САЯ на рис. 9.3. Завершает второй период таблицы инертный газ неон. Существует три стабильных изотопа неона 10Nе20, 10Nе21 и 10Nе22. Их САЯ показаны на рис. 10.1, рис. 10.2 и рис. 10.3. САЯ изотопа неона с минимальным числом нейтронов 10Ne16 изображена на рис. 10.4. При известном максимальном количестве нейтронов в ядре атома 10Ne34, его САЯ будет иметь вид, как показано на рис. 10.5.
При просмотре САЯ всех изотопов элементов первого и второго периода таблицы Менделеева, видны следующие закономерности.
-
1. Протоны находятся друг от друга на расстоянии и не соприкасаются.
-
2. Нейтроны находятся между протонами и разъединяют их.
-
3. Количество нейтронов, соприкасающихся с одним протоном, для всех изотопов не превышает 5. Исключение изотоп 1 Н7 , где нейтронов 6.
-
4. Количество нейтронов, соприкасающихся с одним протоном, в ядрах атомов стабильных изотопов равно 3 или 4.
-
5. Количество протонов, соприкасающихся с одним нейтроном, не превышает 4 для всех изотопов.
-
6. Нуклоны в ядрах расположены компактно.
-
7. В ядре имеются протоны, нейтроны и электроны. Они не рождаются при распаде ядра, они там уже имеются.
-
8. Некоторые части ядер, некоторых элементов, можно рассматривать как ядра гелия.
-
9. Для первого и второго периода таблицы Менделеева стабильны ядра с примерно одинаковым числом протонов и нейтронов. Отличия количества нейтронов могут быть в пределах «+1; +2»
-
10. Наименьшее количество нейтронов в ядре изотопа определяется возможностью их размещения, при условии исключения соприкосновения протонов между собой.
-
11. Наибольшее количество нейтронов в ядре изотопа определяется возможностью их размещения, при условии, что количество нейтронов, соприкасающихся с одним протоном, не превышает 5.
-
12. Для первого и второго периода таблицы значения энергии связи ядер, приходящейся на одну ядерную частицу (нуклон), растет с увеличением числа частиц в ядре, и мало зависит от их сорта. Это можно объяснить в предположении, что с увеличением нуклонов, увеличиваются ядерные силы, сжимающие ядро. Под действием этих сил, нуклоны деформируются. Из шарообразной формы они приобретают форму эллипсоида. Расстояния между нуклонами уменьшаются.
-
13. Ядерные силы в атоме гелия аномально (скачкообразно) увеличиваются по сравнению с соседними элементами. Из схемы ядра гелия видно, что ядерные силы у него направлены так, что они уменьшают расстояние между нейтронами, и увеличивают расстояние между протонами, увеличивая прочность ядра. Поэтому ядро гелия, в некоторых случаях,
становится осколком при разрушении ядра некоторых элементов.
Все приведённые выше схемы рассматривались, когда все нуклоны находятся в сечении одной плоскости (вид сверху). Рассмотрим изотопы с другой стороны (вид сбоку), и изобразим эскиз схемы атома (ЭСА). На рис. 1.5 показан ЭСА водорода. Красным цветом изображен электрон в виде кольца, внутри которого находится ядро, протон (изображен, синим цветом). Плоскость электрона как кольца находится под прямым углом к плоскости чертежа. Поэтому электрон показан как прямая линия. Размер электрона превышает размер ядра на много порядков, поэтому его края показаны линиями обрыва. Электрон атома водорода активно спаривается с другим электроном другого атома водорода, у которого электрон имеет противоположный спин. В результате образуется молекула Н2. В природных условиях, поэтому водород находится в молекулярном состоянии. В атомарном состоянии водород очень активен. На рис. 2.4 показан ЭСА гелия. Красным и желтым цветом показаны два спаренных электрона. Внутри электрона в виде тора находится ядро, изображённое синим цветом. У атома гелия нет валентных электронов, находящихся с внешней стороны ядра. Два спаренных электрона, с противоположными спинами, охватывают ядро. Трудно оторвать такой электрон от ядра, требуется большая энергия. Поэтому гелий называют инертным газом. На рис. 3.5 показан ЭСА лития. Литий, так же, как и гелий, имеет 2 спаренных электрона. Аналогично, как и у гелия, внутри электронов в виде колец находится ядро. С внешней стороны ядра у него находится третий электрон. Этот электрон является валентным. Он может быть сравнительно легко оторван от ядра. Два других электрона, как и у гелия, удалить очень трудно. На это требуется затратить значительную энергию. Внешний валентный электрон может спариваться с другим электроном, имеющим противоположный спин, многих химических элементов, образуя химические соединения. Поэтому литий очень активный элемент, легко вступает в химическую связь. Он проявляет валентность +1, -1. На рис. 4.4 показан ЭСА бериллия. Аналогично, у бериллия, так же, как и у гелия и лития, два спаренных электрона, внутри которых ядро. С внешней стороны ядра находятся два спаренных валентных электрона. Один из этих электронов, или оба, могут быть оторваны. Эти электроны могут спариваться с другими электронами некоторых элементов, образуя химические соединения. Поскольку электроны у бериллия спарены, для их отрыва требуется больше энергии. Поэтому бериллий более активен при повышении температуры и давления. Бериллий проявляет валентность: +1; +2; -1 и -2. ЭСА бора на рис. 5.6 показан. У бора 2 спаренные электроны показанные красным и жёлтым цветом, внутри которых, находится ядро, показанное синим цветом. К ядру присоединяются, с внешней стороны, три валентных электрона. Два валентных электрона спарены. Вследствие наличия одного не спаренного электрона, атомы бора легко соединяются друг с другом. В таком виде атомы бора становятся малоактивны. При повышенной температуре и давлении электроны атома бора могут спариваться с другими электронами некоторых элементов, образуя химические соединения. Бор проявляет валентность: +1; +2; +3; -1; -2; -3. На рис. 6.5 показан ЭСА углерода. У него, как и у предыдущих атомов, описанных выше, два спаренных электрона, внутри которых ядро. С внешней стороны ядра электростатические силы удерживают две пары, спаренные электрона. Поскольку у углерода все электроны спарены, он становится активным только при повышенной температуре и давлении. Углерод проявляет валентность: +1; +2; +3; +4; -1; -2; -3; -4. ЭСА азота на рис. 7.5 показан. У него два спаренных электрона, внутри которых ядро. С внешней стороны ядра находятся 5 электронов. Из них две пары, спаренные электрона, и один не спаренный электрон. Вследствие наличия одного не спаренного электрона, атомы азота соединяются в пары, образуя молекулу N2 с тройной связью. Поэтому природный азот малоактивный. Азот проявляет валентность: +5; +4; +3; +2; +1; -1; -2; -3. Следующим элементом в таблице является кислород. Его ЭСА показан на рис. 8.6. У кислорода уже три пары спаренных электронов, внутри которых ядро. Увеличение количества колец электронов вокруг ядра у кислорода, по сравнению с предыдущими элементами, связано с повышением величины заряда ядра. С внешней стороны ядра находятся два не спаренных валентных электрона. Электроны находятся по разные стороны ядра, поэтому они не спарены. Наличие двух не спаренных электронов делает кислород очень активным окислителем. В природной среде атомы кислорода соединяются в пары, образуя молекулу О2. Можно предположить, что в этой молекуле кислорода остаются два не спаренных электрона. В результате чего кислород остаётся очень активным. Кислород проявляет валентность +1; +2; -1; -2. На рис. 9.4 показан ЭСА фтора. У фтора уже четыре пары, спаренные электрона, внутри которых ядро. С внешней стороны ядра находится один валентный электрон. Этот электрон активно спаривается с другим электроном, имеющим противоположный спин, атомов многих химических элементов.
Поэтому фтор очень активен. Фтор проявляет валентность -1. Завершается второй период системы благородным газом неоном. Его ЭСА показан на рис. 10.6. У атома неона пять пар спаренных электронов в виде колец. Внутри колец находится ядро. У неона нет валентных электронов. Поэтому его называют инертным газом.
В предлагаемой модели атомов элементов, валентные электроны находятся с внешней стороны ядра атома. Остальные электроны в виде тороидов охватывают ядро, так что ядро находится внутри колец. В химических реакциях участвуют в большинстве случаев только валентные электроны. Очень важной характеристикой атомов является энергия ионизации. Энергия ионизации равна энергии по удалению электрона из атома. Для некоторых элементов в таблице 1 приведены значения энергий ионизации некоторых атомов. Энергия ионизации валентных электронов показана красным цветом. Значения энергий ионизаций для электронов, охватывающих ядро, показаны черным цветом. Для удаления валентных электронов требуется меньше энергии, чем для удаления электронов, охватывающих ядро. Это показывают опытные данные. Если удалить все валентные электроны из атома, то для удаления следующего электрона, охватывающего ядро, энергия ионизации возрастает значительным скачком. Величины этих скачков для некоторых элементов приведены в таблице 2. Такой факт подтверждает правильность выбранной схемы ядра и модели атома.
В статье рассмотрены схемы изотопов атомов первого и второго периода таблицы Менделеева. Предполагается, что все нуклоны в атомах этих периодов находятся в одной плоскости, как это показано на рисунках. Нуклоны в атомах каждого следующего периода находятся в следующих плоскостях один над другим, как бы на разных этажах, или можно сказать в следующих ячейках или кластерах. Последний атом предыдущего периода для последующих атомов следующего периода служит как бы основанием или подложкой. Для элементов третьего периода таким основанием или подложкой является атом инертного неона 10 Ne20 , у которого энергия связи на нуклон максимальна для элементов первого и второго периода таблицы Менделеева. Что свидетельствует о наиболее прочном ядре и основании.
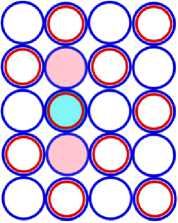
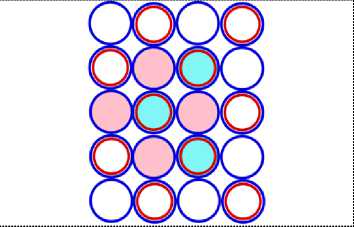
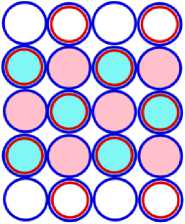
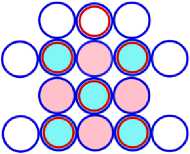
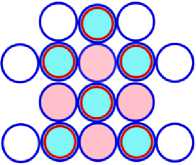
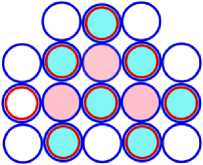
На рисунках схем ядер атомов третьего периода изображается схема ядра атома неона, как это изображалось и раньше, а поверх него, рисуется схема расположения остальных нуклонов изображаемого ядра атома. Эти нуклоны изображены окружностями с заливкой. Окружность с голубой заливкой изображает протон. А окружность с розовой заливкой изображает нейтрон. Такой способ изображения схемы ядра атома позволяет нам видеть ядро атома как бы сверху прозрачными. Где видно основание или подложка, и над ней верх или этаж, второй ячейки ядра атома. Нуклоны второго кластера ядра атома располагаются так, что протоны находятся над нейтронами, а нейтроны над протонами. Силы взаимного притяжения скрепляют их.
На рис. 11.1 показана САЯ первого элемента, третьего периода таблицы Менделеева, натрия 11 Na23 . В основании показаны нуклоны ядра неона в количестве 20 единиц, а оставшиеся три нуклона находятся над ними, в виде ядра элемента 1 H3. Десять электронов этого элемента в виде колец будут охватывать ядро, как это и у неона. Одиннадцатый электрон удерживает протон второй части ядра, как это показано на рис. 11.4. Этот электрон является валентным. Таким образом, валентность натрия -1; +1, аналогично, как и у лития. На рис. 11.1 показан красным цветом в скобках символ лития ( Li), химические свойства которого подобны натрию.
На рис. 12.1 изображена САЯ второго элемента, третьего периода таблицы, магния 12 Mg24 . В основании САЯ неона 10 Ne20 показана. Оставшиеся четыре нуклона, в виде ядра 2 Не4 находятся во второй ячейки ядра. Эта часть ядра удерживает два валентных электрона. Десять электронов охватывают ядро, как это показано на рис. 12.4, не участвуют в химических связях. Поэтому химические свойства магния подобны бериллию. Это показано на рис. 12.1 символом (Ве). Валентность магния +2.
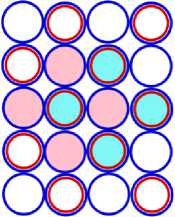
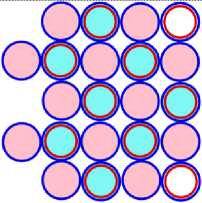
Рис. 13.1 это САЯ алюминия 13 Al27 , где в подложке показана САЯ 10 Ne20 . Оставшиеся семь нуклонов в виде ядра 3 Li7 находятся во второй части ядра. Этот кластер ядра удерживает три валентных электрона. Как показано на рис. 13.4 десять электронов, охватывают ядро, не участвуют в химических связях. Химические свойства алюминия подобны бору. Алюминий проявляет валентность +3.
Рис. 14.1 это САЯ кремния 14 Si28. Как и раньше в основании изображена САЯ неона. Над ней находится восемь нуклонов в виде ядра 4 Ве8 . Четыре валентных электрона определяют химические свойства кремния подобным углероду. Валентность кремния: -4; +2; +4. Рис. 14.4 это ЭСА кремния, вид сбоку.
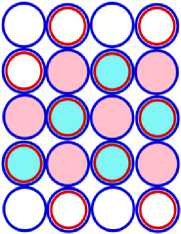
Рис. 15.1 это САЯ фосфора 15Р31. В основании показана САЯ неона. Оставшиеся одиннадцать нуклонов в виде ядра бора 5В11 находятся во второй ячейке ядра. Пять валентных электрона определяют химические свойства фосфора подобным азоту. Фосфор проявляет валентность: -3; +1; +3; +5. Рис. 15.4 ЭСА фосфора, показан сбоку.
Рис.16.1 это САЯ серы 16 S32 . В основании изображена САЯ неона. Во втором ряду нуклоны в виде ядра 6 С12 . Шесть валентных электронов определяют химические свойства серы. Она только частично подобна кислороду. Сера проявляет валентность: -2; +2; +4; +6. ЭСА серы это рис. 16.4.
Рис. 17.1 - САЯ хлора 17 CI35. В основании С АЯ неона. Во второй ячейке ядра нуклоны в виде ядра 7 N15 показаны. Семь валентных электрона определяют химические свойства хлора подобным фтору. Валентность хлора: -1; +1; +2; +3; +4; +5; +6. На рис. 17.4 ЭСА атома хлора.
Рис.18.1 это САЯ атома аргона 18 Ar40 . В первой части имеем САЯ неона. Во второй части ядра атома будет САЯ кислорода 8 О20 . Все 18 электронов охватывают ядро. Валентные электроны отсутствуют. Аргон инертный подобно неону. На рис. 18.4 показан ЭСА аргона. Рассмотрены стабильные изотопы элементов третьего периода таблицы Менделеева.
Для уяснения закономерностей строения ядер атомов, рассмотрим схемы ядер их нестабильных изотопов, имеющих максимальное и минимальное количество нейтронов. На рис. 11.2 САЯ нестабильного атома натрия имеющего известное максимальное количество нейтронов равное 28. Естественно предположить, что в основании находится САЯ неона, имеющего максимально возможное количество нейтронов равное 24. Во второй части ядра атома натрия будет САЯ изотопа 1 Н5 , имеющего один протон. Он будет притягивать один валентный электрон. Поэтому такой атом будет иметь химические свойства аналогично литию.
На рисунках: «рис. 12.2; рис. 13.2; рис. 14.2; рис. 15.2; рис. 16.2; рис. 17.2; рис. 18.2» показаны САЯ изотопов соответственно: «12Mg40; 13Al43; 14Si44; 15P47; 16S49; 17Cl52; 18Ar54», имеющие максимально известное количество нейтронов. В основании или подложке этих схем находится САЯ неона 10Ne34 имеющего максимальное количество нейтронов. Во второй части этих ядер находятся оставшиеся нуклоны. Они будут иметь вид ядер следующих элементов: «2He6; 3Li9; 4Be10; 5B13; 6C15: 7N18: 8O20». Количество протонов в этих частях ядер будет определять и количество валентных электронов в них. Поэтому химические свойства этих элементов будут аналогичны свойствам следующих элементов соответственно: «бериллий, бор, углерод, азот, кислород, фтор, неон». Все остальные электроны, кроме валентных, будут опоясывать ядра соответствующих элементов и в химических связях не участвуют.
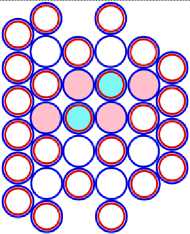
Схемы ядер атомов нестабильных изотопов, элементов третьего периода таблицы Менделеева имеющие минимальное количество нейтронов, показаны на рисунках соответственно: «рис. 11.3; рис. 12.3; рис.13.3; рис. 14.3; рис. 15.3; рис 16.3; рис.17.3; 18.3». Естественно предположить, что в основании или подложке находится САЯ неона, имеющего известное минимальное количество нейтронов равное 5. Во второй части этих ядер находятся оставшиеся нуклоны. Они будут иметь вид САЯ следующих элементов : « 1 H2; 2 He3; 3 Li5; 4 Be6; 5 B9; 6 C10; 7 N10; 8 О11» . Количество валентных электронов в этих ядрах определяется количеством протонов в них. Поэтому химические свойства этих элементов будут аналогичны свойствам следующих элементов соответственно: «литий, бериллий, бор, углерод, азот, кислород, фтор и неон», расположенных в соответствующих рядах таблицы Менделеева.
Схемы ядер и атомов следующих элементов таблицы Менделеева будут рассмотрены в следующих статьях.
Ионизация
Таблица 1. Энергия ионизации атомов некоторых элементов.
|
Атом |
, эВ |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
1 |
Н |
13,6 |
|||||||
|
2 |
Не |
24.6 |
54.4 |
||||||
|
3 |
Li |
5,39 |
75,6 |
122,4 |
|||||
|
4 |
Be |
9,32 |
18,2 |
158,3 |
217.7 |
||||
|
5 |
В |
8,30 |
25,1 |
37,9 |
259,3 |
340,1 |
|||
|
6 |
С |
11,3 |
24 4 |
47,9 |
64.5 |
392,0 |
489.8 |
||
|
7 |
N |
14,5 |
29,6 |
47.5 |
77,4 |
97,9 |
551,9 |
666,8 |
|
|
8 |
0 |
13,6 |
35,1 |
54.9 |
77.4 |
113,9 |
138,1 |
739,1 |
871,1 |
|
9 |
F |
17.4 |
35,0 |
62,7 |
87,2 |
114,2 |
157 1 |
185.1 |
953,6 |
|
10 |
Не |
21.6 |
41,1 |
63,0 |
97,0 |
126,3 |
157,9 |
207.2 |
239,1 |
|
11 |
Na |
5,14 |
47,3 |
71,6 |
98,9 |
138,6 |
172,4 |
208,4 |
264,2 |
|
12 |
Mg |
7,64 |
15,0 |
80,1 |
109.3 |
141,2 |
186.8 |
225.3 |
265,8 |
|
13 |
Al |
5.98 |
18,8 |
28.4 |
120,0 |
153,8 |
190.4 |
241,8 |
285,1 |
|
14 |
Si |
8,15 |
16,3 |
33,5 |
45,13 |
166,7 |
205 1 |
246,4 |
304,0 |
|
15 |
P |
10,5 |
19,7 |
30,2 |
51.4 |
65,0 |
220.4 |
263,3 |
309,3 |
|
16 |
S |
10.4 |
23.4 |
35,0 |
47,3 |
72.5 |
88.0 |
281.0 |
328.4 |
|
17 |
Cl |
13.0 |
23,8 |
39,9 |
53,5 |
67.8 |
96,6 |
114.2 |
348,5 |
|
18 |
Ar |
15.8 |
27,6 |
40.9 |
59,8 |
75,0 |
91,0 |
123.9 |
143.4 |
|
19 |
К |
4.34 |
31,8 |
46.0 |
60,9 |
82,6 |
99,4 |
117.5 |
154,3 |
|
20 |
Ca |
6.11 |
11.9 |
51.2 |
67,0 |
84.4 |
108,7 |
127.4 |
143,3 |
|
21 |
Sk |
6.56 |
12,8 |
24.8 |
73,5 |
91,8 |
111 |
138 |
158 |
|
22 |
Ti |
6.83 |
13,6 |
27.5 |
43.3 |
99,8 |
119 |
141 |
170 |
|
23 |
V |
6.74 |
14.7 |
29.3 |
48.0 |
65.3 |
129 |
151 |
174 |
|
24 |
Cr |
6,76 |
16,5 |
31,0 |
49,2 |
69,5 |
90,6 |
160 |
185 |
|
25 |
Mn |
7.43 |
15,6 |
33,7 |
51.2 |
72,4 |
95,0 |
119 |
195 |
|
26 |
Fe |
7,90 |
16,2 |
30,6 |
54.8 |
75,0 |
99.0 |
125 |
151 |
|
27 |
Co |
7,86 |
17,1 |
33,5 |
51,3 |
78,5 |
102 |
129 |
163 |
|
28 |
Ni |
7,63 |
18,2 |
35,3 |
54.9 |
76,0 |
108 |
133 |
168 |
|
29 |
Cu |
7,72 |
20,3 |
36,8 |
57.4 |
80,0 |
103 |
138 |
182 |
|
30 |
Zn |
9,39 |
18,0 |
39,7 |
59,6 |
83,0 |
103 |
134 |
174 |
Таблица 2
|
Li |
Be |
В |
C |
N |
0 |
F |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
к |
Ca |
|
14 |
8,7 |
6,9 |
6,1 |
5,6 |
1,6 |
2,0 |
9,2 |
5,3 |
4.2 |
3,7 |
3.4 |
3,2 |
3,0 |
7,3 |
4.3 |
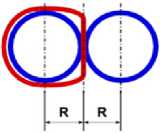
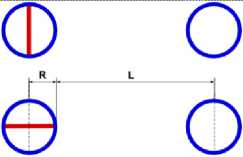
Рис. 1
Рис. 2


Рис. 1.1 1 Н2
Рис. 1.2 1 Н3
Рис. 1.3 1 Н4
Рис. 1.4 1 Н7

Рис. 2.1 2 Не3
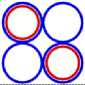
Рис. 2.2 2 Не4
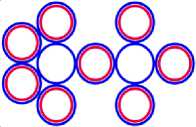
Рис. 2.3 2 Не10
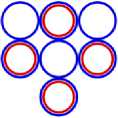
Рис. 3.2 3 Li7
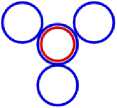
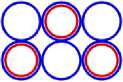
Рис. 3.1 3 Li6
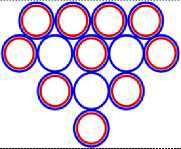
Рис. 3.3 3 Li13
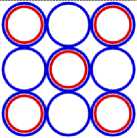
Рис. 3.4 3 Li4
Рис. 4.1 4 Be9
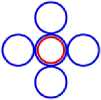
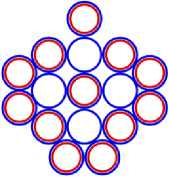
Рис. 4.2 4 Be5
Рис. 4.3 4 Be16
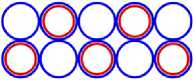
Рис. 5.1 5 B10
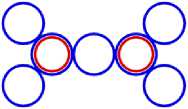
Рис. 5.3 5 B7
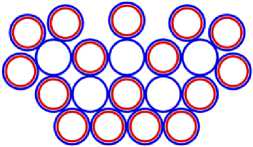
Рис. 5.5 5 B21
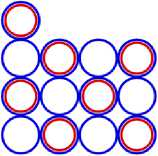
Рис. 6.2 6 C13
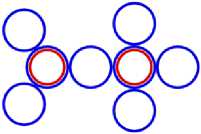
Рис. 6.4 6 C8
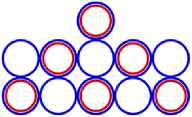
Рис. 5.2 5 B11
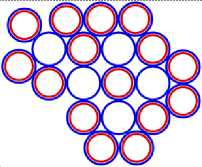
Рис. 5.4 5 B20
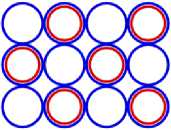
Рис. 6.1 6 C12
Рис. 6.3 6 C22
Рис. 7.1 7 N14
Рис. 7.2 7 N15
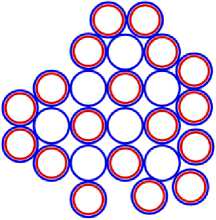
Рис. 7.4 7 N25
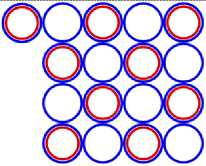
Рис. 8.2 8 O17
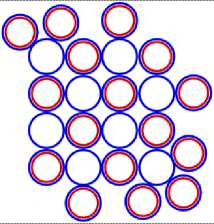
Рис. 8.4 8 O28
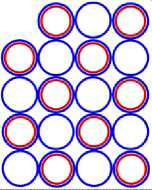
Рис. 9.1 9 F19
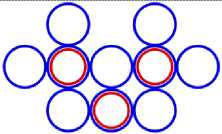
Рис. 7.3 7 N10
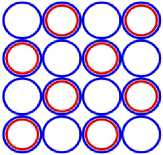
Рис. 8.1 8 O16
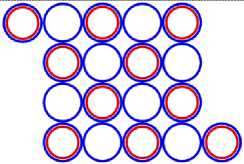
Рис. 8.3 8 O18
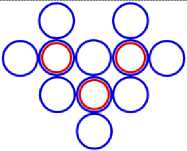
Рис. 8.5 8 O11
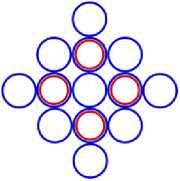
Рис. 9.2 9 F13

Рис. 9.3 9 F31
Рис. 10.1 10 Ne20

Рис. 10.2 10 Ne21
Рис. 10.3 10 Ne22
Рис. 10.4 10 Ne16
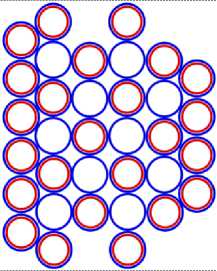
Рис. 10.5 10 Ne34

Рис. 1.5 1 H1

Рис. 2.4 2 He4

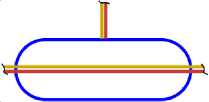
Рис. 3.5 3 Li7
Рис. 4.4 4 Be9
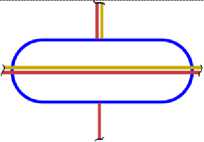
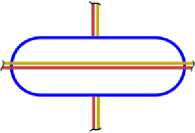
Рис. 5.6 5 B11
Рис. 6.5 6 C12
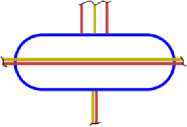
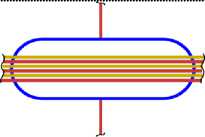
Рис. 7.5 7 N14
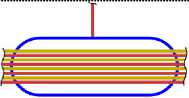
Рис. 8.6 8 O16

Рис. 9.4 9 F19
Рис. 10.6 10 Ne20
12 Mq24 = 10 Ne20 + 2 Ne4 (Be)
Рис. 12.1
11 Na23 = 10 Ne20 + 1 Н3 (Li )
Рис. 11.1
13 Al27 = 10 Ne20 + 3 Li7 (b)
Рис. 13.1
14 Si28 = 10 Ne20 + 4 Be8 (C)
Рис. 14.1
15 P31 = 10 Ne20 + 5 B11 (n)
Рис. 15.1
16 S32 = 10 Ne20 + 6 C12 (o)
Рис. 16.1

17 Cl35 = 10 Ne20 + 7 N15 (f)
Рис. 17.1
18 Ar40 = 10 Ne20 + 8 O20 (Ne)
Рис. 18.1
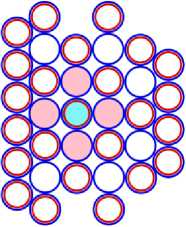
11 Na39 = 10 Ne34 + 1 H5 (Li) Рис. 11.2
12 Mq40 = 10 Ne34 + 2 He6 (Be)
Рис. 12.2
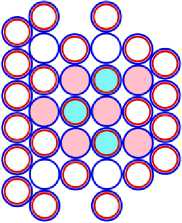
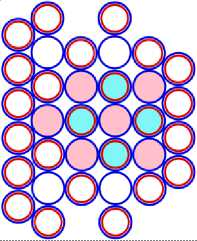
13 Al43 = 10 Ne34 + 3 Li9 (b)
Рис. 13.2
14Si44 = 10Ne34 + 4Be10 (c)
Рис. 14.2
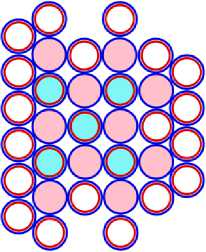
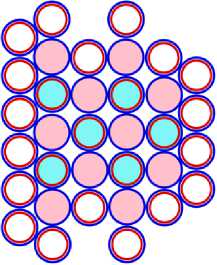
15 P47 = 10 Ne34 + 5 B13 (n)
Рис. 15.2
16 S49 = 10 Ne34 + 6 C15 (o)
Рис. 16.2
17 Cl52 = 10 Ne34 + 7 N18 (f)
Рис. 17.2
18 Ar54 = 10 Ne34 + 8 O20 (Ne)
Рис. 18.2
11 Na17 = 10 Ne15 + 1 H2 (Li)
Рис. 11.3
12 Mq18 = 10 Ne15 + 2 He3 (Be)
Рис. 12.3
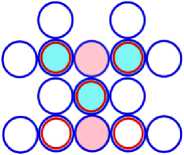
13 Al21 = 10 Ne16 + 3 Li5 (b)
Рис. 13.3
14 Si22 = 10 Ne16 + 4 Be6 (c)
Рис. 14.3
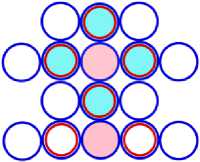
15P25 = 10Ne16 + 5B9 (N)
Рис. 15.3
16S27 = 10Ne17 + 6C10 (O)
Рис. 16.3
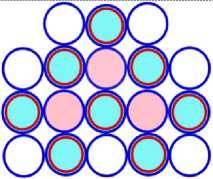
17Cl28 = 10Ne18 + 7N10 (f)
Рис. 17.3
18Ar29 = 10Ne18 + 8O11 (Ne)
Рис. 18.3
11 Na23
12Mq24
Рис. 11.4
Рис. 12.4
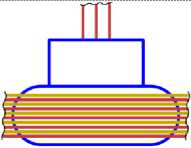
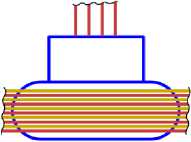
13Al27
14 Si28
Рис. 13.4
Рис. 14.4
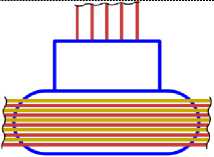
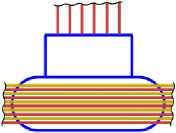
15 P31
Рис. 15.4
16S32
Рис. 16.4
17Cl35
Рис. 17.4
18 Ar40
Рис. 18.4
Список литературы Модель атома
- Кадменский С.Г., Фурман В.И. Альфа-распад и родственные ядерные реакции. М.: Энергоатомиздат, 1985. 221с.
- Грызинский М. Об атоме точно: Семь лекций по атомной физике. / Ред. М. М. Лаврентьев. — Новосибирск, 2004; М.: Editotial URSS, 2005. - 94 с. - Сер. “Библиотека конференции”; Вып. 1.
- Окунев В. С. Кластерная радиоактивность: факты, закономерности, прогнозы; под ред. А. Н. Морозова. — М.: Издательство МГТУ им. Н.Э. Баумана, 2019. – 240 [1] с.: ил. ISBN 978-5-7038-5223-1
- Васильев Б. В. Является ли нейтрон элементарной частицей? Сообщ. ОЯИРЗ-2014-77. Дубна, 2014. 6 с.
- Грызинский М. О природе атома // Поиск математических закономерностей Мироздания: физические идеи, подходы, концепции. Вып. 2. Новосибирск: Изд-во ИМ, 2001. C. 135–160.
- Еганова И. А., Каллис В. О моделировании нейтрона в классической физике: методический обзор. Сообщение Объединенного института ядерных исследований. Дубна, 2015. РЗ-2015-75.
- Косарев А.В. Физические условия и механизмы низкоэнергетических ядерных реакций. // «Академия Тринитаризма», М., Эл № 77-6567, публ.27156, 20.05.2021г. Режим доступа: http://www.trinitas.ru/rus/doc/0016/001h/4705-ks.pdf
- Яворский Б. М. Справочник по физике / Б. М. Яворский, А. А. Детлаф. – М.: Наука, 1980. – 508 с


