Модель определения коэффициента диффузии в растворах электролитов
Автор: Жигжитова С.Б., Балданова Д.М., Бадмаев С.С.
Журнал: Вестник Бурятского государственного университета. Химия. Физика @vestnik-bsu-chemistry-physics
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Предложена модель для определения коэффициента диффузии в растворах электролитов. Данная модель основана на связи между плазменным состоянием системы зарядов и гидродинамическим приближением ионов в растворах. В данном состоянии вещества многочастичные взаимодействия однозначно формализуются плазменными колебаниями. Для расчета необходимых параметров развиваемой модели использованы имеющиеся справочные данные электрической проводимости, общепринятые в химической термодинамике. Полученные значения коэффициента диффузии по предложенной расчетной формуле согласуются с литературными данными, что подтверждает перспективность данного метода оценки диффузии в системе.
Растворы электролитов, коэффициент диффузии, электрическая проводимость, вязкость, плазменно-гидродинамическое приближение
Короткий адрес: https://sciup.org/148328731
IDR: 148328731 | УДК: 541.13:54-145 | DOI: 10.18101/2306-2363-2024-2-3-7
Текст научной статьи Модель определения коэффициента диффузии в растворах электролитов
Жигжитова С. Б., Балданова Д. М., Бадмаев С. С. Модель определения коэффициента диффузии в растворах электролитов // Вестник Бурятского государственного университета. Химия. Физика. 2024. Вып. 2. С. 3–7.
Диффузия ионов зависит от подвижности ионов, их способности двигаться в среде, а также от коэффициента вязкости среды, который влияет на скорость диффузии. Все эти параметры важны при изучении процессов диффузии ионов.
Согласно Дебаю-Фалькенгагену ионы могут совершать гармонические колебания в неравновесных условиях. Движение ионов в процессах диффузии обусловлено градиентом концентрации вещества. Потенциальная энергия взаимодействия ионов определяется следующим выражением:
U = 2 E ea^a • где ea — заряд иона; ^a — потенциал. Известно, что ea^a = Ua . Тогда U = | EUa •
при сложении энергии U a появляется множитель 1/2, поскольку она учтена дважды. В соответствии с законами механики движение ионов при диффузии возможно только под действием силы Fa :
dU a
F n =--
a .
dr
Таким образом, учитывая данные условия, 1 a 2
F a можно представить в виде: dU a
dr
.
Эффективная сила F эф связана с F a следующим соотношением (4):
F =
Fэф
_y dUa = 2f
dr a
.
Запишем силу Стокса для ионов, принимая их за сферические объекты:
( R^Fa = 6n^R 1 + - V •
V rD )
здесь П — вязкость; R — радиус сольватированных ионов; r D — дебаевский радиус и V — скорость ионов [2].
Следовательно, эффективную силу можно представить:
F* = 2 ■ 6 nn R 1 + - |v .
V rD )
Подвижность b — это отношение скорости движения ионов V к эффективной силе эф
b = V-
F эф
R^ ’ 2 • 6 nn R 1 + —
V rD )
С другой стороны, по закону Эйнштейна подвижность можно представить через диффузию
b=-D- kT
Б
.
Коэффициент диффузии можно получить, объединив уравнения (7) и (8:
D = 1 •
kT
Б
( r\
6 nn R 1 + -
V r D J
здесь n — коэффициент вязкости, равный [1]
П =
N A e 2 exp( - —) 411 •Ю - 12
Б
6 n AR (1 + —) rD
Тогда, подставив вязкость (10) в формулу (9), получим окончательное выражение, позволяющее рассчитать коэффициент диффузии:
kJA
Б
^ Ш
Ne 2 exp•I.II • 10 1 a
V кБТ J
Результаты расчета коэффициента диффузии для водных растворов по формуле (11) приведены ниже.
Для хлорида цезия CsCl при 25 °С
Таблица 1
|
C, моль/л |
0,1 |
0,5 |
1 |
2 |
3 |
5 |
|
Ʌ, Ом-1 см2моль-1 |
128 |
118 |
113 |
107 |
98,7 |
85 |
|
D теор·10-5 , см2·сек- 1 |
1,62 |
1,75 |
1,87 |
1,90 |
1,95 |
2,01 |
|
D лит [3] |
- |
1,86 |
1,91 |
2,09 |
- |
- |
Для хлорида натрия NaCl при 25 °С
Таблица 2
|
С, моль/л |
0.001 |
0.005 |
0.01 |
0.1 |
0.5 |
|
Л , Ом-1 см2моль-1 |
123 |
111 |
118 |
106 |
93 |
|
D pac4 •Ю" 5, см2сек-1 |
1,653 |
1,556 |
1,160 |
1,517 |
1,450 |
|
Dлиm •Ю " 5 , см2сек-1 |
1,584 |
1,506 |
1,544 |
1,482 |
1,469 |
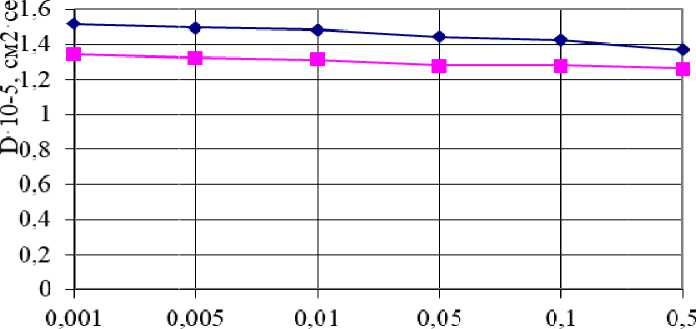
>- расч -в- лит С, моль/л
Рис. 1. За в ис им о ст ь ко э ф фициент а д иффуз ии D хлорида лития LiCl от концентрации при 25 °С
Заключение
Т а к и м об р а зом , ре з ультаты исследования показывают, что ис по льзование у равн ен и я ( 11) для оц енки диффузии в системе было эффективным. Лит е р а т урные значения и зн аче н и я, полученные путем расчета, совпадают в пр ед ел а х по г решн о ст и . Это г овори т о т ом, чт о для анализа процессов диффузии в рассматриваемой системе п ред ложенный метод оценки диффузии может быт ь п рим ен ен с д ос т аточн ой т очн ос т ь ю .
Список литературы Модель определения коэффициента диффузии в растворах электролитов
- Балданова Д. М., Танганов Б. Б. Плазменно-гидродинамическая концепция состояния ионов в растворах электролитов в оценке некоторых свойств: монография. Москва: Издательский дом Академии естествознания, 2012. 100 с. Текст: непосредственный. EDN: QKDAKP
- Плазменно-гидродинамическая теория растворов электролитов и электропроводность / М. М. Балданов, Д. М. Балданова, С. Б. Жигжитова, Б. Б. Танганов // Доклады АН ВШ РФ. 2006. № 1(6). С. 25-33. Текст: непосредственный. EDN: KVQJPN
- Справочник химика. Т. 3 / под редакцией Б. П. Никольского. Москва: Химия, 1969. 1005 с. Текст: непосредственный.


