Моделирование акустических сигналов при оптоакустическом преобразовании для осесимметричных несферических форм эритроцитов
Автор: Кравчук Д.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Математические методы и моделирование в приборостроении
Статья в выпуске: 2 т.29, 2019 года.
Бесплатный доступ
В работе проведено моделирование промежуточных форм при трансформации эритроцитов на примере трехмерных фигур для последующего исследования изменения оптоакустических сигналов. Смоделированы пространственные фигуры эритроцитов с помощью полинома Чебышева. Разработана модель изменения формы эритроцитов для моделирования акустического сигнала с целью определения формы эритроцитов, используя оптоакустический эффект. Известно, что эритроциты переносят кислород и углекислый газ. Кислород переносится из легких в ткани, где он обменивается на CO2. Здоровый эритроцит имеет двояковогнутую форму, клетка является гибкой и принимает форму колокола, когда она проходит через очень маленькие кровеносные сосуды. Эритроцит покрыт мембраной, состоящей из липидов и белков, без ядра и содержит гемоглобин - красный, богатый железом белок, который связывает кислород. Перед выделением из костного мозга в периферическую кровь эритроциты теряют свои ядра, что дает преимущества уменьшенного веса и превращения в двояковогнутый диск с повышенной деформируемостью по сравнению с более жестким сфероидальным.
Оптоакустический эффект, акустический сигнал, эритроциты, лазер
Короткий адрес: https://sciup.org/142218223
IDR: 142218223 | УДК: 535.015 | DOI: 10.18358/np-29-2-i8389
Текст научной статьи Моделирование акустических сигналов при оптоакустическом преобразовании для осесимметричных несферических форм эритроцитов
При воздействии короткого лазерного импульса на тканевую жидкую среду происходит поглощение света, и в результате термоупругого расширения излучается импульс акустического давления, который можно зарегистрировать ультразвуковым преобразователем. Форма и длительность акустического сигнала может говорить о форме и количестве объектов в жидкости, участвующих в поглощении лазерного импульса в биожидкости. В работах [1–11] проводились расчеты сформированного акустического сигнала в результате оптоакустического преобразования для математических моделей неагрегированных и агрегированных эритроцитов, в том числе с учетом кислородона-сыщения. В этих исследованиях для упрощения использовалась сферическая модель формы эритроцита. В настоящей работе приведена математическая модель патологических форм эритроцитов для исследования изменения форм эритроцитов с помощью оптоакустического метода.
Структурная организация мембраны эритроцитов человека позволяет ей претерпевать большие обратимые деформации, сохраняя при этом свою структурную целостность в течение 4-месячного пребывания в кровообращении. Мембрана обладает высокой эластичностью, быстро реагирует на приложенные гидравлические напряжения. В то время как нормальные эритроциты могут деформироваться с линейным расширением примерно до 250 %, увеличение площади поверхности на 3–4 % приводит к лизису клеток. Следовательно, важной особенностью индуцированных деформаций эритроцитов как in vitro , так и in vivo является то, что они не вызывают значительного изменения площади поверхности мембраны [12].
Снижение отношения площади поверхности клеток к объему и, как следствие, увеличение сферичности клеток является отличительной чертой эритроцитов при наследственных сфероцитозе (HS), эллиптоцитозе (HE) и гипергидратирован-ном стоматоцитозе (OHS). В случае HS и HE повышенная сферичность является результатом потери площади поверхности ячейки, в то время как в случае OHS она является результатом увеличенного объема ячейки.
HS является распространенной наследственной гемолитической анемией, поражающей все этнические группы, но особенно распространена у людей североевропейского происхождения (1 на 3000 человек). HS обычно ассоциируется с доминантным наследованием (75 %), хотя случаи, когда наследование не является доминантным (25 %), — не редкость. Типичная HS характеризуется наличием гемолиза с анемией, желтухой, желчными камнями и наличием сфероцитов на мазках периферической крови. Тем не менее клинические проявления HS варьируются от легкой до очень тяжелой анемии. Общей чертой всех форм HS является потеря площади поверхности мембраны и результирующее изменение формы клеток от дискоцитов к стоматоцитам, к сфероцитам. Поскольку эритроциты с уменьшенной площадью поверхности мембраны не могут эффективно пройти через селезенку, они изолируются и удаляются из кровотока селезенкой. Важно отметить, что тяжесть анемии связана со степенью уменьшения площади поверхности мембраны [12].
Рис. 1. Геометрия формирования акустического сигнала при оптоакустическом преобразовании
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ
Оптоакустический эффект описывается уравнением [13, с. 282], [14], которое можно записать через потенциал скорости ϕ как:
(
V 2
I
—
1 д_) с2 б t2J
ф =
β ρC p
Ht ,
Рассмотрим геометрию нерегулярного поглотителя лазерного излучения в жидкости с азимутальной симметрией. Запишем в сферических полярных координатах ( r ' , 0 ', ф ') с помощью замены r' = F ( S '); F ( S' ) — функция, связывающая r' и 0 (рис. 1).
Используем сферические гармоники для параметризации морфологии клеток [16, 17]. Этот набор функций может соответствовать как симметричным, так и несимметричным объектам. В этом случае контур ячейки можно разложить по полиномам Лежандра
r ' ( 0 ' ) = R e
где c — скорость звука, ρ — плотность жидкости, β — коэффициент расширения изобарического объема, C p — удельная теплоемкость, t — время и H t — функция нагрева, определяемая как тепловая энергия, внесенная оптическим лучом; p = — р б ф / 9 t .
Если оптическое излучение с интенсивностью I 0 распространяется вдоль оси X и изменяется со временем синусоидально, то функция нагрева может быть выражена как Ht( x , t ) = μI 0 e – ωt . Здесь μ — коэффициент оптического поглощения освещенной среды. Для такой функции нагрева поле звукового давления в установившемся режиме сводится к выражению [15]:
V
к
—
-1 - 1 v 2 д 2 J
ф=<
\а>в0 о (внутри поглотителя),
0 (снаружи поглотителя).
1 + ^ a n P n ( cos S ')
n
где R e — радиус сферической оболочки, охватывающей эритроцит; α n — параметр, описывающий форму; P n — многочлен Лежандра степени n . Любая произвольная функция между 0 < 0' < п может быть выражена через базисные векторы. Используем это условие для получения нормальной формы дискоцита. Двумерное поперечное сечение фигуры и трехмерная фигура приведены на рис. 2.
Расстояние r'(0') точки на поверхности для сфероидальной частицы запишем в виде:
r-(0-) =
ab
[ b2 sin2 0' + a2 cos2 0 ' ]
где a и b — полуоси.
На рис. 3, 4 приведены сфероиды с различными пропорциями, причем у всех частиц объем неизменный. Уравнения для несферического объекта имеют вид:
а
–1
–2
–3
–4
–1
–2
–3
–4
–4
б
–4
–5–5
–4 –3 –2
–1 0 1
x ,
2 мкм
Рис. 2. Моделируемая форма здорового эритроцита. а — изометрия, б — поперечное сечение
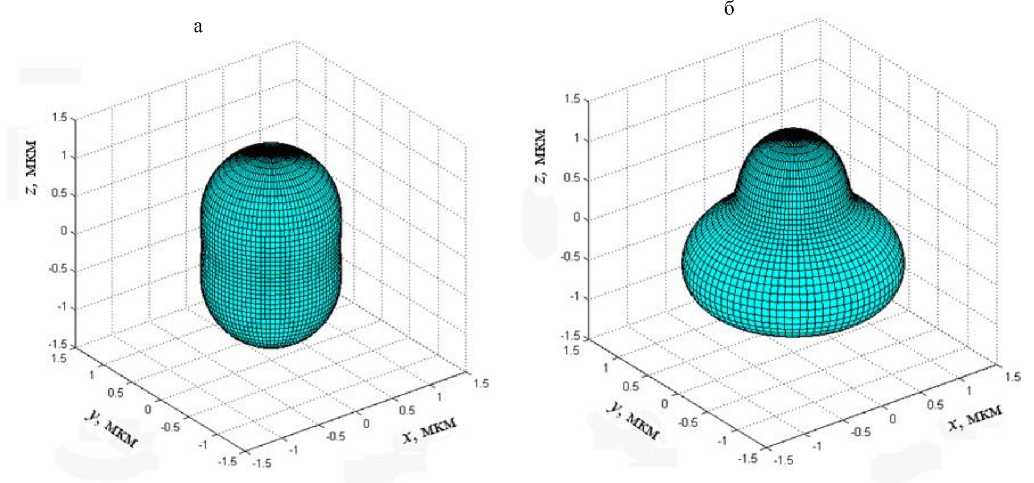
Рис. 3. Частицы, построенные с помощью многочлена Чебышева с ε = 0.25. а — n = 2, б — n = 3
i kr π F ( θ ) 2 π
p ( r , k ) =-— А Sin OdO f r o 2d r ,J e- k W (5)
4 πr 0 0 0
Расчет интеграла проводится численным методом с использованием полинома Чебышева для различных сферических и осесимметричных несферических частиц, поглощающих лазерное излучение и формирующих акустическое поле.
МОДЕЛИРОВАНИЕ
Для построения фигуры с помощью многочлена Чебышева расстояние от точки на поверхности можно записать в виде [18]:
r'O) = R c [ 1 + £ T „ (cos O ') ] , (6)
где T B (cos O ') = cos n O' — многочлен Чебышева
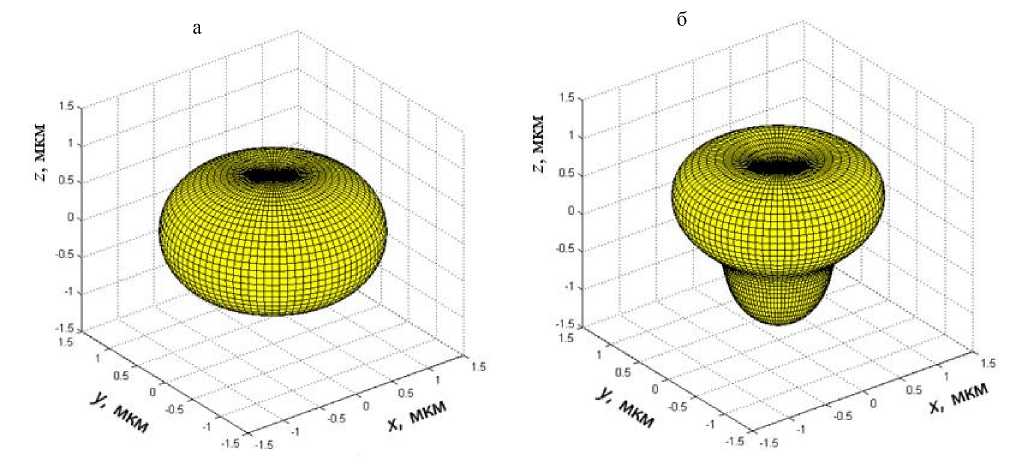
Рис. 4. Частицы, построенные с помощью многочлена Чебышева с ε = –0.25. а — n =2, б — n =3
степени n , где n определяет параметр волнистости, R c — радиус невозмущенной сферы, а ε — параметр деформации.
Частица формируется непрерывным деформированием сферы с использованием многочлена Чебышева степени n .
Частицы с фиксированным объемом приведены на рис. 3 для ε = 0.25 и рис. 4 для ε = –0.25. При четном значении n частицы симметричны относительно плоскости, перпендикулярной оси симметрии. Значения пиков, прогибов (кривизны поверхности) возрастают по мере увеличения величины ε.
Зрелая клетка имеет ширину около 7.8 мкм и толщину 1.7 мкм. Двояковогнутая форма (рис. 2) обеспечивает максимальную гибкость, а форма колокола используется для прохождения самых маленьких капилляров, которые имеют диаметр всего 5 мкм. Способность эритроцитов восстанавливаться после повторяющихся напряжений турбулентной циркуляции зависит от конструкции мембраны.
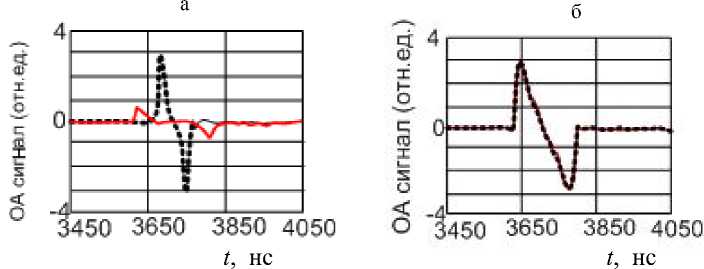
Рис. 5. Моделируемый акустический сигнал, формируемый дискоци-том и патологически измененным эритроцитом при оптоакустическом преобразовании (ОА).
Приведены сигналы в направлениях θ = 0 (пунктир) и θ = π/2 (сплошная линия) на ось симметрии: (a) дискоцит; (б) сфера
На рис. 5 приведен рассчитанный акустический сигнал, формируемый в результате оптоакустического преобразования в жидкости от дискоцитов и сфероидальных моделей эритроцитов с одинаковым объемом. В моделировании использовались параметры лазерной установки LIMO 100-532/1064U [1, 8–10]. Моделирование проводилось в среде Matlab 2017.
ЗАКЛЮЧЕНИЕ
Для определения формы эритроцитов с помощью оптоакустического эффекта была разработана двухмерная модель изменения формы эритроцитов для моделирования акустического сигнала.
Рассчитанные акустические сигналы отличаются для разных частиц в зависимости от их ориентации. Акустический импульс рассчитан, когда приемник расположен при θ = 0, как показано на рис. 5, а. Амплитуда сигнала уменьшается в четыре раза, а длительность акустического сигнала в три раза увеличивается при зондировании в направлении θ = π/2. Для однородной сферы сигналы идентичны со всех сторон (рис. 5, б). Моделирование параметрической поверхности является активной областью исследований в анализе медицинских изображений [16–20]. Поэтому сложные формы могут быть смоделированы с использованием сферических гармонических функций. Можно также предположить, что акустические сигналы от клеток и органелл могут быть получены через сферические гармонические функции для количественной оценки их морфологий.
Список литературы Моделирование акустических сигналов при оптоакустическом преобразовании для осесимметричных несферических форм эритроцитов
- Starchenko I.B., Kravchuk D.A., Kirichenko I.A. An optoacoustic laser cytometer prototype//Biomed Eng. 2018. Vol. 51, is. 5. P. 308-312 DOI: 10.1007/s10527-018-9737-8
- Кравчук Д.А., Старченко И.Б. Теоретическая модель для диагностики эффекта кислородонасыщения эритроцитов с помощью оптоакустических сигналов//Прикл. физ. 2018. № 4. С. 89-94.
- Кравчук Д.А. Математическая модель обнаружения внутриэритроцитарных инфекций с помощью оптоакустического метода//Biomed. Photonics. 2018. Т. 7, № 3. C. 36-42 DOI: 10.24931/2413-9432-2018-7-3-36-42
- Кравчук Д.А., Старченко И.Б. Модель формирования оптоакустического сигнала от эритроцитов для лазерного цитомера//Лазер. мед. 2018. T. 22, № 1. С. 57-61.
- Кравчук Д.А., Старченко И.Б. Математическое моделирование оптикоакустического сигнала от эритроцитов//Вест. нов. мед. техн. 2018. № 1. С. 96-101 DOI: 10.24411/1609-2163-2018-15947
- Кравчук Д.А., Старченко И.Б. Математическое моделирование оптоакустического сигнала от агрегированных эритроцитов для оценки уровня агрегации//Научн. приборостр. 2018. Т. 28, № 1. С. 30-36. URL: http://iairas.ru/mag/2018/full1/Art4.pdf
- Кравчук Д.А., Старченко И.Б. Моделирование процесса насыщения кислородом биологических тканей с помощью оптоакустического метода//Научн. приборостр. 2018. Т. 28, № 2. С. 20-24. URL: http://iairas.ru/mag/2018/full2/Art3.pdf
- Кравчук Д.А., Старченко И.Б. Модель формирования оптоакустического сигнала от агрегированных эритроцитов//Изв. Юго-Запад. гос. ун-та. Серия "Управление, вычислительная техника, информатика. Медицинское приборостроение". 2018. Т. 8, № 2 (27). С. 82-90.
- Орда-Жигулина Д.В., Орда-Жигулина М.В., Старченко И.Б., Кравчук Д.А. Экспериментальная установка для исследования оптоакустической проточной цитометрии//Моделирование, оптимизация и информационные технологии. 2018. Т. 6, № 3 (22). С. 21-29.
- Старченко И.Б., Кравчук Д.А., Кириченко И.А. Прототип оптоакустического лазерного цитомера//Мед. техн. 2017. № 5. C. 4-7.
- Кравчук Д.А., Старченко И.Б. Математическая модель формирования оптоакустического сигнала для оценки уровня агрегации эритроцитов//Вест. новых медицинских технологий. 2019. № 1. С. 119-123.
- Mohandas N., Gallagher P.G. Red cell membrane: past, present, and future//Blood. 2008. Vol. 112. P. 3939-3948
- DOI: 10.1182/blood-2008-07-161166
- Morse P.M., Ingard K.U. Theoretical Acoustics. Princeton, 1968. 949 p.
- Westervelt P.J., Larson R.S. Laser-excited broadside array//J. Acoust. Soc. Am. 1973. Vol. 54, is. 1. P. 121-122
- DOI: 10.1121/1.1913551
- Diebold G.J. Photoacoustic monopole radiation: Waves from objects with symmetry in one, two and three dimensions//Photoacoustic imaging and spectroscopy. Ed. by L.V. Wong. London. 2009. P. 3-17
- DOI: 10.1201/9781420059922.pt1
- Khairy K., Howard J. Spherical harmonics-based parametric deconvolution of 3D surface images using bending energy minimization//Med. Image Anal. 2008. Vol. 12. P. 217-227.
- Khairy K., Foo J., Howard J. Shapes of red blood cells: comparison of 3D confocal images with the bilayer-couple model//Cell Mol Bioeng. 2008. Vol. 1, is. 2-3. P. 173-181
- DOI: 10.1007/s12195-008-0019-5
- Mugnai A., Wiscombe W.J. Scattering from nonspherical Chebyshev particles. I: cross sections, single-scattering albedo, asymmetry factor, and backscattered fraction//Appl. Opt. 1986. Vol. 25, is. 7. P. 1235-1244
- DOI: 10.1364/AO.25.001235
- Zhang H.F., Maslov K., Sivaramakrishnan M., Stoica G., Wang L.V. Imaging of hemoglobin oxygen saturation variations in single vessels in vivo using photoacoustic microscopy//Appl. Phys. Lett. 2007. Vol. 90, is. 5. P. 1-3
- DOI: 10.1063/1.2435697
- Savery D., Cloutier G. Effect'of red blood cell clustering and aisotropy on ultrasound blood backscatter: A Monte Carlo study//IEEE Trans. Sonics Ultrason. 2005. Vol. 52, no. 1. P. 94-103. URL: https://www.lbum-crchum.com/publications-fichiers/w62ieeeuffc005Savery.pdf


