Моделирование экспериментального сепсиса путем выполнения лигирования и пункции слепой кишки (CLP-процедура)
Автор: Шаповалова Елена Юрьевна, Демяшкин Григорий Александрович, Маланичев Михаил Юрьевич, Погосян Давид Ашотович, Зорин Илья Алексеевич, Щекин В.И.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 3, 2020 года.
Бесплатный доступ
В настоящий момент остро стоит проблема лечения сепсиса. Для изучения данных морфофункциональных изменений используют модели на животных, например модель экспериментального перитонита - лигирование и пункцию слепой кишки (cecal ligation and puncture, CLP). Однако исследований, касающихся описания перестроек внутренних органов, в частности морфологической картины кожного покрова, проведено явно недостаточно. Цель исследования. Морфологическая оценка изменений внутренних органов мышей в условиях моделирования сепсиса. Материалы и методы. У мышей (n=40) проводили лигирование и пункцию слепой кишки для формирования экспериментального перитонита (CLP) и тяжелого сепсиса. В контрольной группе (n=10) осуществляли «фиктивную» операцию - срединную лапаротомию с последующим послойным глухим ушиванием операционной раны. Результаты. Во всех жизненно важных органах наблюдали нарушения, индуцированные CLP, особенно в печени (нарушение балочного строения печеночных долек с признаками баллонной дистрофии и зонами некроза, лейкоцитарная инфильтрация, полнокровие синусоидов), почках (истончение висцерального листка капсулы Боумена-Шумлянского, сужение просвета приносящих артериол, баллонная дистрофия проксимальных и дистальных канальцев, повсеместное исчезновение щеточной каемки в нефроцитах) и селезенке (гиперплазия белой пульпы с наличием большого количества апоптотических лимфоцитов), а также отмечали признаки слабой воспалительной инфильтрации в коже. Заключение. Обнаруженные в ходе исследования морфологические изменения соответствуют реакции исследуемых органов при сепсисе. Предложенный метод CLP для создания экспериментального перитонита можно использовать в качестве модели сепсиса.
Сепсис, кожа, воспаление
Короткий адрес: https://sciup.org/14117578
IDR: 14117578 | УДК: 616.5-002 | DOI: 10.34014/2227-1848-2020-3-150-158
Текст научной статьи Моделирование экспериментального сепсиса путем выполнения лигирования и пункции слепой кишки (CLP-процедура)
Введение. В настоящий момент остро стоит проблема лечения сепсиса. По современным представлениям сепсис является острой полио-рганной недостаточностью, вызванной неадекватным ответом иммунной системы. Пусковым механизмом развития генерализованного воспаления является продолжение продукции медиаторов воспаления после элиминации первичного антигена, инициировавшего воспаление [1]. Несмотря на это, золотым стандартом в диагностике остается посев крови, который оказывается положительным лишь у 20 % пациентов, у которых выявлен сепсис.
Для более точного понимания патогенеза и патофизиологии процесса используются модели сепсиса на животных. В настоящее время применяется несколько основных методов моделирования тяжелой воспалительной реакции у животных: введение в организм эндотоксина, внедрение патогена в виде бактерии или вируса, намеренное повреждение одного из естественных защитных барьеров животных. Наиболее распространенной моделью экспериментального перитонита является лигирование и пункция слепой кишки (cecal ligation and puncture, CLP), однако эта модель не лишена определенных недостатков. Во-первых, проблему может представлять формирование абсцессов, которые значительно уменьшают выживаемость. Во-вторых, существует большая вариативность выполнения модели, так как в каждом эксперименте может различаться место и диаметр прокола. В-третьих, CLP-модель не учитывает состояние пациента, в частности его возраст, иммунологический статус, особенности метаболизма, а также проводимую ему поддерживающую терапию [2, 10].
Таким образом, профилактика и лечение сепсиса требуют разработки и усовершенствования экспериментальной модели для понимания патоморфологических и молекулярнобиологических процессов, происходящих во внутренних органах.
Цель исследования. Морфологическая оценка изменений внутренних органов мышей в условиях моделирования сепсиса.
Материалы и методы. Экспериментальное морфологическое исследование проводили на базах Медицинской академии им. С.И. Георгиевского и Сеченовского университета.
Модель животных для исследования in vivo. В качестве моделей использовали самцов половозрелых черных мышей популяции C57BL/6 (30–35 г; 12 нед.). Животные содержались в виварии при 12-часовом световом дне, кондиционировании при температуре 23 °С и влажности 40–60 % на стандартном рационе питания с водой ad libitum. Мыши находились в пластиковых клетках с абсорбирующим слоем (рисовой шелухой), обеспечивающим гнездовой материал. На время эксперимента животные были размещены в клетках по две особи, чтобы исключить возможное влияние длительного одиночного содержания на поведение. Все манипуляции осуществляли согласно международным рекомендациям и руководствам по проведению медико-биологических исследований, уходу и использованию лабораторных животных (ILAR, DELS), Правилам лабораторной практики и приказу Министерства здравоохранения РФ от 01.04.2016 № 199н «Об утверждении правил лабораторной практики».
Протокол выполнения лигирования и пункции слепой кишки (CLP):
-
1. Мыши были поделены на две группы: животных 1-й группы (n=40) использовали для моделирования сепсиса; животным 2-й группы (контрольная; n=10) проводили «фиктивную» операцию – срединную лапаротомию с последующим послойным глухим ушиванием операционной раны.
-
2. Наркотизацию мышей выполняли изо-флураном с использованием наркозного испарителя.
-
3. После бритья брюшка проводили антисептическую обработку операционного поля спиртовым раствором хлоргексидина 0,5 %.
-
4. В асептических условиях выполняли срединную лапаротомию и проводили ревизию брюшной полости с мобилизацией слепой кишки.
-
5. Слепую кишку плотно перевязывали шовным материалом (6-0 PROLENE, 8680G; Ethicon) у ее основания, ниже илеоцекального угла. После этого делали прокол стенки дистального конца слепой кишки иглой 19-го калибра.
-
6. Производили отдавливание содержимого кишечника в брюшную полость через перфорацию. Далее слепую кишку возвращали на свое место в брюшную полость.
-
7. Рану послойно ушивали с использованием 6-0 шелковых нитей.
-
8. Мышей выводили из наркоза путем подкожного введения 1 мл подогретого 0,9 % раствора NaCl, используя иглу 25-го калибра.
-
9. Животных временно помещали под инфракрасную нагревательную лампу 150 W до полного восстановления от анестезии (от 30 мин до 1 ч).
-
10. Мышей продолжали кормить и поить в клетке.
-
11. Каждые 12 ч оценивали общее состояние и поведенческую реакцию животных.
Уже через 12 ч после операции у некоторых мышей (n=28) появлялись летаргичность, повышение температуры тела, диарея, недомогание, анурия, т.е. симптомы, соответствующие развитию сепсиса [3]. При развитии сепсиса, характеризующегося продолжительным болевым синдромом и долгой смертью, стоит проводить эвтаназию, чтобы не подвергать экспериментальных животных страданиям.
Выведение мышей из эксперимента. Все животные 1-й группы скончались от развившегося сепсиса в течение 3–5 сут. Мышам контрольной группы проводили плановую эвтаназию путем усыпления эфиром на 5-е сут. Мышам обеих групп выполняли срединную лапаротомию для забора органов из брюшной полости. При этом оценивали массу органов-мишеней: абсолютную (в граммах) и относительную (в % по отношению к массе тела), а также их внешний вид, размеры, состояние паренхимы на разрезе.
Морфологическое исследование. Учитывая данные специализированной литературы [4], для подтверждения сепсиса на исследование были взяты следующие органы: печень, почки, селезенка, легкие, сердце, головной мозг и фрагмент кожи.
Фрагменты внутренних органов фиксировали в 10 % нейтральном формалине, забуфе-ренном по Лилли (при рН 7,2–7,4), заливали в парафин по стандартной методике. После депарафинизации и регидратации парафиновых срезов их окрашивали гематоксилином и эозином.
Результаты
Морфологическое исследование внутренних органов. У животных при CLP-моделировании при вскрытии брюшной полости обнаружили большое скопление сливкообразного слизисто-гнойного экссудата – признак разлитого перитонита. При гистологическом исследовании толстой и тонкой кишок выявлены некрозы крипт и ворсинок, выраженная полиморфноядерная лейкоцитарная инфильтрация и отек подслизистой, мышечной и серозной оболочек.
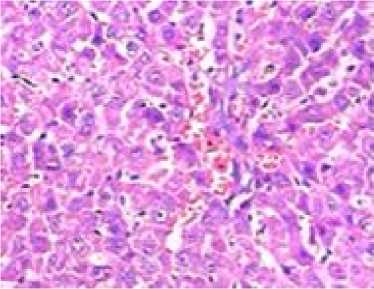
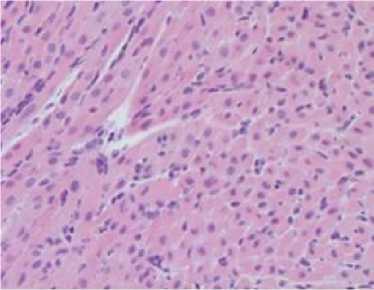
Печень. В печени мышей экспериментальной группы (масса ≈1,5 г; 4,29 % от массы животного) отмечали выраженные изменения гистоархитектоники: нарушение балочного строения печеночных долек с зонами некроза (кариолизис и цитолиз), наличие гепатоцитов с признаками баллонной дистрофии, моно-нуклеарную лейкоцитарную инфильтрацию. Синусоиды и сосуды системы портальной вены были полнокровны (рис. 1). У мышей контрольной группы патологических измене- ний не было (масса ≈1,47 г; 4,38 % от массы животного).
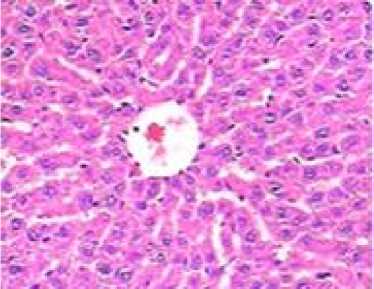
Почки. В паренхиме почек у животных 1-й группы (масса ≈0,23 г; 0,61 % от массы животного) были выявлены следующие изменения: истончение висцерального листка капсулы Боумена–Шумлянского, сужение просвета приносящих артериол, баллонная дистрофия проксимальных и дистальных канальцев, повсеместное исчезновение щеточной каемки в нефроцитах (рис. 1). В почках мышей 2-й группы патологических изменений выявлено не было (масса ≈0,22 г; 0,91 % от массы животного).
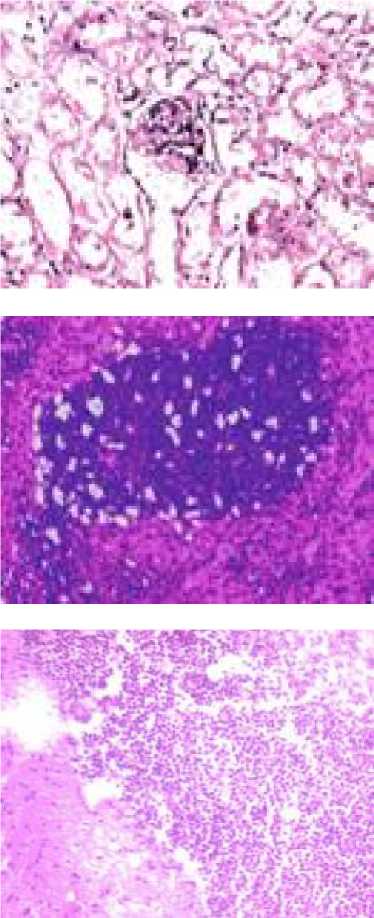
Селезенка. У животных в условиях CLP-модели обнаружена гиперплазия белой пульпы с наличием большого количества апоптотиче-ских лимфоцитов с уплотненными или фрагментированными ядрами (масса ≈0,28 г; 0,29 % от массы животного) (рис. 1). В контрольной группе изменения не выявлены (масса ≈0,24 г; 0,25 % от массы животного).
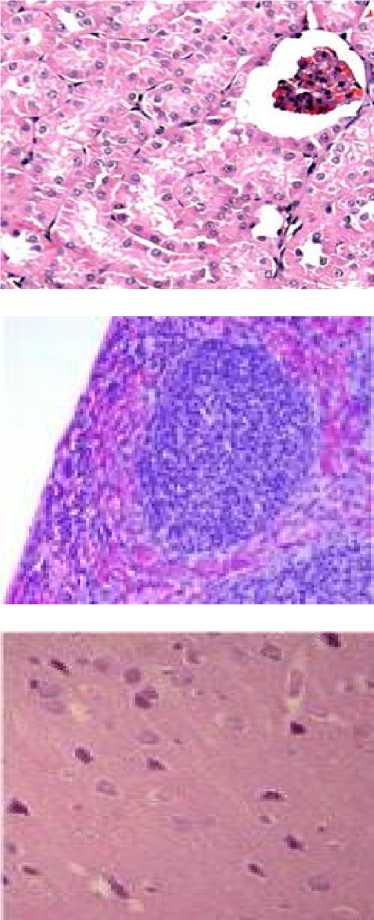
Головной мозг. В некоторых образцах экспериментальной группы (масса ≈0,55 г; 1,63 % от массы животного) (n=16) визуализировали тромботические массы, частично обтурирующие просветы кровеносных сосудов (рис. 1). Головной мозг мышей контрольной группы не имел патологических изменений (масса ≈0,45 г; 1,33 % от массы животного).
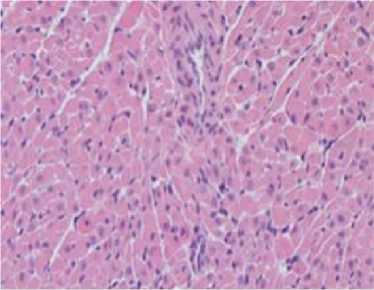
Сердце . У мышей экспериментальной группы (масса ≈0,18 г; 0,51 % от массы животного) вокруг единичных кардиомиоцитов обнаружили воспалительную лейкоцитарную инфильтрацию (миокардит). Кроме того, отмечали признаки дистрофии клеток: вакуолизацию и дезорганизацию миофибрилл (рис. 1). У животных контрольной группы морфофункциональных нарушений не обнаружили (масса ≈0,16 г; 0,5 % от массы животного).
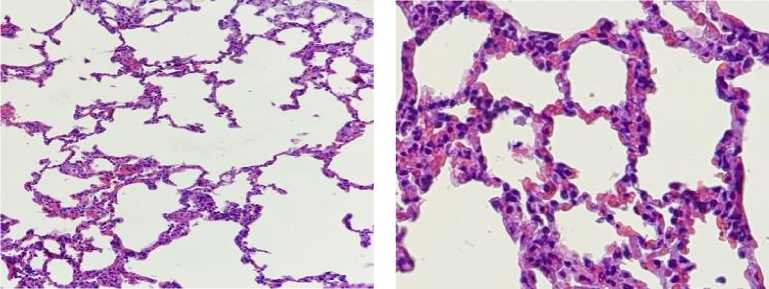
Легкие. Во всех исследуемых образцах мышей 1-й группы (масса ≈0,21 г; 0,6 % от массы животного) наблюдали эмфизематозную перестройку легочной паренхимы с дистрофическими изменениями альвеоцитов 1-го типа, деструкцией альвеол и бронхов мелкого калибра (рис. 1). У мышей контрольной группы признаков поражения легочной паренхимы вы выявили (масса ≈0,20 г; 0,6 % от массы животного).
Кожа. Во фрагментах кожи животных экспериментальной группы выявили слабую воспалительную инфильтрацию, преимуще- ственно мононуклеарных лейкоцитов (рис. 1). В коже животных контрольной группы патологических изменений не обнаружили.
Орган Оrgan
Печень
Liver
Экспериментальная группа
Experimental group
Контрольная группа
Control group
Почка
Kidney
Селезенка
Spleen
Головной мозг Brain
Сердце Heart
Орган Экспериментальная группа
Оrgan Experimental group
Контрольная группа
Control group
Легкое
Lung
Кожа
Skin
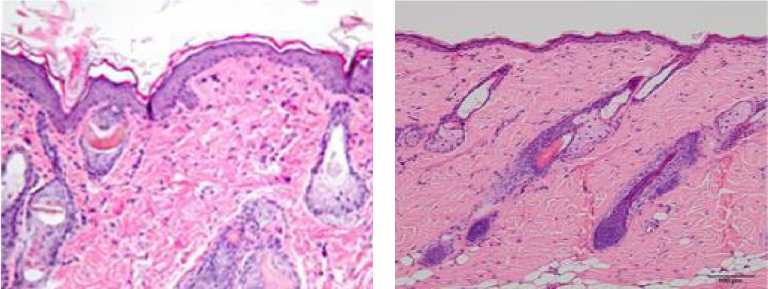
Рис. 1. Морфологические изменения внутренних органов. Окраска гематоксилином и эозином; x 200
Fig. 1. Morphological changes of internal organs (hematoxylin and eosin; magn. x 200)
Обсуждение. Несмотря на имеющиеся данные специализированной научной литературы об использования CLP-модели, изменения, происходящие во внутренних органах, описаны недостаточно, что и послужило поводом для настоящего исследования.
Выявленный в ходе эксперимента гнойный перитонит, подтвержденный микроскопически, доказывает, что технически манипу- ляция была выполнена правильно. Гнойный перитонит возник на фоне полимикробного воспаления, которое запустило каскад системных изменений во внутренних органах, в первую очередь – в жизненно важных.
Изменения в печени (нарушение гистоархитектоники), приводящие к застою крови и впоследствии к печеночной недостаточности, характерны для реакции при тяжелом сепсисе [5].
Особое внимание заслуживают изменения, происходящие в почках, которые наиболее быстро реагируют на септическое состояние. Нарушения фильтрации и реабсорбции в паренхиме почки препятствуют нормальной утилизации аммиака и токсичных метаболитов, а также приводят к дисфункции ренин-ан-гиотензин-альдостероновой системы. Именно быстрое развитие почечной недостаточности влечет за собой скорое прогрессирование по-лиорганной недостаточности и гемодинамических нарушений [6].
Гиперплазия белой пульпы селезенки и образование апоптотических телец являются классическими признаками сепсиса [7].
Изменения, произошедшие в паренхиме легкого, не являются принципиальными для сепсиса. Выявленные эмфизематозные изменения в легких приводят к дыхательной недостаточности и нарушению поведенческих реакций мышей [8].
Изменения, наблюдаемые в других органах: миокардит, ДВС-синдром, активация пролиферации и дифференцировки лимфоцитов, некрозы слизистой оболочки в толстой и тонкой кишке, – подтверждают экспериментальный генез данных патологических процессов.
Особым объектом нашего изучения явилась кожа, так как сведения о процессах, происходящих в этом органе при сепсисе, в существующей литературе единичны. Вовлечение кожи в патологический процесс в виде слабой воспалительной инфильтрации требует дальнейшего изучения.
Резюмируя вышеизложенное, можно отметить, что воспалительная реакция и после- дующие изменения в органах отличаются в зависимости от локализации. Так, наиболее тяжелые изменения происходили в печени и почках. Данные органы наиболее активно снабжаются кровью. Согласно литературным данным индуктором воспаления в различных тканях является цитокиновый шторм [9]. В связи с тем что мыши не получали поддерживающую терапию и были выведены из эксперимента на раннем этапе, тяжелой полиор-ганной дисфункции не отмечалось.
Преимуществами модели экспериментального перитонита являются простота выполнения, наличие полиэтиологического по-лимикробного инфекционного очага, вовлечение в процесс собственных бактерий организма. Развитие генерализованного воспаления протекает по тем же стадиям, с формированием тех же метаболических и гемодинамических нарушений, что и при тяжелом сепсисе у человека. Скорость развития сепсиса может варьировать в зависимости от количества проколов, диаметра перфорации, удаленности от места лигирования. Наша вариация предлагает быстрое развитие воспаления – в течение 3–5 сут. Однако некоторые авторы отмечают, что при использовании поддерживающей терапии выживаемость может увеличиться до 1–2 нед. [10].
Заключение. Обнаруженные в ходе исследования морфологические изменения соответствуют реакции исследуемых органов при сепсисе.
Предложенный метод лигирования и пункции слепой кишки (CLP) для создания экспериментального перитонита можно использовать в качестве модели сепсиса.
Список литературы Моделирование экспериментального сепсиса путем выполнения лигирования и пункции слепой кишки (CLP-процедура)
- Nguyen H.B., Smith D. Sepsis in the 21st century: recent definitions and therapeutic advances. Am. J. Emerg. Med. 2007; 25: 564-571.
- Dejager L., Pinheiro I., Dejonckheere E., Libert C. Cecal ligation and puncture: the gold standard model for polymicrobial sepsis? Trends in Microbiology. 2011; 19 (4): 198-208. DOI: 10.1016/j.tim.2011.01.001
- Comstedt P., Storgaard M., Lassen A.T. The Systemic Inflammatory Response Syndrome (SIRS) in acutely hospitalised medical patients: a cohort study. Scand J. Trauma Resusc. Emerg. Med. 2009; 17: 67. DOI: 10.1186/1757-7241-17-67
- Hotchkiss R.S., Moldawer L.L., Opal S.M., Reinhart K., Turnbull I.R., Vincent J.L. Sepsis and septic shock. Nat. Rev. Dis. Primers. 2016; 2: 16045. DOI: 10.1038/nrdp.2016.45
- Zhu W., Bao R., Fan X. PD-L1 blockade attenuated sepsis-induced liver injury in a mouse cecal ligation and puncture model. Mediators Inflamm. 2013; 2013: 361501. DOI: 10.1155/2013/361501
- Basile D.P., Anderson M.D., Sutton T.A. Pathophysiology of acute kidney injury. Compr. Physiol. 2012; 2 (2): 1303-1353. DOI: 10.1002/cphy.c110041
- Feig J.A., Cina S.J. Evaluation of Characteristics Associated With Acute Splenitis (Septic Spleen) as Markers of Systemic Infection. Archives of Pathology & Laboratory Medicine. 2001; 125 (7). 2.0.CO;2. DOI: 10.1043/0003-9985(2001)125
- Li J.L., Li G., Jing X.Z. Assessment of clinical sepsis-associated biomarkers in a septic mouse model. J. Int. Med. Res. 2018; 46 (6): 2410-2422. DOI: 10.1177/0300060518764717
- Chousterman B.G., Swirski F.K., Weber G.F. Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol. 2017; 39: 517-528. URL: 10.1007/s00281-017-0639-8 (дата обращения: 21.05.2020). DOI: 10.1007/s00281-017-0639-8(
- Gernot Schabbauer. Polymicrobial sepsis models: CLP versus CASP. Drug Discovery Today: Disease Models. 2012; 9; Iss. 1: e17-e21. DOI: 10.1016/j.ddmod.2011.10.002


