Моделирование направленного транспорта лекарственных веществ. Часть II. Многократное введение
Автор: Заборовский А.В., Гуревич К.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.16, 2017 года.
Бесплатный доступ
Разработка новых противоопухолевых препаратов является одной из актуальных задач современной онкологии. При всей значимости поиска новых соединений с противоопухолевой активностью возможности «старых» средств исчерпаны далеко не полностью. Направленный транспорт противоопухолевых средств может подарить им «вторую жизнь» в клинической практике. При разработке и внедрении новых средств направленного транспорта особое значение играет изменение их фармакодинамики и фармакокинетики. В настоящей работе описана формальная фармакокинетическая модель направленного транспорта лекарственных веществ. Описаны условия, при которых для исходного действующего вещества имеет смысл искать средство доставки. Проведен первичный скрининг противоопухолевых средств для целей их модификации для направленного транспорта, исходя из основных предположений модели.
Направленный транспорт, ткани-мишени, противоопухолевые препараты
Короткий адрес: https://sciup.org/140254105
IDR: 140254105 | УДК: 615.277.3 | DOI: 10.21294/1814-4861-2017-16-2-36-41
Текст научной статьи Моделирование направленного транспорта лекарственных веществ. Часть II. Многократное введение
В первой части статьи мы описали ситуацию с однократным введением противоопухолевого препарата, модифицированного для направленного транспорта. В последние годы стали появляться исследования, доказывающие, что модифицированные формы лекарственных веществ (ЛВ) могут оказаться эффективными для химиотерапии даже в тех случаях, когда исходная молекула действующего вещества неэффективна [1, 2]. Проводится большое количество экспериментальных и клинических исследований по изучению особенностей применения модифицированных лекарственных средств в онкологии [3, 4]. Следует отметить, что в мире для клинического использования разрешено не более 10 препаратов, однако еще несколько десятков находятся на разных стадиях предклини-ческих испытаний [5, 6].
Однако при разработке средств направленного транспорта возникает определенный разрыв между экспериментальным и клиническим применением модифицированных препаратов, так как противоопухолевая терапия предполагает многократное введение лекарственного вещества. Иными словами, остро встает вопрос терапевтического лекарственного мониторинга с целью оптимизации режимов проводимой терапии [7]. Терапевтический лекарственный мониторинг проводится для повышения эффективности терапии при снижении вероятности развития побочных эффектов [8–10]. Обычно при проведении терапевтического лекарственного мониторинга концентрация действующего вещества определяется в крови [11, 12]. При этом предполагается, что его содержание в тканях пропорционально измеренному в крови [13], как это делается, например, для противовирусных препаратов [14]. Для направленного транспорта не изучено, в какой степени определение концентрации действующего препарата в крови может отображать его концентрацию в тканях. Кроме того, не понятно, следует ли измерять концентрацию модифицированного препарата или же его активного компонента (без носителя). Для того чтобы ответить на поставленные вопросы, было проведено настоящее исследование.
Материал и методы
Для расчета изменения концентрации ЛВ использовали фармакокинетическую модель, описанную в первой части настоящей статьи [15].
Все обозначения и значения констант – те же, что описаны ранее.
После однократного введения ЛВ в конъюгированной форме в дозе 1 ммоль/мл в момент времени 0 моделировали многократное введение конъюгированного препарата в следующих режимах дозирования:
-
1. Однократное введение 1 ммоль/мл каждые 10 ч;
-
2. Двукратное введение 0,5 ммоль/мл каждые 5 ч;
-
3. Трехкратное введение 0,33 ммоль/л каждые 3 ч;
-
4. Равномерное введение 1 ммоль/мл за 10 ч.
Кроме того, в работе имитировали возможное связывание свободного препарата с белками крови:
С сс = - св-общ св с , св-общ где СС – степень связывания; Ссв-общ – общая концентрация свободного вещества в крови.
Предполагали, что только не связанная с белками форма лекарственного препарата может выводиться из крови и поступать в камеры 1 и 2. Исходя из этого предположения, уравнение (1), описанное в первой части статьи, уточняли следующим образом:
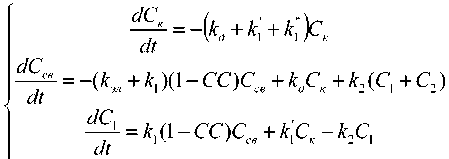
^ = ^ (1 - СС)Ссе + к;ск - к2С2 . at
Использовали численное решение системы (2) методом Рунге–Куты. Решение проводили в программе Excel на основании написанного алгоритма. Шаг по времени – 0,01 ч. Расчет коэффициента корреляции осуществляли методом Пирсона.
Результаты исследования
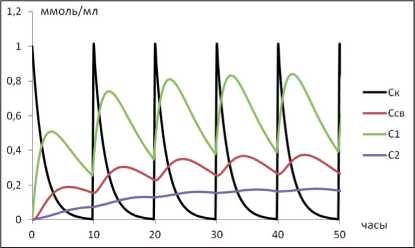
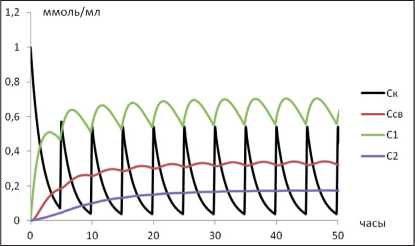
Все 4 смоделированных режима дозирования приводят к установлению «терапевтической» концентрации ЛВ в камере 1 (рис. 1). Обращает внимание, что увеличение кратности дозирования сопряжено с более быстрым установлением концентрации ЛВ в терапевтическом диапазоне.
С точки зрения основных предположений направленного транспорта вероятность развития побочных эффектов противоопухолевой терапии тем меньше, чем больше отношение С1/С2. Как следует из данных, приведенных на рис. 2, равномерное введение ЛВ обеспечивает наиболее плавное изменение соотношения С1/С2. Расчет показывает, что площадь кривой С1/С2 практически не меняется в зависимости от кратности введения препарата. То есть если механизм действия ЛВ таков, что вероятность развития побочных эффектов зависит от его накопленной концентрации, то режим дозирования практически не влияет на него.
Необходимо заметить, что при одинаковых режимах дозирования и неизменных константах скорости связывание с белками крови приводит к кумуляции ЛВ как в плазме крови, так и в тканях (рис. 3). На данном рисунке представлена ситуация равномерного введения ЛВ, однако, как показывает
А)
Б)
В)
Г)
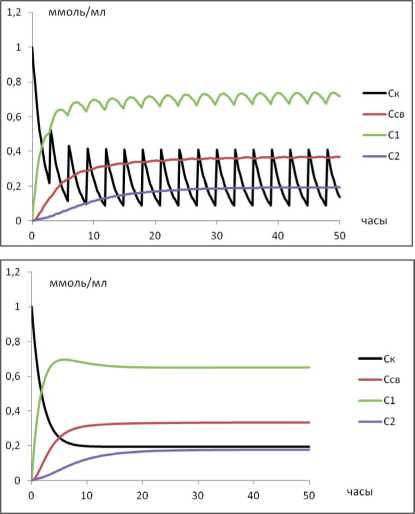
Рис. 1. Динамика изменения концентраций ЛВ при различных режимах введения: А) однократное введение; Б) двукратное введение; В) трехкратное введение; Г) равномерное введение. Во всех случаях – СС =0
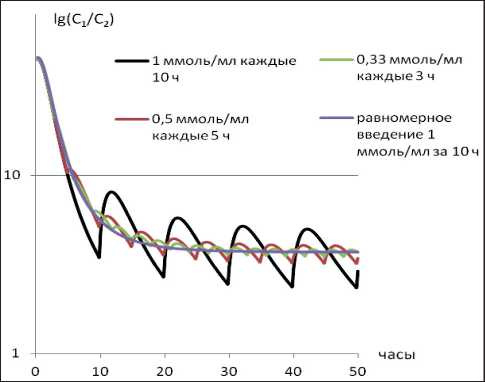
Рис. 2. Отношение С 1/ С 2 для разных режимов дозирования ЛВ, представленных на рис. 1
расчет, аналогичная ситуация наблюдается и при многократном введении. При этом связывание с белками крови приводит к некоторому уменьшению соотношения С 1/ С 2, т.е. вероятности развития побочных эффектов.
Следует отметить, что обычно в целях терапевтического лекарственного мониторинга определяют С св. При этом предполагают, что концентрация препарата в крови пропорциональна в месте действия. Мы решили проверить это предположение для динамики изменения концентраций, представленных на рис. 1. Из данных, представленных в таблице, следует ограниченность возможности использования определения С св для целей лекарственного мониторинга и невозможность – С к.
Особенно подчеркнем тот факт, что значения коэффициента корреляции зависят от режима дозирования ЛВ. В более общем случае на него также окажут влияние период наблюдения и константы, характеризующие фармакокинетические свойства конкретного препарата. Иными словами, в каждой конкретной клинической ситуации должен проводиться расчет коэффициента корреляции с тем, чтобы понимать, в какой степени С св отражает изменение концентраций ЛВ в тканях.
Несмотря на то, что равномерное введение ЛВ, скорее всего, сопряжено с наименьшей вероятностью развития побочных эффектов, возможности использования С св для оценки С 1 ограничены. Большей прогностической ценностью при таком режиме дозирования обладает С к.
Следует отметить ограниченность использования описанной в работе модели для целей оптимизации фармакотерапии модифицированными ЛВ. Она не учитывает, например, возможную индукцию ферментов под влиянием длительной терапии, лекарственные взаимодействия, изменения объемов тканей организма (в первую очередь, опухолевой). Также следует учитывать,
В)
А)
Б)
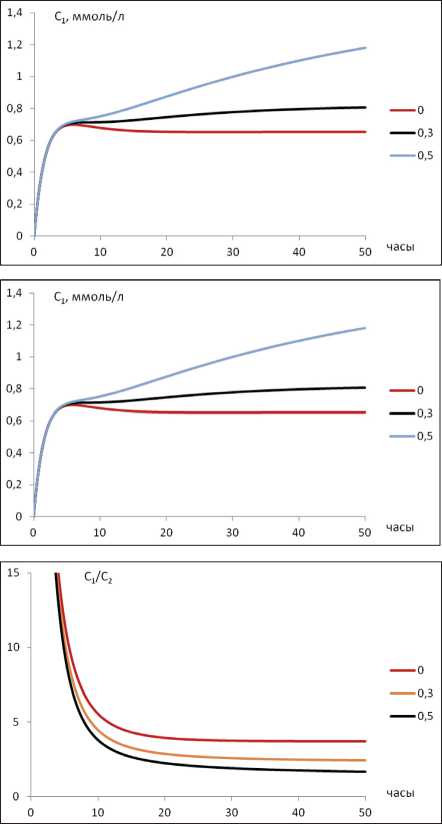
Рис. 3. Динамика изменения концентрация ЛВ при различных значениях СС.
А) изменение С1; Б) изменение С2; В) изменение С1/С2
что на режимы дозирования могут влиять такие состояния пациента, как выраженное ожирение, гипоальбуминемия, почечная, печеночная, сердечная недостаточность и др.
Обсуждение
Разработка средств адресной доставки лекарственных веществ – новое направление в фармакологии, имеющее значение не только для онкологии [16], но и для других отраслей медицины [17]. Однако если при назначении антибактериальных препаратов носитель в наибольшей степени выступает как депо для действующего вещества [18], то для противоопухолевых средств могут принципиально меняться фармакодинамика и фармакокинетика [19]. Данный факт необходимо учитывать как при разработке новых противоопухолевых препаратов в эксперименте, так и при их дальнейшем внедрении в клиническую практику.
В первой части настоящей статьи [15] мы об- суждали то, какие фармакокинетические и фармакодинамические свойства исходного соединения определяют целесообразность или нецелесообразность создания его модифицированной формы для целей направленного транспорта. В этой части статьи мы пытались понять, какие параметры должны быть учтены при использовании модифицированных препаратов в клинической практике, что, в частности, обычно требует их курсового назначения.
При курсовом назначении модифицированных противоопухолевых препаратов при выборе режимов дозирования следует учитывать степень связывания действующих веществ с белками крови. Высокая степень связывания может приводить к кумуляции активного вещества в тканях, что повышает вероятность развития побочных эффектов. С другой стороны, как мы показали ранее, для лекарственных веществ, имеющих высокую степень связывания с белками крови, необходима коррекция режимов дозирования при гипоальбуми-немии [20]. При этом белки крови могут изменять характер ответа эффекторной ткани [21].
Отношение С 1/ С 2 в наименьшей степени подвержено изменению при равномерном введении модифицированного лекарственного вещества. Следует ожидать, что при этом вероятность развития побочных эффектов лекарственной терапии будет наименьшей. Также следует отметить, что корреляция концентраций свободной и конъюгированной форм действующего вещества в крови с таковым в тканях зависит от режимов дозирования. Кажется, что увеличение кратности введения препарата приводит к возрастанию данной корреляции. Неплохие корреляции также наблюдаются при равномерном введении препарата.
Список литературы Моделирование направленного транспорта лекарственных веществ. Часть II. Многократное введение
- Liang C., Xu L., Song G., Liu Z. Emerging nanomedicine approaches fighting tumor metastasis: animal models, metastasis-targeted drug delivery, phototherapy, and immunotherapy. Chem Soc Rev. 2016 Nov 7; 45 (22): 6250-6269
- Estanqueiro M., Amaral M.H., Conceição J., Sousa Lobo J.M. Nanotechnological carriers for cancer chemotherapy: the state of the art. Colloids Surf B Biointerfaces. 2015 Feb 1; 126: 631-48. 10.1016/j. colsurfb.2014.12.041 DOI: 10.1016/j.colsurfb.2014.12.041
- Pérez-Herrero E., Fernández-Medarde A. Advanced targeted therapies in cancer: Drug nanocarriers, the future of chemotherapy. Eur J Pharm Biopharm. 2015 Jun; 93: 52-79. DOI: 10.1016/j.ejpb.2015.03.018
- Drbohlavova J., Chomoucka J.,Adam V., Ryvolova M., Eckschlager T., Hubalek J., Kizek R. Nanocarriers for anticancer drugs-new trends in nanomedicine. Curr Drug Metab. 2013 Jun; 14 (5): 547-64
- Kirtane A.R., Kalscheuer S.M., Panyam J. Exploiting nanotechnology to overcome tumor drug resistance: Challenges and opportunities. Adv Drug Deliv Rev. 2013 Nov; 65 (13-14): 1731-47. 10.1016/j. addr.2013.09.001 DOI: 10.1016/j.addr.2013.09.001


