Моделирование нековалентных взаимодействий кубовых красителей с фрагментами нитрида углерода
Автор: Матвеева Ксения Владимировна, Жеребцов Дмитрий Анатольевич, Барташевич Екатерина Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 т.10, 2018 года.
Бесплатный доступ
В целях изучения возможности модификации нитрида углерода производными полициклических ароматических углеводородов методами теории функционала плотности выполнено моделирование фрагмента слоя структуры C3N4, представленной тремя гептазиновыми звеньями, соединенными аминогруппами. Рассмотрены молекулярные комплексы такого фрагмента с двумя кубовыми красителями: бордо Д и золотисто-желтый ЖХД. Показано, что молекулы красителей комплементарны полости кармана, но исследуемые комплексы не являются плоскими. Вычислены и сравнены энергии взаимодействия и энергии водородных связей в комплексах.
Нитрид углерода, мелем, кубовый бордо, кубовый золотисто-желтый
Короткий адрес: https://sciup.org/147160416
IDR: 147160416 | УДК: 544.169 | DOI: 10.14529/chem180104
Текст научной статьи Моделирование нековалентных взаимодействий кубовых красителей с фрагментами нитрида углерода
Нитрид углерода является одним из нескольких аллотропов семейства нитридов углерода. Этот поликонъюгированный полупроводник, состоящий из атомов углерода и азота, характеризуется слоистой графитоподобной структурой. Полностью полимеризованная форма, имеющая соотношение углерода к азоту, равное 0,75, на практике оказалась недостижима. В материале содержится около 1–2 % водорода, количество которого варьируется в зависимости от методов синтеза. В ряде работ предполагается, что нитрид углерода состоит из графитоподобных слоев, но их относительное расположение не ясно [1, 2].
Нитрид углерода может быть легко синтезирован с помощью твердофазного синтеза из таких дешевых материалов, как меламин [3]. Он нерастворим в большинстве растворителей и демонстрирует большую стабильность как при pH = 0, так и при pH = 14. Из-за этих характеристик нитрид углерода давно привлекает большое внимание как катализатор, в частности, для фотокатали-тического разложения воды [4]. Материалы на основе g-C 3 N 4 обладают высокой активностью и стабильностью при преобразовании солнечной энергии [1, 4]. Зоны проводимости C3N4 являются катодно-анодными, что важно для большего выхода водорода и кислорода [5], а это важный фактор для получения экологически чистых видов энергии. Так же графитоподобный нитрид углерода обладает потенциальной возможностью его использования в оптоэлектронике, но его основные электронные и оптические свойства до сих пор не получили исчерпывающего объяснения, поскольку точная кристаллическая структура все еще не ясна [4].
К 2009 году с помощью рентгенофазового анализа и твердотельного ЯМР подтвердилась структура двумерного g-C3N4, синтезированная термической конденсацией органических полимеров [6]. Была подтверждена трехслойная полимерная структура на основе гептазина. Но из-за отсутствия дальнего порядка в материале получить уточнение трехмерной структуры методом монокристальной рентгеновской дифракции невозможно. Туборски с соавторами [7] использовали рентгенодифракционное моделирование и всю совокупность данных, включая диффузное рассеяние ближнего порядка и рассеяние нейтронов, которое чувствительно к изотопам водорода. После многочисленных исследований они пришли к заключению, что структура, состоящая из гептазиновых колец, связанных посредством вторичных аминогрупп, наиболее устойчива.
Во всем мире проводятся обширные исследования для улучшения фотокаталитических свойств C 3 N 4 . Наиболее распространенные подходы включают в себя легирование серосодержащими добавками для сужения ширины запрещенной зоны [8]. При изучении допирования C3N4 серой на практике была получена структура, которая показывает лучшие фотокаталитические свойства по сравнению с обычным C 3 N 4 .
Синтез из солевых расплавов, впервые предложенный Бождис [9] и соавторами, стал разумной альтернативой обычной термической поликонденсации. Используя этот метод, авторы [10] получили однородный кристаллический образец, однако он не соответствует кристаллической модели, предложенной Бождисом, возможно, из-за того, что данный образец не был свободен от влияния водорода, хлора и лития, которые участвовали в синтезе. Предыдущие экспериментальные исследования показали, что условия синтеза имеют влияние на конечную структуру нитрида углерода, хотя четкого объяснения этому эффекту в литературе не было найдено. В работе [11] изучили путь реакции синтеза, который протекает через промежуточные соединения из дициандиамида в воздухе и инертной атмосфере с использованием DFT. Затем авторы провели поиск стабильной структуры C3N4 и промежуточных соединений, соответствующих различным атмосферам с использованием методов ab initio. Исходя из эксперимента, наиболее стабильную конфигурацию нитрид углерода из гептазина показал при тепловой конфигурации, подтвержденной теорией.
Также интенсивно ведутся исследования на основе квантово-химического моделирования структуры и свойств материалов на основе C3N4. Например, в работе [12] оценки энергии систем C 3 N 4 с включениями атомов серы или фосфора выполнялись с использованием подхода на основе присоединенных плоских волн с учетом обмена и корреляции на уровне функционала РВЕ [13] в программе VASP [14]. Также известны подходы на основе ультрамягких псевдопотенциалов [15] с реализацией в CASTEP [16]. Обычно в качестве прагматического метода для правильного описания ван-дер-ваальсовых взаимодействий используется учет дисперсионных взаимодействий по Гримме DFT-D2 [17, 18]. В целях улучшения качества прогноза ширины запрещенной зоны полупроводников в работе [10] использовался гибридный функционал HSE06 [19], в котором вычисляется полная корреляционная энергия PBE, а ¼ обменной энергии заменяется точным обменом по Хартри-Фоку. Таким образом, несмотря на то, что точная кристаллическая структура нитрида углерода до сих пор требует уточнения, в мире интенсивно ведется моделирование композитных структур на его основе.
В нашей работе методы компьютерного моделирования использованы для построения объективной гипотезы о возможности модификации графитоподобного нитрида углерода производными полициклических ароматических углеводородов. Этот класс соединений отличается протяженными конъюгированными π-системами, что придает им способность принимать и отдавать электроны без собственного разрушения и, в случае эффективной адсорбции на графитоподобном нитриде углерода, влиять на ширину запрещенной зоны модифицированного материала.
Задачами работы являлось построение структурных моделей рассматриваемых кубовых красителей с молекулами тримелема и оценка прочности формируемых ими нековалентных взаимодействий.
Расчетная часть
На первом этапе моделировалась молекулярная структура, состоящая из трех фрагментов мелема (тримелем), связанных между собой вторичной аминогруппой. Затем строились комплексы тримелема с молекулами полициклических ароматических углеводородов, таких как: кубовый бордо (Д) C 26 H 12 O 2 N 4 и кубовый золотисто-желтый C 24 H 12 O 2 (ЖХД).
При оптимизации геометрии комплексов методом Кона – Шэма использовался функционал B3LYP и базисный набор 6-311+G(d, p) [20], при сходимости энергии опирались на значение градиента 0,0001. Проводился анализ волновых чисел в гармоническом приближении, контролировалось отсутствие их отрицательных значений.
Энергия взаимодействия вычислялась по формуле Eint=EAB–(EA+EB)–Ecp с учетом поправки на ошибку суперпозиции базисного набора [21]. Была проведена оценка энергий нековалентных взаимодействий на основе теории, описывающей энергию водородных связей в критических точках электронной плотности, предложенной Эспинозой с соавторами: E HВ = 0,5·v(r b ), [22]. Для сравнения комплексов энергию водородных связей вычисляли по формуле Е НВ (комплекса) = ΣE HВ . Нахождение потенциальной энергии электронов в критических точках электронной плотности и её топологический анализ проводились в программе AIMАll [23].
Обсуждение результатов
Молекулу тримелема после оптимизации геометрии нельзя назвать абсолютно плоской, она изогнута и при этом один фрагмент гептазина располагается под углом 9,3 ˚ по отношению к соседним, а другой– под углом 0,6°.
В комплексе тримелема с красителем Д эти углы становятся еще больше: 17,9 и 2,8°. Молекула красителя при этом не лежит в плоскости тримелема, а располагается под углом к нему. В этом комплексе наблюдается сравнительно сильная водородная связь N–H…О и пять более слабых связей между водородами Д и азотами тримелема. Водородные связи и полученную упаковку комплекса видно на рис. 1, а.
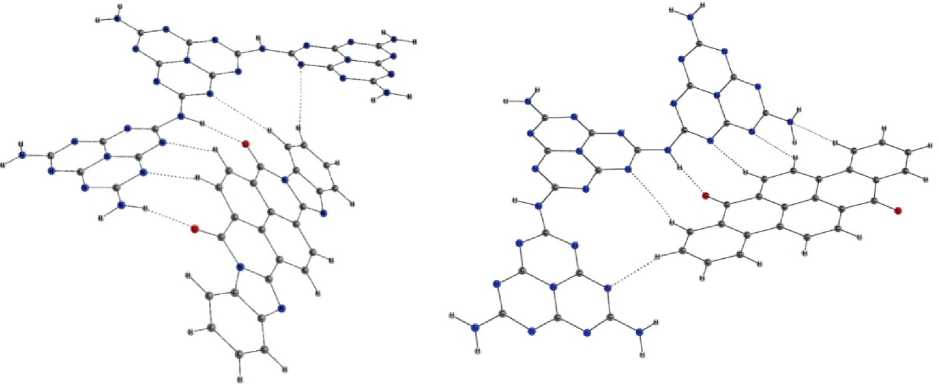
а) б)
Рис. 1. Нековалентные взаимодействия в комплексах тримелема с красителями: а – тримелем – Д; б – тримелем – ЖХД. Пунктиром показаны водородные связи, найденные на основе топологического анализа электронной плотности
В комплексе с ЖХД молекула тримелема имеет торсионные углы между гептазинами: 0,3 и 21,7°. Молекула красителя при этом так же расположена под углом к плоскости тримелема. Между водородом тримелема и кислородом ЖХД образовывается водородная связь N–H…О, но более слабая, чем в комплексе тримелема и Д, так же наблюдается шесть связей между азотом три-мелема и водородами ЖХД и одно слабое взаимодействие между углеродом мелема и водородом красителя. Водородные связи между тримелемом и молекулами красителя так же можно увидеть на рис. 1, б.
В таблице показаны электронная плотность р(г ь ) в критических точках и кинетическая энергия v(rb) в них же для комплексов тримелема и красителей Д и ЖХД.
Топологические характеристики в критических точках электронной плотности комплексов тримелема и красителей
|
Тримелем – Д |
Тримелем – ЖХД |
||||
|
P(r b ) |
v(r b ), ккал/моль |
P(r b ) |
v(r b ), ккал/моль |
||
|
C–H…N |
0,0030 |
–1,88 |
C–H…N |
0,0073 |
–4,58 |
|
C–H…N |
0,0018 |
–1,13 |
C–H…N |
0,0011 |
–0,69 |
|
N–H…O |
0,0135 |
–8,47 |
N–H…O |
0,0206 |
–12,99 |
|
C–H…N |
0,0079 |
–4,96 |
C–H…N |
0,0078 |
–4,89 |
|
C–H…N |
0,0074 |
–4,64 |
C–H…N |
0,0036 |
–2,26 |
|
N–H…O |
0,0096 |
–6,02 |
C–H…N |
0,0012 |
–0,75 |
Оценка потенциальной энергии нековалентных взаимодействий на основе свойств в критических точках электронной плотности показала, что энергия комплекса тримелема с красителем Д составляет –14,3 ккал/моль, а с красителем ЖХД –13,1 ккал/моль, в то время как оценка энергии взаимодействия молекул в комплексе Eint, получаемая на основе DFT, указывает на лучшее взаимодействие между тримелемом и Д. Энергия взаимодействия в комплексе ЖХД и три-мелема составляет –7,8 ккал/моль, и она ниже, чем энергия взаимодействия в комплексе Д и три-мелема, которая равна –6,2 ккал/моль.
При анализе распределения угловых частей молекулярных орбиталей выяснили, что в молекуле тримелема ВЗМО локализована на атомах азота гептазиновых гетероциклов, а НСМО на атомах углерода и центральном атоме азота гептазиновых звеньев. В комплексах «тримелем – Д» и «тримелем – ЖХД» ВЗМО и НСМО локализованы на молекулах красителей, а на гетероатомы азота тримелема вносят свой основной вклад в молекулярную орбиталь, следующую после ВЗМО. Таким образом орбитальные характеристики показывают, что роль нуклеофилов в комплексе выполняют молекулы красителей.
Выводы
В результате моделирования и оптимизации геометрии методами теории функционала плотности структур комплексов фрагментов тримелема и кубовых красителей бордо (Д) и золотистожелтого (ЖХД) выяснили, что комплексы не плоские, молекулы красителей предпочитают располагаться в «кармане» тримелема под углом 15–20° по отношению к ароматическим фрагментам катализатора. Для ЖХД энергия взаимодействия в комплексе с тримелемом немного ниже, чем в комплексе с Д. Альтернативная сравнительная оценка энергий водородных связей на основе свойств в критических точках электронной плотности показала, что оба комплекса характеризуются близкими суммарными значениями энергии водородных связей в комплексах.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ (грант ГЗ № 4.1157.2017/4.6), а также при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011.
Список литературы Моделирование нековалентных взаимодействий кубовых красителей с фрагментами нитрида углерода
- Dai H., Gao X., Liu E., Yang Y., Hou W., Kang L., Fan J., Hu X.Synthesis and Characterization of Graphitic Carbon Nitride Sub-Microspheres Using Microwave Method under Mild Condition//Diamond and Related Materials, 2013, vol. 38, pp. 109-117 DOI: 10.1016/j.diamond.2013.06.012
- Zheng Y., Jiao Y., Zhu Y., Li L.H., Han Y., Chen Y., Du A., Jaroniec M., Qiao S.Z. Hydrogen Evolution by a Metal-Free Electrocatalyst//Nature Communications, 2014, vol. 5 DOI: 10.1038/ncomms4783
- Ong W.J., Tan L.L., Ng Y.H., Yong S.T., Chai S.P. Graphitic Carbon Nitride (g-C3N4)-Based Photocatalysts for Artificial Photosynthesis and Environmental Remediation: are We a Step Closer to Achieving Sustainability?//Chemical Reviews, 2016, vol. 116, no. 12, pp. 7159-7329 DOI: 10.1021/acs.chemrev.6b00075
- Liu J., Liu Y., Liu N., Han Y., Zhang X., Huang H., Lifshitz Y., Lee S.-T., Zhong J., Kang Z. Metal-Free Efficient Photocatalyst for Stable Visible Water Splitting via a Two-Electron Pathway//Science, 2015, vol. 347, no. 6225, pp. 970-974 DOI: 10.1126/science.aaa3145
- Tay Q., Kanhere P., Ng C.F., Chen S., Chakraborty S., Huan A.C.H., Sum T.C., Ahuja R., Chen Z. Defect Engineered g-C3N4 for Efficient Visible Light Photocatalytic Hydrogen Production//Chemistry of Materials, 2015, vol. 27, no. 14, pp. 4930-4933 DOI: 10.1021/acs.chemmater.5b02344
- Wang X., Maeda K., Thomas A., Takanabe K., Xin G., Carlsson J.M., Domen K., Antonietti M. A Metal-Free Polymeric Photocatalyst for Hydrogen Production from Water under Visible Light//Nature Materials, 2009, vol. 8, no. 1, pp. 76-80 DOI: 10.1038/nmat2317
- Tyborski T., Merschjann C., Orthmann S., Yang F., Lux-Steiner M.C. Schedel-Niedrig Th. Tunable Optical Transition in Polymeric Carbon Nitrides Synthesized via Bulk Thermal Condensation//Journal of Physics Condensed Matter, 2012, vol. 24, no. 16 DOI: 10.1088/0953-8984/24/16/162201
- Liu G., Niu P., Sun C., Smith S.C., Chen Z., Lu G.Q.M., Cheng H. Unique Electronic Structure Induced High Photoreactivity of Sulfur-Doped Graphitic C3N4//Journal of the American Chemical Society, 2010, vol. 132, no. 33, pp. 11642-11648 DOI: 10.1021/ja103798k
- Bojdys M.J., Müller J.O., Antonietti M., Thomas A. Ionothermal Synthesis of Crystalline, Condensed, Graphitic Carbon Nitride//Chemistry -A European Journal, 2008, vol. 14, no. 27, pp. 8177-8182. DOI: 1701.00873v1
- Ong W.J., Tan L.L., Ng Y.H., Yong S.T., Chai S.P. Graphitic Carbon Nitride (g-C3N4)-Based Photocatalysts for Artificial Photosynthesis and Environmental Remediation: are We a Step Closer to Achieving Sustainability?//Chemical Reviews, 2016, vol. 116, no. 12, pp. 7159-7329 DOI: 10.1021/acs.chemrev.6b00075
- Yang F., Lublow M., Orthmann S., Merschjann C., Tyborski T., Rusu M., Kubala S., Thomas A., Arrigo R., Hävecker M., Schedel-Niedrig T. Metal-Free Photocatalytic Graphitic Carbon Nitride on p-Type Chalcopyrite as a Composite Photocathode for Light-Induced Hydrogen Evolution//ChemSusChem, 2012, vol. 5, no. 7, pp. 1227-1232 DOI: 10.1002/cssc.201100691
- Liu G., Niu P., Sun C., Smith S.C., Chen Z., Lu G.Q.M., Cheng H. Unique Electronic Structure Induced High Photoreactivity of Sulfur-Doped Graphitic C3N4//Journal of the American Chemical Society, 2010, vol. 132, no. 33, pp. 11642-11648 DOI: 10.1021/ja103798k
- Perdew J.P., Burke K., Ernzerhof M. Generalized Gradient Approximation Made Simple//Physical Review Letters, 1996, vol. 77, no. 18, pp. 3865-3868 DOI: 10.1103/PhysRevLett.77.3865
- Kresse G., Furthmüller J. Efficiency of Ab-Initio Total Energy Calculations for Metals and Semiconductors Using a Plane-Wave Basis Set//Computational Materials Science, 1996, vol. 6, no. 1, pp. 15-50 DOI: 10.1016/0927-0256(96)00008-0
- Perdew J.P., Wang Y. Accurate and Simple Analytic Representation of the Electron-Gas Correlation Energy//Physical Review B, 1992, vol. 45, no. 23, pp. 13244-13249 DOI: 10.1103/PhysRevB.45.13244
- Clark S.J., Segall M.D., Pickard C.J., Hasnip P.J., Probert M.I.J., Refson K., Payne M.C. First Principles Methods Using CASTEP//Zeitschrift für Kristallographie, 2005, vol. 220, no. 5, pp. 567-570 DOI: 10.1524/zkri.220.5.567.65075
- Ceperley D.M., Alder B.J. Ground State of the Electron Gas by a Stochastic Method//Physical Review Letters, 1980, vol. 45, no. 7, pp. 566-569 DOI: 10.1103/PhysRevLett.45.566
- Ortmann F., Bechstedt F., Schmidt W.G. Semiempirical van der Waals Correction to the Density Functional Description of Solids and Molecular Structures//Physical Review B -Condensed Matter and Materials Physics, 2006, vol. 73, no. 20, pp. 1-10 DOI: 10.1103/PhysRevB.73.205101
- Heyd J., Scuseria G.E., Ernzerhof M. Erratum: Hybrid Functionals Based on a Screened Coulomb Potential. (Journal of Chemical Physics (2003) 118 (8207))//Journal of Chemical Physics, 2006, vol. 118, no. 18, pp. 8207-8215 DOI: 10.1063/1.2204597
- Burke K., Werschnik J., Gross E.K.U. Time-Dependent Density Functional Theory: Past, Present, and Future//The Journal of Chemical Physics, 2005, vol. 123, no. 6, pp. 62206 DOI: 10.1063/1.1904586
- Cramer C.J. Essentials of computational chemistry: theories and models. John Wiley & Sons, 2013. 618 p.
- Espinosa E., Molins E., Lecomte C. Hydrogen Bond Strengths Revealed by Topological Analyses of Experimentally Observed Electron Densities//Chemical Physics Letters, 1998, vol. 285, pp. 170-173 DOI: 10.1016/S0009-2614(98)00036-0
- AIMAll (Version 17.11.14), Todd A. Keith, TK Gristmill Software, Overland Park KS, USA, 2017.


