Моделирование острого легочного повреждения путем ингаляции ультрадисперсных аэрозолей бактериального липополисахарида
Автор: Новочадов Валерий Валерьевич, Фролов Дмитрий Михайлович
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 2 (6), 2013 года.
Бесплатный доступ
С целью отработки экспериментальной модели острого легочного повреждения в опытах на 24 белых крысах проводили однократные ингаляции липополисахарида E. coli О128 : B12 в виде ультрадисперсного аэрозоля для лучшего проникновения в респираторный аппарат легких. Исследовали динамику содержания липополисахарида и морфологию легких через 3, 8 и 24 ч после ингаляции. Помимо классических гистологических и количественных морфологических методик, визуализировали иммуногистохимическими методами клетки и структуры, позитивные к CD68, десмину и альфа-антитрипсину. Ателектаз, экссудация в просвет бронхов, интенсивность и динамика сосудистых и макрофагальных реакций, повреждения бронхиального и альвеолярного эпителия, а также выявленная ранняя миграция миофибробластов в межальвеолярные перегородки и супрессия альфа-антитрипсина могут быть отнесены к морфологическим критериям острого легочного повреждения в представленной модели. Разработанная модель адекватно отражает аналогичные процессы при остром токсическом повреждении легких у человека.
Липополисахарид, ингаляционное поступление, легкие, морфология, эндотоксемия
Короткий адрес: https://sciup.org/14967502
IDR: 14967502 | УДК: 616.24-092
Текст научной статьи Моделирование острого легочного повреждения путем ингаляции ультрадисперсных аэрозолей бактериального липополисахарида
Бактериальные липополисахариды (далее – ЛПС) являются уникальными молекулами, обладающими широким спектром биологических эффектов в отношении клеток многих органов и тканей теплокровных при попадании в их организм. Эндогенный ЛПС, посту-
пающий в кровоток из кишечника в небольших концентрациях, является одним из естественных регуляторов иммунитета. При появлении в организме в больших концентрациях за счет своей способности активировать выброс цитокинов макрофагами (далее – МФ), воздействия на эндотелий и паренхиматозные клетки некоторых органов ЛПС способен вызывать мест- ные повреждения тканей и системные реакции, вплоть до септического шока [2; 3; 14].
Последствия ингаляционного поступления ЛПС в организм изучены в наименьшей степени. Специфика токсического повреждения легких обусловлена их структурно-функциональными особенностями, значительными объемами транзита атмосферного воздуха и крови, а также высоким представительством клеток, имеющих рецепторы к ЛПС (CD14, TLR4) и секретирующих биологически активные вещества в ответ на контакт с ним [9; 11; 15].
Интенсивность тканевых изменений в легких варьируется в зависимости от дозы поступающего ЛПС и кратности воздействия. Для острого процесса характерно цитокинза-висимое повреждение эндотелия и эпителиальной выстилки межальвеолярных перегородок, повышение сосудистой проницаемости и накопление экссудата, в том числе и полиморфно-ядерных лейкоцитов, в альвеолярных пространствах. Эта картина по морфологии описывается как «острое легочное повреждение», при максимальной выраженности – как респираторный дистресс-синдром взрослых, или «шоковое легкое» [1; 6; 8; 12].
При ингаляции малых доз бактериального ЛПС развивается повреждение по типу субхронического бронхоальвеолита, сопровождающееся частичной деструкцией бронхиального эпителия и альвеолоцитов, реакцией альвеолярных и бронхиальных МФ, снижением воздушности легких при умеренно выраженной бронхиальной экссудации [2; 5; 7]. Подобная картина повреждения легких описана у людей, имеющих профессиональный контакт с аэрогенной формой ЛПС, – работников мясокомбинатов, парниковых хозяйств и ряда подобных предприятий [10; 13].
Основные модели ингаляционного повреждения легких, применяемые на сегодняшний момент в экспериментальной биологии и медицине [1; 6; 7], исходят из того, что аэрозольная дисперсия ЛПС при спонтанном вдохе практически полностью оседает и обезвреживается в верхних дыхательных путях. В связи с этим для исследования эффектов ЛПС на альвеолярный аппарат легких в основном используется интратрахеальное введение токсина, что достаточно трудоемко. Использование ультрадисперсных аэрозолей может обеспечить лучшую доставку ЛПС к клеткам межальвеолярных перегородок и сделать модель ингаляционного ЛПС более адекватной и доступной в исполнении.
Цель работы – изучить основные эффекты ЛПС при его ингаляционном поступлении в организм в виде ультрадисперсного аэрозоля как доказательство биологической адекватности данной модели острого легочного повреждения.
Материалы и методы
Эксперимент проводили на 24 нелинейных белых крысах породы «вистар» массой от 220 до 240 г в соответствии этическими нормами, изложенным в Международном кодексе медицинской этики (1994), Хельсинской декларации (2000) и Директивах Европейского сообщества 86/609EEC. Животных разделили на две группы. В опытной группе 18 животных помещали на 1 ч в затравочную камеру, содержащую 100 л воздуха в смеси с водно-солевым аэрозолем ЛПС Escherichia coli О128 : B12 (Sigma Chemical Co., St Louis, MO, USA). Микроаэро-зольные капли со средним диаметром 4 мкм, содержащие ЛПС, получали с помощью компрессорного ингалятора CN-231 (Japan). Частицы такого размера способны свободно проникать не только в верхние дыхательные пути, но и в альвеолярный аппарат легких крысы в процессе спонтанного дыхания. Условия опыта были подобраны так, что за время нахождения в камере каждое животное инспирировало ЛПС в дозе порядка 1 мг/кг массы. По 6 животных опытной группы вывели из эксперимента через 3, 8 и 24 ч после ингаляции передозировкой «Золетила» (120 мг/кг массы). Контрольную группу составили 6 крыс, которые находились в обычных условиях вивария без каких-либо воздействий и были выведены из эксперимента в те же сроки.
Забор крови у выбранных животных осуществляли стерильной иглой из подъязычной вены. Тканевые гомогенаты легких приготавливали предварительно простерилизованными (60 мин при 210 °С) инструментами и посудой, используя апирогенный фосфатный бисо-левой буфер с pH 7,20. Весь забранный материал фракционировали на микроцентрифуге ScanSpeed mini BLUE (Denmark) в течение
15 мин при 3 000 об/мин (сыворотка крови) или 13 500 об/мин (тканевые гомогенаты легких).
Концентрацию ЛПС определяли в надосадочной жидкости турбидиметрическим методом с использованием ЛАЛ-реактива Pyrotell-T (Associates of Cape Code inc., USA) на микропланшетном ридере Bio-Rad (iMark, Japan). В сыворотке крови концентрацию выражали в нг/мл жидкости, в тканевых гомогенатах легких – в нг/г полусырой массы органа.
Для патоморфологического анализа кусочки легких размером 5 x 10 x 10 мм фиксировали в течение 48 ч в 10%-м растворе нейтрального формалина. После фиксации и заливки в парафин с блоков готовили срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином по общепринятой методике [2]. Исследование и оцифровку микропрепаратов проводили на микроскопе БИМАМ Р-13 (ЛОМО, Россия) с фотокамерой TK-C620E JVC (Japan). Для морфометрического исследования использовали автоматическую систему обработки изображений «Видеотест-Морфо 3.0» (Россия). Рассчитывали объемные доли (%) воздуха альвеол, бронхиального экссудата, поверхностные плотности эпителиоцитов бронхов и альвеоци-тов (1/мм2).
Иммуногистохимическое исследование проводили на срезах с тех же парафиновых блоков с использованием реактивов компании DakoCytomation (Дания). Визуализацию проводили с помощью непрямого иммуноперок-сидазного метода с высокотемпературной и ферментной демаскировкой антигенов, использовали позитивные и негативные контро-ли антигенов, а также негативные контроли антител. Численную плотность бронхиальных и альвеолярных МФ (1/мм3), а также интенсивность макрофагальных реакций оценивали при визуализации CD68-позитивных клеток. Моноклональные антитела к десмину (клон D33), помимо миоцитов стенок бронхов и сосудов, позволяли маркировать миофибробласты межальвеолярных перегородок и, таким образом, отслеживать инициальные моменты фиброгенеза в ткани легких после их токсического повреждения. Использование антител к альфа-антитрипсину позволяло выявить тканевое распределение и клетки-источники этой антипротеазы, играющих существенную роль в инактивации протеолитических ферментов, а также балансе цитокинов и гормонов пептидной природы в тканях легких.
Обработку количественных данных проводили непосредственно из общей матрицы данных Excel 7.0 (Microsoft, USA) с привлечением возможностей программ Statistica 6.0 (StatSoft Inc., USA), с учетом общепринятых требований для медико-биологических исследований. Для анализа различий между выборками использовали критерий Манна-Уитни.
Результаты и их обсуждение
Ингаляция бактериального ЛПС сопровождалась повышением его концентрации в тканях легких через 3 ч в 18,2 раза (P < 0,001) с последующим постепенным уменьшением. К 8 ч после ингаляции концентрация ЛПС в ткани легких превышала величину показателя у крыс контрольной группы в 3,35 раза (P < 0,01), а к 24 ч с начала эксперимента – практически нормализовалась. При исследовании сыворотки крови, в которой у животных контрольной группы обнаруживалась лишь следовая концентрация ЛПС, удавалось зафиксировать незначительное повышение содержания ЛПС к 3 ч эксперимента. Это свидетельствовало в пользу исключительно ингаляционного поступления токсина в ткани легкого и одновременно не позволяло рассматривать данное состояние как системную эндотоксемию (см. табл. 1).
К 3 ч после ингаляции ЛПС в легких животных морфологически регистрировали признаки острого токсического повреждения. Просветы бронхов были большей частью свободными с небольшим количеством слущенного эпителия, слизисто-белкового экссудата и лейкоцитов, преимущественно лимфоцитов и МФ.
Со стенок бронхов эпителий был местами десквамирован, сосуды их стенки были расширены, периваскулярно наблюдались скопления МФ и лимфоцитов. Часть альвеол была эм-физематозно расширена до разрывов со слиянием соседних альвеол, часть – с уменьшенным просветом за счет увеличения объема межальвеолярных перегородок. Подобный дис-телектаз был обусловлен неравномерным утолщением межальвеолярных перегородок в результате их отека, лейкоцитарной (преимущественно – лимфоцитарной) инфильтрации и пол- нокровия микроциркуляторного русла, но просвет большинства альвеол был чист. В части кровеносных капилляров обнаруживались скопления агрегатов эритроцитов.
Через 8 ч после ингаляции просветы бронхов были большей частью свободными, но их эпителий десквамирован на протяжении, в отдельных бронхах обнаруживались до 30 % диаметра скопления белкового экссудата, окруженного полиморфно-ядерными лейкоцитами, и слу-щенный эпителий. Местами в стенке бронхов фиксировались явления эритро- и лейкодиапеде-за, активные скопления МФ. Выявлялось резкое утолщение межальвеолярных перегородок за счет их отека и лимфоцитарной инфильтрации, полнокровие микроциркуляторного русла, диапедез-ные кровоизлияния вокруг сосудов. Повсеместно, но более под плеврой, обнаруживались небольшие фокусы ателектаза. Часть альвеол была эмфизематозно расширена, в просвете других выявлялся белковый экссудат со значительным количеством клеток, в том числе и МФ. Эпителий альвеол находился в состоянии дистрофии и час- тично отслаивался. Нейтрофильные и лимфоцитарные инфильтраты в отечных межальвеолярных перегородках были весьма многочисленны. Наблюдалась ярко выраженная реакция альвеолярных МФ в виде увеличения их размеров, вакуолизации цитоплазмы и формирования скоплений в межальвеолярной перегородке. В части кровеносных капилляров просвет был спавшимся, в других – резко расширенным и заполненным агрегированными эритроцитами.
Морфология ткани легких в период между 8 и 24 ч существенно не различалась. Достоверных признаков активации фиброгенеза в легких, с учетом продолжительности эксперимента, ни в одном случае не наблюдали.
Полученные данные свидетельствуют о том, что ингаляция ЛПС сопровождается яркими изменениями со стороны паренхимы легких, основу которых составляют сосудистые и клеточные реакции.
Количественные показатели легочного повреждения при ингаляционном поступлении ЛПС приведены в таблице 2.
Таблица 1
Концентрация бактериального липополисахарида в тканях легких и сыворотке крови белых крыс после его 1-часовой ингаляции в виде ультрадисперсного аэрозоля, M ± m
|
Материал |
Контрольная группа |
Опытная группа |
||
|
3 ч |
8 ч |
24 ч |
||
|
Ткани легких |
2,45 ± 0,38 |
44,71 ± 2,70 * |
8,20 ± 1,15 * |
3,22 ± 0,27 |
|
Сыворотка крови |
Следы (<0,025) |
0,34 ± 0,05 * |
Следы (<0,025) |
Следы (<0,025) |
Примечание. * – достоверные различия с величиной показателя в контрольной группе.
Таблица 2
Показатели морфометрии легочной ткани крыс при ингаляции бактериального липополисахарида в виде ультрадисперсного аэрозоля, M ± m
|
Показатели |
Контрольная группа |
Опытная группа |
||
|
3 ч |
8 ч |
24 ч |
||
|
Объемная доля бронхиального экссудата, % |
0,6 ± 0,1 |
3,7 ± 0,2 * |
4,3 ± 0,2 * |
2,5 ± 0,1 * |
|
Поверхностная плотность эпителия бронхов, 1/мм2 |
9 864 ± 429 |
9 203 ± 379 * |
7 558 ± 326 * |
7 411 ± 357 * |
|
Численная плотность бронхиальных макрофагов, 1/мм3 |
474 ± 19,3 |
560 ± 26,3 |
771 ± 39,8 |
801 ± 44,5 |
|
Объемная доля воздуха альвеол, % |
60,2 ± 2,6 |
45,1 ± 2,1 * |
36,1 ± 2,3 * |
31,0 ± 1,8 * |
|
Поверхностная плотность альвеоцитов, 1/мм2 |
8 432 ± 313 |
6 805 ± 489 * |
6 028 ± 318 * |
5 251 ± 283 * |
|
Численная плотность альвеолярных макрофагов, 1/мм3 |
163 ± 9,3 |
366 ± 15,8 * |
412 ± 18,8 * |
447 ± 20,1 * |
Примечание. * – достоверные различия с величиной показателя в контрольной группе.
Объемная доля бронхиального экссудата увеличивалась за время эксперимента более чем семикратно, достигая максимума через 8 ч с момента ингаляции ЛПС и несколько снижаясь к 24 ч (все P < 0,001). Следовательно, поступление в дыхательные пути ЛПС сопровождалось увеличением бронхиальной и альвеолярной секреции в совокупности с уже описанным повреждением бронхиальной стенки и сосудистыми реакциями, приводящим к формированию бронхиального экссудата.
Поверхностная плотность эпителиоцитов бронхов через 3 ч с момента завершения ингаляции ЛПС практически не менялась, достоверное уменьшение величины показателя было зафиксировано через 8 ч (в 1,31 раза, P < 0,05) и 24 ч (в 1,33 раза, P < 0,05) после ингаляции. При этом если на более ранних сроках эксперимента снижение поверхностной плотности клеток бронхиального эпителия в большей мере объяснялось их набуханием и появлением складчатости эпителиального слоя, то к 24 ч с момента ингаляции преобладали истинное устранение клеток из эпителиального слоя и его дезинтеграция.
Проникновение ЛПС в ткани легких сопровождалось увеличением численной плотности бронхиальных МФ начиная с 8 ч от завершения ингаляции: в 1,63 раза на этом сроке (P < 0,01), в 1,69 раза – к 24 ч (P < 0,01). Основной причиной данного изменения стало появление новых скоплений МФ в стенке бронхов и увеличение численности уже имеющихся групп МФ, что может быть объяснено, с учетом динамики эксперимента, исключительно миграцией моноцитов из кровотока.
Воздействие ЛПС сопровождалось значительным снижением воздушности легочной ткани. К 3 ч объемная доля воздуха альвеол уменьшалась в 1,3 раза (P < 0,05), к 8 ч – в 1,7 раза (P < 0,05), к 24 ч – почти вдвое (P<0,01). Выявленные изменения стали следствием сосудистых нарушений, нарастающего тканевого отека, а к 24 ч с момента ингаляции – клеточной экссудации в межальвеолярные перегородки.
В альвеолах поверхностная плотность клеток эпителия прогрессивно уменьшалось во время эксперимента, так что величина показателя была ниже значения в контрольной группе к 3 ч после ингаляции ЛПС в 1,24 раза
(P < 0,05), к 8 ч – в 1,40 раза (P < 0,05), к 24 ч – в 1,61 раза (P < 0,01). Эта динамика явилась отражением повреждения альвеолярного эпителия, которое не прекращалось достаточно длительное время уже в отсутствие высокого содержания ЛПС во вдыхаемом воздухе, тканях легких и системном кровотоке.
Уже с первых часов эксперимента в межальвеолярных перегородках наблюдались скопления МФ с гиперэкспрессией CD-68, которые располагались группами по 2–5 клеток. В последующем существенных изменений в их численности и характере тканевого распределения, по сравнению с более ранними сроками опыта, не происходило. Численная плотность альвеолярных МФ возрастала через 3 ч с момента завершения ингаляции ЛПС в 2,25 раза, к 8 ч – в 2,53 раза, к 24 ч – в 2,74 раза (все P < 0,001). Основной причиной данных изменений было активное проникновение моноцитов из кровотока, что подтверждалось обнаружением маргинации этих клеток в просветах расширенных капилляров межальвеолярных перегородок.
Как известно, активированные МФ выделяют комплекс биологически активных веществ (фактор некроза опухоли α , интерлейкины, интерфероны), которые опосредуют большинство цитотоксических и провоспали-тельных реакций тканей в ответ на поступление в них ЛПС. Активация МФ, а также массивная миграция гранулоцитов и особенно лимфоцитов из кровотока усугубляют картину сосудистых нарушений и вызывают дополнительное повреждение эпителия и эндотелиальных клеток [3; 9].
Альфа-антитрипсин в тканях легких животных контрольной группы и к 3 ч после ингаляции ЛПС визуализировался по поверхности бронхиальной выстилки и в бронхоальвеолярной жидкости, в том числе в альвеолярном экссудате. Высокая экспрессия антитрипсина выявлялась в клетках, где он синтезируется: эпителиоцитах 2-го типа и бронхиальном эпителии. На более поздних сроках эксперимента легочная ткань почти полностью утрачивала альфа-антитрипсин, за исключением участков эпителия бронхов в прикорневых областях легких, где выявлялись небольшие количества этой антипротеазы. Выявленное уменьшение активности альфа-антитрипсина, регулирующего в легких время циркуляции цитокинов, пептидных гормонов, а также активность ферментов тканевого разрушения при острой патологии (катепсинов, фосфолипаз) и сигнальных киназ, мы рассматриваем как один из негативных моментов острого ингаляционного отравления. Инактивация альфа-антитрипсина, характерная для поздних сроков острого ингаляционного отравления, может рассматриваться в качестве еще одного признака необратимости последствий острого токсического повреждения легких данной интенсивности.
Десминпозитивные клетки в легких крыс контрольной группы выявлялись исключительно в составе мышечных слоев бронхов и сосудов малого круга. Начиная с самых ранних сроков эксперимента в опытной группе они обнаруживались не только в разрыхленных и местами поврежденных мышечных слоях артерий и бронхов, но и вокруг них. В межальвеолярных перегородках такие клетки образовывали группы по 5–6, окруженные макрофагами. Именно такие скопления были нами рассмотрены как потенциальные очаги формирования заместительного пневмофиброза при остром токсическом повреждении.
С учетом изложенных фактов и данных научной литературы об отдельных межклеточных взаимодействиях в легких [6; 11; 15], общие черты ингаляционного повреждения легких ЛПС в нашей модели можно представить следующим образом (см. рисунок).
Токсический агент в виде ультрадиспер-сного аэрозоля проникает непосредственно в просвет альвеол. Частичная его задержка в слое сурфактанта сопровождается удалением части ЛПС в бронхоальвеолярную жидкость, связыванием и инактивацией клеток и веществ в составе этой жидкости. Поступивший в ткани ЛПС практически не взаимодействует с аль-веоцитами, но оказывает мощное воздействие на МФ (рецепторы CD14 и TLR4) и эндотелий сосудов (CD14). Именно эти клетки становятся источником нарастающей лавины медиаторов острого токсического повреждения: фактора некроза опухоли альфа, интерлейкинов, простаноидов и оксида азота. Молекулы ЛПС, не нашедшие рецепторы на мембране клеток-мишеней, быстро связываются со специфическими белками, иммуноглобулинами, удаляются в кровоток или разрушаются на месте тканевыми ферментами. Медиаторы опосредуют повреждение альвеоцитов I типа, активацию синтеза сурфактанта альвеоцита-ми II типа, по принципу положительной обратной связи воздействуют на МФ и эндотелиальные клетки. Сосудистые реакции и повреждение клеток альвеолярной выстилки приводят в итоге к нарушениям эластичности межальвеолярных перегородок, ателектазам и нарушениям легочного газообмена.
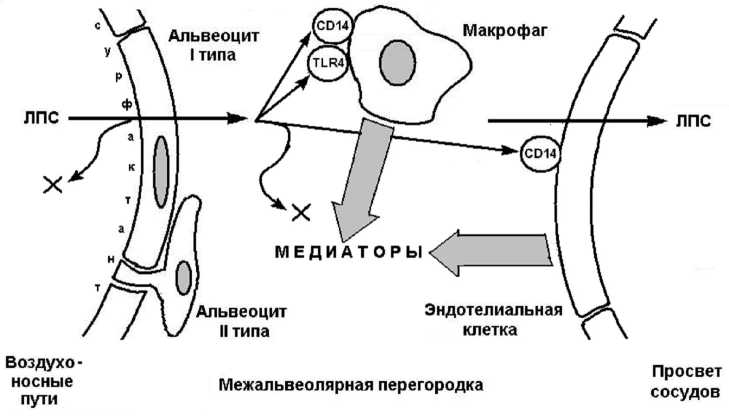
Взаимодействие липополисахарида с рецепторами клеток-мишеней в межальвеолярной перегородке и выброс медиаторов в модели острого легочного повреждения
Заключение
Полученные данные свидетельствуют о том, что однократная ингаляция ультрадиспер-сного аэрозоля бактериального ЛПС сопровождается в эксперименте развитием типичного острого токсического повреждения легких, которое по своим характеристикам подходит в качестве адекватной модели соответствующей нозологии у человека. Количественное морфологическое исследование является достаточно информативным методом для оценки состояния легочной ткани при таком варианте повреждения, а его дополнение методами иммуногистохимии позволяет дополнительно отслеживать в динамике отдельные механизмы легочного повреждения и компенсаторные процессы в ответ на него. Наиболее яркими проявлениями этого повреждения в респираторных отделах легких являются сосудистые реакции, реакции альвеолярных макрофагов, в несколько меньшей степени – повреждение собственно альвеолярного эпителия. Острое легочное повреждение в данной модели сопровождается ранней миграцией миофибробластов в межальвеолярные перегородки, а также инактивацией альфа-антитрипсина в легочной ткани. Представленная модель может быть рекомендована для изучения патогенеза и возможных путей фармакологической коррекции повреждения легочной ткани, вызванной аэрозольным проникновением бактериальных токсинов.
Список литературы Моделирование острого легочного повреждения путем ингаляции ультрадисперсных аэрозолей бактериального липополисахарида
- Войтковская, К. С. Синдром острого повреждения легких: определение, патогенез, экспериментальные модели и роль мезенхимальных стволовых клеток при лечении животных/К. С. Войтковская, А. Л. Черняев//Вестник современной клинической медицины. -2012. -Т. 5, № 2. -С. 60-67.
- Коржевский, Д. Э. Основы гистологической техники/Д. Э. Коржевский, А. В. Гиляров. -СПб.: СпецЛит, 2010. -95 с.
- Косырева, А. М. Половые различия реакции иммунной системы и легких при экспериментальном остром эндотоксикозе/А. М. Косырева, Е. Ю. Симонова, О. В. Макарова//Бюллетень периментальной биологии и медицины. -2012. -Т 153, № 3. -С. 318-321.
- Писарев, В. Б. Бактериальный эндотоксикоз: взгляд патолога/В. Б. Писарев, Н. В. Богомолова, В. В. Новочадов. -Волгоград: Изд-во ВолГМУ, 2008. -320 с.
- Фролов, Д. М. Структурные изменения в легких при аэрозольном поступлении в организм липополисахарида, диспергированного в гидрофобной и водной фазе/Д. М. Фролов, А. Ю. Алексеенко, В. В. Новочадов//Фундаментальные исследования. -2012. -№ 10 (2). -С. 345-348.
- Canadas, O. Bacterial lipopolysaccharide promotes destabilization of lung surfactant-like films/O. Canadas, K. M. W Keough, C. Casals//Biophys J. -2011. -Vol. 100, № 1. -P 108-116.
- Chronic LPS inhalation causes emphysema-like changes in mouse lung that are associated with apoptosis/D. M. Brass [et al.]//Am. J. Respir Cell Mol. Biol. -2008. -Vol. 39, № 5. -Р 584-590.
- Comparative airway inflammatory response of normal volunteers to ozone and lipopolysaccharide challenge/M. L. Hernandez [et al.]//Inhal. Toxicol. -2010. -Vol. 22, № 8. -P. 648-656.
- Differential inflammatory response to inhaled lipopolysaccharide targeted either to the airways or the alveoli in man/W. Moller [et al.]//PLOS One. 2012. -Vol. 7, № 4. -e33505.
- Duquenne, P. Measurement of endotoxins in bioaerosols at workplace: a critical review of literature and a standardization issue/P. Duquenne, G. Marchand, C. Duchaine//Ann. Occup. Hyg. -2013. -Vol. 57, № 2. -P. 137-172.
- Endotoxin-induced translocation of interleukin-6 from lungs to the systemic circulation/E. Tamagawa [et al.]//Innate Immunity. -2009. -Vol. 15. -P. 251-258.
- Liebers, V. Health effects due to endotoxin inhalation (review)/V. Liebers, M. Raulf-Heimsoth, T. Bruning//Arch. Toxicol. -2008. -Vol. 82, № 4. -P. 203-210.
- Pneumoproteins in sewage workers exposed to sewage dust/K.K. Heldal [et al.]//Int. Arch. Occup. Environ. Health. -2013. -Vol. 86, № 1. -P. 65-70.
- Rylander, R. Endotoxin in the environment-exposure and effects/R. Rylander//J. Endotoxin Res. -2002. -Vol. 8. -P. 241-252.
- Surfactant lipids regulate LPS-induced interleukin-8 production in A549 lung epithelial cells by inhibiting translocation of TLR4 into lipid raft domains/W. Abate [et al.]//J. Lipid Res. -2010. -Vol. 51, № 2. -Р 334-344.


