Моделирование процесса диффузии водорода по вакансионному механизму в интерметаллическом гидриде Mg 2NiH 4
Автор: Кузубов А.А., Елисеева Н.С., Краснов П.О., Куклин А.В., Сержантова М.В.
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 3 (49), 2013 года.
Бесплатный доступ
Рассчитаны энергии образования вакансий в интерметаллическом гидриде Mg 2NiH 4. Рассмотрен процесс диффузии водорода по вакансионному механизму в данном материале с целью оценки перспективности применения Mg 2Ni в качестве матрицы для хранения водорода. В ходе работы показано, что процесс наводороживания Mg2Ni будет сопровождаться формированием пассивирующая пленка гидрида, что обусловлено прочностью комплексов NiH 4 и высокими потенциальными барьерами перехода вакансии водорода между соседними никелям.
Водородная энергетика, диффузия, вакансии, теория функционала плотности (dft), mg 2niн 4
Короткий адрес: https://sciup.org/148177107
IDR: 148177107 | УДК: 544.18,
Текст научной статьи Моделирование процесса диффузии водорода по вакансионному механизму в интерметаллическом гидриде Mg 2NiH 4
Интерметаллические гидриды имеют подходящую для прикладного использования кинетику поглоще-ния/выделения водорода в мягких условиях и поэтому в наибольшей мере подходят для создания систем хранения водорода [1; 2]. Однако практическое хранение водорода в таких связанных состояниях сталкивается с рядом сложностей.
Основные трудности, которые необходимо решить для этих материалов – это увеличение скорости процессов сорбции-десорб-ции водорода и повышение циклической устойчивости материала адсорбента. Для их преодоления требуются углубленные теоретиче- ские и экспериментальные исследования в области физико-химических свойств интерметаллидов и гидридов на их основе.
Интерметаллиды на основе магния считаются наиболее перспективными материалами для хранения водорода за счет их высокой емкости, широкой распространенности магния в земной коре и его низкой стоимости по сравнению с альтернативными материалами [3]. Из всех сплавов на основе магния интерметаллическое соединение Mg2Ni, обладающее гексагональной кристаллической решеткой, может быть легко синтезировано.
При этом оно быстро реагирует с водородом с образованием гидрида Mg 2 NiH 4 , что делает его перспективным материалом для хранения водорода [4; 5].
В работе [6] с помощью DFT расчетов были определены наиболее выгодные положения для адсорбирования атомов водорода в объемном интерметаллиде Mg2Ni. Исследование процесса диффузии одиночных атомов водорода в объеме Mg 2 Ni показало, что потенциальные барьеры для миграции атома H очень малы, что свидетельствует о свободном его перемещении. Также наблюдалось, что уже в соединении Mg 126 Ni 54 Н х (х = 2–4) водорода стремиться образовать тетраэдрический комплекс с никелем.
Согласно работе [7], после гидрирования Mg2Ni претерпевает структурную перегруппировку, переходя в гидрид Mg2NiH4. Под давлением 1 атм. этот гидрид переходит из высокотемпературной (ВТ) кубической фазы в низкотемпературную (НТ) моноклинную фазу, температура перехода составляет 518–483 К [8–10]. Ввиду того, что для практического применения адсорбентов водорода наиболее подходящим является материал, поглощающий водород при низком давлении и невысоких температурах, низкотемпературная фаза Mg2NiH4 привлекает большее внимание исследователей в области водород-аккумулирующих материалов [11–14]. Myers и др. [11] исследовали термодинамические, электронные и оптические свойства моноклинной НТ- Mg2NiH4 на основе ab-initio расчетов. Было установлено, что геометрия комплекса NiH4 в НТ-фазе близка к правильному тетраэдру, что согласуется с данными нейтронной дифракции [15]. Были рассчитаны теплота образования Mg2NiH4 из H4 и Mg2Ni, а также энтальпия фазового перехода Mg2NiH4 из НТ в ВТ-фазу, хотя полученные значения оказались значительно выше экспериментальных. Haussermann и др. [12] исследовали структурную стабильность НТ-Mg2NiH4 и Ba2PdH4, используя DFT расчеты. Разница в связывании водорода этими соединениями объясняется различием в силе взаимодействий групп Ni(Pd)-H и Mg(Ba)-H. Авторами было предложено, что температура десорбции водорода из Mg2NiH4 может быть снижена путем введения дефектов (например, замена атома Mg на атом Al) вблизи тетраэдрического комплекса NiH4. Jasen и др. [13] также провели расчет электронной структуры НТ-Mg2NiH4 в рамках приближения локальной плотности (LDA). Ими был сделан вывод, что связь водорода с никелем сильнее, чем с магнием, и взаимодействие sp оболочек Ni с s-оболочкой водорода является основным в гидриде. На основании расчетов [14] теплоты реакции гидрирования, энтальпии образования и энергии, необходимой для отрыва атома водорода, был сделан вывод, что при гидрировании Mg2Ni вероятность образования НТ-фазы Mg2NiH4 выше, чем ВТ-фазы. Также было установлено, что для удаления водорода при низких температурах из НТ-Mg2NiH4 обладающим высокой структурной стабильностью, необходим ввод в состав материала примесей-катализаторов, облегчающих кинетику процессов сорбции/десорбции. Вследствие высокой энергии связи водорода с никелем, еще одной проблемой, которая может возникнуть при использовании гидрида Mg2NiH4 – скорость диффузии в нем атомов водорода. Поскольку в случае малой подвижности водорода гидрирование Mg2Ni при нормальных условиях может приводить к образованию пассивирующей пленки. Таким образом, детальное изучение кинетики диффузии водорода внутри чистой фазы Mg2NiH4 позволит сделать заключение о целесообразности использования данного интерметаллида в качестве сорбента водорода.
Объекты и методы исследования. В настоящей работе исследования осуществлялись с помощью квантово-химического моделирования в лицензионном программном пакете VASP 5.3 (Vienna Ab-initio Simulation Package) [16–18] в рамках метода функционала плотности (DFT) [19–20] с использованием базиса плоских волн и PAW формализма [21–22]. Вычисления проводились в рамках обобщенного градиентного приближения (GGA) – обменно-корреля-ционого функционала PBE (Perdew-Burke-Ernzerhof) c коррекцией Grimme, учитывающей ванн-дер-ваальсово взаимодействие [23]. Для нахождения переходного состояния и потенциальных барьеров при переходе вакнсии водорода внутри Mg 2 NiH 4 был применен метод упругой ленты (nudged elastic band).
На начальном этапе работы была смоделирована элементарная моноклинная ячейка Mg 2 NiH 4 . При оптимизации ее геометрии для интегрирования по первой зоне Брюллюэна (1BZ) эта зона автоматически разбивалась на сетку 6 х 6 х 2, выбранную по схеме Монхорста-Пака [24]. Далее для изучения диффузии вакансии водорода в Mg 2 NiH 4 была сконструирована суперячейка из 2×2×1 элементарных ячеек. При нахождении оптимальных геометрий суперячейки количество k -точек вдоль каждого из направлений составляло 2 × 2 × 2. Энергия обрезания плоских волн E cutoff в расчетах была равна 269,5 эВ. При моделировании всех исследуемых структур оптимизация геометрии проводилась до значения максимальных сил, действующих на атомы, равных 0,01 эВ/Ǻ.
Для различных вакансий водорода в Mg2NiH4 были рассчитаны их энергии образования.
Расчет энергии образования вакансии в Mg 2 NiH 4 реализовывался по формуле:
E = ( E tota l – E Mg2N i Н4 – 0,5 E H2), (1)
где E total – полная энергия системы Mg 2 NiH 4 c вакансией водорода, E Mg 2 NiН 4 – полная энергия интерметаллического гидрида Mg2NiH4, E H – энергия молекулы водорода.
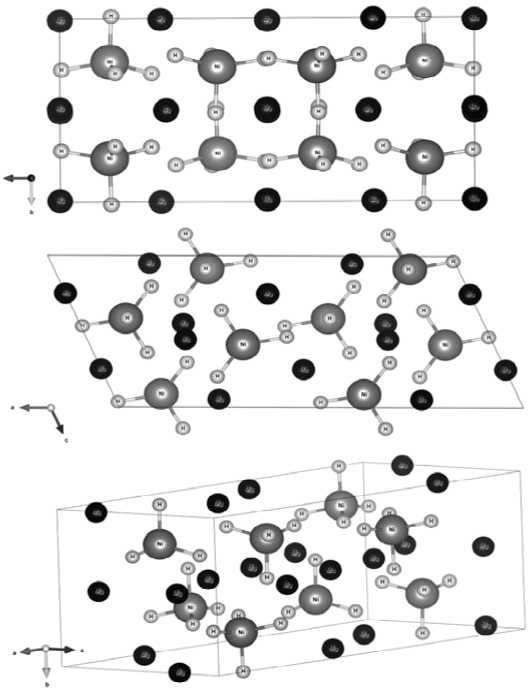
Результаты и обсуждение. В ходе оптимизации геометрии элементарной ячейки Mg2NiН4 (рис. 1) была получена ее оптимальная геометрия, которая хорошо согласуется с установленной экспериментально (табл. 1) [10].
Далее, с помощью суперячейки Mg 2 NiН 4 (2×2×1 элементарных ячеек), смоделированной из оптимальной геометрии элементарной ячейки, были найдены энергии образования вакансий водорода (рис. 2, табл. 2).
в
Рис. 1. Элементарная ячейка Mg2NiН4: a – вид в направлении (100); b – вид в направлении (010); c – объемный вид ячейки
а
б
Таблица 1
Экспериментально определенные и рассчитанные параметры решетки Mg2NiН4
|
Параметры решетки |
a, Å |
b, Å |
c, Å |
|
Экспериментальные |
6,4038 |
6,4830 |
14,3430 |
|
Рассчитанные |
6,2403 |
6.2814 |
13.9577 |
В работе рассматривались четыре возможные неэквивалентные вакансии 1–4 (рис. 2), а также три вспомогательные для оценки потенциальных барьеров перехода вакансии водорода между соседними никелями.
При этом положения 5 и 7 являются аналогами 1, положение 6 – аналог 2.
Согласно рассчитанным энергиям образования различных вакансий наиболее стабильным положением оказалось 4 (рис. 2, табл. 2). Также стоит отметить, что положения 1 и 3 являются эквивалентными.
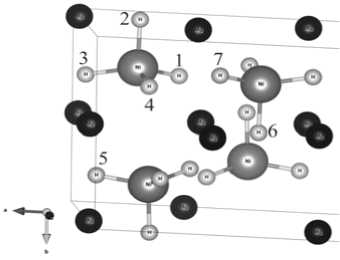
Таблица 2
Значения энергии образования вакансии водорода в Mg2NiН4
|
Положение водорода |
Энергия образования вакансии Е , эВ |
|
1 |
1,1617 |
|
2 |
1,0386 |
|
4 |
1,0074 |
Рис. 2. Положения вакансий водорода в Mg2NiН4
В ходе изучения диффузии вакансии водорода рассматривались различные пути его миграции: в переделах одного атома (1–2, 1–4) и между соседними атомами никеля (4–5, 1–6, 4–7) (рис. 2). Как видно из табл. 3 миграция вакансии водорода в пределах одного атома никеля осуществляется легко в виду невысоких потенциальных барьеров перехода.
Таблица 3
Значения величин потенциального барьера перехода вакансии водорода в Mg2NiН4
|
Начальное и конечное положения вакансии водорода |
Потенциальный барьер перехода, эВ |
|
|
в прямом направлении |
в обратном направлении |
|
|
1–2 |
0.27 |
0.39 |
|
1–4 |
0.35 |
0.50 |
|
4–5 |
0.85 |
0.69 |
|
1–6 |
0.94 |
1.07 |
|
4–7 |
1.27 |
1.11 |
Не смотря на это, диффузия вакансии к соседнему атому никеля затруднена. Таким образом, при некоторой степени гидрирования интерметаллида Mg 2 Ni на его поверхности будет образовываться пассивирующая пленка гидрида, формированию которой способствуют высокая стабильность комплексов NiH 4 и высокие потенциальные барьеры перехода вакансии водорода между соседними атомами никеля.
В ходе работы с помощью DFT расчетов были определены энергии образования вакансий водорода в интерметаллическом гидриде Mg2NiН4. Установлено, что наиболее выгодное расположение вакансии водорода 4 (рис. 2). Согласно полученным результатам по моделированию диффузии водорода по вакансионно-му механизму, можно сделать вывод об образовании пассивирующей пленки Mg 2 NiН 4 на поверхности Mg 2 Ni. Следовательно применение данного интерме-таллида без допантов в качестве матрицы для хранения водорода нецелесообразно.


