Моделирование сорбции ионов некоторых двухвалентных металлов на фрагментах оксигидрата циркония
Автор: Лымарь Андрей Анатольевич, Никитин Евгений Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 11 (187), 2010 года.
Бесплатный доступ
Экспериментальными и компьютерными методами изучали сорбцион-ные свойства оксигидрата циркония. Компьютерное моделирование производилось с использованием метода Монте-Карло и последующей оптимизацией ab initio. При этом моделировались сорбционные комплексы фрагментов оксигидрата циркония с ионами Са2+, Mn2+, Ni2+, Cu2+. В рассчитанных комплексах определялись порядки связей по Малликену. Экспериментально сорбционную ёмкость определяли на гелях, полученных медленным гидролизом раствора оксихлорида циркония. Значения сорбции сопоставляли с суммой порядков связи сорбируемого металла и сорбционными центрами геля. Установлено, что данные величины находятся в линейной зависимости. Таким образом, порядок связи можно использовать для определения сорбции металлов на гелях оксигидрата циркония.
Оксигидратные гели, компьютерное моделирование, порядок связи, сорбция
Короткий адрес: https://sciup.org/147160161
IDR: 147160161 | УДК: 544.16+544.18
Текст краткого сообщения Моделирование сорбции ионов некоторых двухвалентных металлов на фрагментах оксигидрата циркония
Гели оксигидрата циркония нашли широкое применение для доочистки сточных вод от тяжелых металлов, а главное - в качестве материалов, используемых для сорбции радиоактивных элементов. На большинстве АЭС России и стран бывшего СССР до сих пор используется сорбент марки «Термоксид-3», созданный на основе цирконогеля, производимый в г. Березники Пермского края.
Разработка сорбционных материалов, способных работать при повышенных уровнях радиации, в данный момент актуальна для Челябинской области, как в связи с прошлыми радиационными катастрофами на ПО «Маяк», так и в связи со строительством Южно-Уральской АЭС. В то же время, создание технологии получения новых сорбентов невозможно без развития теоретических представлений о сорбционных процессах.
Экспериментальная часть
Методы компьютерной химии позволяют прогнозировать характеристики химических соединений с затратой лишь машинного времени. Однако для этого необходимо решить регрессионную задачу «структура-свойство». Поиск количественных соотношений «структура-свойство» основан на применении методов математической статистики для построения моделей, позволяющих по описанию структур химических соединений предсказывать их свойства.
Сорбционные свойства оксигидратов циркония изучали экспериментально и методами компьютерного моделирования. Компьютерное моделирование сорбционных комплексов производили при помощи комбинированной методологии с использованием метода Монте-Карло и последующей оптимизацией геометрии ab initio UHF 3-21G [1, 2]. Моделирование сорбции проводили на частицах [ZrO(OH)2]„, п = 3-10. В качестве сорбируемых частиц были выбраны ионы: Са2+, Mn2+, Ni2+, Cu2+. В рассчитанных комплексах определяли порядки связей по Малликену, заряды на атомах сорбируемого металла по Малликену и теплоты реакции сорбции.
Экспериментально сорбционную ёмкость определяли на оксигидратах циркония, которые получали медленным осаждением раствором аммиака из раствора оксихлорида циркония по методике, изложенной в работе [3]. Сорбцию изучали стандартным методом изомолярных серий [4] в статических условиях.
Результаты и их обсуждение
Считается, что сорбционными центрами в оксигидратных гелях являются концевые ОН-группы [4]. Однако можно утверждать лишь о наиболее вероятном взаимодействии сорбируемого иона и концевой ОН-группы. Теоретически возможно взаимодействовие иона с любым участком геля. При этом в качестве сорбционных центров могут выступать как концевые ОН-группы, так и мостиковые ол- и оксо-связи.
При сорбции двухзарядного иона необязательно образование двух одинарных связей, поскольку электроны не имеют строгой локализованное™ в пространстве. В большинстве случаев может образовываться несколько связей с порядками менее единицы. Следовательно, важную роль должен играть размер иона, так как слишком маленький или слишком большой ионы будут либо образовывать меньше связей, либо искажать структуру матрицы геля. И то и другое приведёт к уменьшению теплоты реакции и, скорее всего, к уменьшению сорбционной способности.
Рассмотрим взаимодействие иона кальция Са2+ с фрагментами оксигидрата циркония [ZrO(OH)2]„? п = 3-10 (рис. 1). Связями, порядок которых менее 0,050, будем пренебрегать ввиду малости их вклада.
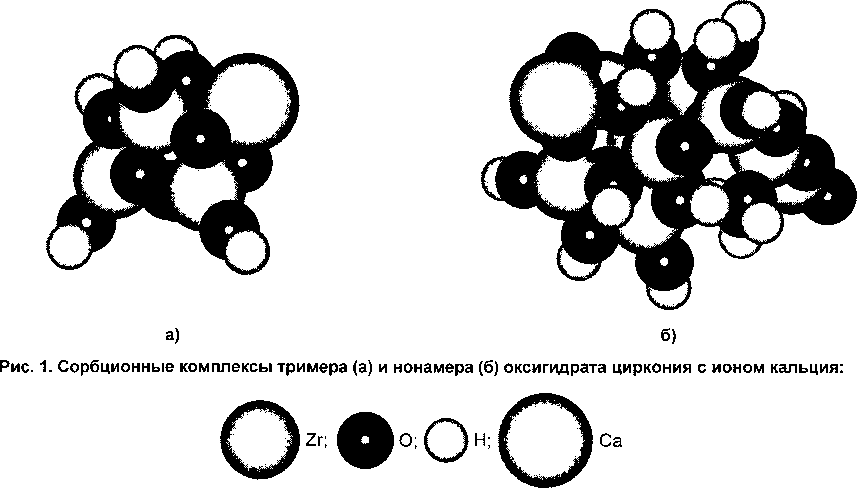
Тример оксигидрата циркония [ZrO(OH)2]3 образует с ионом кальция три связи. Две связи -через атомы кислорода с порядками 0,169 и 0,077 и одну связь - через концевую ОН-группу порядка 0,095. Распределение порядков связей по типам сорбционных центров для различных степеней полимеризации приведено в табл. 1. В табл. 2 приведены параметры сорбционных комплексов.
Таблица 1 Распределение порядков связей иона кальция Са2+ и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации п
|
Сорбционные центры |
Степени полимеризации (п) сорбционных комплексов {[ZrO(OH)2]n"Ca}2+ |
|||||||
|
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
Порядки связей |
||||||||
|
Концевые ОН-группы |
0,095 |
0,100 |
0,102 0,089 0,094 |
— |
0,130 0,086 |
0,129 |
— |
0,099 0,063 0,129 |
|
Мостиковые ОН-группы |
0,071 |
0,053 |
0,101 0,089 |
0,057 |
0,078 0,063 |
0,090 |
0,065 |
|
|
Оксо-связи |
0,169 0,077 |
0,099 0,062 |
— |
0,119 |
0,090 |
0,138 |
0,115 0,182 |
— |
Таблица 2
Параметры сорбционных комплексов оксигидрата циркония с ионом кальция
Ион кальция имеет достаточно большой радиус, поэтому образует связи сразу со всеми сорбционными центрами, находящимися рядом с ним. Вероятности взаимодействия с сорбционными центрами различных видов практически одинаковы. Однако порядки связей иона кальция с сорбционными центрами оксигидрата циркония имеют невысокие значения.
Рассмотрим взаимодействие иона марганца Мп2+ с фрагментами оксигидрата циркония (рис. 2). Распределение порядков связей иона марганца и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации приведено в табл. 3. В табл. 4 приведены параметры сорбционных комплексов.
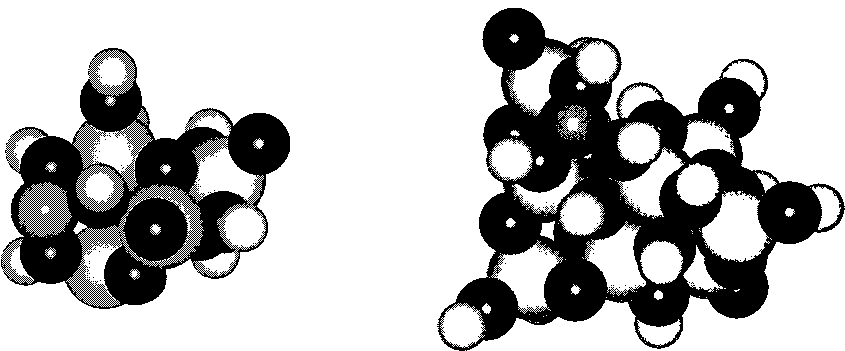
а)
Рис. 2. Сорбционные комплексы пентамера (а) и нонамера (б) оксигидрата циркония с ионом марганца:
Таблица 3
Распределение порядков связей иона кальция Мп2+ и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации п
|
Сорбционные центры |
Степени полиме |
ризации (п) сорбционных комплексов {[ZrO(OH)2]n*Mn}?+ |
||||||
|
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
Порядки связей |
||||||||
|
Концевые ОН-группы |
0,315 |
0,498 |
0,398 0,323 |
— |
— |
0,263 |
0,399 0,387 0,305 |
0,331 0,271 |
|
Мостиковые ОН-группы |
— |
0,429 |
0,328 |
0,319 0,290 0,353 |
0,283 0,364 |
0,288 0,218 |
— |
— |
|
Оксо-связи |
— |
— |
— |
— |
0,456 |
0,355 |
— |
0,391 |
Таблица 4
Параметры сорбционных комплексов оксигидрата циркония с ионом марганца
|
п |
Концевые ОН-группы |
Мостиковые ОН-группы |
Оксо-связи |
Сумма порядков связей |
Заряд иона марганца |
АН, кДж/моль |
|
3 |
0,315 |
— |
— |
0,315 |
0,799 |
-995,2 |
|
4 |
0,498 |
0,429 |
0,927 |
1,406 |
-946,3 |
|
|
5 |
0,721 |
0,328 |
— |
1,049 |
1,391 |
-1113,3 |
|
6 |
— |
0,962 |
— |
0,962 |
1,376 |
-1052,2 |
|
7 |
— |
0,647 |
0,456 |
1,103 |
1,322 |
-1070,3 |
|
8 |
0,263 |
0,506 |
0,355 |
1,124 |
1,337 |
-1370,7 |
|
9 |
1,091 |
— |
— |
1,091 |
1,357 |
-1245,2 |
|
10 |
0,602 |
— |
0,391 |
0,993 |
1,368 |
-1144,9 |
Пояснения см. к табл. 2.
Как видно из табл. 3 и 4, ион марганца преимущественно образует связи с концевыми и мостиковыми ОН-группами.
Рассмотрим взаимодействие иона никеля Ni2+ с фрагментами оксигидрата циркония (рис. 3). Распределение порядков связей иона никеля и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации приведено в табл. 5. В табл. 6 приведены параметры сорбционных комплексов.
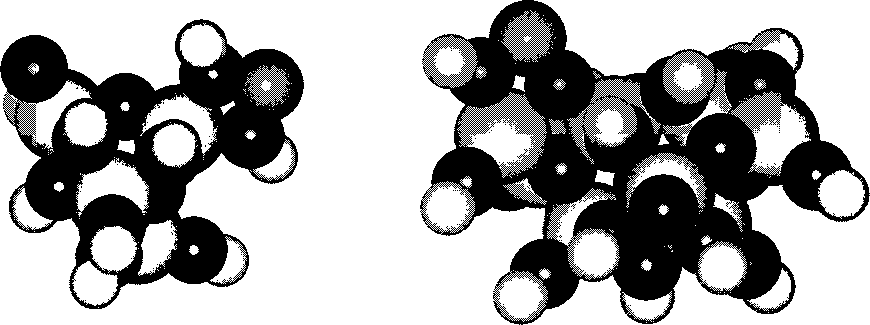
а) б)
Рис. 3. Сорбционные комплексы пентамера (а) и октамера (б) оксигидрата циркония с ионом никеля:
Таблица 5
Распределение порядков связей иона никеля Ni2+ и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации п
|
Сорбционные центры |
Степени полимеризации (п) сорбционных комплексов {[ZrO(OH)2]n-Ni}2+ |
|||||
|
3 |
4 |
5 |
8 |
9 |
10 |
|
|
Порядки связей |
||||||
|
Концевые ОН-группы |
0,398 |
0,398 0,689 |
0,531 0,498 |
0,466 |
0,442 0,336 0,241 |
0,299 |
|
Мостиковые ОН-группы |
— |
— |
— |
— |
0,228 0,445 |
|
|
Оксо-связи |
0,661 |
— |
0,657 |
_ |
0,067 |
|
Таблица 6
Параметры сорбционных комплексов оксигидрата циркония с ионом никеля
|
п |
Концевые ОН-группы |
Мостиковые ОН-группы |
Оксо-связи |
Сумма порядков связей |
Заряд иона никеля |
АН, кДж/моль |
|
3 |
0,398 |
— |
0,661 |
1,059 |
1,301 |
-1425,7 |
|
4 |
1,087 |
— |
— |
1,087 |
1,282 |
-1489,7 |
|
5 |
1,029 |
— |
— |
1,029 |
1,360 |
-1295,4 |
|
8 |
0,466 |
— |
0,657 |
1,123 |
1,257 |
-1460,0 |
|
9 |
1,019 |
— |
— |
1,019 |
1,349 |
-1553,4 |
|
10 |
0,299 |
0,673 |
0,067 |
1,039 |
1,332 |
-1377,4 |
Пояснения см. к табл. 2.
В отличие от кальция и марганца большинство связей, образованных ионом никеля - это связи с концевыми ОН-группами. Вероятности образования связей с мостиковыми ОН-группами и с оксо-связями составляют 0,10 и 0,22.
Рассмотрим взаимодействие иона меди Сп2+ с фрагментами оксигидрата циркония (рис. 4). Распределение порядков связей иона меди и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации приведено в табл. 7. В табл. 8 приведены параметры сорбционных комплексов.
б)
Рис. 4. Сорбционные комплексы тетрамера (а) и гептамера (б) оксигидрата циркония с ионом меди:
Таблица 7
Распределение порядков связей иона меди Си2+ и оксигидрата циркония по типам сорбционных центров для различных степеней полимеризации п
|
Сорбционные центры |
Степени полимеризации (п) сорбционных комплексов {[ZrO(OH)2]n-Cu}2+ |
|||||
|
3 |
4 |
5 |
6 |
7 |
10 |
|
|
Концевые ОН-группы |
0,138 |
0,253 |
0,281 0,249 |
0,170 |
0,251 0,311 |
0,340 |
|
Мостиковые ОН-группы |
— |
— |
— |
— |
0,250 |
— |
|
Оксо-связи |
0,186 |
— |
0,265 |
0,242 |
— |
— |
Таблица 8
Параметры сорбционных комплексов оксигидрата циркония с ионом меди
|
п |
Концевые ОН-группы |
Мостиковые ОН-группы |
Оксо-связи |
Сумма порядков связей |
Заряд иона меди |
АН, кДж/моль |
|
3 |
0,138 |
0,186 |
— |
0,324 |
0,823 |
-1307,2 |
|
4 |
0,253 |
— |
— |
0,253 |
0,843 |
-1236,5 |
|
5 |
0,530 |
— |
0,265 |
0,795 |
1,462 |
-1233,3 |
|
6 |
0,170 |
— |
0,242 |
0,412 |
0,749 |
-1349,9 |
|
7 |
0,562 |
0,250 |
— |
0,812 |
1,477 |
-1253,0 |
|
10 |
0,340 |
— |
— |
0,340 |
0,796 |
-1509,0 |
Пояснения см. к табл. 2.
Ион меди, аналогично иону никеля, образует связи преимущественно с концевыми ОН-группами.
В реальном геле оксигидрата циркония могут присутствовать частицы с различными степенями полимеризации. Предположим, что вероятность образования всех частиц примерно одинакова, тогда сопоставление экспериментальных данных необходимо производить с усреднёнными по степеням полимеризации величинами.
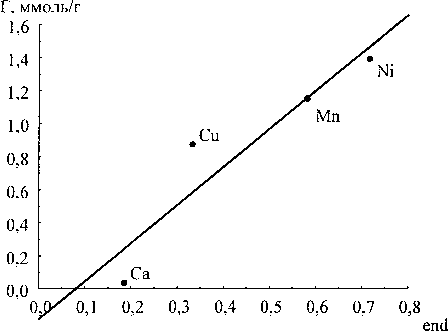
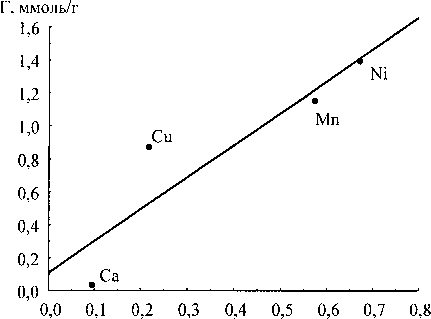
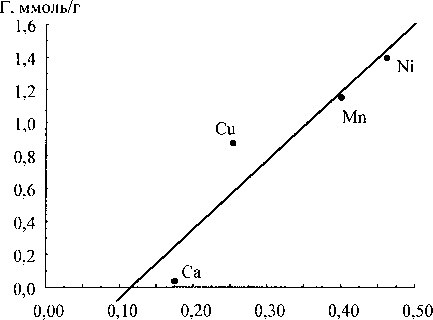
Экспериментально определённые значения сорбции сопоставляли с суммой порядков связи сорбируемого иона и сорбционными центрами геля (рис. 5).
Все зависимости имеют линейный характер. При этом, если в качестве дескриптора рассматривать порядки связей с концевыми ОН-группами, то значения сорбции можно вычислить по уравнению (1) с коэффициентом корреляции 0,934. Для мостиковых ОН-групп по уравнению (2) с коэффициентом корреляции 0,906. Для оксосвязей по уравнению (3) с коэффициентом корреляции 0,932. Для общей суммы порядков связей по уравнению (4) с коэффициентом корреляции
0,897.
Г = -0,19+ 2,31 - end,(1)
Г = 0,11 + 1,93-ol,(2)
Г = -0,49+ 4,19-охо,(3)
Г = -0,24+ 1,55-ВО,(4)
Г = -1,26-0,002 АН.(5)
Таким образом, лучшим критерием из рассмотренных для определения величины сорбируемости ионов двухвалентных металлов является среднее по степеням полимеризации значение суммы порядков связей иона с концевыми ОН-группами оксигидрата циркония.
С повышением значения сорбционной ёмкости теплоты реакции сорбции возрастают по модулю (рис. 6).
б)
В)
0X0
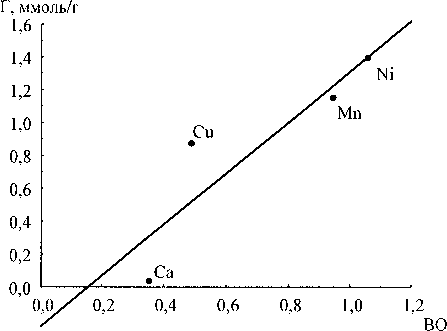
Рис. 5. Зависимость величины сорбции от суммы порядков связи сорбируемого иона с гелем: end - сумма порядков связей иона кальция с концевыми ОН-группами; ol - сумма порядков связей иона кальция с мостиковыми ОН-группами; охо - сумма порядков связей иона кальция с оксо-связями; ВО - сумма порядков связей иона кальция с гелем; а) взаимодействие с концевыми ОН-группами; б) взаимодействие с мостиковыми ОН-группами; в) взаимодействие с оксосвязями; г) суммарный порядок связей
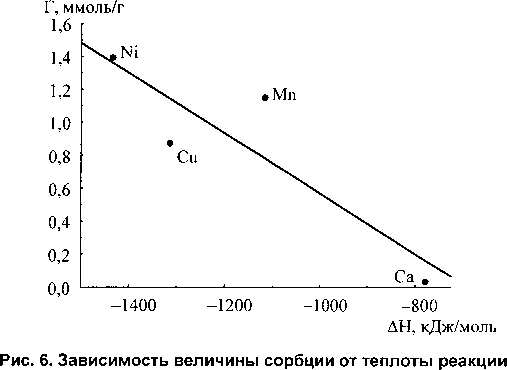
Зависимость описывается уравнением (5) с коэффициентом корреляции 0,885.
Заключение
Экспериментально определённая сорбционная способность оксигидратов циркония по отношению к ионам марганца, никеля, меди и кальция коррелирует с вычисленными при моделировании теплотой реакции сорбции и суммой порядков связей атома сорбируемого металла с ато- мами, принадлежащими оксигидрату циркония. Порядок связи по Малликену и теплоты реакции сорбции можно использовать в качестве дескриптора для определения сорбируемости металлов на оксигидратных гелях.
Список литературы Моделирование сорбции ионов некоторых двухвалентных металлов на фрагментах оксигидрата циркония
- Gaussian Basis Sets for Molecular Calculations/S. Huzinaga, J. Andzelm, M. Klobukowski et al. -Amsterdam: Elsevier, 1984. -324 p.
- Granovsky A.A. -http://classic.chem..msu.su/gran/games/index.html
- Направления структурообразования оксигидратных гелей циркония и редкоземельных элементов/Ю.И. Сухарев, В.В. Авдин, А.А. Лымарь и др.//Журнал структурной химии. -2006. -Т.47?№1.-С. 146-151.
- Амфлетт, Ч. Неорганические иониты/Ч. Амфлетт. -М.: Мир, 1966. -188 с.


