Моделирование термодинамических свойств известково-глинозёмистых расплавов
Автор: Тюрин Александр Георгиевич, Працкова Светлана Евгеньевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 (260), 2012 года.
Бесплатный доступ
Рассчитаны избыточные энтальпии, энтропии, энергии Гиббса расплавов системы СаО-Ai 2О 3 в интервале температур 1500-1800 °С. Термодинамические свойства согласованы с наиболее достоверными экспериментальными данными по энергиям Гиббса реакций образования алюминатов кальция, термодинамическим характеристикам плавления чистых оксидов и фазовой диаграмме состояния.
Известково-глинозёмистые расплавы, избыточные термодинамические свойства, обобщённая теория "регулярных" ионных растворов
Короткий адрес: https://sciup.org/147160214
IDR: 147160214 | УДК: 544-971+669.14
Текст научной статьи Моделирование термодинамических свойств известково-глинозёмистых расплавов
Термодинамические свойства расплавов системы CaO–Al 2 O 3 представляют значительный интерес для металлургии, технологий керамических материалов и цемента. Для их определения проведено значительное количество экспериментальных исследований [1–12]. Однако достоверные термодинамические данные в области высоких температур (выше 1800 K) практически отсутствуют.
У диаграммы состояния системы CaO–Al 2 O 3 до сих пор не существует общепринятой версии; разные её варианты отличаются составом и количеством алюминатов кальция и их устойчивостью. В бескислородной атмосфере система характеризуется образованием четырёх промежуточных фаз (рис. 1): СА 6 , СА 2 , СА и С 3 А (С – CaO, А – Al 2 O 3 ).
Энергии Гиббса реакций образования алюминатов кальция из простых оксидов по данным разных авторов сильно отличаются друг от друга, особенно их зависимости от температуры. Наиболее достоверные значения были получены в работе [1] масс-спектрометрическим эффузионным методом Кнудсена (табл. 1). Принятые значения термодинамических величин, характеризующие процессы плавления оксидов кальция и алюминия, следующие [14]:
A m H ( CaO ) = 52 кДж/моль, T ^ ( CaO ) = 2900 K;
A m H ( Al2O3 ) = 111,4 кДж/моль, T ( Al2O3 ) = 2327 K.
Таблица 1
Стандартные энергии Гиббса реакций образования алюминатов кальция из оксидов при 1833–2033 К [1]
|
№ п/п |
Реакция* |
A r G T =A r H T - T A rST, Дж |
|
1 |
3CaO(т)+Al 2 O 3 (т)=3CaO∙Al 2 O 3 (т) |
14720–18,14 Т |
|
2 |
CaO(т)+Al 2 O 3 (т)=CaO∙Al 2 O 3 (т) |
22900–28,10 Т |
|
3 |
CaO(т)+2Al 2 O 3 (т)=CaO∙2Al 2 O 3 (т) |
–6300–9,94 Т |
|
4 |
CaO(т)+6Al 2 O 3 (т)=CaO∙6Al 2 O 3 (т) |
–2880–5,00 Т |
* – стандартное состояние оксидов – чистый твёрдый компонент.
Результаты расчётов и их обсуждение
Разными авторами при моделировании термодинамических свойств известковоглинозёмистых расплавов использовались модели молекулярных ассоциированных растворов [5], регулярных [15] и субрегулярных [16, 17] ионных растворов. При этом возникали принципиальные проблемы в согласовании фазовых диаграмм состояния с термодинамическими свойствами фаз, установленными другими авторами. Так Д.М. Лаптев, рассчитывая диаграмму плавкости CaO–SiO 2 [18], ввёл понятие о «термохимической» теплоте плавления CaO, которая отличается от термодинамической и особым «расчётным» способом меняется с температурой.
В настоящей работе рабочей моделью системы была выбрана обобщённая теория «регулярных» ионных растворов [19]. За счёт концентрационной и температурной зависимостей энергии смешения компонентов эти проблемы согласования здесь снимаются.
Активности компонентов расплавов CaO–Al 2 O 3 описывали формулами:
RT In a ( CaO ) ж = RT In x ^ + x 22 Г 2 x ^ ■ Q ^ ( T ) + ( 1 - 2 xx ) ■ Q . 2 ( T ) + xx ( 2 - 3 x ^ ) ■ Q ^ ( T ) 1 ; (1)
71 T’ 1 / A 1 Z~\ \ 71 T’ 1 2 . 'I 2 / 1 'I \ /1 ( 1 ) / T’A . 'I Zll 2 ) / rp \ / >1 1 \ /ll 3 ) / гт-г \ /''I \
RT ln a( Al 2 O 3 ) ж = RT ln x 2 + 2 x 1 Г( 1 - 2 x 2 ) ■ Q 12 ( T ) + 2 x 2 ■ Q 12 ( T ) + x 2 ( 2 - 3 x 2 ) ■ Q 12 ( T ) J . (2)
N 2 N 2+ 3+
Здесь x =---1— , x 2 =---2-- ионные доли катионов кальция (Ca ) и алюминия (Al ); N 1 и N 2 -
1 1 + N 2 2 1 + N 2
мольные доли CaO и Al 2 O 3 в расплаве; Q yk ) ( T ) - энергетические параметры модели.
Оценка значений энергетических параметров компонентов Q ^k )( T ) проводилась путём обработки экспериментальных данных по фазовой диаграмме состояния (см. рис. 1) с учётом данных табл. 1 и характеристик процесса плавления простых оксидов [14]. Значения параметров описываются полиномами четвёртого порядка относительно температуры и охватывают область температур 1600–3000 K:
Q 1 ( 2 ) = -5,3 • 10 7 + 136 800 Т - 130,18 Т 2 + 0,055 Т 3 - 8,8• 10 -6 Т 4, Дж/моль;
Q 1 ( 2 2 ) = 2,27-10 7 - 33 800 Т + 20,37 Т 2 - 0,006 Т 3 + 7,85• 10 -7 Т 4, Дж/моль;
Q 1 ( 2 3 ) = -7,2-10 7 + 97 000 Т - 42,20 Т 2 + 0,004 Т 3 + 1,2-10 6 Т 4, Дж/моль.
Результаты расчётов фазовых равновесий в системе CaO–Al 2 O 3 представлены на рис. 1. Линия ликвидус расчётной диаграммы состояния практически сливается с экспериментальной, что свидетельствует о применимости используемой модели раствора для описания термодинамических свойств расплавов.
Избыточную энергию Гиббса известково-глинозёмистых расплавов описывали уравнением [19]
GE
= x 1 x 2 x 1 ■ Q 2 ( T ) + x 2 ■ Q y^ ( T ) + x 1 x 2 ■ Q^ ( T ) .
Избыточную энтальпию и энтропию жидкого раствора оценивали по уравнению Гиббса– Гельмгольца:
|
HE =- T 2 |
E д — l T J |
; S E =- ( G. ) . (4) l д T J P , X i P , Xi |
|
∂ T |
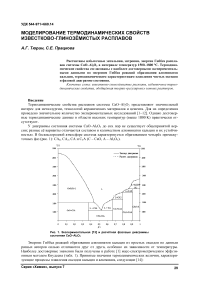
В интервале температур 1500–1800 °С данные расчётов приведены в табл. 2 и на рис. 2–4. В рассматриваемом интервале температур и в области гомогенности оксидных расплавов избыточная энергия Гиббса отрицательна и по абсолютной величине не превышает 100 кДж моль . При ионной доле алюминия х 2 меньше 0,65 при всех температурах растворы образуются с выделением тепла и с упорядочением, что указывает на процессы ассоциации компонентов в расплавах CaO–Al 2 O 3 . При дальнейшем увеличении содержания глинозёма в расплаве с ростом температуры проявляется отчётливая тенденция к расслоению подобно системе CaO–SiO 2 [18]. В целом модельные значения термодинамических свойств известково-глинозёмистых расплавов не противоречат имеющимся экспериментальным данным [1–12].
Таблица 2 Результаты расчетов избыточных термодинамических функций известково-глинозёмистых расплавов
|
x 1 |
x 2 |
GE , кДж/моль |
SE , Дж/моль·K |
HE , кДж/моль |
|
1 |
2 |
3 |
4 |
5 |
|
t = 1500 °С |
||||
|
0,54 |
0,46 |
–12,09 |
–28,46 |
–62,56 |
|
0,52 |
0,48 |
–13,08 |
–20,90 |
–50,14 |
|
0,5 |
0,5 |
–13,87 |
–14,71 |
–39,94 |
|
0,48 |
0,52 |
–14,46 |
–9,93 |
–32,07 |
|
0,46 |
0,54 |
–14,84 |
–6,63 |
–26,59 |
|
0,44 |
0,56 |
–15,02 |
–4,80 |
–23,52 |
|
0,425 |
0,575 |
–15,01 |
–4,39 |
–22,78 |
|
t = 1600 °С |
||||
|
0,6 |
0,4 |
–17,45 |
–135,39 |
–271,03 |
|
0,58 |
0,42 |
–17,54 |
–117,84 |
–238,24 |
|
0,56 |
0,44 |
–17,55 |
–100,88 |
–206,50 |
|
0,54 |
0,46 |
–17,50 |
–84,75 |
–176,23 |
|
0,52 |
0,48 |
–17,37 |
–69,65 |
–147,82 |
|
0,5 |
0,5 |
–17,18 |
–55,74 |
–121,57 |
|
0,48 |
0,52 |
–16,92 |
–43,16 |
–97,77 |
|
0,46 |
0,54 |
–16,61 |
–32,04 |
–76,63 |
|
0,44 |
0,56 |
–16,23 |
–22,46 |
–58,29 |
|
0,42 |
0,58 |
–15,79 |
–14,46 |
–42,88 |
|
0,4 |
0,6 |
–15,31 |
–8,08 |
–30,43 |
|
0,38 |
0,62 |
–14,76 |
–3,30 |
–20,95 |
|
0,36 |
0,64 |
–14,18 |
–0,11 |
–14,38 |
|
0,34 |
0,66 |
–13,54 |
1,57 |
–10,59 |
|
0,333 |
0,667 |
–13,31 |
1,82 |
–9,90 |
|
t = 1700 °С |
||||
|
0,59 |
0,41 |
–35,86 |
–251,25 |
–531,58 |
|
0,57 |
0,43 |
–33,72 |
–224,09 |
–475,85 |
|
0,55 |
0,45 |
–31,55 |
–197,20 |
–420,62 |
|
0,53 |
0,47 |
–29,40 |
–170,90 |
–366,58 |
|
0,51 |
0,49 |
–27,27 |
–145,50 |
–314,34 |
|
0,49 |
0,51 |
–25,21 |
–121,26 |
–264,45 |
Окончание табл. 2
|
1 |
2 |
3 |
4 |
5 |
|
0,47 |
0,53 |
–23,22 |
–98,41 |
–217,39 |
|
0,45 |
0,55 |
–21,32 |
–77,16 |
–173,56 |
|
0,43 |
0,57 |
–19,53 |
–57,67 |
–133,32 |
|
0,41 |
0,59 |
–17,86 |
–40,08 |
–96,93 |
|
0,39 |
0,61 |
–16,31 |
–24,48 |
–64,62 |
|
0,37 |
0,63 |
–14,90 |
–10,95 |
–36,51 |
|
0,35 |
0,65 |
–13,62 |
0,48 |
–12,68 |
|
0,33 |
0,67 |
–12,47 |
9,80 |
6,87 |
|
0,31 |
0,69 |
–11,46 |
17,05 |
22,19 |
|
0,29 |
0,71 |
–10,57 |
22,29 |
33,41 |
|
t = 1800 °С |
||||
|
0,59 |
0,41 |
–70,33 |
–453,30 |
–1010,02 |
|
0,56 |
0,44 |
–62,05 |
–391,76 |
–874,16 |
|
0,53 |
0,47 |
–53,79 |
–329,92 |
–737,73 |
|
0,5 |
0,5 |
–45,78 |
–269,39 |
–604,22 |
|
0,47 |
0,53 |
–38,19 |
–211,53 |
–476,69 |
|
0,44 |
0,56 |
–31,19 |
–157,53 |
–357,75 |
|
0,41 |
0,59 |
–24,88 |
–108,38 |
–249,56 |
|
0,38 |
0,62 |
–19,36 |
–64,86 |
–153,81 |
|
0,35 |
0,65 |
–14,69 |
–27,54 |
–71,78 |
|
0,32 |
0,68 |
–10,87 |
–3,18 |
–4,28 |
|
0,29 |
0,71 |
–7,91 |
–27,13 |
48,33 |
|
0,26 |
0,74 |
–5,76 |
44,32 |
86,12 |
|
0,23 |
0,77 |
–4,33 |
54,98 |
109,63 |
|
0,2 |
0,8 |
–3,53 |
59,51 |
119,84 |
|
0,19 |
0,81 |
–3,37 |
59,76 |
120,52 |
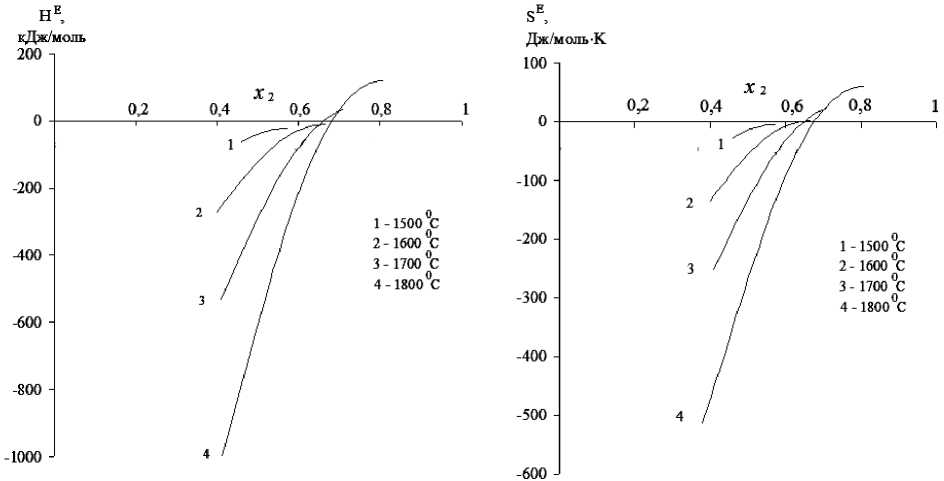
Рис. 2. Избыточная энтальпия известково-глинозёмистых расплавов в интервале температур 1500–1800 °С
Рис. 3. Избыточная энтропия известково-глинозёмистых расплавов в интервале температур 1500–1800 °С
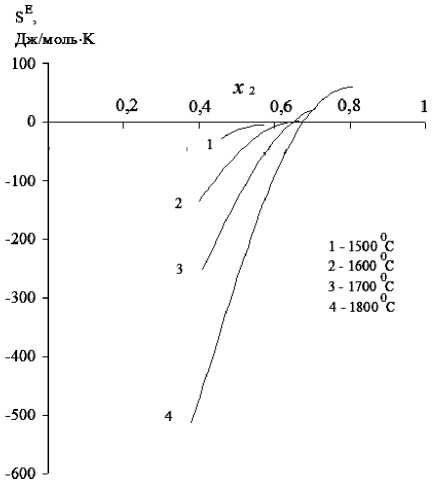
Рис. 4. Избыточная энергия Гиббса известковоглинозёмистых расплавов в интервале температур 1500–1800 °С
Заключение
-
1. Показана применимость обобщённой теории «регулярных» ионных растворов для аналитического описания термодинамических свойств известково-глинозёмистых расплавов.
-
2. Выведены выражения для активностей и избыточных термодинамических функций расплавов системы CaO–Al 2 O 3 в интервале температур 1600–3000 K.
Список литературы Моделирование термодинамических свойств известково-глинозёмистых расплавов
- Шульц, М.М. Масс-спектрометрическое исследование термодинамических свойств расплавов алюминатов кальция/М.М. Шульц, С.И. Шорников//Доклады Академии Наук. -1995. -Т. 340, № 3. -С. 350-352.
- Nagata, K. Activity of components in oxide melts CaO-Al2O3/K. Nagata, J. Tanabe, K.S. Goto//Proc. VI Int. Iron and Steel Congr. Nagaya, Japan. -1990. -Vol. 1. -Р. 217-224.
- Fujisawa, T. Thermodynamics of liquid CaO, Al2O3/T. Fujisawa, C. Yamauchi, A. Sakao//Proc. VI Int. Iron and Steel Congr. Nagaya, Japan. -1990. -Vol. -Р. 201-208.
- Rog G. Thermodynamic functions of calcium aluminate/G. Rog, A. Kozlowska-Rog, K. Zakula-Sokol//J. Chem. Thermodyn. -1993. -Vol. 25, № 7. -Р. 807-810.
- Зайцев, Ф.И. Термодинамические свойства и фазовые равновесия в системе CaF2-Al2O3-CaO/Ф.И. Зайцев, Н.В. Королёв, Б.М. Могутнов//I Советско-чехословацкий симпозиум по теории металлургических процессов: тез. докл. -1989. -Ч. 1. -С. 82-87.
- Ghosh, D. Standard Free Energy of Formation of Alumina/D. Ghosh, D.A.R. Kay//Electrochem. Soc. -1977. -Vol. 124, № 12. -Р. 1836-1845.
- Chemical and phase equilibria in the CaO-Al2O3 system/K. Adamkovicova, L. Rosa, S. Porvas, I. Proks//Chem. Papers. -1985. -Vol. 39, № 1. -Р. 3-13.
- Thermodynamic properties of CaO-Al2O3 liquid solution/M. Allibert, C. Chatillon, K.T. Jacob, R. Lourtan//J. Amer. Ceram. Soc. -1981. -Vol. 64, № 5. -Р. 307-314.
- Чемекова, Т.Ю. К вопросу о характере диаграмм состояния системы CaO-Al2O3/Т.Ю. Чемекова, Ю.П. Удалов//Изв. АН СССР. Неорган. материалы. -1974. -Т. 10, № 12. -С. 2191-2193.
- Nurse R.W., Welch J.H., Majumdar A.J.//Trans. Brit. Ceram. Soc. -1965. -Vol. 64, № 9. -Р.409-418.
- Rein, R.H. Activities in liquid slags CaO-Al2O3/R.H. Rein, J. Chipman//Trans. Met. Soc. AIME. -1965. -Vol. 233, № 2. -Р. 415-425.
- Sharma, R.A. Thermodynamic study of СаО-Л12О3 liquid slags/R.A. Sharma, F.D. Richardson//J. Iron and Steel Inst. -1961. -Vol. 198, № 4. -Р. 386-390.
- Бережной, А.С. Диаграмма состояния многокомпонентных окислов/А.С. Бережной. -Киев: Наукова думка, 1970. -544 с.
- Термодинамические свойства индивидуальных веществ: справ./под ред. Л.В. Гурвич. -М.: Наука, 1981. -Т. 3. -Кн. 1. -С. 472.
- Кожеуров, В.А. Термодинамика металлургических шлаков/В.А. Кожеуров. -Свердловск: Металлургиздат, 1955. -163 с.
- Срывалин, И.Т. Активности компонентов в оксидных системах/И.Т. Срывалин, О.А. Есин//Известия вузов. Черная металлургия. -1959. -№ 8. -С. 3-7.
- Вильгельм, Е.М. О применении термодинамики ионных расплавов/Е.М. Вильгельм, Г.Г. Михайлов//Физико-химические исследования металлургических процессов. -Свердловск: УПИ, 1978. -Вып. 6. -С. 63-69.
- Лаптев, Д.М. Расчёт диаграммы плавкости СаО-SiO2/Д.М. Лаптев//Известия вузов. Чёрная металлургия. -1970. -№ 6. -С. 10-13; 1970. -№ 8. -С. 7-11.
- Тюрин, А.Г. Обобщённая теория «регулярных» растворов/А.Г. Тюрин//Труды XI Российской конференции «Строение и свойства металлических и шлаковых расплавов»: тез. докл. -Челябинск: ЮУрГУ, 2004. -С. 96-97.