Модельные эксперименты с многокомпонентными растворами и грибной биомассой: возможность металлоносного биоминералообразования при угленакоплении
Автор: Павлова Л.М., Радомская В.И., Шумилова Л.П., Иванов В.В.
Журнал: Вестник геонаук @vestnik-geo
Рубрика: Научные статьи
Статья в выпуске: 7 (295), 2019 года.
Бесплатный доступ
В статье представлены результаты модельных экспериментов по извлечению химических элементов из многокомпонентных растворов биомассой микроскопических грибов. Полученные данные свидетельствуют о том, что сорбционное сродство элементов к грибной биомассе как сорбенту соответствует следующему ряду: Bi ≈ Sn ≈ Pb ≈ Fe ≈ Hg ≈ (Sb) ≈ Cr > Cd ≈ Zn ≈ Cu ≈ V ≈ Se > Co ≈ Mn ≈ (Sb) ≈ As ≈ Ni ≈ Sr, который отражает непростой характер взаимодействия и взаимовлияния элементов в многокомпонентной системе. С помощью сканирующей электронной микроскопии на грибной биомассе обнаружены полиметалльные новообразования сложного состава, представленные тонкими ксеноморфными частицами (фазами, зернами), а также хорошо ограненными кристаллами, их сростками и двойниками, что доказывает потенциальную возможность масштабного металлоносного биоминералообразования в органогенных седиментолитах. Сложный механизм извлечения химических элементов из многокомпонентных растворов реализуется в несколько этапов: первоначальный этап начинается с физико-химической сорбции (за счет электростатического и ван-дер-ваальсового взаимодействий), в дальнейшем протекает ионный обмен или комплексообразование с последующим восстановлением некоторых сорбированных ионов металлов.
Элементы, многокомпонентные растворы, извлечение, биосорбция, микроскопические грибы, биогенное минералообразование, угли
Короткий адрес: https://sciup.org/149129391
IDR: 149129391 | УДК: 550.72:550.47 | DOI: 10.19110/2221-1381-2019-7-33-42
Текст научной статьи Модельные эксперименты с многокомпонентными растворами и грибной биомассой: возможность металлоносного биоминералообразования при угленакоплении
Работами ряда отечественных и зарубежных исследователей неоднократно отмечались повышенные и высокие концентрации тех или иных металлов в углях различных регионов мира [1, 3, 25]. Согласно аналитическим данным А. П. Сорокина с соавт. [27], большинство ценных элементов-примесей в углях представлено рассеянными тонкими минеральными фазами. Например, в углях Ерковецкого буроугольного месторождения Амурской области обнаружены минералы различных классов. Это самородные минералы и твердые растворы: Au, Ag, Pt, Pd, Pb, Cu, Zn, Bi, Fe, Cr, Ni, W, Al, Se, Au–Ag, Au–Ag–Cu, Au–Cu(Ni, Zn), Ag–Sn, Cu–Zn, Pb–Cu, Fe–Ti, Fe–Cr, Cr–Ti и Ti–Ca(Fe, K, Si); сульфиды: FeS2, FeCuS2, ZnS, PbS, и Ag2S; сульфоселениды и селениды: Ag2(S,Se), Pb(Se,S) и PbSe; сульфаты: BaSO4, (Ba,Sr)SO4 и SrSO4; карбонаты: CaCO3 и BaCO3; оксиды: Fe3O4, FeTiO3, TiO2,
FeCr2O3 и SiO2; силикаты ZrSiO4; алюмосиликатные минералы с широким вариационным рядом элементов (Fe, Ti, K, Ca, Na и Mg); хлориды: NaCl и KCl; фосфаты и оксиды редкоземельных элементов Ce-ряда. Уголь – продукт преобразования растительной биомассы через стадию диагенеза. И в процессах трансформации органического вещества на стадии торфо-накопления ведущую роль играют грибы, являющиеся по своей сути его основными минерализаторами. В органогенных горизонтах запасы грибной биомассы могут быть значительными, например, в метровой толще торфяников количество грибной биомассы может достигать 13 т на 1 га [15].
Существует представление [25], что минералонакопление платиновых металлов в угленосных впадинах может происходить на стадиях осадко(торфо)на-копления и диагенеза органического вещества при дренировании органической толщи низкотемператур- 33
ными растворами хлоридно-сульфатного характера. В работах [18, 21—23] показано, что мицелий микроскопических грибов может служить центрами аккумуляции и минерализации платины, палладия, золота. Однако участие и роль микромицетов в процессах биоминералообразования цветных, редких и рассеянных металлов в составе органического вещества практически не очерчены, и работы по биогенезу их минералов редки.
Изучение процессов биоминерализации и биотрансформации элементов, моделирующих некоторые геологические процессы, возможно только в условиях лабораторных экспериментов. Поэтому целью данной работы было исследование в модельных экспериментах возможности биогенного извлечения и осаждения химических элементов из многокомпонентных растворов биомассой микроскопических грибов, а также определение механизмов этого процесса.
Материалы и методы
Для экспериментов использовали физиологически активную биомассу нескольких штаммов микроскопических грибов, выделенных из разных природных мест обитания: Cladosporium cladosporioi-des (Fresen.) G. A. de Vries (штаммы обозначены как Cl г, Cl пр, Cl Албын); Talaromyces funiculosus (Thom) Samson, N. Yilmaz, Frisyad et Seifert (штаммы обозначены как Tal г, Tal пр, Tal Албын) и 2 штамма Trichoderma aureoviride Rifai (обозначены как Tr пр, Tr Албын). Расширением «г» обозначены штаммы, выделенные из техногенных городских почв (г. Благовещенск), расширением «Албын» – из техногенных грунтов поля золоторудного месторождения Албын (Амурская область), расширением «пр» – из природных буротаежных почв. Выбор видов микромицетов был обусловлен их известной высокой сорбционной активностью по отношению к отдельным элементам [11], а также повсеместной встречаемостью и доминированием в природных и антропогенных сообществах Дальнего Востока [26].
Грибную биомассу наращивали методом глубинного культивирования в 5-литровых пластиковых емкостях, содержащих 2500 мл жидкой среды Чапека (рН 6.5). Культивирование осуществляли при 24 °С на рассеянном свету при периодическом встряхивании; через 7 суток биомассу концентрировали фильтрованием, промывали дистиллированной водой на фильтрах, затем удаляли излишнюю влагу отжиманием между листами фильтровальной бумаги и в таком виде использовали в экспериментах.
Готовили два варианта многокомпонентных растворов, используя ГСО, – с концентрациями каждого элемента по 0.5 мг/л (рН 3.2) и по 50 мг/л (рН 1.7). Растворы состояли из азотнокислых солей Zn(II), Hg(II), Ni(II), Mn(II), Pb(II), Cd(II), Cu(II), Co(II), Bi(III), Sr(II), солянокислых солей Sn(IV), Sb(III), As(III), водного раствора К2Cr2O7, NH4VO3, подкисленных растворов Na2SeO3. ГСО Fe(III) представлял собой раствор железоаммонийных квасцов в азотной кислоте. Состав применяемых ГСО обусловил высокое содержание S, N в растворах.
Кислотность исходных многокомпонентных растворов составляла 2.07 и 0.43 единицы рН для кон- 34
центраций 0.5 и 50 мг/л соответственно. Понижали кислотность исходных многокомпонентных растворов добавлением 0.05 М NaOH до значений 3.2 и 1.7 (до едва заметного помутнения раствора). Для оценки сорбционной активности каждого штамма осуществляли контакт биомассы с водными растворами смеси солей химических элементов (Т : Ж = 1 : 30—700 г/см3) в течение 6 суток в статических условиях при периодическом перемешивании. В холостые пробы грибную биомассу не добавляли.
Степень извлечения элемента из раствора грибной биомассой вычисляли (с учетом его содержания в холостой пробе) по формуле: Е, % = (С исх – С i ) X х 100 % / С исх , где С исх. — концентрация элемента в холостой пробе, мг/мл; Сi – концентрация элемента в растворе после биоизвлечения, мг/мл.
Остаточное содержание элементов в растворах после их извлечения грибной биомассой определяли масс-спектральным (X-7, Thermo Elemental, США) и атомно-эмиссионным (ICAP-61, Thermo Jarrell Ash, США) с индуктивно связанной плазмой методами в ИЦ ИПТМ РАН (Черноголовка).
Электронно-микроскопические исследования и электронно-зондовый микроанализ грибной биомассы выполнены с помощью сканирующего электронного микроскопа (СЭМ) JSM-6490LV c энергодисперсионным спектрометром (ЭДС) INCA Energy, X-max в лаборатории микро- и наноисследований ДВГИ ДВО РАН (Владивосток). Образцы напыляли углеродом. ИК-спектрометрия выполнена с помощью ИК-Фурье-спектрометра Nicolet iS10 (Thermo Fisher Scientific) в АЦМГИ ИГиП ДВО РАН (Благовещенск).
Результаты и их обсуждение
Результаты экспериментов свидетельствуют, что в целом все элементы из экспериментальных многокомпонентных растворов хорошо извлекались грибной биомассой (табл. 1); при этом рН растворов после сорбции слегка повысился – на 0.5—1.0 единицы. При исходно высокой концентрации ионов в растворе показатели биосорбции будут также высокими относительно растворов с изначально низкой концентрацией сорбируемых элементов [13]. Поэтому анализ извлечения элементов грибной биомассой проводили раздельно для концентрированных и разбавленных растворов.
Для каждого из вариантов исследуемые металлы условно разделили на 3 группы в соответствии со степенью извлечения: с максимальными, промежуточными и минимальными показателями. Все штаммы характеризуются максимальным извлечением преимущественно Bi, Sn, Pb, Hg, Fe (85–100 %) из разбавленных растворов и Bi, Sn, Fe, Cr, Pb, Sb (75–100 %) – из концентрированных. Во вторую, промежуточную, группу включены элементы со степенью извлечения 50—80%. Это Hg и Se из концентрированных растворов. Из разбавленных растворов степень извлечения элементов несколько варьирует в зависимости от вида микромицета, но в целом к этой группе можно отнести V, Cr, Cu, Zn, Cd.
В сравнительно меньшем количестве (до 50 %) биомассой всех штаммов извлекались Mn, Co, As, Sr, Ni и из разбавленных, и из концентрированных
Таблица 1. Степень извлечения химических элементов грибной биомассой из многокомпонентных растворов, %
Таким образом, сродство элементов к грибной биомассе можно представить в виде следующих рядов: Bi ≈ Sn ≈ Pb ≈ Hg ≈ Fe ≈ Cr ≈ Cu > V ≈ Zn > Cd > Co ≈ Mn ≈ Se ≈ As ≈ Sr ≈ Ni ≈ Sb – для многокомпонентных растворов с низкой концентрацией каждого элемента (0.5 мг/л); Sn ≈ Bi ≈ Fe ≈ Pb > Hg ≈ Sb ≈ Se > Cr ≈ Cd ≈ Cu ≈ Ni ≈ Zn ≈ V > Sr ≈ Co ≈ As ≈ Mn – для концентрированных многокомпонентных растворов (50 мг/л). Это свидетельствует о поглощении металлов и некоторых металлоидов биомассой как функции сродства конкретного элемента при данной концентрации. Изменение позиции Sb в сорбционных рядах для концентрированных и разбавленных растворов, возможно, связано с изменением заряда комплекса, который образуется при частичном гидролизе Sb c повышением рН раствора [11].
По суммарной степени извлечения наиболее высокими показателями относительно других видов как из разбавленных, так и из концентрированных растворов характеризуется биомасса Cladosporium cladospo-rioides г, наименьшими – все три штамма Talaromyces funiculosus. Резистентные ко многим антропогенным воздействиям микромицеты характеризуются и высоким адаптационным потенциалом, что согласуется с обнаруженным нами фактом более интенсивного связывания элементов клеточной поверхностью штамма Cladosporium cladosporioides , выделенного из сравнительно более загрязненного места обитания.
Грибной мицелий может извлекать химические элементы из растворов несколькими путями [14]. В первую очередь, клеточная стенка, грибные пигменты, внеклеточные полисахариды сорбируют элементы из растворов на свою поверхность. Кроме того, многие виды грибов способны к внутриклеточному поглощению элементов, а также к осаждению образовавшихся в растворах соединений химических элементов на грибные гифы – аккумуляторы ионов. Осаждение ионов на клеточных стенках и других внешних поверхностях биомассы (биосорбция) – процесс энерго- и метаболизмонезависимый, определяющими факторами для которого будут поверхностные свойства самого биосорбента, ионные характеристики сорбируемых элементов, формы их соединений в жидкой фазе и условия протекания процесса биосорбции.
Способностью сорбировать различные вещества, в том числе и металлы, микромицеты в большой степени обязаны хитин-глюкановому комплексу клеточной оболочки. Макромолекулы хитина в клеточной стенке грибного мицелия представлены линейными пучками – микрофибриллами – толщиной 15—25 нм и длиной 1—2 мкм в виде пространственной решетки. Промежутки между пучками заполнены глюканами, обеспечивающими связь между ними [4]. Глюканы обладают высокой проницаемостью для водных растворов; за счет этого сорбционная площадь микрофибрилл может увеличиваться до 1000 м2 на 1 г грибной биомассы [4]. Небольшое расстояние между микрофибриллами (~ 5—10 нм) обеспечивает высокую вероятность захвата ионов из раствора. Сорбционными центрами на поверхности грибной клетки будут функциональные 36
группы хитин-глюканового комплекса, неструктурных полисахаридов, белков, липидов, пигментов.
ИК-спектры поглощения грибной биомассы показывают аддитивную величину всех ингредиентов клеточной оболочки. Тем не менее во всех образцах грибной биомассы удалось выделить спектральные области, характерные для определенных классов веществ. Обнаружено присутствие связанных межмолекулярными водородными связями OH-групп (широкие полосы в области 3285—3260 см-1), ОН-групп спиртов, карбоновых кислот, полисахаридов (пики поглощения в области 1148 см-1 и 1037 см-1). О наличии метиленовых групп свидетельствовали полосы в области 3007—2852 см-1. Полосы поглощения в области 1740—1733 см-1 свидетельствовали о С-О-связи карбоксильных групп и сложных эфиров, полосы в области 1320—1210 см-1 – об аминокислотах. Об амидных группах (амид I и амид II) полипеп-тидных компонентов говорят полосы средней и малой интенсивности в диапазоне длин волн 1627—1633 см-1 и 1556—1513 см-1 соответственно; о СН2- и СН3-группах – полосы поглощения при 1404—1359 см-1 и 712 см-1; о фосфатных группах (Р=О) нуклеиновых кислот, полисахаридов и фосфолипидов – пики невысокой интенсивности при 1247—1231 см-1; об алифатической связи С-О-С – полосы поглощения при 1153—1060 см-1. По полученным данным можно предположить, что центрами взаимодействия клеточных стенок грибной биомассы с катионами металлов будут гидроксильные, карбоксильные, карбонильные группы структурных полисахаридов, ацетоамидогруппы хитин-глюканового комплекса, амино- и фосфатные группы неструктурных белков, пигментов и липидов.
При электронно-микроскопических исследованиях поверхности грибной биомассы после эксперимента нами было обнаружено множество рассеянных металлосодержащих зёрен (фаз, частиц) различной морфологии — ксеноморфных (см. рисунок, а) и их кластеров (см. рисунок, b, c), а также призматических кристаллов, их двойников и незакономерных сростков (см. рисунок, d, e, f). Размеры обнаруженных фаз варьируются в широких пределах — 1.2—15 х 0.8—9.4 мкм. По данным электронно-зондового микроанализа, состав этих фаз полиэлементный. Результаты элементного состава таких тонкодисперсных фаз пока весьма трудно интерпретировать в виде известных минералов (не обнаружено в обширных международных базах данных) или каких-либо химических соединений. На некоторых ЭДС-спектрах зафиксировано наличие О, P, S и N. Эти элементы характерны как для компонентов клеточной оболочки, так и для сорбционного раствора.
На текущем этапе исследований с применением лишь одного метода диагностики можно предполагать присутствие различных смесей новообразований: интерметаллидов, халькогенидов, сульфатов, гидроксидов и, вероятно, металлоорганических соединений. В целом установлена принадлежность их к нескольким полиэлементным группам: Fe–Cr–Cd, Fe–Zn, Ni–Fe–Cd, Ni–Fe–Cr, Zn–Mn–Fe, Pb–Sr–S, PbS–Sr, Pb–Fe–Sr, Pb–Sn—S–Cr–Fe–Se–Cu–V–Cr, Pb–S–Sr–Sn–Fe–Cu–Cr, Sn–Bi–Sb–Se–Fe–As–V– Cr, Sn–Sb–Se–Fe–As–V–Cr, Sn–Fe–Se, Sn–Fe–Se– Bi–Sb–As–Cr–V, Fe–Cr–Hg–Sn–Se–As, Hg–Sn–Se– Fe–Cr–As и др.

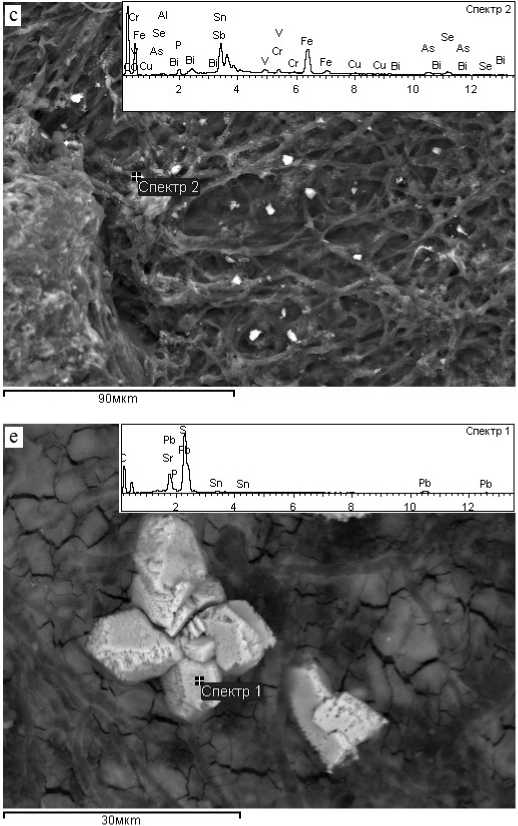
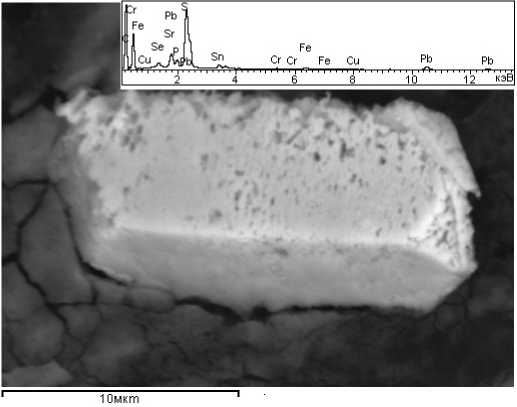
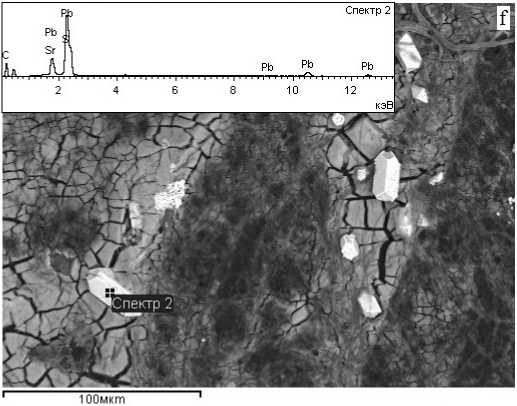
Электронно-микроскопические снимки металлоносных фаз, образованных после 6-суточного взаимодействия биомассы микроскопических грибов с химическими элементами в многокомпонентных растворах: а, b — ксеноморфные микрочастицы; c — «россыпь» частиц и кристаллов; d — гладкогранный рыхлоструктурированный кристалл; e, f — сростки и двойники удлиненных Pb-Sr-S-кристаллов. Врезки — ЭДС-спектры состава металлоносных фаз
Electronic micro-photographs of metal-bearing phases. These phases formed by 6-day interaction of the microscopic fungi biomass with chemical elements in multicomponent solutions: a, b — xenomorphic microparticles; c — “scattering” of particles and crystals; d — smooth-faceted loosely structured crystal; e, f — intergrowths and twins of elongated Pb-Sr-S crystals. Inserts — EDS-spectra of the metal-bearing phases composition
Состав энергодиперсионных спектров и морфология некоторых кристаллов, обнаруженных на поверхности грибной биомассы, позволяют с некоторой долей вероятности идентифицировать их как следующие минералы: пирит (FeS2) см. рис., b; англезит (PbSO4) — см. рис., e, f. Согласно литературным данным [14], минеральные фазы на поверхности грибных гиф образуются либо в результате элементарных процессов осаждения вторично образованных минералов, либо за счет зарождения кристаллов на клеточной стенке и их дальнейшего роста. Многие грибы могут осаждать восстановленные формы металлов и металлоидов. В формировании кристаллов пирита, несомненно, главенствующую роль сыграла деятельность микромицетов (произошло восстановление Fe(III) до Fe(II)). Согласно [7, 14], биохимическое восстановление ионов Fe(III) до Fe(II) грибами возможно. Образование англезита в большей степени обусловлено составом многокомпонентного раствора. Взаимодействие ионов свинца и сульфата может приводить к образованию нерастворимой соли PbSO4 и последующему ее осаждению на грибную биомассу. Наличие в спектре линий Sr не доказывает присутствия его соединений в составе новообразованного минерала, так как анализируемая поверхность кристалла очень пористая, она могла быть просто покрыта соединением другого состава. На поверхности минерала могут осаждаться, например, малорастворимые сульфаты стронция.
В полиэлементной ионной системе такие характеристики, как атомный вес, атомный или ионный радиус, плотность заряда и электроотрицательность элементов, влияют на степень их извлечения. Известно, что из двух ионов одинакового заряда большую сорбционную способность проявляют ионы большего радиуса, так как они сильнее поляризованы и лучше притягиваются заряженной поверхностью сорбента. Ионы же меньшего радиуса более склонны к гидратации и формированию гидратной оболочки, снижающей такое электростатическое взаимодействие. Высокая степень извлечения грибной биомассой Pb, Hg, Cd и Bi относительно элементов с подобными зарядами (Cu, Zn, Ni, Co, Mn и Sb, As) может быть связана как с их большими ионными радиусами (табл. 2), так и с осаждением образующихся в многокомпонентном растворе нерастворимых солей, например сульфатов свинца, на грибную биомассу.
Высокие показатели извлечения ионов Fe при достаточно малом радиусе можно объяснить не только закреплением части ионов железа в биохимически образованном пирите, но и хорошей гидратируемо-стью Fe3+ при низких рН раствора – гидрокомплексы Fe3+ начинают образовывать при рН 2.5. А с гидрокомплексами железа проходит соосаждение ионов других металлов, о чем свидетельствует сложный состав обнаруженных на грибной биомассе минеральных частиц. Масштабы закрепления элементов будут определяться близостью радиусов ионов металлов с радиусом Fe3+ [29] и значениями электроотрицательности.
Щелочные и щелочноземельные элементы плохо сорбируются хитином и хитозаном из-за невысокого значения ионного потенциала [17]. Ион Sr2+, имеющий большой радиус, но низкие показатели извлечения, выбивается из этой закономерности, возможно, из-за межионной конкуренции, которая определяет
Таблица 2. Ионные характеристики химических элементов по [5,10]
Table 2. Ionic characteristics of chemical elements in [5,10]
|
Ион Ion |
Ионный радиус (R, нм) Ion radius according |
IP = Z/10R |
Электроотрицательность по Л. Полингу Electronegativity according to L. Poling |
||
|
по В. Гольдшмидту to V. Goldschmidt |
по Л. Полингу to L. Poling |
по Г. Бокию, Н. Белову to G. Boky, N. Belov |
|||
|
Pb2+ |
0.132 |
0.121 |
0.112 |
1.5-1.7-1.8 |
2.33 |
|
Sr2+ |
0.127 |
0.113 |
0.120 |
1.6-1.8-1.7 |
0.95 |
|
Bi3+ |
0.120 |
0.116 |
0.120 |
2.5-2.6-2.5 |
2.02 |
|
Hg2+ |
0.112 |
0.110 |
0.112 |
1.8-1.8-1.8 |
2.00 |
|
Cd2+ |
0.103 |
0.097 |
0.099 |
1.9-2.1-2.0 |
1.69 |
|
Mn2+ |
0.091 |
0.080 |
0.091 |
2.2-2.5-2.2 |
1.55 |
|
Sb3+ |
0.090 |
0.089 |
0.090 |
3.3-3.4-3.3 |
2.05 |
|
Zn2+ |
0.083 |
0.074 |
0.083 |
2.4-2.7-2.4 |
1.65 |
|
Co2+ |
0.082 |
0.072 |
0.078 |
2.4-2.8-2.6 |
1.88 |
|
Ni2+ |
0.078 |
0.069 |
0.074 |
2.6-2.9-2.7 |
1.91 |
|
Sn4+ |
0.074 |
0.071 |
0.067 |
5,4-5,6-6,0 |
1.96 |
|
Cu2+ |
0.072 |
0.072 |
0.080 |
2.8-2.8-2.5 |
1.90 |
|
Se4+ |
0.070 |
0.069 |
- |
5.7-6.0- |
2.55 |
|
Fe3+ |
0.070 |
0.067 |
- |
4.3-4.5- |
1.83 |
|
As3+ |
0.069 |
0.069 |
- |
4.3-4.3- |
2.18 |
|
V5+ |
0.040 |
0.059 |
- |
12.5-8.5- |
1.63 |
|
Cr6+ |
0.035 |
0.052 |
0.035 |
17.1-11.5-11.5 |
1.66 |
Примечание : Z — валентность иона.
Note: Z — valence of ion.
селективное накопление металлов микроорганизмами. Ионный потенциал (IP) определяет многие свойства элемента – чем он выше, тем больше склонен элемент быть активным поляризатором других ионов, и наоборот, при уменьшении ионного потенциала он начинает приобретать свойства пассивной поляризации.
Ионы V5+, Cr6+, которые в растворе находятся в виде анионов, также в больших количествах извлекаются из растворов грибной биомассой. На биосорбцию Cr6+ в большой степени дополнительное влияние оказывает рН раствора – при рН < 2 хром находится в виде Cr3O102- и Cr4O103-, при рН 2–6 — HCrO4- в равновесии с CrO4- [16]. Протонированные функциональные группы грибной клеточной стенки взаимодействуют с отрицательно заряженными анионами металлов путем электростатического притяжения [12 ].
Ион Co2+ характеризуется малым ионным радиусом и низкой поляризуемостью, что обуславливает преимущественно ионный характер связи катионов кобальта с анионогенными группами сорбента. Но в результате конкурентной сорбции количество извлекаемого кобальта значительно меньше, чем остальных d -элементов. Очень низкая биосорбция никеля связана, скорее всего, с тем, что в очень кислых растворах (рН ≈ 2) мала доля определенной ионной формы никеля, которая может взаимодействовать с сорбентом. Низкая сорбция никеля происходит из-за электростатического отталкивания ионной формы Ni2+ в кислой среде и положительно заряженной клеточной поверхности.
Мышьяк характеризуется сильным сродством к гидроксидам железа. Но его прочному закреплению на гидроксидах железа может препятствовать конкуренция со стороны других оксианионов [28].
Таким образом, механизмы извлечения грибной биомассой химических элементов из многокомпонентных растворов достаточно сложные. Определяющими факторами процесса являются характер и количество функциональных групп сорбента, валентное состояние химических элементов в растворе, а также состав и рН среды взаимодействия [20].
Клетки микромицетов содержат различные молекулы, которые могут выступать как центры связывания, причем в различных механизмах. Например, карбоксильные группы способны к комплексообразованию, к электростатическому притяжению ионов металлов.
Кислотность реакционной среды оказывает сильное влияние на заряд поверхности сорбента и на состояние элементов в растворе. Величины рН экспериментальных растворов составляли 1.7 и 3.2 единицы. Металлы в таких кислых растворах по большей части будут находиться в форме катионов Меn+ и частично — в гидролизованном виде. Клеточная стенка микромицетов, являясь по своей природе полиионным обменником, в зависимости от кислотно-щелочных условий будет проявлять как катионообменные, так и анионообменные свойства. Изоэлектрическая точка микробной биомассы находится в области рН 2—3 [9], поэтому в условиях проведения эксперимента грибная клеточная стенка в большей степени будет проявлять катионооб- менные свойства, а большинство функциональных групп клеточной поверхности находятся в протонированном состоянии. За счет процессов протонирования функциональных групп клеточной поверхности между катионами металлов и ионом водорода будет конкуренция за сайты связывания. И первоначально, скорее всего, можно говорить о механизме адсорбции элементов за счет сил электростатического притяжения, ван-дер-ваальсового взаимодействия. В дальнейшем в результате ионных взаимодействий катионов металла с гидроксильными группами, аминогруппами на поверхности клеточных оболочек может происходить высвобождение протона и замена их на металл по реакциям:
R‒COOH +Me2+ = R‒COO‒Me+ + H+ (1)
R‒NH3+ + Me2+ = R‒NH2‒Me2+ + H+ (2).
Для хитин-глюканового комплекса грибной клеточной стенки основным механизмом взаимодействия с ионами металлов будет хелатирование, вследствие чего будут хорошо сорбироваться практически все тяжелые металлы [4]. Способность хитина к комплексообразованию объясняется высокой электронно-донорной способностью атомов азота и кислорода в составе ацетоамидогрупп. При анализе токсичности тяжелых металлов для живых систем Ф. Т. Бингам с соавт. [2] показали, что двухвалентные ионы Mn, Fe, Co, Ni и Cu предпочтительнее связываются в местах, где находятся N-донорные атомы. Можно предположить, что ионы металлов взаимодействуют также и с группами, содержащими S и P. Например, тиольная группа может взаимодействовать с катионами по реакции: R‒SH + Me2+ = R‒S‒Me+ + H+ (3).
Ионы Zn образуют связь с донорными атомами N или S; Cd, Hg и Pb также предпочитают места связывания с донорными атомами S [2]. За счет клеточных пигментов увеличивается разнообразие функциональных групп (карбоксильных, фенольных, хиноновых, метоксильных, сложноэфирных) и, соответственно, может увеличиваться количество сорбированных элементов. Далее сорбированные ионы металлов могут частично восстанавливаться до нулевого состояния за счет взаимодействия с сульфгидрильными группами клетки либо продуктами жизнедеятельности микроорганизмов [21, 22] (в разбавленных растворах отмечался рост биомассы), например, по реакции: R‒S‒Me+ + 2 e = 2R‒S + Me0 (4). О способности микроскопических грибов аккумулировать ионы отдельных металлов с образованием нульва-лентных частиц и предполагаемом механизме образования минеральных частиц на органической матрице сообщали ранее [6, 8, 18—22, 25].
Заключение
В результате модельных экспериментов по извлечению химических элементов из многокомпонентных растворов грибной биомассой на ее поверхности обнаружены разнообразные по составу частицы в виде морфологически неправильных и ограненных зерен и их сростков.
Предложенный ряд сорбционного сродства химических элементов к биомассе микроскопических гри- 39
бов как сорбенту: Bi ≈ Sn ≈ Pb ≈ Fe ≈ Hg ≈ ( Sb ) ≈ Cr > > Cd ≈ Zn ≈ Cu ≈ V ≈ Se > Co ≈ Mn ≈ ( Sb ) ≈ As ≈ Ni ≈ Sr – отражает непростой характер взаимодействия и взаимовлияния элементов в многокомпонентной системе. Изменение позиции Sb в сорбционных рядах для концентрированных и разбавленных растворов обусловлено химическими свойствами элемента при разных рН раствора.
Механизм извлечения химических элементов из многокомпонентных растворов с образованием частично восстановленных форм сложный. Он реализуется в несколько этапов: первоначальный этап начинается с физико-химической сорбции (за счет электростатического и ван-дер-ваальсового взаимодействий, включающих сорбцию как катионных, так и анионных форм); в дальнейшем вероятны процессы биосорбции за счет хелатирования и ионного обмена между активными группами грибной клеточной стенки и ионами металлов. Сорбированные металлы могут восстанавливаться. Восстановление может происходить в результате взаимодействия с сульфгидрильными группами либо за счет продуктов жизнедеятельности микроорганизмов. Кроме того, состав ионного фона многокомпонентных растворов способствует зарождению кристаллов (в данном случае пирита и англезита) и их осаждению на клеточной поверхности. Таким образом, многообразие механизмов взаимодействия грибной биомассы с химическими элементами в многокомпонентных растворах доказывает потенциальную возможность масштабного металлоносного биоминералообразования в органогенных седименто-литах. Полученные данные расширяют представления о роли микромицетов в концентрировании различных химических элементов в бассейнах органогенного се-диментогенеза, что, несомненно, может представлять определенный интерес для дальнейшего развития теории биогенного минерало- и рудообразования.
Авторы выражают искреннюю благодарность и признательность к.г-м.н., старшему научному сотруднику Института геологии и минералогии им. В. С. Соболева СО РАН Е. В. Лазаревой за внимательный анализ рукописи, конструктивные замечания и ценные советы, что позволило значительно улучшить качество представляемого материала.
Список литературы Модельные эксперименты с многокомпонентными растворами и грибной биомассой: возможность металлоносного биоминералообразования при угленакоплении
- Арбузов С. И., Ершов В. В., Поцелуев А. А., Рихванов Л. П. Редкие элементы в углях Кузнецкого бассейна. Кемерово: Кемеровский полиграфкомбинат, 2000. 248 с.
- Бингам Ф. Т., Коста М., Эйхенбергер Э. и др. Некоторые вопросы токсичности ионов металлов. М.: Мир, 1993. 368 с.
- Вялов В. И., Богомолов А. Х., Шишов Е. П., Чернышев А. А. Угольные месторождения Дальнего Востока России и ресурсный потенциал содержащихся в них ценных металлов//Георесурсы. 2017. Т. 2. С. 256-262. DOI: 10.18599/grs.19.25
- Горовой Л. Ф., Косяков В. Н. Клеточная стенка грибов -оптимальная структура для биосорбции//Биополимеры и клетка. 1996. Т. 12. № 4. С. 49-60.
- Краткий справочник физико-химических величин. Л.: Химия, 1974. 200 с.


