Модифицирование бетона гидротермальным нанокремнеземом
Автор: Потапов В.В., Ефименко Ю.В., Горев Д.С.
Журнал: Нанотехнологии в строительстве: научный интернет-журнал @nanobuild
Статья в выпуске: 3 т. 11, 2019 года.
Бесплатный доступ
Показана возможность применения гидротермального нанокремнезема как модифицирующей добавки для повышения прочности бетона на основе портландцемента. Предложена технология получения гидротермального нано-кремнезема в виде золей и нанопорошков с помощью ультрафильтрационного мембранного концентрирования и криохимической вакуумной сублимации. Приведены результаты повышения прочности бетона при сжатии вводом добавки золя гидротермального нанокремнезема. Эксперименты выполнены на высокоподвижных бетонах (ОК = 10–19 см) на равноподвижных смесях с водоцементным отношением В/Ц = 0,61–0,71 при дозе SiO2 2 мас.% и расходе суперпластификатора поликарбоксилата 0.95±0.05 мас.% по цементу. На начальной стадии твердения в возрасте 1 сутки повышение прочности бетона при сжатии достигло 90–128% по сравнению с контрольным образцом. В возрасте 28 сут повышение прочности составило 40%. В эксперименте с известковой средой установлена высокая хемосорбционная активность гидротермального нанопорошка по отношению к Ca(OH)2. Это указывает, что аморфная нанодобавка SiO2, имеющая высокую удельную поверхность, вызывает образование высокопрочных гидратов силикатов кальция в цементной (известковой) среде в результате пуццолановой реакции, и это обуславливает повышение прочности бетона.
Гидротермальный раствор, золь, нанопорошок, кремнезем, хемосорбционная способность, пуццолановая реакция, прочность бетона при сжатии
Короткий адрес: https://sciup.org/142218162
IDR: 142218162 | УДК: 544.23:691.26-022.532 | DOI: 10.15828/2075-8545-2019-11-3-248-265
Текст научной статьи Модифицирование бетона гидротермальным нанокремнеземом
N owadays one can witness an increasing demand of different kinds of amorphous silica, especially SiO2, in nanodispersed form (sols, gels and nanopowders) in various industries and construction. The new source for them is hydrothermal solutions extracted in the regions of active volcanism [1, 2, 3].
The methods used in nanotechnology resulted in emergence of new ideas concerning the kinetics of the formation and structure of the calcium silicate hydrate gel-C–S–H (dimensions, shape, density, etc.) [4]. On a small scale (1–5 nm) the C–S–H gel has a layer structure, and layers tend to cluster into compact domains wherein the distances between individual C–S–H layers are in the order of several nanometers. On a larger scale (from 5 to 100 nm) domains form three-dimensional disc-shaped structures of 60х30х5 nm3 (5 nm of thick, length of disk axis is about 60 nm), so-called C–S–H particles. During the hydration process the amount of C–S–H particles increases, the particles aggregate forming three varieties of amorphous C–S–H gel at a micro level (1 µm): 1) LD– C–S–H low density gel; 2) HD–C–S–H high density gel; 3) UD-C-S-H ultrahigh density gel.
Three varieties of the C–S–H gel show different mechanical properties: a C–S–H-gel with a high and ultra-high density possesses higher stiffness and hardness compared to a low-density C–S–H gel. The C–S–H gel lacks a fixed stoichiometry, the gel chemical composition varies from point to point within the batch volume, so the C–S–H gel is characterized by the Ca/Si ratio. According to the data of scanning electron microscopy and transmission electron microscopy the Ca/Si ratio varies within the C–S–H gel in the range of 0.6–2.0.
Nanoparticles with a large specific surface area (up to 1000 m2/g) are distinguished by their chemical activity [5–21]. They can act as centers accelerating hydration reactions, as well as a nanofiller reducing porosity.
The goals of this paper were to show: 1) possibility of applying nanoparticles of hydrothermal silica for rising compressive strength of Portland cement concretes; 2) that one of the main factors affecting increase of concrete strength under the introduction of hydrothermal nanosilica is the reaction of the pozzolanic type between the surface of SiO2 nanoparticles and calcium hydroxide
(Ca(OH)2 portlandite – the product of cement minerals hydration (tricalcium silicate – alateum, dicalcium silicate – belite).
MAIN PART
Production of hydrothermal sols and nanopowders and characteristics of them
The experiments on the membrane concentration of nanosilica in the hydrothermal medium were carried out at the sites of operating Mutnovsky geothermal power plant (50 MWt) and Verkhne-Mutnovsky geothermal power plant (12 MWt). At the flow rate of 1100– 1200 ton/h of the liquid phase of heat carrier and SiO2 content in the initial aqueous medium 400–800 mg/kg the potential for SiO2 production is 3–5 thousand tons per year. Apart from silica there are some others components in Initial aqueous solution (Table 1).
Productive wells of geothermal power plants bring to the surface the heat carrier in the form of a steam-water mixture with a steam quality of 0.2–0.3. In separators steam is separated from water and fed to the turbine for electricity generation. Water enters expanders where in final steps pressure drops to 0.1 MPa (100оС). Then water is fed into heat exchangers in which the temperature is rised to 20–70оC, then it is transferred into a tank for hydrothermal solution aging, polycondensation of the orthosilicic acid molecules and SiO2 particles growth. After the solution is taken out to the surface the pressure and temperature decrease, the solution becomes supersaturated respect to the amorphous silica solubility, hydrolysis and polycondensation of the orthosilicic acid OSA molecules that lead to the formation of spherical SiO2 nanoparticles with diameters from 5–100 nm run in it.
The finite sizes of silica particles depend primarily on the temperature and pH at which the polycondensation of the OSA molecules takes place. The polycondensation temperature increase and pH decrease lead to the raise of the finite particle sizes. At the stage of polycondensation the temperature was varied in the range from 20 to 70оC at pH = 9.0–9.2 to form SiO2 particles with specified sizes and concentrations.
Aqueous silica sols were obtained from the separate after the completion of the OSA polycondensation by 3-step
Table 1
The concentration of main components of the initial hydrothermal solution (the separate of productive wells of Mutnovsky GeoPP), pH = 9.2
|
Component |
Nа+ |
К+ |
Li+ |
Са2+ |
Мg2+ |
Fe 2+, 3+ |
Al3+ |
Сl– |
SO42 |
HCO3– |
CO32– |
H3BO3 |
SiO2 |
|
Concentration, mg/dm3 |
282 |
48.1 |
1.5 |
2.8 |
4.7 |
< 0.1 |
< 0.1 |
251.8 |
220.9 |
45.2 |
61.8 |
91.8 |
780 |
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ concentration of the SiO2 particles with ultrafiltration membranes of polyethersulfone with the parameter of the minimum mass weight cut of particles MWCO = 50 kD: at the 1st stage the SiO2 content in the sol was increased from 0.05 to 0.3–0.4 % wt., at the 2nd – up to 10 % wt., at the third stage – up to 20–30 % wt. and higher.
To obtain nanopowders the sols were dispersed, the droplets were solidified in the liquid nitrogen at the temperature of – 196оC and obtained cryogranules were sublimed in a vacuum chamber at the pressures of 2.6–6.6 Pa. The small size of the sol droplets, the high surface of heat transfer made it possible eventually to achieve rapid hardening and the absence of particles coalescence: the particle sizes in powders did not exceed the particle sizes in sols. The specific energy consumption during the sols production is 0.18–1.0 kWh/kg SiO2, the total energy consumption for nanopowder production is 7.0–14.3 kWh/kg SiO2.
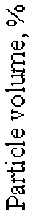
Range of particle sizes, nm
Fig. 1. The distribution of nanoparticles sizes of silica sol’s sample
Dynamic light scattering and electrophoretic light scattering (Zetasizer, Mal-vern, Great Britain), scanning electron microscopy (JEM-100CX, JEOL, Japan), low-temperature nitrogen adsorption (ASAP-2010, Micromeritics, USA), X-ray diffraction analysis (ARL X’TRA, Thermo Scientific, Switzerland) were used to study the characteristics of sols and powders.
The chemical composition of the samples was determined on the microanalyzer JXA 8100, GEOL, Japan, equipped with three wave spectrometers and EMF prefix INCAx-sight, Oxford, UK. Working voltage is 20 kV, current is 1*10-8 A. Identified elements are from B to U.
Thermogravimetric analysis (TGA) was performed in closed Pt-crucibles on the derivatograph OD-102 (Hungary) at TG – 50 mg and DTGA – 1/5 sensitivities to a temperature of 920–940oC.
The distribution by sizes of silica sol particles was determined with dynamic light scattering method, zeta potential of the particles – by means of electrophoresis. Fig. 1 shows the results for one sol sample with the following characteristics: the sol density ρs = 1080 g/dm3, the content of SiO2 = 150 g/dm3, pH = 8.6, the average SiO2 particle diameter dm = 41.6 nm, the average zeta potential of the SiO2 particles surface ξm = –28.2 mV.
Table 2 presents the range of SiO2 sol characteristic values where their values can be varied by means of the temperature at the stage of polycondensation of OSA and ultrafiltration membrane concentration.
Fig. 2 shows TEM-images of nanopowder particles obtained by cryochemical vacuum sublimation of the sol sample.
The technological regime developed by us makes it possible to vary the characteristics of mesoporous powders within the following limits: the specific surface area
Table 2
Physical and chemical characteristics of aqueous silica sols obtained by the ultrafiltration membrane concentration
|
Characteristics |
Values |
|
pH |
8.0–9.2 |
|
Total SiO2 content, g/dm3 |
3.0–940.0 |
|
Sol density ρs, g/dm3 |
1000–1510 |
|
Nanoparticles average diameters, nm |
5–100 |
|
Salinity TDS, mg/dm3 |
800–2000 |
|
Specific electrical conductivity σm, mS/сm (20оС) |
0,8–1,56 |
|
Average Zeta-potential ξ of nanoparticles surface, mV |
–25.0…–56.0 |
|
Dynamic viscosity η, mPа•s (20оС) |
1.0–120.0 |
|
SiO2 content in the material precipitated from sol, % wt. |
up to 99.72 |
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ

Fig. 2. TEM-images of nanopowder particles is from 100 up to 500 m2/g, the pore volume is 0.20– 0.30 cm3/g, the average powder pore diameter is from 2 to 15 nm, the average particle diameter is from 5 up to 100 nm, the density of surface silanol groups is up to 4.9 nm–2, the residual moisture is up to 0.2 % wt., and the bulk density is 0.02–0.30 kg/dm3.
Application of nanosilica to improve concrete strength
The experiments were carried out to study the effect of silica nanoparticles on the compressive strength of concretes (cement–sand–water–crushed stone).
Portland cement (PC) of Korean production of 42.5R class, which meets the standards of Russia for Portland cements was used as a binder. According to GOST 311082003 it is classified as a type of CEM-I based on clinker with the content C3S = 55–58%, C3A = 8.2–8.5% and conventional chemical-mineralogical clinker quality indicators (lime saturation coefficient KH = 90–91%, alumina module p = 1.7, silicate module n = 2.3). Physicalmechanical characteristics (brand, rest on a sieve No. 008, setting time, compressive strength) are within the requirements of the standard for the fast-hardening Portland cement of CEM I brand of 42.5B class. The fillers were crushed stone of diorite fraction from 5 to 20 mm according to GOST 8267 –State standard of Russian Federation (bulk density is 1300 kg/m3, density is 2.73 g/cm3) and quartz-feldspar sand according to GOST 8736 (Mkr = 3.4 and 2.9, density is 2.62 g/cm3) in a mixture with standard quartz monofractional sand. The additive/addition is a superplasticizer from a series of highly effective waterreducing ability of polycarboxylates (PCX). The density of the aqueous solution of PCX was 1082 g/dm3, the solids content was 412 mg/g.
The effectiveness of the silica sol addition (additive) was determined by the concrete strength. The watercement ratio was within the limits of W/C = 0.61–0.71, the sediment of the standard cone is ST = 12–19 sm, the SiO2 content is 2.0 % of the cement mass, the addition of the solution is PCX = 2.2–2.6 % of the mass of cement. Concrete tests were carried out according to GOST 30459-2003, item 7. The consumption of materials (kg/m3) is as follows: cement (PC 550) – 345±5; sand quartz-feldspar – 400; sand standard quartz – 400; crushed stone fraction 5–20 mm – 1060. The dosage of the sol was calculated taking into account the fact that there are 3500 g of cement and 2250 g of water in a batch of 10 liters in addition to crushed stone and sand.
Sol volume (VS) was calculated by the equation:
VS = C•SiO2/100•КSi, (1)
where C is the cement consumption, g; SiO2 – silica concentration, %; КSi is SiO2 content in the sol, g/dm3.
Thus, the sol volume per 10 liters of batch is:
VS = 3500•2/100•115 = 0.609 dm3.
This volume of sol contains 0.609 [dm3]×15 [g/dm3] = 70 g SiO2.The mobility of concrete mixtures was provided by means of an appropriate dosage of PCX. Technological and structural parameters of the quality of mixtures and concrete were determined according to the following standards: mobility, density of concrete mixture – GOST 10181; concrete density – GOST 12730.0; concrete compressive strength at the age of 1, 2 and 28 days of normal storage and after steam treatment (ST) in accordance with GOST 10180. The efficiency criteria were calculated by the Equation 2 GOST 30459-2003:
∆Rt = 100•(Rtb–RtR)/Rtb, (2)
where Rtb is concrete strength of basic composition in the equivalent age, MPa; RtR – concrete strength of the control composition in the equivalent age, MPa. The results of concretes tests with the addition/additive of silica sol in a combination with PCX are presented in Table 3.
According to the results obtained SiO2 nanoadditives can be applied: first, to accelerate the strength of concrete (more than twofold increase in strength after the first day of hardening); secondly, to increase strength at the age of 28 days – up to 40%. At W/C = 0.52–0.55 the silica sol introduction resulted in an increase of compressive strength of concrete at the age of 28 days at the cement SiO2 consumption: 0.5% – (+28), 1% – (+ 43%), 2% – (48%), 3% – (58.5%).
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
Table 3
Concrete test results with the addition (additive) of silica sol
(№ 66 and № 69 compositions are control, criterion of efficiency is in the brackets)
|
Set |
Composition number |
SiО2,% from C |
PCX (SVC 5Neu), % from C |
W/C |
Slump test, cm |
Mixture density, kg/m3 |
Compression strength, МPа |
«Early» strength (R1/R28), % |
||||
|
1 day |
2 days |
28 days |
Steam (1 day) |
Storage standard |
Steam |
|||||||
|
1 |
66 |
– |
– |
0.643 |
13 |
2345 |
6.8 |
12.0 |
26.6 |
– |
26 |
– |
|
67 |
2 |
0.95 |
0.715 |
10 |
2322 |
12.7 (+86%) |
19.8 (+65%) |
33.6 (+26%) |
– |
38 |
– |
|
|
68 |
2 |
1.06 |
0.643 |
18–20 |
2320 |
15.5 (+128%) |
– |
36.4 (+37%) |
– |
43 |
– |
|
|
2 |
69 |
– |
– |
0.62 |
16 |
2322 |
10.1 |
– |
28.5 |
19.7 |
35 |
69 |
|
70 |
2 |
0.91 |
0.61 |
18 |
2335 |
19.2 (+90%) |
– |
39.9 (+40%) |
26.6 (+35%) |
48 |
67 |
|
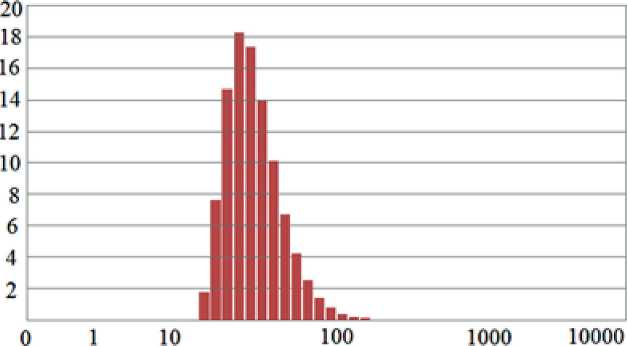
Fig. 3. Concrete strength under the compression: W/C = 0,715 (with SiO2 additive/addition = 2,0% wt., SiO2 content in sol – 115 g/dm3), W/C = 0,643 (without additive/addition), superplasticizer -polycarboxylate SVC 5Neu (1.06% wt.)
Chemisorption of Ca(OH)2 on amorphous silica-containing materials
The calcium oxide was obtained by the thermal decomposition of calcium carbonate (CaCO3, analytic grade) at 1000оC in the muffle furnace MP-8. The solution of hydrate of lime was obtained by resolution of calcium oxide in the distilled water with the subsequence centrifugal process in the centrifuge Sigma 2-16P (4500 rpm). The solution of calcium hydroxide was stored in the plastic bottle filled with argon. The concentration by CaO is 1.06 g/dm3. Characteristics of argon gas are 99.993%, superior grade, GOST 10157-79.
For the titrimetric determination of calcium, the solution of sodium hydroxide (2 N), solution of Trilon B (0.05 N), indicator murexide (high grade) were used. For determination of Ca2+ concentration, 1 ml of sample solution was pipetted to the conic flask (100 ml) for titration, then 10 ml of water, 2 ml of the sodium hydroxide solution and 20-30 ml of murexidev were added and the obtained sample was titrated by the Trilon B solution. A coloring at the final point of titration changed from pink to violet. The molar concentration (mol/l) was calculated by formula:
C CaO = V 1 •C 1 /(2•V 2 ), (3)
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ where V1 is the volume of Trilon B solution, C1 is the concentration of Trilon B solution and V2 is the volume of the sample solution.
Three different silica-containing materials (Geosil, CSF, Bryansk tripoli) were examined. Into the conic flask (250 ml, NS 29/32) with stir-bar Heidolph MR 3001, the test material in amounts of 0.5 to 0.6 g was placed, 250 ml of the calcium hydroxide solution with content by CaO 1.06 g/dm3 were added; the flask was filled with argon and plugged by a stopper. The experiment was executed with a daily agitation (5–10 hours) using the stir-bar. The samples with volumes of 1 ml were taken at intervals of 15 minutes, 5 h, 24 h, 3 days, 5 days etc.; at that, the solution of the calcium hydroxide in the flask was periodically renewed by 60-80% after preliminary centrifuging and the intermediate value of CaO in the renewed solution was determined. Upon completion of the experiment, the deposit was centrifuged (4500 rpm), and washed (for removal of probable precipitates of Ca(OH)2 at the surface of SiO2) by the cooled (8–12оC) distilled water to neutral pH. Then the deposit was centrifuged (4500 rpm), washed three times with acetone (analytic grade) for removal of water and dried in the vacuum cabinet at 50°C, 10 mm Hg. The accepted procedure of cleaning preparations from free Ca(OH)2 was confirmed by the absence of differencial thermogravimetry analyses (480оC) and X-Ray analyses (2.63, 4.93Å) reflexes. The obtained samples were soldered into the ampoules with argon atmosphere and analyzed.
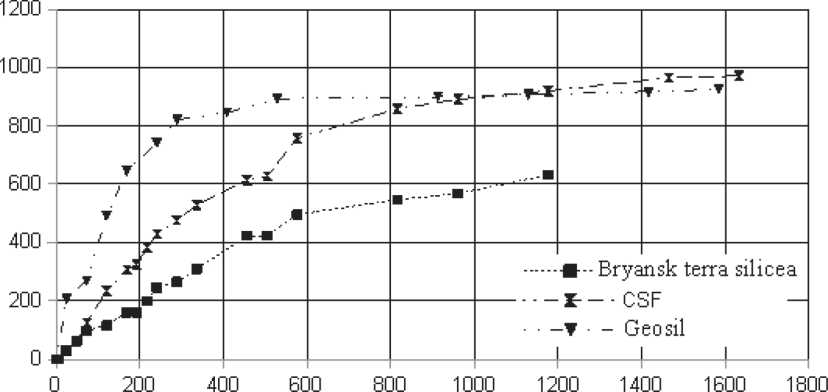
The data on binding of Ca(OH)2 by the amorphous silicon dioxides in the argon atmosphere (Fig. 4) were obtained. In different papers it was shown that the reaction between Ca(OH)2 and SiO2 proceeds according to a mechanism of chemisorptions [22, 23, 24] by securing the Ca2+ cation on the ionized surface silanol groups SiOH. A binding of Ca(OH)2 was faster realized on the Geosil sample having the greatest specific surface. The difference in binding of Ca(OH)2 between three samples was expressed especially strongly during the first hours of reaction. At a point in time of 200 h, a binding by CaO was about 680 mg of CaO/1 g of SiO2 for Geosil, 325 mg of CaO/1 g of SiO2 for CSF, 200 mg of CaO/1 g of SiO2 for tripoli. With the course of time, a flattening of curves in Fig. 4 took place.
Table 4 shows the final weight change of three different silica after the termination of the binding of CaO. According to table 4, the mass increment of Geosil and CSF samples after saturation was more than twice.
When increasing the mass after interaction with Ca(OH)2 in the composition of the samples, the pres-
Time, hour
Fig.4. Data on the kinetics of binding of CaO samples Geosil, CSF and Bryansk terra silicea
Table 4
Changes in the mass of drugs after saturation in lime water Ca(OH)2
|
Sorbent |
Specific surface area, m2/g |
initial weight, g |
weight after completion of sorption, g |
the increase of mass, time |
|
Geosil |
418 |
1.059 |
2.39 |
2.25 |
|
Microsilica CSF |
20 |
0.53 |
1.17 |
2.21 |
|
Bryansk terra silicea |
0.6 |
0.51 |
0.867 |
1.7 |
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
Table 5
Chemical composition (oxides) of the Geosil sample after interaction with Ca(OH)2 for 8 days (wt. %)
|
Spectrum |
In stats. |
Al |
Si |
Ca |
Total |
|
Spectrum 1 |
Yes |
29.83 |
26.15 |
55.98 |
|
|
Spectrum 2 |
Yes |
27.08 |
22.29 |
49.38 |
|
|
Spectrum 3 |
Yes |
26.77 |
22.71 |
49.47 |
|
|
Spectrum 4 |
Yes |
26.84 |
21.42 |
48.26 |
|
|
Spectrum 5 |
Yes |
0,33 |
30.82 |
26.74 |
57.89 |
|
Max. |
0,33 |
30.82 |
26.74 |
||
|
Min. |
0 |
26.77 |
21.42 |
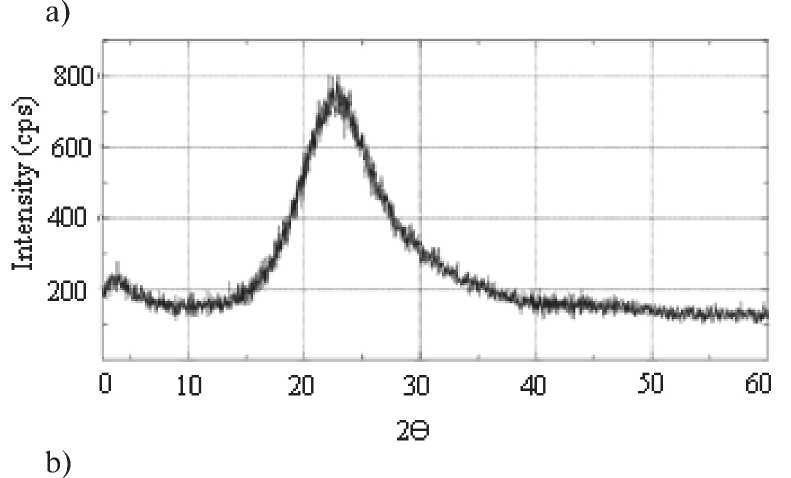
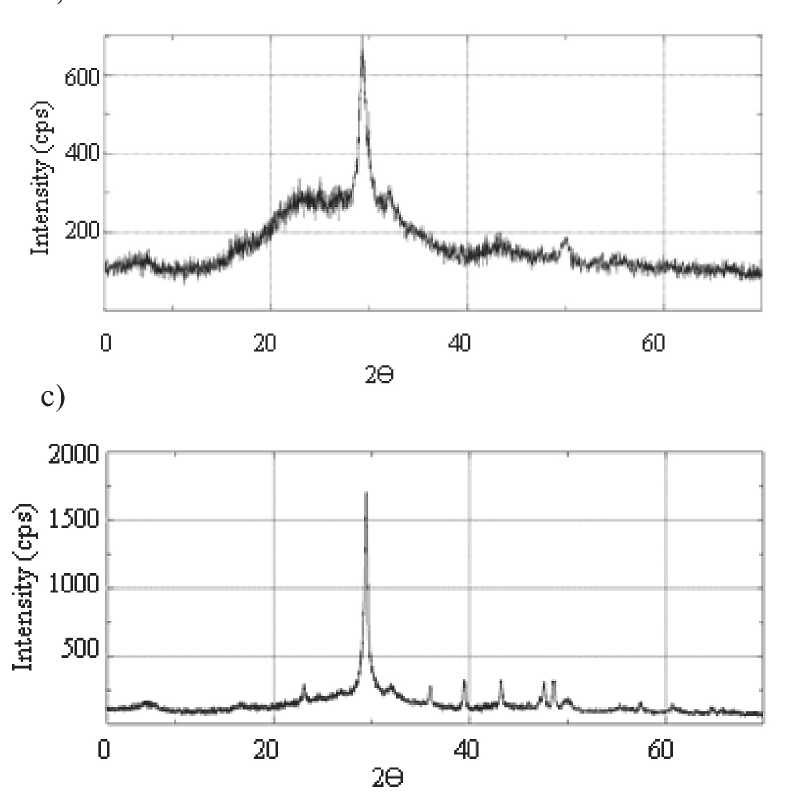
Fig. 5. Data of X-ray analysis of amorphous
SiO2 nanopowder into hydrosilicate (0,9–1,3) CaO•SiO2•H2O during a long interreaction of SiO2 (am) with Ca(OH)2 in argon medium: а – initial SiO2 nanopowder; b – interreaction material at the age of 8 days; c – interreaction material at the age of 69 days ence of significant amounts of Ca together with Si (Geosil sample, table. 5) can be observed.
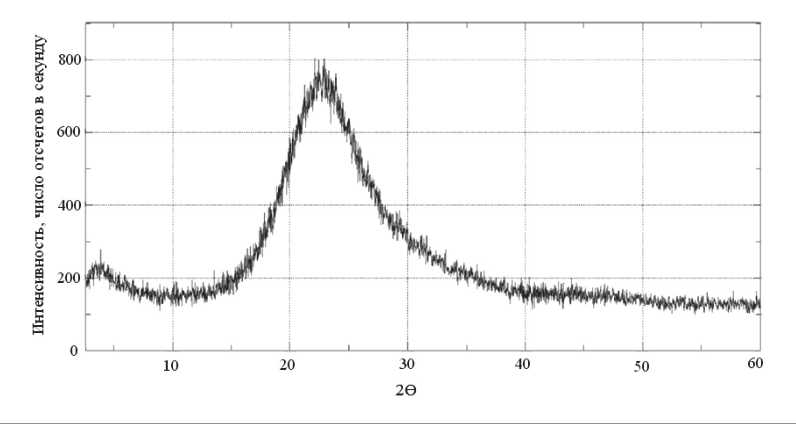
X-ray diffraction analysis illustrates the transformation of amorphous SiO2 to the crystalline CSH(I). The formation of Cao•SiO2•H2O crystals from amorphous SiO2 in Ca(OH)2 medium was confirmed by x-ray phase analysis (Fig. 5).
CONCLUSION
-
1. It was shown that sols and nanopowders SiO2 can be produced from hydrothermal solutions. Technological processes of nanosilica obtaining on basis of hydrothermal solutions include solution cooling to the specified temperature, polycondensation and nucleation of the orthosilicic acid and silica particles growth, the membrane concentration by the ultrafiltration and the cryochemical vacuum sublimation.
-
2. Nanosilica obtained on basis of a hydrothermal solution is applicable as an effective modifying additive/ addition for concretes: 1) to accelerate solidification; 2) to increase the concrete compressive strength at the age of 28 days.
-
3. Amorphous powder of hydrothermal nanosilica Geosil in lime medium has a high chemisorption activity for the absorption of Ca(OH)2, exceeding the chemisorption activity of other amorphous silica-containing materials (microsilica CSF, Bryansk terra silicea) with a smaller specific surface area. The chemisorption activity established in the experiment is higher in materials with a larger specific surface area: Bryansk terra silicea – CSF-Geosil increases in the series. Pozzolanic reaction is accompanied by very rapid emergence of nano-disperse sedimentation stability of the particles hydrosilicate composition xCaO•ySiO2•zH2O – as the product of the reaction SiO2+Ca(OH)2 → CSH. The products of the Geosil reaction with Ca(OH)2 contain a significant amount of the element Ca together with Si. Measurements of the mass of the reaction product before and after the pozzolan reaction showed more than a twofold increment, which is consistent with the scheme of the above reaction.
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
ВВЕДЕНИЕ
В настоящее время наблюдается рост потребления промышленностью и строительной индустрией различных типов аморфного кремнезема, в частности, SiO2, в нанодисперсной форме (золей, гелей и нанопорошков). Их новый источник – гидротермальные растворы, извлекаемые на поверхность в районах активного вулканизма [1, 2, 3].
Результаты, полученные с помощью методов нанотехнологий, позволили сформировать новые представления о кинетике образования и структуры геля гидратов силиката кальция – C–S–H (размеры, форма, плотность и др.) [4]. На малом масштабе (1–5 нм) гель C–S–H имеет слоевую структуру, а слои – тенденцию к скоплению в компактные домены, в которых расстояния между отдельными слоями C–S–H составляют порядка нескольких нанометров. На большем масштабе (от 5 до 100 нм) домены формируют трехмерные структуры, имеющие форму диска, размерами 60х30х5 нм (5 нм – толщина, 60 нм – длина оси диска) – так называемые C–S–H-частицы. В ходе процесса гидратации увеличивается количество C–S–H частиц, частицы агрегируют, образуя три разновидности аморфного C–S–H геля на микроуровне (1 мкм): 1) C–S–H-гель с низкой плотностью; 2) C–S–H-гель с высокой плотностью; 3) C–S–H-гель с ультравысокой плотностью. Три разновидности геля C–S–H демонстрируют различные механические свойства: C–S–H-гель с высокой и ультравысокой плотностью имеет большие жесткость и твердость по сравнению с гелем C–S–H с низкой плотностью. Гель C–S–H не имеет фиксированной стехиометрии, химический состав геля меняется от точки к точке внутри объема замеса, поэтому гель C–S–H характеризуют отношением Ca/Si. По данным сканирующей электронной микроскопии и трансмиссионной электронной микроскопии, отношение Ca/Si варьирует внутри C–S–H-геля в пределах 0,6–2,0.
Наночастицы, обладающие большой удельной поверхностью (до 1000 м2/г), отличаются высокой химической активностью [5–21]. Они могут действовать как центры, ускоряющие реакции гидратации, а также как нанонаполнитель, уменьшая межзерновую микропористость цементов в бетоне.
Целями данной работы было показать: 1) возможность применения наночастиц гидротермального кремнезема для повышения прочности при сжатии портландцементных бетонов; 2) одним из главных факторов повышения прочности бетона при вводе гидротермального нанокремнезема является реакция пуццоланового типа между поверхностью аморфных наночастиц SiO2 и гидроксидом кальция (портлан-дит Ca(OH)2 – продукт гидратации цементных минералов: трехкальциевого (алит) и двухкальциевого (белит) силикатов кальция).
ОСНОВНАЯ ЧАСТЬ
Получение гидротермальных золейи нанопорошков SiO2 и их характеристики
Эксперименты по мембранному концентрированию нанокремнезема в гидротермальной среде были проведены на площадках действующих геотермальных электрических станций – Мутновской ГеоЭС (50 МВт) и Верхне-Мутновской ГеоЭС (12 МВт). При расходе жидкой фазы теплоносителя продуктивных скважин Мутновской ГеоЭС 1100–1200 т/ч и содержании SiO2 в исходной водной среде 400– 800 мг/кг потенциал по производству нанокремнезема SiO2 равен 3–5 тыс. т/год. Кроме кремнезема в исходном растворе находится ряд других компонентов (табл. 1).
Продуктивные скважины геотермальных электрических станций выводят на поверхность теплоносителя в виде пароводяной смеси с массовым паросодержанием 0,2-0,3. В сепараторах паровая фаза отделяется и подается на паровую турбину для выработки электроэнергии. Жидкая фаза (сепарат) направляется в расширители, в конечных ступенях которых давление падает до 0,1 МПа (100оС), далее направляется в теплообменники, в которых температура доводится до 20–70оС, затем переводится в танк для старения гидротермального раствора и поликонденсации молекул ортокремниевой кислоты (ОКК) и роста частиц SiO2. После вывода раствора на поверхность давление и температура снижаются, раствор становится пересыщенным относительно растворимости аморфного кремнезема, в нем про-
Таблица 1
Концентрация основных компонентов исходного гидротермального раствора (сепарат продуктивных скважин Мутновской ГеоЭС), pH = 9,2
|
Компонент |
Nа+ |
К+ |
Li+ |
Са2+ |
Мg2+ |
Fe 2+, 3+ |
Al3+ |
Сl– |
SO42 |
HCO3– |
CO32– |
H3BO3 |
SiO2 |
|
Концентрация, мг/дм3 |
282 |
48,1 |
1,5 |
2,8 |
4,7 |
< 0,1 |
< 0,1 |
251,8 |
220,9 |
45,2 |
61,8 |
91,8 |
780 |
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ ходят гидролиз и поликонденсация молекул ОКК, приводящие к формированию сферических наночастиц SiO2 с диаметрами от 5–100 нм.
Конечные размеры частиц кремнезема зависят в первую очередь от температуры и pH, при которых проходит поликонденсация молекул ОКК. Повышение температуры поликонденсации и снижение pH приводят к увеличению конечных размеров частиц. Для формирования частиц SiO2 с заданными размерами и концентрацией на стадии поликонденсации температуру варьировали в пределах от 20 до 90оС при pH = 9,0–9,2.
Водные золи кремнезема получали из сепарата после завершения поликонденсации ОКК 3-ступенчатым концентрированием частиц SiO2 c помощью ультрафильтрационных мембран из полиэфирсуль-фона с параметром минимальной отсекаемой массы
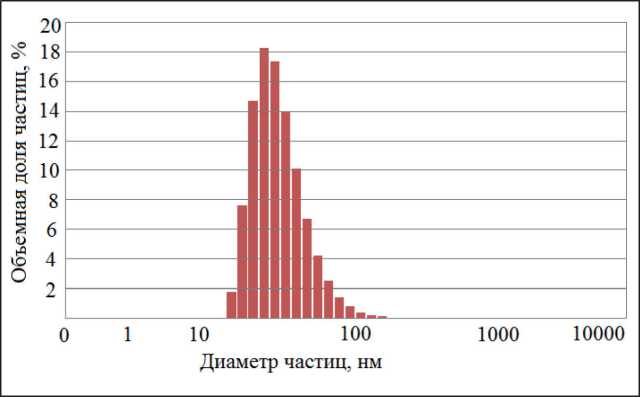
Рис. 1. Распределение размеров наночастиц в образце золя кремнезема частиц MWCO = 50 кДа: на 1-й ступени содержание SiO2 в золе повышали от 0,05 до 0,3–0,4 мас.%, на 2-й - до 10 мас.%, на 3-й ступени – до 20– 30 мас.% и выше.
Для получения нанопорошков золи диспергировали, мелкие капли отверждали в жидком азоте при температуре –196оC и получали криогранулы, которые сублимировали в вакуумной камере при давлениях 0,02-0,05 мм рт. ст. Мелкие размеры капель золя, высокая поверхность теплообмена позволили в итоге достичь быстрого твердения и отсутствия слипания частиц: размеры частиц в порошках не превышали размеры частиц в золях. Удельный расход электроэнергии при производстве золей составляет 0,18–1,0 кВт•ч/кг SiO2, суммарные затраты электроэнергии на получение нанопорошка – 7,0– 14,3 кВт•ч/кг SiO2.
Для изучения характеристик золей, исходных порошков и продуктов их взаимодействия с известью использовали методы динамического рассеяния света и электрофоретического рассеяния света (Zetasizer в, Malvern, Великобритания), сканирующей электронной микроскопии (JEM-100CX, JEOL, Япония), низкотемпературной адсорбции азота (ASAP-2010, Micromeritics, США), рентгенофазового анализа (ARL X’TRA, Thermo Scientific, Швейцария) и минидифрактометр Miniflex, Rigaku, Япония.
Химический состав образцов определялся на микроанализаторе JXA8100, Джеол, Япония, оснащенном тремя волновыми спектрометрами и ЭДС приставкой INCAx-sight, Оксфорд, Великобритания. Рабочее напряжение 20kV, ток 1*10-8 А. Определяемые элементы от В до U.
Таблица 2
Физико-химические характеристики водных золей кремнезема, полученных ультрафильтрационным мембранным концентрированием
|
Характеристики |
Значения |
|
pH |
8,0–9,2 |
|
Общее содержание SiO2, г/дм3 |
3,0–940,0 |
|
Плотность золя ρs, г/дм3 |
1000–1510 |
|
Средние значения диаметров наночастиц, нм |
5–100 |
|
Солесодержание TDS, мг/дм3 |
800–2000 |
|
Удельная электропроводность σm, мСм/см (20оС) |
0,8–1,56 |
|
Средние значения дзета-потенциала ξ поверхности наночастиц, мВ |
–25,0…–56,0 |
|
Динамическая вязкость η, мПа•с (20оС) |
1,0–120,0 |
|
Содержание SiO2 в веществе, осажденном из золя, мас.% |
до 99,72 |
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ

Рис. 2. ТЭМ-изображения наночастиц порошка кремнезема
Термогравиметрический анализ (ДТГА) проводили в закрытых Pt-тиглях на дериватографе OD 102 (Венгрия) при чувствительностях по ТГ – 50 мг и по ДТГА – 1/5 до температуры 920–940оС.
Распределение частиц золей по размерам определяли методом динамического светорассеяния, дзета-потенциал частиц – методом электрофореза. На рис. 1 приведены результаты определений для одного из образцов золя, имевшего следующие характеристики: плотность золя ρs = 1080 г/дм3, содержание SiO2 = 150 г/дм3, pH= 8,6, среднее значение диаметра частиц SiO2 dm = 41,6 нм, среднее значение дзета-потенциала поверхности частиц SiO2 ξm = –28,2 мВ).
В табл. 2 приведен диапазон характеристик золей SiO2, в котором могут варьироваться их значения с помощью температуры на стадии поликонденсации ОКК и ультрафильтрационного мембранного концентрирования.
На рис. 2 приведены ТЭМ-изображения частиц нанопрошка, полученного криохимическим вакуумным сублимированием образца золя.
Разработанный нами технологический режим позволяет варьировать характеристики ме-зопористых порошков в следующих пределах: удельную поверхность – от 100 до 500 м2/г, объем пор – 0,20–0,30 см3/г, средний диаметр пор порошка – от 2 до 15 нм, средние диаметры частиц – от 5 до 100 нм, плотность поверхностных силанольных групп – до 4,9 нм–2, остаточную влажность – до 0,2 мас.%, насыпную плотность - 0,02– 0,30 кг/дм3.
Применение нанокремнезема для повышения прочности бетонов
Нами проведены эксперименты по изучению влияния наночастиц кремнезема на прочность при сжатии бетонов (цемент–песок–вода–щебень) вводом золя SiO2.
В качестве вяжущего применялся портландцемент (ПЦ) корейского производства класса 42,5R, соответствующий стандартам России для портландцементов. По ГОСТ 31108–2003 он классифицируется как тип ЦЕМ-I на основе клинкера с измеренными нами содержанием С3S = 55–58%, С3А = 8,2–8,5% и обычными химико-минералогическими показателями качества клинкера (коэффициент насыщения известью КН = 90–91%, глиноземный модуль p = 1,7, силикатный модуль n = 2,3). Физико-механические характеристики (марка, остаток на сите № 008, сроки схватывания, предел прочности при сжатии) находятся в пределах требований стандарта к бы-стротвердеющему портландцементу марки ЦЕМ I класса 42,5Б. Заполнителями служили щебень диоритовый фракции от 5 до 20 мм по ГОСТ 8267 (насыпная плотность 1300 кг/м3, плотность 2,73 г/см3) и песок кварц-полевошпатовый по ГОСТ 8736 (Мкр = 3,4 и 2,9, плотность 2,62 г/см3) в смеси со стандартным кварцевым монофракционным песком. Добавка – суперпластификатор из серии высокоэффективных по водоредуцирующей способности поликарбоксилатов (ПКК). Плотность водного раствора ПКК составляла 1082 г/дм3, содержание сухого вещества – 412 мг/г.
Эффективность действия добавки золя кремнезема определяли по прочности бетонов. Водоцементное отношение было в пределах В/Ц = 0,61–0,71, осадка стандартного конуса ОК = 12–19 см, содержание SiO2 = 2,0% от массы цемента, добавка раствора ПКК = 2,2–2,6% от массы цемента. Испытания бетона проведены по ГОСТ 30459–2003 п. 7. Расход материалов (кг/м3) следующий: цемент (ПЦ 550) – 345±5; песок кварц-полевошпатовый – 400; песок стандартный кварцевый – 400; щебень фракции 5–20 мм – 1060. Дозировку золя рассчитывали с учетом того, что в замес объемом 10 л кроме щебня и песка входит 3500 г цемента и 2250 г воды.
Объем ( VЗ ) золя рассчитывался по формуле:
VЗ = Ц•SiO2/100•КSi, (1)
где Ц – расход цемента, г; SiO2 – концентрация кремнезема, %; КSi – содержание SiO2 в золе, г/дм3.
Таким образом, объем золя в расчете на 10 л замеса составляет:
VЗ = 3500•2/100•115 = 0,609 дм3.
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
Такой объем золя содержит 0,609 [дм3] × 115 [г/дм3] = 70 г SiO2.
Равноподвижность бетонных смесей обеспечивали с помощью соответствующей дозировки ПКК. Определение технологических и строительно-технических показателей качества смесей и бетона производилось по методикам следующих стандартов: подвижность, плотность бетонной смеси – ГОСТ 10181; плотность бетона – ГОСТ 12730.0; прочность бетона при сжатии в возрасте 1, 2 и 28 сут нормального хранения и после тепловлажностной обработки (ТВО) по ГОСТ 10180.
Критерии эффективности рассчитывали по формуле 2 ГОСТ 30459-2003:
∆Rt = 100•(Rtосн.–Rtконтр.)/Rtосн., (2)
где Rtосн. – прочность бетона основного состава в эквивалентном возрасте, МПа; Rtконтр. – прочность бетона контрольного состава в эквивалентном возрасте, МПа.
Результаты испытаний бетонов с добавкой золя кремнезема в сочетании с ПКК представлены в табл. 3.
Согласно полученным результатам (рис. 3), нанодобавки SiO2 применимы: во-первых, для ускорения набора прочности бетона (более чем двукратное повышение прочности после первых суток твердения); во-вторых, для повышения прочности в марочном
Таблица 3
Результаты испытаний бетонов с добавкой золя кремнезема
(составы № 66 и № 69 – контрольные, в скобках – критерии эффективности)
|
Серия |
№ состава |
SiО2,% от Ц |
ПКК (SVC 5Neu), %, от Ц |
В/Ц |
ОК, см |
Плотность смеси, кг/м3 |
Прочность при сжатии, МПа |
«Ранняя» прочность (R1/R28), % |
||||
|
1 сутки |
2 суток |
28 сут |
ТВО |
Норм. хран. |
Пар |
|||||||
|
1 |
66 |
– |
– |
0,643 |
13 |
2345 |
6,8 |
12,0 |
26,6 |
– |
26 |
– |
|
67 |
2 |
0,95 |
0,715 |
10 |
2322 |
12,7 (+86%) |
19,8 (+65%) |
33,6 (+26%) |
– |
38 |
– |
|
|
68 |
2 |
1,06 |
0,643 |
18–20 |
2320 |
15,5 (+128%) |
– |
36,4 (+37%) |
– |
43 |
– |
|
|
2 |
69 |
– |
– |
0,62 |
16 |
2322 |
10,1 |
– |
28,5 |
19,7 |
35 |
69 |
|
70 |
2 |
0,91 |
0,61 |
18 |
2335 |
19,2 (+90%) |
– |
39,9 (+40%) |
26,6 (+35%) |
48 |
67 |
|
Рис. 3. Предел прочности бетона при сжатии: В/Ц = 0,715 (с добавкой SiO2 = 2,0 мас.%, содержание SiO2 в золе – 115 г/дм3, суперпластификатор - поликарбоксилат SVC 5Neu (0,95 мас.%)), В/Ц = 0,643 (без добавки)
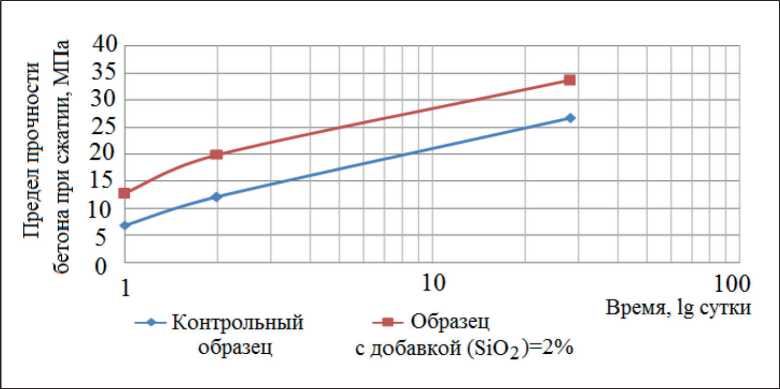
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ возрасте 28 сут - до 40%. При В/Ц = 0,52–0,55 ввод золя кремнезема приводил к повышению прочности бетона при сжатии в возрасте 28 сут при расходах SiO2 по цементу: 0,5% – (+28%), 1% – (+43%), 2% – (+48%), 3% – (+58,5%).
Хемосорбция Ca(OH)2 на аморфных кремнеземсодержащих материалах
Оксид кальция получали термическим разложением карбоната кальция (CaCO3, чда) при 1000оC в муфельной печи МП-8. Раствор гидроксида кальция получали растворением оксида кальция в дистиллированной воде с последующим центрифугированием на центрифуге Sigma 2-16P (4500 об/мин). Раствор гидроксида кальция хранился в пластиковой бутылке, заполненной аргоном. Концентрация по CaO 1,05 г/дм3. Газ аргон (99,993%, сорт высший ГОСТ10157-79).
Для титрометрического определения кальция использовались: раствор гидроксида натрия (2 N), раствор трилона Б (0,05 N), индикатор мурексид (хч). Для определения концентрации Ca2+ отбирали пипеткой 1 мл анализируемого раствора в коническую колбу (100 мл) для титрования, прибавляли 10 мл воды, 2 мл раствора гидроксида натрия, 20–30 мг му-рексида и титровали раствором трилона Б. Окраска в конечной точке титрования изменялась от розовой к фиолетовой. Молярную концентрацию (моль/л) кальция рассчитывали по формуле:
CCa = V1•C1/(2•V2), (3)
где V1 – объем раствора трилона Б, C1 – концентрация раствора трилона Б, V2 – объем анализируемого раствора.
Изучали три различных кремнеземсодержащих материала: Геосил, CSF, брянский трепел. В коническую колбу (250 мл, NS 29/32) с магнитным мешаль-ником Heidolph MR 3001 помещали исследуемый материал в количестве от 0,5 до 0,6 г, наливали 240 мл раствора гидроксида кальция с содержанием по CaO 1,06 г/дм3, заполняли аргоном и закрывали стеклянной пробкой. Эксперимент проводили при ежедневном (по 5–10 часов) перемешивании на магнитной мешалке. Пробу отбирали по 1 мл с интервалами 15 мин, 5 ч, 24 ч, 3 д, 5 д и т.д., при этом раствор гидроксида кальция в колбе периодически обновляли на 60–80% после предварительного центрифугирования и устанавливали промежуточное значение CaO обновленного раствора. По окончании эксперимента осадок центрифугировали (4500 об/мин), промывая (для удаления вероятных осадков Ca(OH)2 на поверхности SiO2), охлажденной (8–12оC) дистиллированной водой до нейтрального pH. Затем осадок центрифугировали (4500 об/мин), промывая три раза ацетоном (чда) для удаления воды, и сушили в вакуумном шкафу при 50оC, 10 мм рт. ст. Принятая схема очистки препаратов от свободного Ca(OH)2 подтвердилась отсутствием рефлексов ДТГА (480оС) и РФА (2,63, 4,93Å). Выделенные образцы запаяли в ампулы в атмосфере аргона и подвергали анализам.
Получены данные по связыванию Ca(OH)2 аморфными кремнеземами в атмосфере аргона (рис. 4). В различных работах показано, что реакция между Ca(OH)2 и SiO2 идет по механизму хемосорбции [22, 23, 24] закреплением катиона Ca2+ на ионизованных поверхностных силанольных группах SiOH. Связывание Ca(OH)2 быстрее проходило на образце Геосил, имеющем наибольшую удельную поверхность. Особенно сильно разность в связывании Ca(OH)2 между тремя образцами была выражена
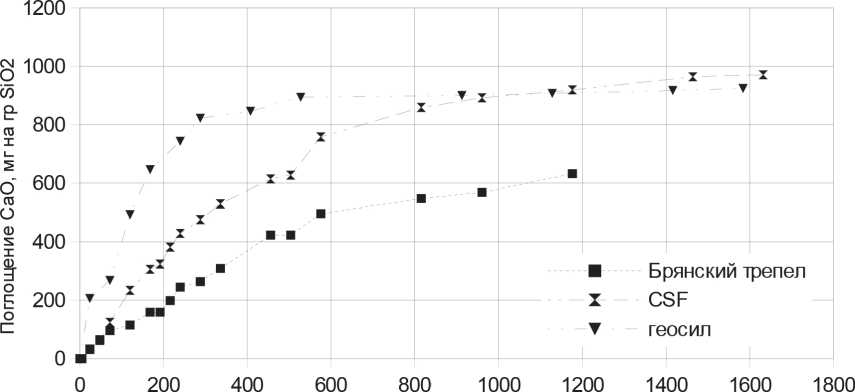
Время,час
Рис. 4. Данные по кинетике связывания CaO образцами Геосил, CSF и трепел
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
Таблица 4
Изменение массы препаратов после насыщения в известковой воде Ca(OH)2
|
Сорбент |
Удельная площадь поверхности, м2/г |
Исходная масса, г |
Масса после завершения сорбции, г |
Приращение массы, раз |
|
Геосил |
418 |
1,059 |
2,39 |
2,25 |
|
Микрокремнезем CSF |
20 |
0,53 |
1,17 |
2,21 |
|
Трепел (брянский) |
0,6 |
0,51 |
0,867 |
1,7 |
Таблица 5
Химический состав (оксиды) образца Геосил после взаимодействия с Ca(OH)2 в течение 8 суток (мас. %)
В табл. 4 показано конечное изменение массы трех различных кремнеземов после прекращения связывания CaO. Согласно данным таблицы 4, приращение массы образцов Геосил и CSF после насыщения составляло более, чем в два раза.
При увеличении массы после взаимодействия с Ca(OH)2 в составе образцов установлено присутствие вместе с Si значительных количеств Ca (образец Геосил, табл. 5).
Рентгенофазовым анализом проиллюстрировано преобразование аморфного SiO2 в кристаллогидрат CSH(I). Факт образования кристаллов СаО•SiO2•H2O из аморфного SiO2 в среде Ca(OH)2 подтвержден с помощью рентгенофазового анализа (рис. 5).
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
б)
в)
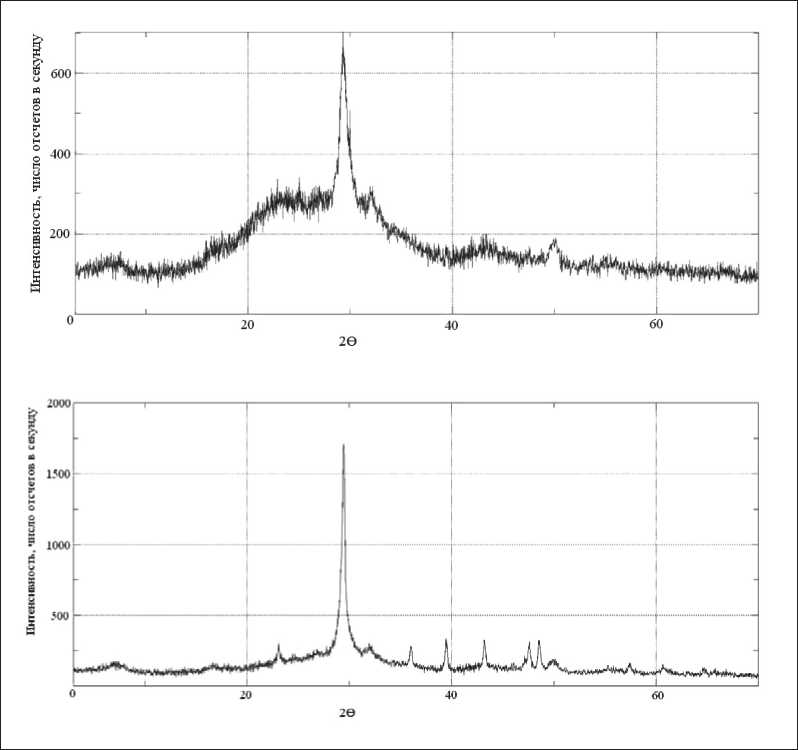
Рис. 5. Данные рентгенофазового анализа преобразования аморфного нанопорошка SiO2 в гидросиликат (0,9–1,3) CaO•SiO2•H2O в процессе длительного взаимодействия SiO2 (ам.) с Ca(OH)2 в среде аргона: а – исходный нанопорошок SiO2; б – продукт взаимодействия в возрасте 8 сут; в – продукт взаимодействия в возрасте 69 сут.
ЗАКЛЮЧЕНИЕ
-
1. Показано, что из гидротермальных растворов можно выделять золи и нанопорошки SiO2. Технологические процессы получения нанокремнезема включают охлаждение раствора до заданной температуры, нуклеацию и поликонденсацию ортокремние-вой кислоты и рост частиц кремнезема, мембранное концентрирование ультрафильтрацией и криохими-ческую вакуумную сублимацию.
-
2. Нанокремнезем, полученный на основе гидротермального раствора, применим как эффективная модифицирующая добавка для бетонов: 1) для ускорения твердения; 2) повышения предела прочности бетона при сжатии в марочном возрасте 28 сут.
-
3. Аморфный порошок гидротермального нанокремнезема Геосил в известковой и цементной среде обладает высокой хемосорбционной активно-
- стью по поглощению Ca(OH)2, превышающей хемо-сорбционную активность других аморфных крем-неземсодержащих материалов (микрокремнезем CSF, брянский трепел) с меньшей удельной поверхностью. Установленная в эксперименте хемосорб-ционная активность выше у материалов с большей удельной поверхностью: возрастает в ряду брянский трепел-CSF-Геосил. Пуццолановая реакция сопровождается очень быстрым возникновением нано-дисперсных седиментационно устойчивых частиц гидросиликатного состава xCaO•ySiO2•zH2O – как продукт реакции SiO2+Ca(OH)2 → CSH. В продуктах реакции Геосила с Ca(OH)2 содержится значительное количество элемента Ca вместе с Si. Имерения массы продукта реакции до и после прохождения пуццолановой реакции показали более чем двухкратное ее приращение, что согласуется со схемой вышеуказанной реакции.
RESEARCH RESULTS OF THE LEADING SCIENTISTS • РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВЕДУЩИХ УЧЕНЫХ
Список литературы Модифицирование бетона гидротермальным нанокремнеземом
- Лесовик В.С., Потапов В.В., Алфимова Н.И. Повышение эффективности вяжущих за счет использования нано-модификаторов // Строительные материалы. – 2011. – № 6. – С. 12–18.
- Потапов В.В., Туманов А.В., Закуражнов М.С. и др. Повышение прочности бетона за счет ввода наночастиц SiO2 // Физика и химия стекла. – 2013 . – Т. 39, № 4. – С. 611–617.
- Потапов В.В., Сердан А.А., Кашпура В.Н. и др. Получение и свойства нанокремнезема на основе гидротермального раствора // Химическая технология. – 2017. – № 2. – С. 65–73.
- Sobolev K., Ferrada Gutierrez M. How Nanotechnology Can Change the Concrete World. American Ceramic Society Bulletin. 2005;10:14-19.
- Sobolev K. et al, «Development of nano-SiO2 based admixtures for high-performance ce-ment-based materials» // Progress report. CONACYT. Mexico. 2006. 340 P.
- Sobolev K., Flores I., Hermesillo K., Torres-Martinez L.M. Nanomaterials and nanotech-nology for high-performance cement composites // Proceedings of ASI Session on «Nanotechnology Concrete: Recent Developments and Future Perspectives». November 7. 2006. Denver. USA. 296 P.
- Sanchez F., Sobolev K. Nanotechnology in concrete – A review // Construction and Build-ing Materials. No. 24. 2010. P. 2060–2071.
- Yang T., Keller B., Magyari E. AFM investigation of cement paste in humid air at different relative humidities // J. Phys. D.: Appl. Phys. 2002. P. 25–28.
- Beaudoin J., Raki L., Alizadeh R. A 29Si MAS NMR study of modified C–S–H nanostruc-tures // Cem. Concr. Compos. 2009. V. 31(8). P. 585–90.
- Jennings H.M. Refinements to colloid model of C–S–H in cement: CM-II // Cem. Concr. Res. 2008. V. 38(3), P. 275–289.
- Bordallo H.N., Aldridge L.P., Desmedt A. Water dynamics in hardened ordinary Portland cement paste or concrete: from quasielastic neutron scattering // J. Phys. Chem. 2006. V. 110(17). P. 966–976.
- Faucon P., Delaye J., Virlet J., Jacquinot J., Adenot F. Study of the structural properties of the C–S–H(I) by molecular dynamics simulation // Cem. Concr. Res. 1997. V. 27(10). P. 1581–1590.
- Bjornstrom J., Martinelli A., Matic A., Borjesson L., Panas I. Accelerating effects of col-loidal nano-silica for beneficial calcium–silicate–hydrate formation in cement // Chem. Phys. Lett. 2004. V. 392(1–3). P. 242–248.
- Li H., Zhang M-H., Ou J-P. Flexural fatigue performance of concrete containing nano-particles for pavement // Int. J. Fatig. 2007. V. 29(7). P. 1292–1301.
- Abdoli N., Arefi R., Mollaahmadi E., Abdollahi B. To study the effect of adding Fe2O3 nanoparticles on the morphology properties and microstructure of cement mortar // Life Science Journal. 2011. V. 8(4). P. 550–554.
- Li Z., Wang H., He S., Lu Y., Wang M. Investigations on the preparation and mechanical properties of the nano-alumina reinforced cement composite // Mater. Lett. V. 2006. V. 60(3). P. 356–359.
- Nazari A., Riahi H. The effects of ZrO2 nanoparticles on physical and mechanical proper-ties of high strength self compacting concrete // Materials Research. 2010. V.13. No. 4. P. 1–13.
- Nazari A., Riahi H. Effects of CuO nanoparticles on compressive strength of self-compacting concrete // Sadhana. V. 36. Part 3. June 2011. P. 371–391.
- Chang T.-P., Shih J.-Y., Yang K.-M., Hsiao T.-C. Material properties of Portland cement paste with nano-montmorillonite // J. Mater. Sci. 2007. V. 42(17). P. 7478–7487.
- Kuo W.-Y., Huang J.-S., Lin C.-H. Effects of organo-modified montmorillonite on strengths and permeability of cement mortars // Cem. Concr. Res. 2006. V. 36(5). P. 886–895.
- Lee J., Kriven M. Synthesis and hydration study of Portland cement components prepared by the organic steric entrapment\ method // Mater. Struct. 2005. V. 8(1). P. 87–92.
- Бутт Ю.М., Рашкович Л.Н. Твердение вяжущих при повышенных температурах. – М.: Издательство литературы по строительству, 1965. – 222 с.
- Ли Ф.М. Химия цемента и бетона. – М.: Стройиздат, 1961. – 645 с.
- Ефименко Ю.В., Кузнецова Л.А., Антропова В.А. Особенности влияния микро-кремнезема на структуру мелкозернистого керамзитобетона литьевой консистенции // Наука и технология силикатных материалов – настоящее и будущее: тр. междунар. конф. – М.: ЦПС, 2003. – С. 98–106.


