Модифицирование поверхности микрореакторов микрофлюидного чипа для проведения полимеразно-цепной реакции в режиме реального времени
Автор: Сляднев М.Н., Лаврова М.В., Еркин М.А., Новолоцкий Д.В., Крисько А.В., Ганеев А.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Материалы научного семинара "Микрочиповые технологии в аналитической химии"
Статья в выпуске: 3 т.17, 2007 года.
Бесплатный доступ
Статья посвящена оптимизации микрофлюидной аналитической системы (МФАС), предназначенной для осуществления полимеразно-цепной реакции в режиме реального времени (ПЦР-РВ) в стеклянно-кремниевом микрочипе, содержащем 16 микрореакторов объемом 1.3 мкл каждый. Приведены оценки методов модифицирования поверхности микрореакторов и доказано, что предложенное полимерное покрытие на основе полиметилметоксисилоксана позволяет предотвратить ингибирование ПЦР. Предложенная методика модифицирования позволила создать высокий контактный угол смачивания кремниевой поверхности водой и значительно снизить время подготовки микрочипа к анализу. Проведенные оценки показали, что созданная мультиреакторная ПЦР-МФАС позволяет осуществлять определение ДНК методом ПЦР-РВ с эффективностью, равной теоретическому пределу.
Короткий адрес: https://sciup.org/14264495
IDR: 14264495 | УДК: 543.42;
Текст научной статьи Модифицирование поверхности микрореакторов микрофлюидного чипа для проведения полимеразно-цепной реакции в режиме реального времени
Микрофлюидные аналитические системы (МФАС) приобретают большую актуальность в области аналитической химии благодаря своим уникальным характеристикам. МФАС широко используют для интеграции нескольких стадий анализа в едином устройстве, для ускорения аналитических операций за счет высоких тепловых и массовых градиентов и для снижения объемов дорогостоящих реагентов [1–7]. Сейчас уже существует много экспериментальных МФАС для самых различных целей [9–12], однако одной из наиболее часто решаемых при помощи МФАС задач, относящейся к области биоаналитической химии, является реализация полимеразно-цепной реакции (ПЦР) [13–15]. Интерес к созданию ПЦР-МФАС связан с возможностью значительного увеличения скоростей нагрева/охлаждения реакционной смеси, что в свою очередь приводит к росту экспресс-ности анализа и снижению вероятности протекания побочных реакций [16] по сравнению со стандартным инерционным ПЦР-оборудованием. Снижение расхода дорогостоящих реагентов за счет МФАС позволяет снизить стоимость единичного анализа.
К достоинствам МФАС относят высокое соотношение площади поверхности к объему (SVR), что является ключевым фактором при проведении многих аналитических процессов. Однако большое SVR приводит к инактивации компонентов ПЦР-смеси, что в конечном итоге приводит к ин- гибированию ПЦР. В зависимости от выбора материала микрочипа ингибирование ПЦР вызывается не только большим SVR, но и ингибиторным влиянием материала микрочипа [15, 17]. Наибольшее ингибиторное влияние на ПЦР имеет кремний — материал, высокий коэффициент теплопроводности которого делает его привлекательным для создания ПЦР-МФАС. В литературе уделяют большое внимание созданию различных вариантов модифицирующих покрытий внутренней поверхности микрореакторов [15, 17–20].
Отметим, что большинство исследователей не продемонстрировали влияния типа модифицирующего покрытия на эффективность протекания реакции, которую можно оценить только при детектировании продуктов ПЦР в режиме реального времени (ПЦР-РВ). Метод ПЦР-РВ имеет уникальное преимущество по сравнению с гель-электрофорезом или методом конечной точки — возможность количественной оценки начальной концентрации ДНК в пробе по кинетической кривой ПЦР [21]. После получения кинетических кривых ПЦР и оценки величин пороговых циклов ( C t ) становится возможным определение эффективности реакции.
Настоящая статья посвящена выявлению сорбирующегося компонента реакции при использовании различных типов модифицирующих покрытий, оценке влияния типа модифицирующего покрытия на величину порогового цикла реакции, оценке эффективности ПЦР, полученных при проведении реакции в микрореакторах созданного микрочипа; разработке и оптимизации мультире-акторной микрофлюидной системы для определения ДНК методом ПЦР-РВ и сравнению достигнутых характеристик созданной ПЦР-МФАС со стандартным ПЦР-РВ оборудованием.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Топология ПЦР-микрочипа
Предложенный нами ранее стеклянно-крем-ниевый ПЦР-микрочип характеризовался: небольшим количеством микрореакторов (9 микрореакторов); наличием гидродинамической связи между микрореакторами, что приводило к перемешиванию проб при проведении термоциклирования; большими линейными размерами входных и выходных отверстий, что приводило к частичному испарению проб при термоциклировании; низкой эффективностью использования всего объема пробы (5 %) [22, 23], что при малой концентрации ДНК в пробе приводило к ложноположительным результатам анализа; перепадом глубин между микрореактором и каналом, что приводило к образованию пузырьков воздуха при вводе проб в микрореакторы. На основании выявленных ограничений в настоящей работе разработали новую топологию стеклянно-кремниевого микрочипа (см. рис. 1, а).
Микроструктуры в ПЦР-чипах изготовлены методом анизотропного химического травления кремниевых пластин (ЗАО "Светлана-полупро-водники", Россия). Ширина микроканалов составила 280 мкм, а глубина 200 мкм. Размеры каждо-
44 мм
а

б
Глубина 0.2 мм
Глубина 0.2 мм
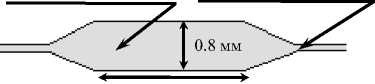
9.2 мм
Рис. 1. Микрофлюидный ПЦР-микрочип.
а — топология микрофлюидного ПЦР-чипа;
б — форма и размеры микрореактора микрочипа го из входных отверстий — 0.5 х 0.5 мм при глубине травления до 200 мкм. Как показано на рис. 1, б, каналы, постепенно уширяясь, образуют микрореакторы с размерами 9.2 х 0.8 мм и глубиной 200 мкм каждый. Объем микрореакторов составил 1.3 мкл; таким образом, эффективность использования пробы достигла 40 %. Все 16 микрореакторов гидродинамически независимы, что элиминирует перемешивание проб при термоциклировании и предотвращает образование пузырьков воздуха при вводе проб в микрореакторы. Линейные размеры микрочипа составили 22 х 44 мм, что позволило значительно снизить стоимость кремниевой заготовки.
Ввод проб в ПЦР-микрочип осуществляли при помощи специально разработанной системы, которая состояла из поликарбонатной накладки с последовательно присоединенным к ней пластиковым наконечником с фильтром и резиновой грушей. Разрежение, создаваемое на выходных отверстиях, позволило экспрессно вводить пробы (3 мкл) в микрореакторы микрочипа.
Герметизацию микрочипа осуществляли при помощи полиолефиновой самоклеющейся пленки (Abgene), приклейку которой проводили после удаления избытков проб на входных и выходных отверстиях при помощи безворсовой салфетки.
Установка для проведения ПЦР-реакции в режиме реального времени на микрофлюидном чипе
Установка состояла из двух систем: системы термоциклирования и системы флуоресцентного детектирования.
Система флуоресцентного детектирования, в которой применена эпифлуоресцентная оптическая схема, аналогична детально описанной ранее [22, 23], за исключением детектора. В качестве детектора излучения была выбрана цифровая ПЗС-камера (прибор с зарядовой связью (ПЗС), MultiBlue Biotech CCD, Perkin Elmer) на основе ПЗС-матрицы с диагональю 1/3 дюйма (KAI-0340, Kodak). Квантовая эффективность выбранной матрицы составляет 54 % на 500 нм. Размер ПЗС-матрицы составляет 4.74 х 3.55 мм, число активных пикселов — 640 х 480.
Прeдел обнаружения системы флуоресцентного детектирования по буферному раствору флуоресцеина составил 5 х 10-9 М, что сравнимо с чувствительностью системы детектирования стандартного ПЦР-РВ оборудования [24]. Такая высокая чувствительность связана с отсутствием фоновой флуоресценции материала микрочипа по сравнению с полимерным материалом пластиковой пробирки стандартного оборудования.
Программа обработки результатов аналогична описанной ранее [22, 23], за исключением введения
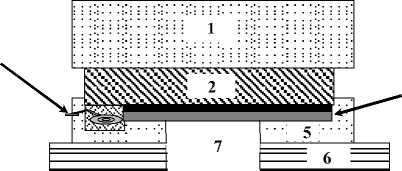
Рис. 2. Система термоциклирования.
1 — радиатор, 2 — элемент Пельтье, 3 — ПЦР-микрочип, 4 — термодатчик, 5 — картридж микрочипа, 6 — пластиковая платформа, 7 — окно для детектирования нормирующего кадра для устранения неоднородностей засветки на детектируемой площади. Полученные результирующие значения аналитических сигналов использовали для построения кинетической кривой ПЦР в координатах "интенсивность флуоресценции—число циклов" и оценки основного параметра кинетической кривой ПЦР — величины порогового цикла, оценка которого производилась по максимуму второй производной от кривой ПЦР, аппроксимированной функцией сигмоидного типа [25].
Система термоциклирования несколько изменена по сравнению с предложенной ранее [22, 23]. В оптимизированной системе термоциклирования (см. рис. 2) использовали элемент Пельтье, который механически прижимается к микрочипу в зоне микрореакторов со стороны кремниевой подложки. Размеры выбранного нагревательного модуля были обусловлены размерами зоны микрореакторов ПЦР-микрочипа — 22 х 10 мм. Тепловая мощность элемента Пельтье составила 22 Вт при максимальной силе тока в 8.5 А и напряжении в 4.8 В.
Контроль температуры активной стороны элемента Пельтье осуществляли при помощи платиновых термодатчиков (JUMO, GmbH & Co), предварительную калибровку которых осуществляли по показаниям ртутного термометра. Абсолютная погрешность измерения температуры (T, °С) в диапазоне от –200 °С до +400 °С при помощи выбранных термодатчиков составляет ±(0.15+ +0.002 х |T|) °С, время отклика — 16 мс, что является достаточным для измерения температуры при высоких скоростях термоциклирования. Управление мощностью, подаваемой на элемент Пельтье, и считывание показаний термодатчика осуществляли при помощи пропорционального интегрального-дифференциального алгоритма регулирования.
В системе термоциклирования создали пластиковый картридж (см. рис. 2), который спроектиро- вали с учетом минимального теплоотвода от микрочипа в пластиковую подложку. Скорости нагре-вания/охлаждения созданной системы термоциклирования составили 8.7 °С/с и 7.8 °С/с соответственно (в диапазоне от 60 до 95 °С, в интервале от 5 до 95 % от амплитуды перехода). Увеличение скоростей нагревания/охлаждения по сравнению с предложенной ранее системой [23] произошло благодаря минимальному отводу тепла через покровную пластину микрочипа в пластиковую платформу нагревательной системы и благодаря снижению линейных размеров микрочипа.
Растворы и реактивы
Для проведения ПЦР использовали тест-систему "35S", в которой контрольным образцом является плазмида pUC-18 со вставкой целевого фрагмента длиной 130 п. о. (ЗАО "Синтол"). Приготовление смеси ПЦР проводили в ламинарном ПЦР-боксе (ЗАО "Ламинарные системы"). Общий объем однократно приготовляемой ПЦР-смеси составлял 25 мкл и содержал: 1 х ПЦР-буфер с 10 х раствором SYBR Green I, 12.5 мМ дНТФ, 125 мМ MgCl 2 , 6.25 пкмоль смеси праймеров, 2.5 Е Taq ДНК-полимеразы. Концентрацию ДНК в ПЦР-смеси варьировали от 2 х 10’ до 2 копий/мкл. При проведении экспериментов по выявлению сорбирующегося компонента готовили ПЦР-смеси, в которых отсутствовали или ДНК и праймеры ("ДНК(-)"), или Taq ДНК-полимераза ("ПОЛИ(-)"), или все три перечисленных компонента ("ДНК(-); ПОЛИ(-)"). При детектировании кинетических кривых ПЦР с использованием специфичного зонда с флуорофором FAM и тушителем флуоресценции BHQ1 (далее зонд FAM) использовали ПЦР-буфер, не содержащий SYBR Green I, и добавляли в 25 мкл смеси зонд FAM, так что его содержание в смеси ПЦР составляло 2.5 пкмоль. Использовали режим амплификации смеси ПЦР, рекомендуемый производителем: прогревание — 90 с при 95 °С, а затем 50 циклов из интервалов при 95 °С — 15 с и при 60 °С — 40 с.
Для проведения статического модифицирования использовали 50 %-й раствор диметилдихлор-силана (Si(СH 3 ) 2 Сl 2 , ACROS Organics) в сухом толуоле и полиметилметоксисилоксан (ПММС, CH 3 -[Si(OCH 3 )(CH 3 )-O] m -Si(CH 3 ) 3 , Пента-Север). Для вспомогательных работ использовали концентрированные HNO 3 и Н 2 SO 4 , Н 2 O 2 , толуол, хлороформ, ацетон. Все реактивы отечественного производства, квалификации "ОСЧ". Для динамической пассивации использовали буферный раствор бычьего сывороточного альбумина (БСА, Fermen-tas) — 5 мкг/мкл в смеси ПЦР.
Для детектирования продуктов ПЦР методом гель-электрофореза использовали агарозу (Sigma Aldrich) и TAE-буфер (40 мМ Tris-буфер, 1 мМ
ЭДТА, рН = 7.6, Sigma Chemical Co.). Из прошедших термоциклирование смесей ПЦР отбирали по 15 мкл аликвот, которые после смешения с 5 мкл бромфенолового синего (Fermentas) помещали в лунки на геле. Для определения величины намно-женного фрагмента использовали стандартный маркер молекулярного веса ("Low range DNA marker", Fermentas).
Дополнительное оборудование и установка для детектирования продуктов реакции методом гель-электрофореза
Для проведения экспериментов по выявлению сорбирующегося компонента смеси ПЦР использовали ПЦР-амплификатор ("Терцик", ЗАО "ДНК-Технология"), пластиковую ванну для горизонтального гель-электрофореза (НПФ "Литех") с блоком питания и специально разработанную установку для детектирования результатов гель-электрофореза. Все компоненты созданной установки, за исключением объектива (Fujinon, фокусное расстояние — 25 мм, относительная апертура — 1.4) и двухкоординатного столика, аналогичны компонентам, использованным при создании установки для флуоресцентного детектирования. Используемый двухкоординатный столик позволил перемещать пластину агарозного геля относительно детектора флуоресцентного излучения для получения отдельных кадров изображения. После получения отдельных изображений проводили их совмещение в программе Аdobe Photoshop, ориентируясь на положение входных лунок на агарозном геле.
Для проведения ПЦР-РВ на стандартном оборудовании использовали анализатор нуклеиновых кислот (АНК-16, ИАнП).
Методики модифицирования поверхности микрореакторов
До модифицирования микрочипа в микрореакторы вводили смесь H 2 SO 4 и H 2 O 2 (3:1 по объему). Затем микрочип помещали в стакан, содержащий аналогичную смесь, и инкубировали 5 мин. Далее микрочип промывали порциями дистиллированной воды и сушили ацетоном.
Методика 1
Используя вакуумный насос, через микрочип прокачивали раствор ПММС (60 мкл) так, чтобы раствор модификатора покрывал зоны входных отверстий. Затем чип просушивали потоком воздуха и нагревали на плитке в течение 5 мин при 100 °С.
Методика 2
Сначала проводили модифицирование согласно методике 1. Затем в микрореакторы микрочипа вводили концентрированную HNO3, помещали микрочип в термостойкую колбу, заполненную концентрированной HNO3, и кипятили микрочип 10 мин. Затем микрочип извлекали из колбы, промывали порциями дистиллированной воды и ацетона и сушили при 80 °С в течение 2–3 мин. Микрочип обрабатывали толуольным раствором Si(СH3)2Сl2 путем ввода в микрореакторы так, чтобы порции раствора покрывали внешнюю кремниевую поверхность зоны входных отверстий. Инкубировали раствор модификатора внутри микрочипа 3 ч. Далее удаляли раствор модификатора, микрочип последовательно промывали порциями толуола, дистиллированной воды, ацетона и сушили на воздухе в течение 10 мин при 100 °С.
Методика 3
Микрочип обрабатывали толуольным раствором Si(СH 3 ) 2 Сl 2 путем ввода в микрореакторы так, чтобы порции раствора покрывали внешнюю кремниевую поверхность зоны входных отверстий. Инкубировали раствор модификатора внутри микрочипа 3 ч. Затем раствор модификатора удаляли, микрочип последовательно промывали порциями толуола, дистиллированной воды, ацетона и сушили на воздухе в течение 10 мин при 100 °С.
Перед вводом смесей ПЦР в микрореакторы микрочипов проводили 10 мин УФ-облучение кремниевой поверхности микрочипов в ПЦР-боксе. При выявлении сорбирующегося компонента проводили 10 мин инкубирование смесей ПЦР в микрореакторах микрочипа, после чего смеси извлекали и проводили термоциклирование в ам-плификаторе "Терцик".
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выявление сорбирующегося компонента ПЦР-смеси в зависимости от типа используемого модифицирующего покрытия и оценка влияния типа модифицирующего покрытия на величину порогового цикла ПЦР
Для проведения экспериментов по выявлению сорбирующегося компонента использовали ПЦР-микрочипы, модифицированные при помощи описанных выше методик 1 и 2, и микрочип, не прошедший модифицирование, и ПЦР-смеси: растворы "ДНК(-)", "ПОЛИ(-)" и "ДНК(-); ПОЛИ(-)". На рис. 3. представлена электрофореграмма, полученная после проведения гель-электрофореза, а в табл. 1 представлено описание проб на дорожках геля. Отметим, что в отсутствие статического модифицирования и при использовании методики 2 наблюдается сорбция Taq ДНК-полимеразы (рис. 3, дорожки 5 и 12). Кроме того, аналогичный эффект, но в несколько меньшей степени заметен и для остальных компонентов (рис. 3, дорожки 6, 7, 13, 14). В этом случае сорбирующимся
150 п. о.
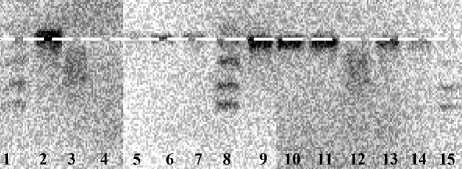
Рис. 3. Электрофореграмма, полученная при проведении экспериментов по выявлению сорбирующегося компонента компонентом смеси ПЦР могут являться компоненты буфера. В случае взаимодействий ионов Mg(II) с поверхностью активность Taq ДНК-полимеразы снижается, что результируется в уменьшении выхода ампликонов при проведении ПЦР [26]. При использовании методики 1 для модифицирования поверхности микрореакторов ПЦР-микрочипа (рис. 3, дорожки 9, 10, 11) ингибирование ПЦР минимально.
В случае модифицирования поверхности
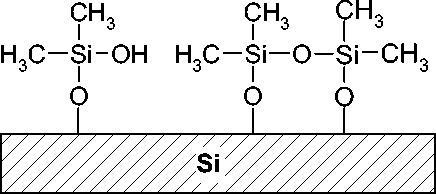
Si(СH 3 ) 2 Сl 2 поверхность покрывается модификатором неравномерно, несмотря на создание аморфного окисла кремния после окисления полимерного покрытия из ПММС, т. к. силанольные группы на созданной поверхности неоднородно распределены. Кроме того, Si(СH 3 ) 2 Сl 2 образует только частично сшитое полимерное покрытие (см. рис. 4, а). В отличие от модифицирования поверхности при помощи Si(СH 3 ) 2 Сl 2 методика 1, основанная на использовании ПММС, позволяет получить плотно сшитое полимерное покрытие, что позволяет полностью предотвратить контакт между кремниевой поверхностью микрореакторов и смесью ПЦР, что результируется в предотвращении ингибирования смеси ПЦР (см. рис. 4, б). Ранее показано [27], что наилучшим вариантом модифицирования поверхности является полиди-метилсилоксан (ПДМС, Пента-Север), однако применение ПММС позволяет получить химически привитое покрытие, что увеличивает степень надежности покрытия.
Отметим, что проведенный эксперимент позволил качественно оценить используемые методики модифицирования и без использования дорогостоящих микрочипов сделать выбор в пользу наиболее перспективных методик.
Табл. 1 . Способы модифицирования микрочипов и описание проб на дорожках электрофореграммы (к рис. 3)
|
№ дорожки |
Методика модифицирования и модифицирующее покрытие |
Описание пробы |
|
1 |
Микрочип отсутствует |
Ладдер |
|
2 |
” |
К(+) |
|
3 |
” |
К(-) |
|
4 |
” |
К(-) (без Taq ДНК-полимеразы) |
|
5 |
Нет модифицирования |
"ДНК(-)" |
|
6 |
"ПОЛИ(-)" |
|
|
7 |
"ДНК(-); ПОЛИ(-)" |
|
|
8 |
Микрочип отсутствует |
Ладдер |
|
9 |
Методика 1: CH 3 -[Si(OCH 3 )(CH 3 )-O] m -Si(CH 3 ) 3 |
"ДНК(-)" |
|
10 |
"ПОЛИ(-)" |
|
|
11 |
"ДНК(-); ПОЛИ(-)" |
|
|
12 |
Методика 2: Si(CH 3 ) 2 Сl 2 после окисления, CH 3 -[Si(OCH 3 )(CH 3 )-O] m -Si(CH 3 ) 3 |
"ДНК(-)" |
|
13 |
"ПОЛИ(-)" |
|
|
14 |
"ДНК(-); ПОЛИ(-)" |
|
|
15 |
Микрочип отсутствует |
Ладдер |
а
б
CH 3 O
O Si O Si O Si CH
I /
O H 3 C
CH 3 O
H C Si O Si O Si O
O
O
Si O Si O
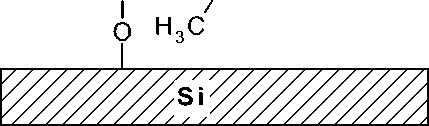
Рис. 4. Модифицированная поверхность кремния. а — модификатор Si(СH 3 ) 2 Сl 2 ; б — модификатор полиметилметоксисилоксан
Табл. 2. Значения С t , полученные при проведении ПЦР в микрореакторах ПЦР-микрочипа с использованием различных методик модифицирования поверхности
|
Модифицирующее покрытие и методика модифицирования |
С t , n = 5 |
S r [%], n = 5 |
|
Методика 1: CH 3 -[Si(OCH 3 )(CH 3 )-O] m -Si(CH 3 ) 3 |
20.35 |
0.19 |
|
Методика 2: Si(CH3)2Сl2 после окисления CH 3 -[Si(OCH 3 )(CH 3 )-O] m -Si(CH 3 ) 3 |
21.91 |
0.40 |
|
Методика 3: Si(CH 3 ) 2 Сl 2 |
21.57 |
0.29 |
Однако электрофореграммы не отражают влияния типа используемого полимерного покрытия на величину порогового цикла ПЦР, поэтому для дальнейших экспериментов по выбору оптималь- ной методики модифицирования проводили ПЦР в микрореакторах ПЦР-микрочипов.
При постановке ПЦР в микрореакторах микрочипа использовали 3 описанных выше методики модифицирования поверхности. При проведении экспериментов использовали ПЦР-смеси, содержащие неспецифичный интеркалятор SYBR Green I. Концентрация ДНК при проведении экспериментов составила 2 x 10 5 копий/мкл. Полученные значения величин в зависимости от методики пассивации приведены в табл. 2. Как видно из таблицы, минимальное значение С t , т. е. минимальное ингибирование ПЦР, достигается при использовании методики 1. Из приведенных данных в табл. 2 можно заметить, что относительное стандартное отклонение S r значений порогового цикла в случае использования методики 1 составляет минимальную величину, что говорит о воспроизводимости нанесения модифицирующего полимерного покрытия.
Также было отмечено, что методика 1 способствует значительному увеличению гидрофобных свойств поверхности входных отверстий микрочипа по сравнению с использованием методики 3 [22, 23], что позволяет предотвратить растекание и перемешивание проб при вводе в микрореакторы. Контактный угол смачивания ( θ ) кремниевой поверхности водой на входных отверстиях микрочипа при использовании методики 1 составил 130– 134°, в то время как при использовании методики 3 контактный угол смачивания составил величину порядка 85–90°.
Время модифицирования поверхности при помощи методики 1 составляет не более 10 мин, что позволяет значительно сократить время подготовки микрочипа к анализу по сравнению с методиками модифицирования, предложенными в литературе [20, 28].
Сравнение параметров ПЦР-кривых, полученных на микрочипе и на стандартном оборудовании
На рис. 5, а представлены кривые ПЦР, полученные в ПЦР-микрочипе и на стандартном оборудовании для различных начальных концентраций ДНК в пробе, а в табл. 3. представлены соответствующие значения величин пороговых циклов для различных исходных концентраций ДНК ( N Д ис Н х К ).
Отметим, что полученные значения C t для ПЦР-кривых, полученных на АНК и в микрореакторах микрочипа, различаются: значения пороговых циклов для стандартного оборудования несколько больше, чем для кривых ПЦР, полученных в микрочипе, что связано с незначительной сорбцией зондов на внутреннюю поверхность микрореакторов. Такая гипотеза возникла вследствие незначительного падения интенсивности
а
I фл. , усл. ед.
1.0
0.8
0.6
0.4
0.2
0.0

40 50
Номер цикла
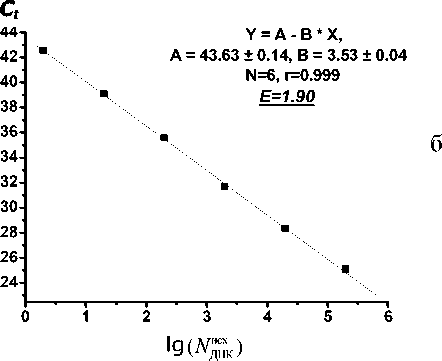
Рис. 5. Сравнение параметров кривых ПЦР, полученных в микрочипе и на стандартном оборудовании.
ПЦР-кривые (а):
1 — ПЦР-микрочип, 2 копий/мкл; 2 — ПЦР-микрочип, 20 копий/мкл; 3 — ПЦР-микрочип, 2·102 копий/мкл; 4 — ПЦР микрочип, 2·103 ко-пий/мкл; 5 — ПЦР-микрочип, 2·104 копий/мкл; 6 — ПЦР-микрочип, 2·105 копии/мкл; 7 — АНК, 2·105 копий/мкл; 8 — АНК, 2·104 копий/мкл; 9 — АНК, 2·103 копий/мкл.
Градуировочная зависимость (б), полученная в микрореакторах ПЦР-микрочипа
флуоресценции (5–7% от исходного значения) на стадии инициации реакции. По-видимому, именно сорбция зондов приводит к несколько более позднему достижению порогового цикла. Важно отметить, что определение пороговых циклов для всех кривых ПЦР проводилось в идентичных условиях, т. е. по максимуму второй производной от кривой ПЦР.
Табл. 3. Оценка величины порогового цикла ( C t ) кинетических кривых ПЦР, полученных в микрореакторах микрочипа и на АНК-16 при различной исходной концентрации ДНК ( N ДисНхК ) в пробе
|
ПЦР-устройство |
исх N ДНК , ко-пий/мкл |
C t , n = 5 |
S r [%], n = 5 |
|
АНК-16 |
2·105 |
24.55 |
0.09 |
|
2·104 |
27.85 |
0.11 |
|
|
2·103 |
30.83 |
0.12 |
|
|
ПЦР-микрочип |
2·105 |
25.35 |
0.18 |
|
2·104 |
28.35 |
0.20 |
|
|
2·103 |
31.50 |
0.20 |
|
|
2·102 |
35.40 |
0.29 |
|
|
20 |
39.11 |
0.37 |
|
|
2 |
42.61 |
0.62 |
Относительное стандартное отклонение Sr для значений Ct, полученных в микрочипе, значительно меньше 1 %, что позволяет говорить о том, что в интервале исходных концентраций ДНК от 2·105 до 20 копий/мкл величина относительного стан- дартного отклонения по концентрации составит от 1.5 до 20 %, что связано с логарифмической градуировочной зависимостью. Полученные погреш- ности находятся на уровне допустимых при проведении количественного ПЦР-РВ анализа [21].
Больший угол наклона, достигнутый для ПЦР-кривых в микрочипе, связан с тем, что малый объем микрореакторов микрочипа минимизирует температурные неоднородности и ускоряет массо- перенос по сравнению с полипропиленовыми пробирками, что отражается на эффективности протекания реакции [29]. На ранних этапах амплификации эффективности ПЦР для АНК и микрочипо-вой системы равны, а на более поздних этапах амплификации происходит более эффективное протекание ПЦР в микрочипе по сравнению со стандартным оборудованием [29]. При построении гра- дуировочных графиков в координатах lg (NДНК) —
Сt с использованием значений пороговых циклов для начальных концентраций ДНК, равных 2·105, 2·104 и 2·103 копий/мкл, эффективность ПЦР в микрореакторах микрочипа и на стандартном обо- рудовании оказалась равна теоретическому пределу — 2, что говорит об устранении ингибирования ПЦР в микрореакторах микрочипа. В случае малых исходных концентраций ДНК угол наклона ПЦР-кривых (см. рис. 5, а), полученных в микро- чипе, несколько уменьшается, что связано с инги-
бированием Taq ДНК-полимеразы при проведении большого количества термоциклов.
На рис. 5, б представлена градуировочная зависимость, полученная при проведении ПЦР в микрореакторах микрочипа. Как видно из приведенных данных, диапазон определяемых содержаний составил 6 порядков, а минимально обнаружимое количество молекул ДНК составило 1 копию/мкл при эффективности реакции, равной 1.90. При построении градуировочной зависимости эффективность ПЦР, определяемая по углу наклона полученной зависимости, зависит от значений пороговых циклов на уровне малых исходных концентраций ДНК в пробе, поэтому результирующая эффективность ПЦР, рассчитанная по градуировочной зависимости, составила величину меньше теоретического предела, что достигается и для стандартного оборудования.
ВЫВОДЫ
В настоящей работе создана методика модифицирования поверхности микрореакторов, основанная на создании полимерного покрытия на поверхности кремния. Методика позволяет предотвратить ингибирование ПЦР в микрореакторах стеклянно-кремниевого микрочипа, создать высокий контактный угол смачивания кремниевой поверхности водой и значительно снизить время подготовки микрочипа к анализу. Выявлен преимущественно сорбирующийся компонент — Taq ДНК полимераза. Проведенные оценки параметров ПЦР-кривых, полученных в микрочипе и на стандартном оборудовании, позволили показать, что созданная мультиреакторная ПЦР-МФАС позволяет осуществлять экспрессное определение ДНК методом ПЦР-РВ с эффективностью, аналогичной достигаемой на стандартном оборудовании. Созданная ПЦР-МФАС позволяет в 8 раз сократить расход дорогостоящих проб и реагентов, а все используемые компоненты разработанных методик ввода проб и герметизации отличаются высокой доступностью. Созданная ПЦР-МФАС может быть использована при создании нового микрочипового оборудования для биохимических исследований.


