Модифицирующее действие экстрактов кожицы винограда и красного вина на чувствительность бактерий Escherichia coli к различным антибиотикам
Автор: Безматерных К.В., Смирнова Г.В., Октябрьский О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Экстракты красного вина и кожицы винограда содержат значительное количество полифенолов, включая активные антиоксиданты кверцетин и ресвератрол, и проявляют высокую антирадикальную и хелатирующую способность. Внесение экстрактов в культуру E. coli вызывает 30%-ное ин-гибирование скорости роста, индукцию антиоксидантных генов katG и sodA и повышение устойчивости бактерий к перекиси водорода. Предобработка клеток E. coli каждым из экстрактов снижает бактерицидную активность ципрофлоксацина и цефотаксима и, наоборот, усиливает чувствительность бактерий к канамицину и стрептомицину. Воздействие экстрактов осуществляется, по-видимому, путем их влияния на скорость роста бактерий, редокс-статус клеток и уровень экспрессии антиоксидантных генов. В случае ципрофлоксацина, предобработка экстрактами может снижать степень повреждения ДНК и уровень индукции SOS-ответа. Модулирующий эффект экстрактов должен учитываться при антибиотикотерапии.
Растительные экстракты, полифенолы, антиоксидантные гены, антибиотики
Короткий адрес: https://sciup.org/147204790
IDR: 147204790 | УДК: 579.22
Текст научной статьи Модифицирующее действие экстрактов кожицы винограда и красного вина на чувствительность бактерий Escherichia coli к различным антибиотикам
Полифенолы, являющиеся обычными компонентами продуктов растительного происхождения и входящие в состав медицинских и косметических препаратов, привлекают растущий интерес в связи с их положительным влиянием на здоровье чело века [Crozier, Jaganath. Clifford. 2009]. Эти соединения обладают антиоксидантными свойствами благодаря способности связывать свободные радикалы и хелатировать ионы железа [Rice-Evans et al. 1995; Perron. Brumaghim. 2009]. Вместе с тем, в аэробных условиях полифснолы могут подвергаться аутоокиелению и генерировать активные
(С Безматерных К. В., Смирнова Г. В., Октябрьский О. Н., 2016
формы кислорода, выступая в качестве прооксидантов [Tang, Halliwell, 2010], При действии на живые клетки полифенолы модулируют передачу7 внутриклеточных сигналов и влияют на регуляцию экспрессии генов и активности ферментов* участвующих в ответе на окислительный и другие стрессы [Eberhardt, Jeffery', 2006; Smirnova et aL 2009]*
Высокая антиоксидантная и антипролифера-тивная активность ряда полифенолов (кверцетин, ресвератрол и др.) обусловливает их широкое использование в составе биологически активных добавок и лекарственных препаратов при профилактике и лечении заболеваний, связанных с окислительным стрессом (рак, диабек сердечнососудистые и другие). Кроме того* полифенолы являются компонентами экстрактов лекарственных растений, широко применяемых в традиционной медицине. В последние годы показано, что действие антибиотиков на бактериальные клетки приводит к накоплению окислительных повреждений во всех типах макромолекул (ДНК, белки. липиды), что вносит вклад Б бактерицидный эффект [Belenky el at* 2015]. В связи с этим можно ожидать, что при одновременном применении, воздействие на бактерии полифенолов, обладающих антиоксидантными свойствами, может интерферировать с действием антибиотиков, влияя тем самым на эффективность ан-тибиотикотерапии. Ранее мы и другие исследователи показали, что зеленый и черный чай и экстракты некоторых лекарственных растений изменяют чувствительность бактерий Е. cob к антибиотикам разных классов [Smirnova el aL 2012; Maralhe el al., 2013; Samoilova el aL 2014],
Целью настоящей работы является изучение влияния экстрактов вина и кожицы красного винограда, которые ЯВЛЯЮТСЯ богатыми источниками полифенолов, включая кверцетин и ресвератрол, на чувствительность бактерий Е. сой к антибиотикам с разным механизмом действия (ципрофлоксацин, канамицин, стрептомицин и цефотаксим),
Материалы и методы исследования
Приготовление экстрактов. Красное виноградное вино “PRIOS” (Испания) упаривали на роторном испарителе IKA RV10 (Германия) и лио-фильно высушивали. Сухой экстракт разводили в ДМСО. Конечная концентрация экстракта вина в экспериментах с бактериями составляла 3,6 мг/мл. Сухую кожицу7 красного винограда (10 г) размалывали и экстрагировали 3 раза по 30 мин, раствором Этиловый спирт : вода в соотношении 4 : 1 (v/v) на ультразвуковой водяной бане (El masonic S10 Н, Elma, 37 kHz, 30W) при температуре 60°С, Объединенный экстракт упаривали на роторном испа рителе и лиофильно высушивали, Конечная концентрация экстракта кожицы в экспериментах с бактериями составляла 3,8 мг/мл.
Общее содержание полифеполов в экстрак тах измеряли модифицированным методом Folin-Ciocalteu [Wu et aL 2006]. Экстракты (10 мкл) смешивали с 40 мкл реагента Fol in-Cioca lieu, встряхивали в течение 15 сек. и инкубировали 3 мин. при комнатной температуре. Затем добавляли 100 мкл 7%-ного карбоната натрия, и смесь доводили деионизированной водой до 3 мл. Через 90 мин. инкубации при комнатной температуре измеряли поглощение при 760 нм, используя спектрофотометр Shimadzu UV-VIS. Полученные значения сравнивали со стандартной кривой, построенной для растворов галловой кислоты, и выражали как эквиваленты галловой кислоты (мкг GAE/мг сухого экстракта).
Содержание отдельных поли фенолов в экстрактах определяли методом ВЭЖХ на жидкостном хроматографе Shimadzu LC-20AD. Разделение проводили на колонке С18 с использованием растворителей: А - ацетонитрил: В - смесь бидистил-лированной воды и уксусной кислоты в соотношении 40 : 1. Скорость потока - 1 мл/мин. Режим подачи растворителей: 0-15 мин., А - 14%, В - 86%; 16—15 мин.. А - 35%. В - 65%; 46-48 мин.. А -100%. Анализ пиков осуществляли при длинах волн 220-400 нм.
Хелатирующую активность экстрактов оп ределяли модифицированным методом [Kim et al„ 2005]. Реакционную смесь, содержащую 50 мкл образца и 10 мкл 1 мМ FeS04, активировали добавлением 6.7 мкл 5 мМ феррозина в ацетатном буфере, Раствор перемешивали и инкубировали при комнатной температуре в течение 10 мин,, после чего определяли поглощение при длине волны 562 нм. Хелатирующую активность рассчитывали, используя уравнение
Хелатирующий эффект (%) = ((Поглощение контроля - Поглощение образца) / Поглощение контроля) х 100,
График зависимости хелатирующего эффекта от концентрации исследуемого образца использовали для расчета ЕС?о как концентрации, при которой Fe2^ ионы связываются на 50%.
Анти радикальную активность полифенолов и экстрактов определяли по их способности связывать стабильный DPPH радикал [Shyur et aL, 2005]. Определение проводили в реакционной смеси, содержащей 3 мл 0.3 мМ DPPH'-этанольного раствора, 1 мл 50 мМ Tris-HCl буфера (pH 7.4) и 5-20 мкл экстракта. После 30 мин. инкубации при комнатной температуре измеряли поглощение при
517 нм. Ингибирующий эффект на уровень DPPH* рассчитывали согласно формуле
Ингибирующий эффект (%) = ((Поглощение контроля - Поглощение образца) / Поглощение контроля) х 100.
Строили график зависимости ингибирующего эффекта от концентрации исследуемых соединений и определяли величину7 1С5о как концентрацию, при которой связывается 50% свободных радикалов DPPH*.
Штаммы бактерий и условия культивирования. В качестве объекта исследований использовали штамм Е. coh BW25113 ^(araD-araB^CI, MacZ47^3(; ;гтВ-3\ V, rphA, ^(rhaD-rhaB)56^, hsdRSW, полученный из Е. coii Genetic Stock Center (CGSC). Штаммы NM3001 и NM3011, несущие слияния промоторов so^Zd и sail (sfb4) генов со структурным геном lacZ. кодирующим 0-галактозидазу. были сконструированы путем трансдукции фагом PI слияний sodA.dacZ и 5mlA(sfiA)\lacZ из Е, coli DM4000 (дар проф. М. Volkert) и QC772 (дар проф. D. Touati) в BW25113. Штамм NM3021, несущий транскрипционное генное слияние katG::lacZs был получен путем трансформации клеток К colt BW25113 плазмидой рКТЮЗЗ [Tao et al, 1989]. Штаммы NM3031 и NM3041 со слияниями katE.:lacZ к rpoS(katF)\dacZ были созданы путем трансформации клеток Е. сок BW25113 плазмидами pRS KatE 16 (дар проф. М. Volkert) и pRS 415 KatF5 (дар проф. A. Eisenstark).
Бактерии выращивали на минимальной среде М9 (Na2HPO^12H2O -15.13 г/л; КН2РО, - 3 г/л; NH.C1 - 1 г/л; NaCl - 0.5 г/л; MgSO^7H2O - 0.246 г/л; СаС12 - 0.011 г/л) с добавлением 0.15% глюкозы, 0.2% казаминовых кислот и тиамина (10 мкг/мл). За ростом следили путем измерения оптической плотности при длине волны 600 нм (ODy * ).
Удельную скорость роста культуры (ц) рассчитывали по формуле где OD^otti и ООб(*)№) - оптическая плотность культуры, измеренная при длине волны 600 нм, во время Г2 и 6,1 - время в часах.
Чувствительность Е* coll к H2Oi и антибиотикам определяли микропланшетным методом. Клетки из ночной культуры центрифугировали и переносили в колбы объемом 250 мл, содержащие 100 мл среды М9, до начальной OD^ = 0Л и выращивали на качалках при скорости вращения 140 об/мин и температуре 37°С до ОО6См> = 0.6, Далее культуру центрифугировали и ресуспендировали в 8 мл среды М9, В ячейки планшета добавляли по 5
мкл исследуемых экстрактов, 5 мкл концентрированных клеток и среду7 М9 до общего объема 200 мкл. Планшеты инкубировали на качалках (140 об/мин, температура 37°С) 20 мин,, измеряли OD^io и в опытные ячейки вносили Н2О2 (4 мМ) или антибиотики ципрофлоксацин (0.03, 0,3 и 3 мкг/мл), стрептомицин (10 и 40 мкг/мл), канами-цин (10 и 40 мкг/мл) и цефотаксим (5 и 10 мкг/мл). Отбор проб и измерение OD^ на микропланшет-ном спектрофотометре BioRad xMark, проводили до и через 30 и 70 мин, после внесения антибиотиков, Индекс антиоксидантной активности (АОА) рассчитывали как отношение удельной скорости роста бактерий, предобработанных экстрактами, к удельной скорости роста без предобработки через 30 мин, после добавления Н2О2.
Колопнеобразующую способность определяли в образцах из контрольной культуры и культур, обработанных экстрактами и антибиотиками. Пробы отмывали, разводили 0.9%-ным NaCl, капли полученной суспензии (10 мкл) помещали на чашки с LB-агаром и инкубировали в термостате при 37°С. Количество образовавшихся колоний (КОЕ) подсчитывали через 24 ч. инкубации.
Статиста чес кую обработку экс пер име1 ■-тальпых данных осуществляли с помощью пакета программ Microsoft Excel и Statistica 6,0. Каждый результат показан как среднее значение по меньшей мере трех-пяти независимых экспериментов ± стандартная ошибка среднего, Достоверность различий была определена с помощью t-критерия Стьюдента, статистически значимыми считались различия данных при уровне значимости р <0,05.
Результаты и их обсуждение
Для понимания биологических эффектов экстрактов красного вина и кожицы винограда был предварительно изучен их состав, а также хелатирующая и антиоксидантная активность. Состав и свойства исследуемых экстрактов представлены в табл. 1. Общий уровень полифенолов в экстракте вина был в 2 раза выше, чем в экстракте кожицы винограда. Оба экстракта содержали примерно одинаковое количество ресвератрола, но существенно отличались по уровню кверцетина, которого в экстракте кожицы было в 2 раза больше, чем в экстракте красного вина.
Кверцетин обладает высокой хелатирующей способностью (ЕСso = 0*004 мкг), и его повышенное содержание в экстракте кожицы может быть причиной в 2 раза более высокой хелатирующей активности этого экстракта* Напротив, значение IC50 было ниже, то есть антирадикальная активность выше у экстракта вина* чем у экстракта кожицы. Отсутствие параллелизма между хелатирующей и антпрадикальной активностями может
Содержание полифенолов, хелатирующая спосо объясняться тем* что отдельные компоненты экстрактов, например ресвератрол, проявляют выраженную антирадпкальную активность, но при этом не хелатируют железо. В целом способность экстрактов связывать радикалы DPPH* была в 20-30 раз ниже по сравнению с чистым препаратом кверцетина и в 6-9 раз ниже по сравнению с ресвератролом (не показано).
Таблица 1 ость и анти радикальная активность экстрактов красного вина и кожицы винограда
|
Состав и свойства |
Экстракт вина |
Экстракт кожицы винограда |
|
Общие полифенолы, мг GAE/r экстракта |
111 ±2 |
54 ± 1 |
|
Ресвератрол, мкг/г экстракта |
81.5 |
75.9 |
|
Кверцетин, мкг/г экстракта |
55.1 |
115.6 |
|
ЕСзи, мг экстракта |
0.169 |
0.082 |
|
ТС50, мг экстракта |
0.3X6 |
0.536 |
Внесение в культуральную среду экстрактов вина и кожицы винограда приводило к снижению удельной скорости роста К. сой на 28 и 30% по Сравнению С контролем. Соответственно, в Присутствии экстрактов замедлялся прирост числа колониеобразующих единиц (КОЕ). Таким образом, оба экстракта демонстрировали умеренное бактериостатическое действие па клетки К. coli. Бактериостатический эффект был, по-видимому, обусловлен Суммарным ДеЙСТВИеМ ИНГреДИеНТОВ, ВХО ДЯЩИХ в состав экстрактов. Кверцетин и ресвератрол в концентрациях, присутствующих в культуральной среде с добавлением экстрактов вина (1.10 мкг/мл и 163 мкг/мл) и кожицы винограда (2.31 мкг/мл и 1.52 мкг/мл)* не оказывали статистически значимого влияния на ц и КОЕ.
А нтиба ктериальна я а ктивность ра стительных экстрактов и отдельных полифенолов была отмечена ранее [Scalbert, 1991: Smith* Imlay. Mackie* 2003: Cushnie, Lamb* 2005; Obeidat et al., 2012: Subramanian et al.* 2014]. В ряде случаев было установлено, что механизм бактериостатического и бактерицидного действия полифенолов связан с продукцией активных форм кислорода (АФК) или окислительным повреждением мембран [Smith* Imlay. Mackie* 200.3: Subramanian et al., 2014]. АФК могут образовываться в результате аутоокисления полифенолов в аэробных условиях. В частности* ранее мы продемонстрировали, что богатые полифенолами растительные экстракты* а также танин и кверцетин, продуцируют перекись водорода и индуцируют антиоксидантные гены katG и sodA, кодирующие, соответственно, каталазу HPI и Мп-супероксиддисмутазу [Smirnova et al., 2009: Samoilova et al.. 2014]. Индукция антиоксидантных генов и возрастание активности ферментов, осуществляющих деструкцию АФК, способствуют повышению устойчивости к последующему окислительному стрессу [Smirnova et al.* 2009: Samoilova et al.? 2014]
Измерение активности ^-галактозидазы в штаммах* несущих слияние с геном lacZ, показало, что экстракты вина и кожицы винограда индуцируют экспрессию генов katG и sod А (табл. 2). Как отмечалось ранее, индукция этих генов может быть связана с генерацией активных форм кислорода при аутоокислении полифенолов и с активацией Fur регул она* в состав которого входит ген sodA, вследствие дефицита железа в результате его хелатирования [Smirnova et а!., 2009]. Экспрессия гена rpoS. кодирующего транскрипционный регулятор общего стрессового ответа* не изменялась в присутствии экстракта вина и достоверно снижалась экстрактом кожицы винограда (табл. 2). Аналогичным образом изменялась экспрессия подконтрольного регулятору RpoS гена katE, кодирующего каталазу НРП. Экспрессия гена sidAT входящего в состав SOS-регулона, который активируется в ответ на повреждение ДНК, не зависела от наличия экстрактов в среде.
Ранее было показано, что ресвератрол вызывает фрагментацию ДНК и дозозависимое повышение экспрессии гена smIA [Hwang. Lim* 2015]. В наших экспериментах концентрация ресвератрола в составе вина и кожицы винограда, а также соответствующая доза чистого препарата были недостаточны для того, чтобы вызвать SOS-ответ.
Повышение экспрессии антиоксидантных генов katG и sodA способствовало возрастанию устойчивости бактерий к последующему пероксидному стрессу. Индекс антиоксидантной активности (отношение удельной скорости роста бактерий, пре-добработанных экстрактом, к необработанным клеткам через 30 мин. после добавления Н2О2) составлял 5.3 и 5.5 для экстрактов вина и кожицы винограда, соответственно (табл. 2). Таким образом, исследуемые экстракты демонстрировали высокую антиоксидантную активность как в химиче- ском. так и в биологическом тесте*
Ранее мы и другие исследователи показали, что экстракты некоторых лекарственных растений способны модифицировать действие на Е. coil антибиотиков* имеющих различные внутриклеточные мишени (синтез ДНК, клеточной стенки и белка)* Направление и сила эффекта в значительной мере зависели от природы антибиотика и вида экстракта и были связаны с экспрессией антиокси дантных генов и хелатированием железа [Smirnova et aL 2012; Marathe et al** 2013; Samoilova et al** 2014]. В данной работе исследовалось влияние экстрактов вина и кожицы винограда на чувствительность Е. colt к антибиотикам ципрофлоксацину (синтез ДНК)* цефотаксим}7 (синтез клеточной стенки) и аминогликозидам канам ицину и стрептомицин}7 (синтез белка).
Таблица 2
Влияние экстрактов красного вина и кожицы винограда на экспрессию исследуемых генов и индекс АОА
|
Активность р-галактозидазы, ед. Миллера |
Контроль (ДМСО) |
Экстракт вина |
Экстракт кожицы винограда |
|
katGvJacZ |
7O±3 |
121±8*(1.73) |
139±11* (1.99) |
|
katEvJacZ |
417±31 |
409±28 (0.98) |
358±21 (0.86) |
|
rpoSvJacZ |
262±16 |
226±14 (0.86) |
202±9* (0.77) |
|
sodAOacZ |
55±2 |
94±5*(1.71) |
100±8* (1.82) |
|
stdAvJacZ |
56±5 |
47^2 (0*84) |
56^2(1.0) |
|
Индекс AOA |
1.0 |
5*3 |
5.5 |
Представлены данные через 50 мин, экспозиции с экстрактами, В скобках указан коэффициент относительно контроля, * Статистически достоверная разница с контролем (р<0.05).
Низкие дозы ципрофлоксацина (0.03 и 0.3 мкг/мл) не ингибировали рост в течение 30 мин. после воздействия. В этих условиях предобработка бактерий экстрактами вина и кожицы винограда снижала удельную скорость роста на 30-40%. Высокая доза ципрофлоксацина (3 мкг/мл), напротив, быстро ингибировала рост. При этом в культурах, предобработанных экстрактами, ц было на 30% выше, чем в тех, которые были обработаны только антибиотиком. В случае канамицина и стрептомицина экстракты вина и кожицы винограда усиливали ингибирование роста, вызванное антибиотиками (10 и 40 мкг/мл). Наиболее выраженный эффект предобработки экстрактами на рост бактерий наблюдался при экспозиции к цефотаксиму. Цефотаксим вызывал лизис клеток через 23 и 18 мин. после внесения в среду’ при дозе 5 и 10 мкг/мл, соответственно. Предобработка экстрактами предотвращала лизис в течение 70 мин. при концентрации цефотаксима 5 мкг/мл и существенно замедляла его при более высокой дозе антибиотика. Эти результаты хорошо согласуются с полученными нами ранее данными о влиянии богатых полифенолами экстрактов (зеленый и черный чай, толокнянка, брусника и др.) на рост Е. coh в присутствии антибиотиков с разным механизмом действия [Samoilova et al., 2014].
При экспозиции Е. coh ко всем изученным антибиотикам наблюдалось дозозависимое снижение числа КОЕ (рисунок). Предобработка бактерий экстрактами вина и кожицы винограда повышала значение КОЕ при действии низкой дозы ципрофлоксацина (0.03 мкг/мл) в 138 и 88 раз, соответственно. Концентрации кверцетина и ресвератрола, близкие к тем, которые содержатся в экстрактах, оказывали противоположное действие, повышая чувствительность бактерий к низкой дозе ципрофлоксацина. При более высоких концентрациях ципрофлоксацина протекторный эффект предобработок экстрактами был выражен значительно слабее.
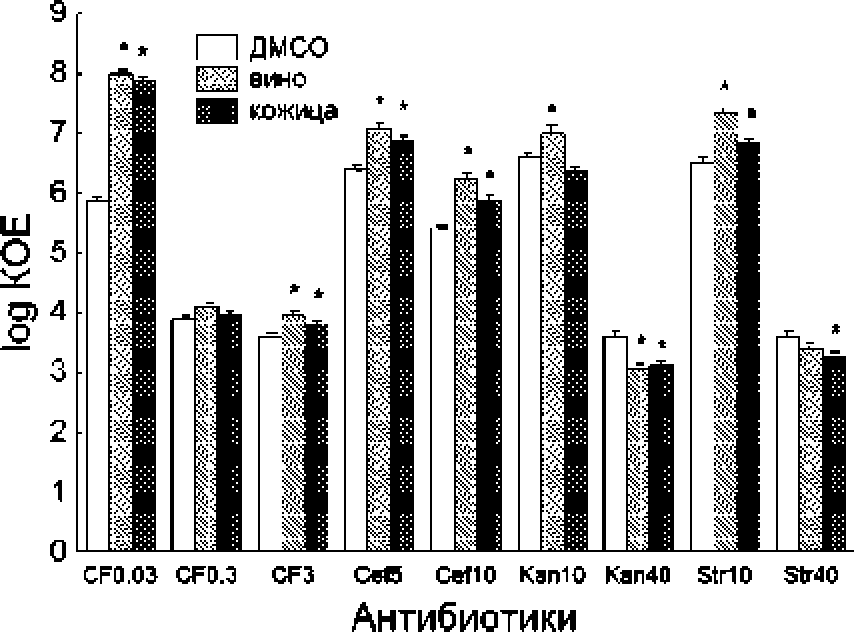
Влияние экстрактов вина и кожицы винограда на выживаемость Е. coh BW25113 при экспозиции к антибиотикам с разным механизмом действия,
CF0.03, CF0.3, CF3 - 0.03, 0.3 и 3 мкг/мл ципрофлоксацина, Се15, СеПО - 5 и 10 мкг/мл цефотакси-ма; Kani 0, Кап40 - 10 и 40 мкг/мл канамицина;
Str 10, Str40 - 10 и 40 мкг/мл стрептомицина. Представлены данные через 70 мин. после добавления антибиотика. ^Статистически достоверная разница по сравнению с действием антибиотика па клетки, не обработанные экстрактами (р<0.05)
Предобработка экстрактами в 3-6 раз повышала КОЕ при действии обеих доз цефотаксима, что хорошо согласуется со способностью экстрактов ингибировать лизис, индуцированный этим анти- биотиком. Напротив, экстракты вина и кожицы винограда в 2-4 раза усиливали бактерицидную активность высоких доз канамицина и стрептомицина (рисунок).
Аналогичным образом на чувствительность к канамицину и стрептомицину" влияли кверцетин и ресвератрол. Данные, полученные в настоящей работе, хорошо согласуются с результатами наших предшествующих исследований, показавших, что экстракты зеленого и черного чая. толокнянки и брусники ослабляют бактерицидный эффект ципрофлоксацина и ампициллина, но повышают восприимчивость к канамицину. Эффекты, вызываемые экстрактами, были тесно связаны с суммарным уровнем полифено лов и могли быть обусловлены влиянием на степень окислительного стресса в присутствии антибиотиков. Сходство модифицирующего действия различных экстрактов на чувствительность к антибиотикам может свидетельствовать об общности факторов и механизмов, ведущих к такой модификации.
Недавно мы показали [Смирнова и др.. 2016]. что скорость роста бактерий может быть основным фактором, определяющим их чувствительность к ципрофлоксацину и ампициллину, независимо от условий, влияющих на рост. Экстракты вина и кожицы винограда вызывали 30%-ное ингибирование скорости роста, которое могло быть следствием ирооксидантной и хелатирующей активности полифенолов, входящих в их состав. Такое снижение скорости роста может быть причиной протекторного действия экстрактов при экспозиции бактерий к ципрофлоксацину и цефотаксиму, который. как и ампициллин. ОТНОСИТСЯ к классу" 0-лактамов. Кроме того, показано, что действие антибиотиков на уровне первичных мишеней влечет за собой неспецифические метаболические изменения. способствующие окислительному повреждению всех типов макромолекул в клетке (ДНК. белки, липиды) [Belenky el al.. 2015]. Предобработка экстрактами изменяет редокс-ситуацию внутри клеток и стимулирует экспрессию антиоксидантных генов kaiG и sodA. что также может вносить вклад в модуляцию восприимчивости к антибиотикам. Поскольку исследуемые антибиотики имеют различные первичные внутриклеточные мишени, модулирующий эффект, производимый экстрактами, может сильно варьировать в зависимости от типа антибиотика, ВПЛОТЬ до противоположного воздействия у аминогликозидов по сравнению с хинолонами и 0-лактамами.
Внутриклеточной мишенью фторхинолона ципрофлоксацина являются бактериальные топоизомеразы. Хинолоны связываются с комплексом ДНК-фермент, препятствуя восстановлению разрывов в молекуле ДНК, что приводит к фрагментации хромосом и. в конечном итоге, к гибели кле ток [Drlica et al., 2008]. Экспозиция к ципрофлоксацину7, как и к другим агентам, повреждающим ДНК, индуцирует SOS-ответ, контролирующий репарацию ДНК и филаментацию клеток [Piddock. Wise, 1987]. В наших экспериментах ципрофлоксацин индуцировал экспрессию принадлежащего к SOS-регулону гена suLA* Максимальный уровень экспрессии наблюдался при концентрации ципрофлоксацина 0.3 мкг/мл. Предобработка экстрактами вина и кожицы винограда значительно ингибировала экспрессию sulA при этой концентрации ципрофлоксацина, свидетельствуя о снижении степени повреждения ДНК. Необходимы дальнейшие исследования для точного определения сайтов, на которые влияют компоненты экстрактов при действии других антибиотиков.
Заключение
Полученные в работе данные показывают, что предобработка клеток Е. сой экстрактами вина и кожицы винограда снижает чувствительность бактерий к ципрофлоксацину и цефотаксиму, но повышает восприимчивость к высоким дозам канамицина и стрептомицина. Модифицирующий эффект может быть связан с суммарным действием полифенолов в составе экстрактов. Воздействие экстрактов на клетки осуществляется, по-видимому. путем их влияния на скорость роста бактерий, редокс-сшуацию и уровень индукции антиоксидантных генов. В случае ципрофлокса цина. предобра ботка экстракта м и может снижать степень повреждения ДНК Модулирующее влияние продуктов, богатых полифенолами, на бактерицидную активность различных антибиотиков должно учитываться при антибактериальной терапии.
Исследования выполнены при финансовой поддержке грантов РФФИ №14-04-9603 L 16-04-00762 и Программы УрО РАН №15-4-4-16.
Список литературы Модифицирующее действие экстрактов кожицы винограда и красного вина на чувствительность бактерий Escherichia coli к различным антибиотикам
- Смирнова Г.В. и др. Роль тиоловых редокс-систем при ответе бактерий Escherichia coli на стрессорные воздействия температур и антибиотиков//Микробиология. 2016. Т. 85(1). С. 1-11
- Belenky P. et al. Bactericidal antibiotics induce toxic metabolic perturbations that lead to cellular damage//Cell Rep. 2015. Vol. 13. P. 968-980
- Crozier A., Jaganath I.B., Clifford M.N. Dietary phenolics: chemistry, bioavailability and effects on health//Nat. Prod. Rep. 2009. Vol. 26. P. 10011043
- Cushnie T.P.T., Lamb A.J. Antimicrobial activity of flavonoids//Int. J. Antimicrob. Agents 2005. Vol. 26. P. 343-356
- Drlica K. et al. Quinolone-mediated bacterial death//Antimicrob. Agents Chemother. 2008. Vol. 52. P. 385-392.
- Eberhardt M.V., Jeffery E.H. Perspective. When dietary antioxidants perturb the thiol redox//J. Sci. Food Agric. 2006. Vol. 86. P. 1996-1998.
- Hwang D., Lim Y.H. Resveratrol antibacterial activity against Escherichia coli is mediated by Z-ring formation inhibition via suppression of FtsZ expression//Sci. Rep. 2015. Vol. 5. P. 10029
- Kim H-J. et al. Evalution of antioxidant activity of Vetiver (Vetiveria zizanioides L.) oil and identification of its antioxidant constituents//J. Agric. Food Chem. 2005. Vol. 53. P. 7691-7695
- Marathe S.A. et al. Curcumin reduces the antimicrobial activity of ciprofloxacin against Salmonella typhimurium and Salmonella typhi//J. Antimicrob. Chemother. 2013. Vol. 68. P. 139-152
- Miller J.H. Experiments in molecular genetics. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press. 1972
- Obeidat M. et al. Antimicrobial activity of crude extracts of some plant leaves//Res. J. Microbiol. 2012. Vol. 7. P. 59-67
- Perron N.R., Brumaghim J.L. A review of the anti-oxidant mechanisms of polyphenol compounds related to iron binding//Cell Biochem. Biophys. 2009. Vol. 53. P. 75-100
- Piddock L.J.V., Wise R. Induction of the SOS response in Escherichia coli by 4-quinolone antimicrobial agents//FEMS Microbiol. Lett. 1987. Vol. 41. P. 289-294
- Rice-Evans C.A. et al. The relative antioxidant activities of plant-derived polyphenolic flavonoids//Free Radic. Res. 1995. Vol. 22. P. 375-383
- Samoilova Z. et al. Medicinal plant extracts variously modulate susceptibility of Escherichia coli to different antibiotics//Microb. Res. 2014. Vol. 169. P. 307-317
- Scalbert A. Antimicrobial properties of tannins//Phytochemistry. 1991. Vol. 30. P. 3875-3883
- Shyur L-F. et al. Antioxidant properties of extracts from medicinal plants popularly used in Taiwan//Inter. J. Appl. Sci. Eng. Technol. 2005. Vol. 3. P. 195-202
- Smirnova G. V. et al Influence of polyphenols on Es-cherichia coli resistance to oxidative stress.//Free Radic. Biol. Med. 2009. Vol. 46. P. 759768
- Smirnova G. et al. Influence of plant polyphenols and medicinal plant extracts on antibiotic susceptibility of Escherichia coli//J. Appl. Microbiol. 2012. Vol. 113. P. 192-199
- Smith A.H., Imlay J.A., Mackie R.I. Increasing the oxidative stress response allows Escherichia coli to overcome inhibitory effects of condensed tannins//Appl. Environ. Microbiol. 2003. Vol. 69. P. 3406-3411
- Subramanian M. et al. Resveratrol induced inhibition of Escherichia coli proceeds via membrane oxidation and independent of diffusible reactive oxygen species generation//Redox biology. 2014. Vol. 2. P. 865-872
- Tang S.Y., Halliwell B. Medicinal plants and antioxi-dants: What do we learn from cell culture and Caenorhabditis elegans studies?//Biochem. Biophys. Res. Commun. 2010. Vol. 394. P. 1-5
- Tao K. et al. Molecular cloning and nucleotide sequencing of oxyR, the positive regulatory gene of a regulon for an adaptive response to oxidative stress in Escherichia coli: homologies between OxyR protein and a family of bacterial activator proteins//Mol. Gen. Genet. 1989. Vol. 218. P. 371-376
- Wu L-C. et al. Antioxidant and antiproliferative activities of red pitaya//Food Chem. 2006. Vol. 95. P. 319-327


