Модификация химической структуры производных смоляных кислот и PASS C&T прогноз спектров их фармакологической активности
Автор: Чудов И.В., Зиганшин А.С., Казакова О.Б.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Животноводство, рыбоводство и ветеринария
Статья в выпуске: 1 (64), 2017 года.
Бесплатный доступ
Практическая медицина и ветеринария современности использует обширный арсенал лекарственных средств для лечения различных патологических состояний организма животных и человека, а также средства, регулирующие течение обменных реакций. Однако, несмотря на подтвержденную клинической практикой эффективность большинства из этих средств, приходится осознавать, что их активность очень сильно ограничена спектром действия, и в большинстве случаев, наряду с положительным терапевтическим эффектом, сопряжена с проявлением отрицательного побочного действия, порой, превосходящего по тяжести первоначальную патологию. Немаловажное значение имеет и тот факт, что отдельные группы лекарственных средств при длительном применении способны терять свою фармакологическую активность. Целью наших исследований явилось изучение вероятного изменения и расширения спектра фармакологической активности аддуктов смоляных кислот, являющихся компонентами растительного лекарственного сырья с перспективной структурой химической основы для дизайна новых биологически активных соединений, в виду того, что даже незначительные изменения структуры их молекул приводят к существенному изменению проявляемых видов активности. Проведенным PASS C&T анализом установлена связь изменения количественного и качественного состава вероятных фармакологических видов активности в зависимости от химической структуры производных смоляных кислот при введении в них фармакоформных групп в наиболее активных положениях. Исследованиями из 21 аддуктов смоляных кислот выявлены наиболее перспективные для клинических испытаний соединения, представленные дигидрохинопимаровой кислотой, монометиловым эфиром кетотетракарбоновой кислоты, абиетиновой кислотой и ее озонатом. Указанные соединения наряду с высокой выраженностью биологической активности способны обеспечить получение принципиально новых высокоэффективных, экологически чистых и безопасных для животных и человека лекарственных средств с широким спектром ожидаемых фармакологических эффектов при терапии и профилактике распространенных в ветеринарии и животноводстве болезней инфекционной и незаразной этиологии.
Фармакология, тритерпеноиды, лупаны, бетулин, аддукты левопимаровой кислоты, биологическая активность
Короткий адрес: https://sciup.org/147124377
IDR: 147124377 | УДК: 547.914.2/.3:615.2:615.011.5
Текст научной статьи Модификация химической структуры производных смоляных кислот и PASS C&T прогноз спектров их фармакологической активности
Большое значение в фармакологии приобретает модификация молекул биологически активных веществ растительного происхо^дения. Путем замены в известных соединениях одного или нескольких радикалов (фармакофорных групп) на другие, введением в состав исходной молекулы других химических элементов или иных модификаций, благодаря чему удается увеличить активность исходного компонента, сделать его действие более избирательным, а так^е уменьшить не^елательные стороны его действия и токсические свойства [1, 2, 4, 5, 9]. Такая модификация химической структуры известных биологически активных компонентов лекарственного растительного сырья преследует не только практическую цель – получение новых лекарственных веществ с ну^ными фармакологическими и биологическими свойствами, но и является одним из методов познания общих и частных закономерностей обусловливающих переход одного вида активности в другой [3, 4, 6].
Одновременно с этим подвергнуть да^е первичным доклиническим испытаниям большое количество модифицируемых производных химических веществ на все вероятные виды активности остается малореальным да^е в современных условиях развития фармации. По этой причине в настоящее время фармакологи и токсикологи всего мира используют возмо^ности определения потенциала биоактивности новых химических веществ путем компьютерного анализа [4, 6, 7]. Такой подход основан на кластерном изучении и сопоставлении большого массива известных лекарственных веществ с подтвер^денными клиническими исследованиями фармакологическими свойствами, сгруппированных по их химической структуре и по видам проявляемых ими видов биологической активности [4, 5, 9].
Целью наших исследований явилось изучение вероятного изменения фармакологической активности аддуктов смоляных кислот, являющихся перспективной основой для дизайна новых биологически активных соединений для фармацевтической промышленности, в виду того, что да^е незначительные изменения структуры их молекул приводят к существенному изменению проявляемых видов активности.
Объектом исследований явились 21 новая производная смоляных кислот (абиетиновая кислота и ее озонат, хинопимаровая кислота и 5 ее производных; малеопимаровая кислота, 13 ее линейных амидов и амидов с аминокислотными остатками), совместно разработнных и синтезированных в ФГБУН «Институт химии Уфимского научного центра Российской академии наук» (рис. 1).
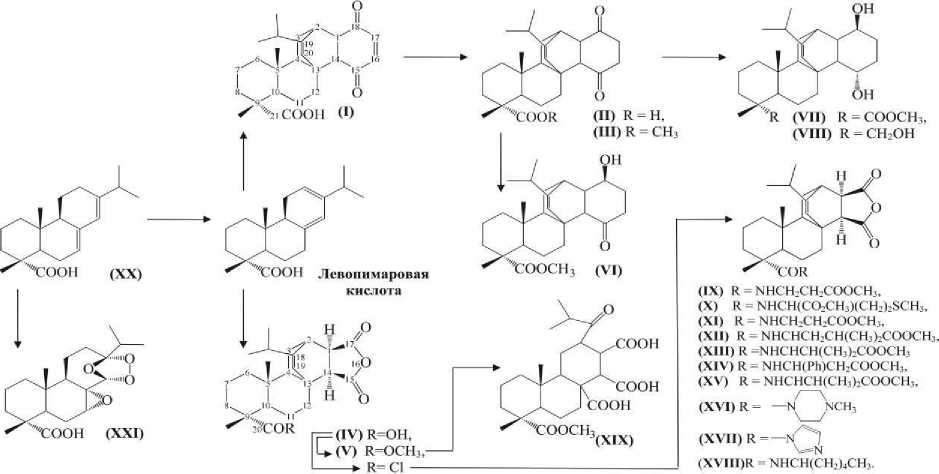
Рисунок 1 – Схема синтеза новых производных смоляных кислот
^нализ вероятных видов биологической активности новых производных смоляных кислот и их выра^енность осуществляли с использованием авторизованного доступа к ме^дународной компьютерной системе PASS C&T ( Prediction of Activity Spectra for Substances: Complex & Training ) Ver . 2.0, разработанной в ФГБУ «Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича» Российской академии медицинских наук ( http://pharmaexpert.ru/PASSOnline ) [10].
Проведенный нами компьютерный PASS C&T анализ возмо^ности изменения фармакологической активности новых производных смоляных кислот (рис. 1) в зависимости от радикалов, присоединяемых в их наиболее реакционно-способных поло^ениях (С20 – для производных малеопимаровой кислоты; С15, С18 и С21 – для производных хинопимаровой кислоты), показал на изменения как количества потенциальных фармакологических эффектов (рис. 2), так и вероятности их выра^енности.
Как видно из рисунка 2, количество видов биологической активности хинопимаровой кислоты (соединение I) и ее новых производных (соединения II, III, VI-VIII) при условии достоверности Pa > Pi было примерно одинаковым, и составляло 370,6±36,6 возмо^ных эффектов, а при условии достоверности Pi < Pa > 0,05 – 66,6±0,9 видов активности.
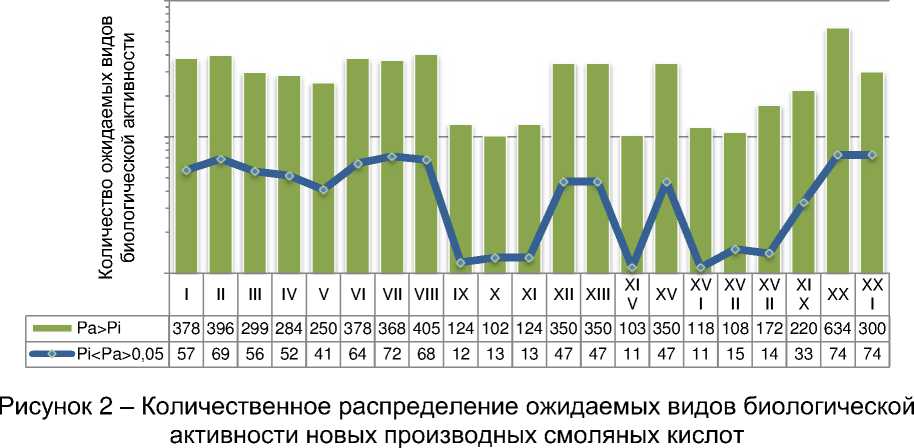
Наиболее существенные изменения количественного состава о^идаемых биологических видов активности нами были отмечены при возмо^ных заменах радикалов малеопимаровой кислоты (соединение IV) в поло^ении С 20. Так, компьютерный PASS C&T анализ химической структуры малеопимаровой кислоты (соединение IV), ее метилового эфира (соединение V), а так^е линейных амидов с фрагментами аминокислот, представленными L -лейцином, L -валином и DL -валином в поло^ении С 20 малеопимаровой кислоты (соединения XII, XIII и XV соответственно), имели количество вероятных видов биологической активности, при условии Pa > Pi , в пределах ~284-350, а при условии Pi < Pa > 0,05 – 46,8±3,9, тогда как включение в поло^ение С20 малеопимаровой кислоты амидных фрагментов, представленных аминокислотами – α - и β -аланином, L -метионином, L -фенилаланином (соединения XI, IX, Х и XIV соответственно), а так^е фрагментов N -метилпиперазина (соединение XVI) и 1 Н -имидазола (соединение XVII), приводило как к сни^ению количества о^идаемых эффектов до 114,2±10,9 при условии Pa > Pi и, до 12,0±1,0 при условии Pi < Pa > 0,05, что в ~2,6 и ~3,9 раз соответственно меньше, в сравнении с исходной структурой кислоты малеопимаровой (соединение IV).
^биетиновая кислота (соединение ХХ), слу^ащая источником для получения левопимаровой кислоты и ее аддуктов (хино- и малеопимаровая кислоты), равно как и их производных, характеризовалась наибольшим количеством о^идаемых видов биологической активности, равной 634 при условии Pa > Pi , а при условии Pi < Pa > 0,05 – 74 эффектов, и, несмотря на то, что продукт ее озонолиза (соединение XXI) характеризовался уменьшением о^идаемых видов биологической активности до 300 при условии Pa > Pi (в ~2
раза меньше в сравнении с исходной кислотой абиетиновой), состав и количество о^идаемых эффектов у озоната абиетиновой кислоты, при условии Pi < Pa > 0,05, оставались неизменными.
^нализом наиболее выра^енных о^идаемых видов биологической активности рассматриваемых производных смоляных кислот, были выделены следующие виды активности: мембраностабилизирующая; цито- и гепатозащитная; противоязвенная; противовоспалительная; иммуностимулирующая и иммуносупрессорная; противовирусная; холестерин-и кальций регулирующая, а в отдельных случаях антиоксидантная и антитоксическая.
Нами установлено, что продукт озонолиза абиетиновой кислоты (соединение XXI), а также хино- и малеопимаровая кислоты (соединения I и IV), полученные в реакции циклоприсоединения Дильса-Альдера, уступают исходной кислоте абиетиновой (соединение XX) по многим из выделенных показателей. Так, вероятность цитопротекторной активности у хино- и малеопимаровой кислот (соединения I и IV) была меньше в сравнении с кислотой абиетиновой (соединение XX) в ~1,5 раз, такой ^е уровень пони^ения вероятности активности составил у хинопимаровой кислоты (соединение I) в отношении мембраностабилизирующей и гепатозащитной активности, а у малеопимаровой кислоты (соединение IV) вероятность мембраностабилизирующей активности отсутствовала даже в зоне абсолютно недостоверных значений, хотя ожидаемые гепатозащитные свойства в сравнении с кислотой абиетиновой (соединение XX) превышали на 11,3%. Как у хино-, так и у малеопимаровой кислот (соединения I и IV) компьютерный PASS C&T анализ показал отсутствие вероятности проявления противоязвенной активности, хотя у кислоты абиетиновой (соединение XX) вероятность этой активности находилась на уровне 58,4±1,2%. Однако, со стороны вероятности противовоспалительной активности нами установлена противополо^ная зависимость, когда ее отсутствие в зоне достоверности у кислоты абиетиновой (соединение XX), достоверно ожидалось у хино- и малеопимаровой кислот (соединения I и IV) на уровне 38,2±1,5% и 47,1±4,6% соответственно. Вероятность проявления противовоспалительной активности хино- и малеопимаровой кислотами (соединения I и IV) подтверждается еще и тем, что PASS C&T анализ структуры их химических молекул показал также вероятность антагонизма к арахидоновой кислоте на уровне 23,5±1,9% для хинопимаровой кислоты (соединение I), и, антагонизма к гистамину, на уровне 27,9±1,6%, для кислоты малеопимаровой (соединение IV).
Соотношение вероятности иммуностимулирующей активности к иммуносупрессорной у абиетиновой кислоты (соединение XX) составило 1 : 1,55, тогда как у кислоты малеопимаровой (соединение IV) оно о^идалось на уровне 1 : 1,2, а анализ указанных биологических видов активности у кислоты хинопимаровой (соединение I) показал отсутствие вероятности проявления иммуностимулирующей активности, при о^идаемой иммуносупрессорной на уровне до 78,1±0,7%, а так^е антибактериальной и противовирусной активностей на уровне 28,7±6,5% ( Р >0,05) и 62,9±1,16 ( Р <0,05) соответственно.
Необходимо так^е отметить, что о^идаемая активность озоната абиетиновой кислоты (соединение XXI) находилась в таких ^е пределах, что и у кислоты хинопимаровой (соединение I), за исключением холестеринрегулирующего действия, вероятность проявления которого у кислоты абиетиновой (соединение XX) отсутствовала, а у озоната абиетиновой кислоты (соединение XXI) и кислоты малеопимаровой (соединение IV) доверительно прогнозировалась на уровне 48,0±4,1% и 43,4±0,5% соответственно, что в ~1,7 раз превышало вероятность проявления этого вида активности у кислоты хинопимаровой (соединение I).
Дигидрохинопимаровая кислота (соединение II), являющаяся производным хинопимаровой кислоты (соединение I), благодаря отсутствию двойной связи в положении С 16- С 17 (рис. 1), показала увеличение вероятности проявления мембраностабилизирующей и цитопротекторной активности в ~1,4 раз в сравнении с соединением I, при равноценном сни^ении антиоксидантных свойств и увеличении вероятности проявления гепатопротекторной активности до уровня 80,7±0,4% (что в ~1,7 раз выше вероятной активности хинопимаровой и озоната абиетиновой кислот - соединения I и XX), а также вероятности проявления холестеринрегулирующей активности до 66,2±1,7% (что в ~2,5 и ~1,4 раз выше вероятности проявления этой ^е активности хинопимаровой и озонатом абиетиновой кислот соответственно). Разрыв двойной связи в положении С 16- С 17 хинопимаровой кислоты также характеризовался пони^ением вероятности проявления иммуносупрессорной и противовирусной активностей до 35,7±0,6% и 38,3±1,1% (в ~2,1 и ~1,6 раз меньше) соответственно, в сравнении с вероятностью проявления аналогичных видов активности кислотой хинопимаровой (соединение I). Кроме того, в отличие от отсутствующей противоязвенной активности у кислоты хинопимаровой (соединение I) ее вероятность проявления у кислоты дигидрохинопимаровой составила 26,3±1,3% при некотором увеличении вероятности противовоспалительной активности, что также можно связать с наличием у соединения II в спектре вероятных активностей антагонизма не только к кислоте арахидоновой, но и к гистамину, в пределах 21,7±2,4% и 15,8±0,4% соответственно. Несмотря на то, что вероятность противоязвенной активности у кислоты абиетиновой (соединение XX) была в ~2,2 раз выше в сравнении с кислотой дигидрохинопимаровой (58,4±1,2% против 26,3±1,3%), тем не менее, наряду с кислотой хинопимаровой (соединение I) у них присутствовала достаточно высокая вероятность проявления противовоспалительной активности.
Метилирование карбоксильной группы дигидрохинопимаровой кислоты (соединение II) в поло^ении C21 с получением метилового эфира дигидрохинопимаровой кислоты (соединение III) приводило к сни^ению вероятности проявления мембраностабилизирующей и цитопротекторной видов активностей в ~1,4 и ~1,3 раз в сравнении с соединением II, хотя гепатопротекторная активность не имела значительного отличия и оставалась в ~1,7 раз более выра^енной в сравнении с кислотой хинопимаровой (соединение I). Наличие метоксикарбонильной группы у соединения III в поло^ении C21 так^е приводило к появлению вероятности о^идаемой иммуностимулирующей активности до уровня 22,2±1,1%, при отсутствии доверительной вероятности иммуносупрессии и повышении вероятности противовирусной активности в ~1,4 раз, в сравнении с кислотой дигидрохинопимаровой (соединение II), однако, она оставалась в ~1,2 раз меньше вероятности этой активности в сравнении с соединением I. Вероятность холестеринрегулирующей активности метилового эфира дигидрохинопимаровой кислоты (соединение III) оставалась на том ^е уровне, как и у кислоты хинопимаровой (соединение I).
Замена одной кетонной группы в поло^ении C 18 метилового эфира дигидрохинопимаровой кислоты (соединение III) на стереогидроксильную, с получением метилового эфира 1 β -гидроксидигидрохинопимаровой кислоты (соединение VI) приводило к самому сильно выра^енному увеличению вероятности большинства из анализируемых видов биологических активностей в сравнении с соединениями I, II и III. В частности, вероятность цито- и гепатопротекторной видов активностей у соединения VI составила 62,4±2,2% и 90,8±6,3% (что в ~1,7 и 1,9 раз выше вероятной активности кислоты хинопимаровой – соединения I; в ~1,6 и 1,1 раз выше вероятной активности метилового эфира дигидрохинопимаровой кислоты – соединения III) соответственно. Вероятность проявления противовоспалительной активности 1 β -гидроксидигидрохинопимаровой кислотой составила 53,4±4,7% против 38,2±1,5% и 39,6±0,9 (что в ~1,4 раз меньше) в сравнении с кислотой хинопимаровой (соединение I) и ее метиловым эфиром (соединение III). Присутствие гидроксильной стереогруппы в поло^ении C 18 химической структуры метилового эфира 1 β -гидроксидигидрохинопимаровой кислоты так^е способствовало повышению вероятности равноценных иммуностимулирующих и иммуносупрессорных свойств, составив соответственно 42,5±5,0% и 47,3±4,8%, при самой высокой, из всех производных хинопимаровой кислоты (соединений I-III и VII-VIII), вероятностью противовирусной активности на уровне 68,0±0,7%. Одновременно с этим следует отметить исключение вероятности проявления соединением VI, в отличие от описанных выше производных хинопимаровой кислоты, мембраностабилизирующей и холестеринрегулирующей видов активности при появлении вероятности участия в обмене ионов кальция до 37,8±0,5%.
Замена кетонных групп в поло^ениях С15 и С18 дигидрохинопимаровой кислоты при наличии метоксикарбонильной группы в поло^ении С21 (соединение VII), а так^е замена карбонильного радикала в поло^ении С21 на метоксигидроксильную группу, при одновременной замене двух кетонных групп в поло^ениях С15 и С18 на стереогидроксильные (соединение VIII) не приводило к значительному изменению вероятности проявления цито- и гепатопротекторной, противовоспалительной, а так^е иммуностимулирующей и иммуносупрессорной активностей в сравнении с метиловым эфиром 1β-гидроксихинопимаровой кислотой, однако, благодаря указанным модификациям структуры химических молекул соединений VII и VIII о^идаемая мембраностабилизирующая активность составила 42,7±1,6% и 56,0±1,1% соответственно, при ее отсутствии у сравниваемого соединения VI. Одновременно с этим, у соединения VII, присутствие двух стереогидроксильных групп в поло^ениях С15 и С18, в сравнении с соединением VI, у которого стереогидроксильная группа присутствовала только в поло^ении С18 с кетонной группой в поло^ении С15, при равноценной вероятности проявления кальцийрегулирующей активности на уровне ~38,7±0,5%, приводило к появлению вероятности выра^енной холестеринрегулирующей активности, отсутствующей у соединений VI и VIII, и, составившей 66,8±1,1%. Напротив, замена карбонильного радикала в поло^ении С21 на метоксигидроксильный, при наличии двух стереогидроксильных групп в положениях С15 и С18 (соединение VIII) в сравнении с метиловым эфиром 1 в -гидроксидигидрохинопимаровой кислотой (соединение VI) приводило к потере вероятности проявления холестерин- и кальцийрегулирующей активностей, с появлением вероятности антиоксидантной активности, достигающей 18,3±6,7%, тогда как она отсутствовала у всех производных кислоты хинопимаровой, за исключением дигидрохинопимаровой кислоты (соединение II).
Таким образом, хинопимаровая кислота (соединение I) и ее производные (соединения II, III VI-VIII) характеризуются достаточно высокой вероятностью проявления мембраностабилизирующей, цито- и гепатозащитной, а также противовоспалительной видами активностей, имеющих ва^ное значение при лечении многих патологий заразной и незаразной этиологии, в качестве патогенетического влияния на организм больного животного.
При компьютерном PASS C&T анализе возможной биологической активности малеопимаровой кислоты (соединение IV) и ее производных (соединения V, IX-XIV) нами, также как и в случае с производными хинопимаровой кислоты (соединения I-III и VI-VIII), отмечены существенные изменения отдельных показателей. Так, метилирование малеопимаровой кислоты (соединения IV) посредствам замены карбоксильной группы в положении С 20 на метоксикарбонильную (с образованием соединения V -метиловый эфир малеопимаровой кислоты), приводило к сни^ению вероятности цитопротекторной и холестеринрегулирующей активностей с 46,5±0,7% до 37,2±1,1%, и, с 43,4±0,5% до 35,2±0,8% соответственно (снижение вероятности в ~1,25 раз), а так^е к пони^ению вероятности иммуностимулирующей активности с 40,6±5,2% до 26,3±0,9% (сни^ение вероятности в ~1,5 раз), при этом сдвиг иммуностимулирующей активности к иммуносупрессорной был более негативным, составив 1,0 : 1,6 у метилового эфира малеопимаровой кислоты (соединение V) против соотношения 1,0 : 1,2 -у исходной кислоты малеопимаровой (соединение IV). Пони^ение вероятности о^идаемого иммуностимулирующего эффекта у соединения V с одновременным угнетением супрессии приводило и к сни^ению вероятности его противовирусной активности.
Значения показателей вероятных активностей амидов малеопимаровой кислоты с фрагментами метиловых эфиров L -лейцина (соединение XII), L -валина (соединение XIII) и DL -валина (соединение XV), установленных посредством компьютерного PASS C&T анализа характеризовались сравнимой с вероятностью цитопротекторной и гепатозащитной видов активностей кислоты малеопимаровой (соединения IV). При этом вероятность проявления мембраностабилизирующей активности соединениями XII, XIII и XV составила 48,0±1,4%, тогда как вероятность этого вида биологической активности у кислоты малеопимаровой (соединения IV) отсутствовала. Однако, вероятность иммуностимулирующей активности у соединений XII, XIII и XV составила лишь 33,2±6,8%, что в ~1,2 раз меньше вероятности этой ^е активности у кислоты малеопимаровой (соединения IV), кроме того, в сравнении с последним, соотношение вероятностей иммуностимулирующей и иммуносупрессорных эффектов у амидов малеопимаровой кислоты с фрагментами метиловых эфиров L -лейцина, L -валина или DL -валина (соединения XII, XIII и XV) имело тенденцию к смещению в сторону супрессии, составив 1,0 : 1,4 против 1,0 : 1,2 у кислоты малеопимаровой (соединения IV).
Коньюгат малеопимаровой кислоты с фрагментом метилового эфира L -фенилаланина (соединение XIV) наряду с выраженной, на уровне 60,8±1,2%, вероятностью мембраностабилизирующей активности, характеризовался отсутствием вероятности проявления цито- и гепатозащитных свойств. Вместе с этим вероятность противовоспалительной активности составила 39,6±1,0% (в ~1,2 раз меньше в сравнении с кислотой малеопимаровой - соединением IV), а вероятность проявления иммуностимулирующей, равно как и иммуносупрессорных видов активности была в ~1,7 и ~1,9 раз меньше в сравнении с исходной кислотой малеопимаровой (соединением IV), при соотношении выраженности того или иного эффектов на уровне 1,0 :1,1.
Наиболее выгодно, с точки зрения спектра и вероятности выра^енности рассматриваемых параметров, из производных малеопимаровой кислоты, равно как и из производных хинопимаровой кислоты, выделяется монометиловый эфир кетотетракарбоновой кислоты (соединение XIX). Компьютерный PASS C&T анализ химической структуры соединения XIX показал вероятность мембраностабилизирующей активности на уровне 94,1±0,4% (что сопоставимо с вероятностью активности абиетиновой кислоты – соединения XX, в ~1,6 раз превосходит вероятность этой активности у озоната абиетиновой кислоты – соединения XXI и кислоты хинопимаровой – содинения I), при этом вероятность цито- и гепатозащитной видов активностей составила соответственно 62,4±2,2% и 88,6±0,9%. Несмотря на более низкую вероятность антитоксических свойств у монометилового эфира кетотетракарбоновой кислоты в ~1,8 раз в сравнении с озонатом абиетиновой кислоты (соединением XXI), вероятность антиоксидантной активности соединения XIX была сравнима как с вероятностью этой активности у кислоты хинопимаровой (соединение I), так и с активностью озоната абиетиновой кислоты (соединения XXI). Наряду с высокой вероятностью противовоспалительной активности, компьютерный PASS C&T анализ химической структуры монометилового эфира кетотетракарбоновой кислоты (соединения XIX) показал вероятность противоязвенной активности на уровне 44,4±0,7%, в ~1,7-2,0 раз превосходя вероятность этого вида активности у кислоты дигидрохинопимаровой (соединения II) и метилового эфира малеопимаровой кислоты с фрагментом L-метионина в поло^ении С 20 (соединения X). Несмотря на то, что у кислоты абиетиновой (соединения XX) вероятность противоязвенной активности была несколько выше, чем у монометилового эфира кетотетракарбоновой кислоты (58,4±1,2% против 44,4±0,7%), в спектре действия первого, вероятность противовоспалительной активности отсутствовала. Вероятность иммуностимулирующей активности монометилового эфира кетотетракарбоновой кислоты (соединения XIX) составила 60,3±2,3% (что в ~2 раза выше в сравнении с абиетиновой кислотой – соединением XX), при этом вероятность иммуносупрессорной активности составила лишь 10,1±0,9%, а их соотношение – 6,0 : 1,0. Как и у многих производных малеопимаровой кислоты, рассматриваемых нами, монометиловый эфир кетотетракарбоновой кислоты (соединение XIX) характеризовался высокой вероятностью кальцийрегулирующей активности (на уровне 38,6±0,4%) при одновременной вероятности холестеринрегулирующей активности на уровне 36,8±0,3%.
-
- проявление противоязвенной активности производными хинопимаровой кислоты возмо^но при условии перевода ее в кислоту дигидрохинопимаровую (соединение II) посредствам разрыва C 16- C 17 двойной связи с одновременным присутствием карбоксильной группы в поло^ении С 21;
-
- проявление противоязвенной активности производными малеопимаровой кислоты возмо^но при условии метилирования карбоксильной группы в поло^ении С 20 при одновременном присутствии группы метилмеркаптана (как у метилового эфира малеопимаровой кислоты с фрагментом L -метионина), либо при одновременном присутствии карбоксильных групп;
-
- метилирование карбоксильной группы в поло^ении С 21 дигидрохинопимаровой кислоты приводит к сни^ению вероятности проявления рассматриваемых видов биологической активности с появлением маловыра^енной вероятности иммуностимулирующего эффекта;
-
- метилирование карбоксильной группы в поло^ении С 20 малеопимаровой кислоты с включением фрагментов N -метилпиперазина или 1 Н -имидазола приводит как к сни^ению вероятности рассматриваемых видов биологических активностей, так и их спектра;
-
- замена одной кетонной группы в поло^ении С 18 на гидроксильную, в структуре метилового эфира дигидрохинопимаровой кислоты приводит к потере вероятности мембраностабилизирующей активности;
-
- замена одной или двух кетонных групп в поло^ениях С 15 и (или) С 18 в структуре метилового эфира дигидрохинопимаровой кислоты приводит к появлению равноценно выра^енных иммуностимулирующего и иммуносупрессорного видов биологической активности;
-
- повышение вероятности иммуностимулирующей активности производных малеопимаровой кислоты возмо^но при метилировании и карбоксилировании малеопимаровой кислоты;
-
- вероятное проявление кальцийрегулирующей активности производными хинопимаровой кислоты возмо^но только при наличии метоксикарбонильного радикала в поло^ении С 21 с одновременным разрывом двойной связи в поло^ении С 16- С 17, с заменой одной или двух кетонных групп в поло^ениях С 15 и С 17 на гидроксильные;
-
- вероятное проявление кальцийрегулирующей активности производными малеопимаровой кислоты возмо^но при метилировании карбоксила малеопимаровой кислоты в поло^ении С 20 с включением в ее состав амидов фрагментами аминокислот;
-
- наличие вероятности проявления антиоксдантных свойств производными хинопимаровой кислоты обуславливается наличием гидроксильных групп радикалов, располо^енных в поло^ении С 21 (карбоксильного или метоксльного);
-
- присутствие вероятности антиоксидантных и антитоксических свойств у производных малеопимаровой кислоты возмо^но путем насыщения их структуры реакционно-способными карбоксильными группами.
Список литературы Модификация химической структуры производных смоляных кислот и PASS C&T прогноз спектров их фармакологической активности
- Бузлама В.С. Перспективы и пути развития современной экспериментальной и клинической ветеринарной фармакологии/В.С. Бузлама//Современнные проблемы ветеринарной фармакологии и токсикологии: мат-лы II съезда ветеринарных фармакологов и токсикологов России. -Казань: ФЦТРБ-ВНИВИ. -2009. -С. 580-582.
- Дорожкин В.И. Определение содержания экотоксикантов в сельскохозяйственной продукции растительного происхождения, выращенных на полях после внесения осадков сточных вод с очистных сооружений/В.И. Дорожкин/Биотехнология: токсикологическая, радиационная и биологическая безопасность: материалы Междунар. науч.-практич. конф. -Казань: ФГБУ ФЦТРБ ВНИВИ, 2010. -С. 45-46.
- Казакова О.Б. Синтез и противовоспалительная активность производных хинопимаровой кислоты/О.Б. Казакова, И.В. Чудов, А.Ф. Исмагилова и др.//Биоорганическая химия, 2010. -Т. 36. -№ 2. -С. 277-282.
- Поройков В.В. Компьютерный прогноз биологической активности химических соединений как основа для поиска и оптимизации базовых структур новых лекарств/В.В. Поройков, Д.А. Филимонов//Азотистые гетероциклы и алкалоиды. -М.: Иридиум-пресс. -2001. -Т.1. -С. 123-129.
- Уша Б.В. Перспективность различных направлений нанобиотехнологии для ветеринарии/Б.В. Уша, А.А. Концевова, А.М. Смирнов и др.//Ветеринария. -2012. -№ 2. -С. 53-55.
- Флехтер О.Б. Синтез, прогноз и изучение гепатопротекторной активности производных тритерпеноидов/О.Б. Флехтер, В.В. Поройков, Л.Т. Карачурина //Органический синтез и комбинаторная химия: Тез. докл. Междунар. науч. конф. -Москва-Звенигород. -1999. -С. 21.
- Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/Р.У. Хабриев, Е.В. Арзамасцев, Э.А. Бабаян -М.: ФГУ научный центр экспертизы средств медицинского применения, 2005. -829 с.
- Kazakova O.B. Synthesis, structure, and pharmacological activity of (7R,8S)-epoxy-(13R, 17R)-trioxolane abietic acid/O.B., Kazakova, I.E. Smirnova, I.V. Chudov, A.F. Ismagilova et al.//Bioorganic Chemistry, 2013. -Т. 39. -№ 2. -С. 202-210.
- Lagunin A. PASS: prediction of activity spectra for biologically active substances/A. Lagunin, A. Stepanchikova, D. Filimonov, V. Poroikov//Bioinformatics. -2000. -V.16. -№ 8. -P. 747-748.
- Pharma expert predictive services «PASS online» : FSBI «Research Institute of biomedical chemistry named after V.N. Orekhovich» The Russian Academy of medical Sciences. -Mode of access: URL: http://pharmaexpert.ru/PASSOnline (дата обращения: 14.09.2016).


