Модификация радиочувствительности овец
Бесплатный доступ
Установлено, что при остром воздействии g-излучения в сублетальной (2 Гр) и летальной (6 Гр) дозах через девять месяцев после пролонгированного облучения овец в дозах 0,5 и 0,1 Гр соответственно отсутствует выраженная активация процесса свободнорадикального перекисного окисления липидов (ПОЛ). В плазме крови животных наблюдали снижение интенсивности спонтанной хемилюминесценции (СХЛ), тенденцию к повышению концентрации малонового диальдегида (МДА) и слабое изменение содержания диеновых и триеновых конъюгатов (ДК и ТК), а также уровня концентрации a-токоферола и ретинола. Однократное острое воздействие g-излучения в дозах 2 и 6 Гр увеличивало интенсивность процесса свободнорадикального ПОЛ в плазме крови овец. При развитии лучевой патологии регистрировали повышение интенсивности СХЛ и концентрации МДА, ДК, ТК и a-токоферола при одновременном снижении уровня содержания ретинола. Сравнительный анализ полученных данных по интенсивности процесса свободнорадикального ПОЛ в плазме крови и выживаемости овец показал, что пролонгированное облучение в дозах 0,1 и 0,5 Гр модифицирует реакцию организма на последующее острое воздействие g-излучения в сублетальной и летальной дозах.
Овцы, свободнорадикальное пол, пролонгированное облучение, g-излучение, радиоиндуцированное поражение, малые дозы облучения, радиочувствительность
Короткий адрес: https://sciup.org/170170156
IDR: 170170156
Текст научной статьи Модификация радиочувствительности овец
В механизмах биологического действия ионизирующих излучений важная роль принадлежит свободнорадикальному перекисному окислению липидов (ПОЛ). Значительный интерес к процессу свободнорадикального ПОЛ обусловлен тем, что он протекает во всех типах клеточных мембран и участвует в регуляции метаболизма клеток. При этом свободные радикалы, наряду с вторичными мессенджерами (ионы Са2+, циклические аденозинмонофосфат и гуанозинмонофосфат (цАМФ и цГМФ), фосфоинозитолы) выполняют функцию регуляторных молекул в биохимических реакциях.
Ранее нами было показано [9], что пролонгированное облучение овец в дозах 0,1 и 0,5 Гр ингибирует интенсивность процесса свободнорадикального ПОЛ в течение всего периода исследования (90 сут) и характеризуется снижением в плазме крови содержания малонового диальдегида, диеновых и триеновых конъюгатов и α-токоферола при одновременном повышении уровня ретинола. В свою очередь, модификация интенсивности процесса свободнорадикального ПОЛ приводит к изменению активности аденилатциклазы и проницаемости плазматической мембраны для ионов Са2+ в клетках периферической крови.
Модификация интенсивности процесса свободнорадикального ПОЛ при воздействии γ-излучения в дозах 0,1 и 0,5 Гр может быть одним из факторов повышения радиорезистентности организма животных к последующему облучению в больших дозах. Поэтому целью исследования стала оценка интенсивности процесса свободнорадикального ПОЛ в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной (2 Гр) и летальной (6 Гр) дозах однократно и повторно после пролонгированного облучения в дозах 0,1 и 0,5 Гр.
Мирзоев Э.Б.* – вед. науч. сотр., д.б.н.; Кобялко В.О. – ст. науч. сотр., к.б.н. ГНУ ВНИИСХРАЭ.
Материалы и методы
Эксперименты были проведены на 23 овцах породы «Прекос» (живая масса 30-37 кг; возраст 1-1,5 года). Животных содержали в условиях вивария ГНУ ВНИИСХРАЭ Россельхозакаде-мии. Рационы овец были сбалансированы по основным питательным веществам согласно нормам ГНУ ВИЖ Россельхозакадемии [10].
Первая серия экспериментов выполнена на 11 овцах. Две группы подопытных животных (по 4 головы в каждой) через девять месяцев после пролонгированного воздействия Y-излучения в дозах 0,5 и 0,1 Гр, были повторно облучены в сублетальной (2 Гр) и летальной (6 Гр) дозах соответственно. Контрольную группу составили интактные животные (3 головы).
Вторая серия опытов проведена на 12 овцах. Две группы подопытных животных (по 4 головы в каждой) были облучены однократно в сублетальной (2 Гр) и летальной (6 Гр) дозах. Контролем служили интактные животные (4 головы).
Облучение овец проводили на установке ГУЖ-24 с источником излучения 137Cs (энергия Y-квантов 0,67 МэВ). Мощность дозы Y-излучения составляла 1,5 Гр/час. Интенсивность и равномерность облучения контролировали с помощью клинического дозиметра типа 27012 и сферической ионизационной камеры АК-253. Неравномерность облучения не превышала 15%.
Кровь отбирали из яремной вены овец в пробирки с цитратом натрия (конечная концентрация 0,38%) на 1-е, 2-е, 3-и, 5-е, 7-е, 10-е, 15-е, 20-е, 25-е и 30-е сутки. Плазму крови получали общепринятым способом. В плазме крови животных исследовали динамику показателей свободнорадикального ПОЛ: интенсивность спонтанной хемилюминесценции (СХЛ), содержание малонового диальдегида (МДА), диеновых и триеновых конъюгатов (ДК и ТК), а также концентрации а-токоферола и ретинола. Кроме того, учитывали общее состояние животных, реакцию на внешние раздражители, аппетит, функциональное состояние желудочно-кишечного тракта.
Регистрацию СХЛ осуществляли на собранной из стандартных блоков установке, работающей в квантовометрическом режиме и предназначенной для регистрации сверхслабых световых потоков [5]. Содержание продуктов свободнорадикального ПОЛ МДА, ДК и ТК определяли методом спектрометрии [4, 6]. Оптическую плотность образцов измеряли при длине волны Х=532; Х=233; Х=275 нм соответственно. Концентрации а-токоферола и ретинола - микроколо-ночной высокоэффективной жидкостной хроматографии [15].
Результаты обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента. Различия значений считали достоверными при р<0,05 [7].
Результаты
Лучевое поражение животных сопровождается усилением неферментативных окислительных процессов, возникновением свободных радикалов, гидропероксидов как в липидах, так и водных фазах организма. При активации процесса свободнорадикального ПОЛ возрастает интенсивность хемилюминесценции крови и клеток тканей, которая характеризует окисление белковых, углеводных и липидных компонентов. Кроме того, цепной механизм инициирования этого процесса выявляет многообразие продуктов (МДА, ДК и ТК), количественное определение которых служит оценкой его интенсивности.
Через девять месяцев у овец, подвергнутых пролонгированному воздействию γ-излучения в дозах 0,1 и 0,5 Гр, регистрировали активацию процесса свободнорадикального ПОЛ. Так, интенсивность СХЛ в плазме крови облучённых животных составляла 23,4±6,2 и 25,1±4,8 имп./10 с соответственно, а у интактных – 17,2±0,5 имп./10 с.
Облучение овец в дозе 2 Гр на фоне пролонгированного воздействия γ-излучения в дозе 0,5 Гр ингибировало интенсивность СХЛ в плазме крови (рис. 1). Максимальное уменьшение уровня показателя наблюдали на 5-15-е сутки исследования (34-50% от исходных данных). В то же время однократное острое воздействие в дозе 2 Гр увеличивало интенсивность СХЛ. Величина показателя возрастала на 2-е, 3-и, 20-е и 25-е сутки исследования и составила 162%, 149%, 142% и 161% соответственно (р<0,05).
% от контроля
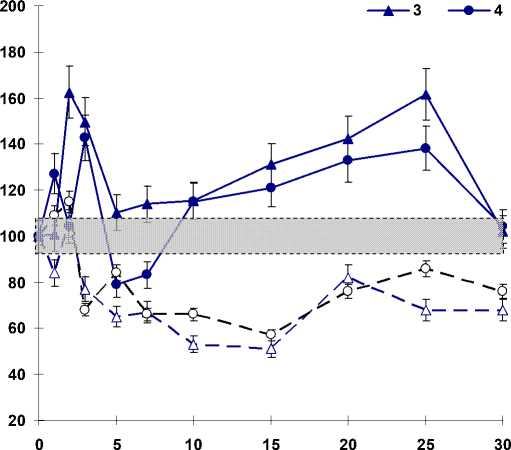
Сроки исследований, сутки
Рис. 1. Интенсивность СХЛ в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,5 и 0,1 Гр.
1 – 0,5+2 Гр; 2 – 0,1+6 Гр; 3 – 2 Гр; 4 – 6 Гр; I1 – контроль.
В плазме крови овец, подвергнутых γ-воздействию в летальной дозе (6 Гр) на фоне пролонгированного облучения в дозе 0,1 Гр, наблюдали нелинейный характер изменений интенсивности СХЛ. Так, к исходу вторых суток значение показателя возрастало на 14%, в период с 3 по 15-е сутки регистрировали снижение её уровня в 1,2 и 1,7 раза. В последующие сроки (20-30-е сутки) отмечали некоторое повышение интенсивности СХЛ, хотя значения её были ниже исходных данных. В то же время однократное острое воздействие в летальной дозе (6 Гр) усиливало интенсивность СХЛ в плазме крови на 1-е и 3 сутки после облучения. Максимальное повышение регистрировали на 3 сутки, что составило 142% от исходных данных (p<0,05). В дальнейшем на 5-е и 7-е сутки наблюдали уменьшение уровня показателя с последующим увеличением на 15-25-е сутки (121-138% от исходных данных, p<0,05).
Следовательно, однократное облучение овец в сублетальной (2 Гр) и летальной (6 Гр) дозах приводит к повышению интенсивности СХЛ в плазме крови. Уровень интенсивности её был сравнительно одинаков, однако при облучении овец в дозе 6 Гр отмечали сдвиг максимума значений к начальным срокам исследования. Кроме того, регистрировали снижение величины показателя относительно исходных данных. Напротив, при повторном облучении овец в дозах 2 и 6 Гр после пролонгированного воздействия в дозах 0,5 и 0,1 Гр наблюдали ингибирование интенсивности СХЛ.
Оценка количества промежуточных и конечных продуктов процесса свободнорадикального ПОЛ выявила следующие особенности. Содержание МДА в плазме крови повторно облучённых овец в дозе 2 Гр имело тенденцию к увеличению (рис. 2). В то же время однократное острое воздействие в дозе 2 Гр повышало уровень МДА в плазме крови овец. Максимальные значения отмечали на 7-е и 15-е сутки.
% от
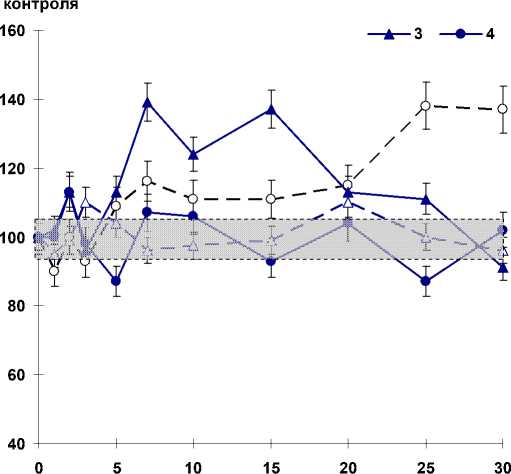
Сроки исследований, сутки
Рис. 2. Концентрация МДА в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,5 и 0,1 Гр.
1 – 0,5+2 Гр; 2 – 0,1+6 Гр; 3 – 2 Гр; 4 – 6 Гр; – контроль.
Облучение овец в летальной дозе на фоне пролонгированного воздействия в дозе 0,1 Гр снижало концентрацию МДА в плазме крови в начальные сроки исследования с последующим повышением на 5-30-е сутки. Напротив, однократное острое воздействие в летальной дозе увеличивало значение показателя к исходу вторых сутки. На 3-и, 5-е сутки и последующие сроки исследования регистрировали фазовый характер изменений. Следует отметить, что минимальные значения этого показателя были ниже исходных данных на 13,7%.
Содержание ДК в плазме крови повторно облучённых животных имело тенденцию к снижению (рис. 3). При однократном остром облучении овец в дозе 2 Гр отмечали нелинейный характер изменений. Так, на 1-е сутки исследования регистрировали тенденцию к увеличению значений показателя, а на 2-е и 3 сутки – снижение. Облучение овец в летальной дозе на фоне пролонгированного воздействия в дозе 0,1 Гр выявило достоверное снижение значений показателя на 30-е сутки. В то же время однократное воздействие в летальной дозе (6 Гр) повышало уровень ДК в период с 1 по 15-е сутки развития лучевой патологии.
% от контроля 1 2
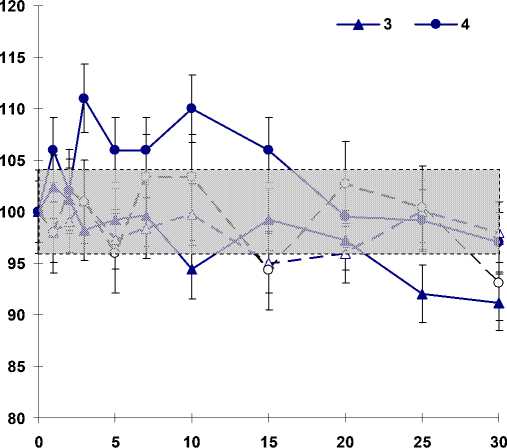
Сроки исследований, сутки
Рис. 3. Содержание ДК в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,5 и 0,1 Гр.
1 – 0,5+2 Гр; 2 – 0,1+6 Гр; 3 – 2 Гр; 4 – 6 Гр; I-___J – контроль.
Определение концентрации ТК в плазме крови овец, подвергнутых повторному острому воздействию γ-излучения в дозе 2 Гр, выявило тенденцию к повышению значений показателя (рис. 4). В то же время концентрация ТК в плазме крови однократно облучённых овец возрастала. На 1-е сутки после воздействия в дозе 2 Гр содержание ТК составило 157% (p<0,05). В дальнейшем на 2-е и 3-и сутки регистрировали некоторое уменьшение уровня показателя, хотя его значения были выше исходных на 20% и 27% соответственно. Максимальное увеличение составило 191% на 20-е сутки исследования (p<0,05).
Облучение овец в летальной дозе на фоне пролонгированного воздействия в дозе 0,1 Гр обнаружило тенденцию к снижению уровня ТК. Следует отметить, что динамика значений показателя при повторном облучении носила нелинейный характер. В то же время однократное острое воздействие в летальной дозе (6 Гр) повышало содержание ТК в плазме крови овец. Так, на 1-е сутки после воздействия значение этого показателя составило 256% от исходных данных (p<0,05). В течение всего периода исследования изменения концентрации ТК в плазме крови носили нелинейный характер при максимуме значений на 10-е сутки (488%, p<0,05).
% от контроля
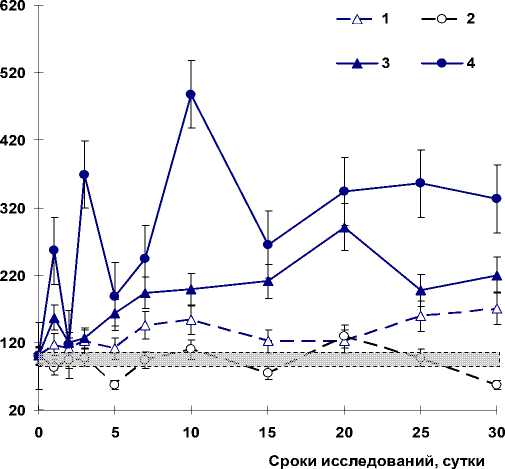
Рис. 4. Содержание ТК в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,5 и 0,1 Гр.
1 – 0,5+2 Гр; 2 – 0,1+6 Гр; 3 – 2 Гр; 4 – 6 Гр; I____1– контроль.
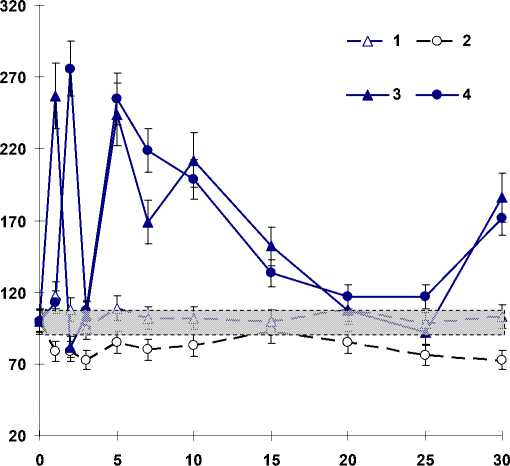
Процесс свободнорадикального ПОЛ регулируется биоантиоксидантами, к числу которых относят α-токоферол и ретинол. Определение концентрации жирорастворимых витаминов в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,1 и 0,5 Гр, обнаружило следующие особенности. Так, у овец, облучённых в дозе 2 Гр, на фоне пролонгированного воздействия в дозе 0,5 Гр в течение всего периода исследования не наблюдали существенных изменений концентрации α-токоферола (рис. 5). В то же время однократное облучение овец в дозе 2 Гр повышало уровень α-токоферола в плазме крови. Достоверные различия значений отмечали на 1-е (257%), 5-10-е (245-210%) и 30-е (186%) сутки.
Облучение овец в летальной дозе на фоне пролонгированного воздействия в дозе 0,1 Гр приводило к уменьшению концентрации α-токоферола в плазме крови. Напротив, однократное острое облучение увеличивало уровень α-токоферола в плазме крови. Максимальные значения показателя регистрировали на 2-е (274%, р<0,05), 5-10-е (253-194%, р<0,05) и 30-е (170%, р<0,05) сутки исследования.
% от контроля
Сроки исследований, сутки
Рис. 5. Содержание α-токоферола в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,5 и 0,1 Гр.
1 – 0,5+2 Гр; 2 – 0,1+6 Гр; 3 – 2 Гр; 4 – 6 Гр; – контроль.
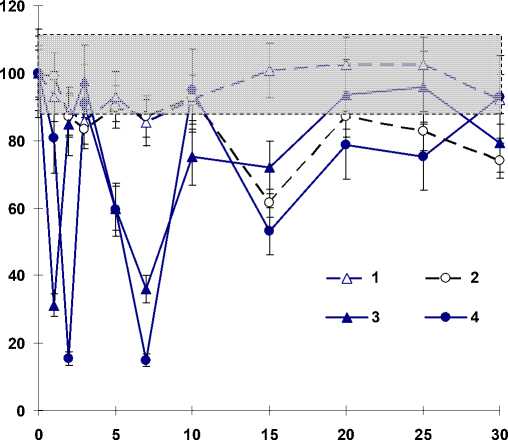
Содержание ретинола в плазме крови овец, подвергнутых острому воздействию γ-излучения в дозе 2 Гр на фоне пролонгированного облучения в дозе 0,5 Гр, было ниже исходных данных в течение первых 10 суток (рис. 6). В последующие сроки уровень этого показателя возрастал до исходных значений. Однократное острое воздействие γ-излучения в сублетальной дозе (2 Гр) также снижало концентрацию ретинола. Так, на 1-е сутки уменьшение составило 68% (р<0,05), а на 5-7-е сутки – 64-40% (р<0,05). В дальнейшем значения показателя возрастали, хотя и были ниже исходных данных.
Облучение овец в летальной дозе (6 Гр) на фоне пролонгированного воздействия в дозе 0,1 Гр приводило к снижению концентрации ретинола в течение всего срока исследования. В то же время однократное острое воздействие γ-излучения в дозе 6 Гр обнаружило нелинейный характер изменений значений показателя. Содержание ретинола на 2-е сутки было ниже исходных данных на 83,7% (р<0,05), а на 5-7-е сутки – на 59,6-85,1% (р<0,05).
Оценка клинических показателей выявила наиболее короткий латентный период и выраженные симптомы лучевой болезни у овец, однократно облучённых в летальной дозе (6 Гр). Через 3 часа после воздействия наступала вялость, а на 7-е сутки отмечали диарею. К концу исследования фиксировали депрессию и эпиляцию. На 25-е сутки пали две овцы, а на 30-е сутки – остальные. В то же время у животных, облучённых повторно в сублетальной и летальной дозах, после пролонгированного воздействия в малых дозах, отмечали сглаженный характер проявления клинических симптомов. Причём, при повторном облучении в летальной дозе гибели овец не наблюдали.
% от контроля
Сроки исследований, сутки
Рис. 6. Содержание ретинола в плазме крови овец, подвергнутых острому воздействию γ-излучения в сублетальной и летальной дозах однократно и повторно после пролонгированного облучения в дозах 0,5 и 0,1 Гр.
1 – 0,5+2 Гр; 2 – 0,1+6 Гр; 3 – 2 Гр; 4 – 6 Гр; C-’-J – контроль.
Таким образом, при повторном остром воздействии γ-излучения в сублетальной (2 Гр) и летальной (6 Гр) дозах через девять месяцев после пролонгированного облучения овец в дозах 0,5 и 0,1 Гр отсутствовала выраженная активация процесса свободнорадикального ПОЛ. В то же время однократное облучение овец в дозах 2 и 6 Гр инициировало процесс свободнорадикального ПОЛ в плазме крови. Следствием активации процесса свободнорадикального ПОЛ явилось изменение концентрации α-токоферола и ретинола. В целом изменения интенсивности процесса свободнорадикального ПОЛ после однократного воздействия γ-излучения в сублетальной и летальной дозах регистрировали до проявления клинических симптомов лучевой болезни, что позволяет рассматривать их в качестве патогенетического фактора.
Обсуждение результатов
Сравнительный анализ показателей процесса свободнорадикального ПОЛ при однократном и повторном облучении овец в сублетальной и летальной дозах выявил различия. Так, при однократном воздействии отмечали увеличение, а при повторном – уменьшение интенсивности СХЛ. Изменения концентрации продуктов свободнорадикального ПОЛ (МДА, ДК и ТК) в плазме крови повторно облучённых животных носили менее выраженный характер.
Модификация ответной реакции организма при однократном и повторном облучении животных в сублетальной и летальной дозах, вероятно, зависит от исходного уровня показателя. Согласно закону исходного уровня (правило Вильдера): если исходный уровень показателя соответствует нижней границе нормы, то ответная реакция состоит в его повышении до средних величин; если он находится близко к верхней границе нормы – реакция заключается в его снижении; если входит в диапазон средних величин – реакция отсутствует [8].
После пролонгированного облучения овец в дозах 0,1 и 0,5 Гр отмечали ингибирование процесса свободнорадикального ПОЛ, которое, возможно, обусловлено модификацией системы антиоксидантной защиты [1, 13], поэтому можно предположить, что предварительное облучение животных изменяет исходный уровень показателя и «границы нормы реакции».
В целом полученные данные демонстрируют, что пролонгированное воздействие ионизирующим излучением в дозах 0,1 и 0,5 Гр модифицирует ответную реакцию организма овец при повторном облучении в сублетальной и летальной дозах и повышает радиорезистентность организма.
Аналогичные результаты получены на лабораторных животных. Установлено, что предварительное облучение мышей в дозе 0,1 Гр за 5 час до воздействия в повреждающей дозе 2 Гр снижает интенсивность процесса свободнорадикального ПОЛ при одновременном уменьшении количества однонитевых разрывов в ДНК тимоцитов и числа клеток в тимусе [14]. Предполагается, что защитный эффект предварительного воздействия связан не только с активацией ферментов репарации ДНК, но и антиоксидантных систем организма, которые ингибируют процесс свободнорадикального ПОЛ, стабилизируют структуры клеточных мембран и уменьшают вероятность окислительной деструкции молекулы ДНК.
Повышение радиорезистентности организма млекопитающих зависит от большего числа факторов, к числу которых можно отнести величину дозы хронического (пролонгированного) и острого облучения, мощности дозы и время после первого воздействия [16, 17, 19]. Полученные результаты указывают на возможность проявления радиорезистентности и через девять месяцев после предварительного пролонгированного облучения в дозах 0,1 и 0,5 Гр. Необходимо отметить, что повышение радиорезистентности овец при повторном облучении в сублетальной и летальной дозах не является классическим примером проявления индукции адаптивного ответа (АО). Однако механизмы их реализации могут быть схожи.
В настоящее время предложены гипотезы, объясняющие развитие АО в клетках млекопитающих [2, 11, 12]. В качестве пускового события рассматриваются свободнорадикальное перекисное окисление плазматической мембраны клеток и активация рецепторов фактора роста [2].
Передача информации от вторичных посредников, в частности от ионов Са2+ и цАМФ, различным белкам внутри клеток происходит путём их фосфорилирования и осуществляется протеинкиназой С. Предполагается, что при действии ионизирующих излучений в малых дозах активность протеинкиназы С за счёт увеличения пассивной проницаемости мембраны для ионов Са2+ и, соответственно, роста его внутриклеточной концентрации поддерживается аномально продолжительное время, что повышает скорость фосфорилирования клеточных белков.
Возможно, протеинкиназа С выполняет ключевую роль и в индукции АО, так как ингибиторы фермента подавляют его развитие [3]. В свою очередь, протеинкиназа С активирует эндонуклеазу [20], которая повышает резистентность клеток к последующему воздействию ионизирующих излучений в больших дозах [18]. Кроме того, протеинкиназа С участвует в экспрессии генов металлотионеинов, так как ингибиторы фермента блокируют индукцию синтеза мРНК металло-тионеинов, а активаторы, напротив, увеличивают. Дополнительным доказательством является то, что антагонисты ионов Са2+ также подавляют развитие АО, индуцированного рентгеновским излучением или H 2 O 2 . Следовательно, полученные нами данные дополняют и подтверждают роль процесса свободнорадикального ПОЛ в повышении радиорезистентности млекопитающих.
Выводы
Показано, что пролонгированное воздействие ионизирующим излучением в дозах 0,1 и 0,5 Гр модифицирует ответную реакцию организма овец при повторном облучении в сублетальной и летальной дозах и повышает радиорезистентность организма. Полученные данные дополняют и подтверждают роль процесса свободнорадикального ПОЛ в модификации радиочувствительности овец и указывают на возможность проявления радиорезистентности через девять месяцев после предварительного пролонгированного облучения в малых дозах.
Список литературы Модификация радиочувствительности овец
- Барабой В.А., Олейник С.А., Блюм И.А., Хмелевский Ю.В. Прооксидантно-антиоксидантный гомеостаз у морских свинок после фракционированного рентгеновского облучения в малых дозах и коррекция его нарушений антиоксидантным комплексом//Радиационная биология. Радиоэкология. 1993. Т. 34, вып. 2. С. 240-246.
- Боднарчук И.А. Гипотеза о механизме индукции адаптивного ответа при облучении клеток млекопитающих в малых дозах//Радиационная биология. Радиоэкология. 2002. Т. 42, № 1. С. 36-43.
- Гильяно Н.Я., Бондарев Г.Н., Бикинеева Е.Г., Красотская Г.И., Носкин Л.А. Влияние ингибиторов протеинкиназы С и NО-синтазы на радиационно-индуцированный цитогенетический адаптивный ответ в клетках китайского хомячка в культуре//Радиационная биология. Радиоэкология. 2001. Т. 41, № 6. С. 659-663.
- Гончаренко М.С., Латинова А.М. Метод оценки перекисного окисления липидов//Лабораторное дело. 1985. № 1. С. 60-61.
- Журавлев А.И., Асанов М.И. Чувствительность и рабочие характеристики современных хемилюминометров//Биофизика. 1991. Т. 36, вып. 3. С. 489-497.
- Журавлев А.И., Мяльдзин А.Р., Баранов А.В. Методы регистрации свободнорадикального окисления липидов в сыворотке, плазме и мембранах клеток крови: Метод. указ. М.: МВА, 1989. С. 12.
- Лакин Г.Ф. Биометрия: учебное пособие для биол. спец. вузов: 4-изд., перераб. и доп. М.: Высшая школа, 1990. 352 с.
- Лейтес С.М. Правила исходного состояния и его значение в физиологии и патологии//Проблемы регуляции обмена веществ в норме и патологии. М.: Медицина, 1977. С. 5-23.
- Мирзоев Э.Б., Кобялко В.О. Интенсивность свободнорадикального перекисного окисления липидов, активность аденилатциклазы и проницаемость плазматической мембраны для ионов Са2+ в клетках периферической крови овец, облучённых в малых дозах//Радиационная биология. Радиоэкология. 2009. Т. 49, № 3. С. 261-267.
- Нормы и рационы кормления сельскохозяйственных животных. Справочное пособие: 3-е издание, переработанное и дополненное/под ред. А.П. Калашникова, В.И. Фисинина, В.В. Щеглова, Н.И. Клейменова. М.: Россельхозакадемия, 2003. 456 с.
- Пелевина И.И., Алещенко А.В., Антощина М.М., Кудряшова О.В., Семенова Л.П., Серебряный А.М. Реакция популяции клеток на облучение в малых дозах//Радиационная биология. Радиоэкология. 2003. Т. 43, № 2. С. 161-166.
- Пелевина И.И., Алещенко А.В., Антощина М.М., Рябченко Н.И., Семенова Л.П., Серебряный А.М. Индивидуальная вариабельность в проявлении адаптивного ответа клеток человека на воздействие ионизирующей радиации и подходы к её определению//Радиационная биология. Радиоэкология. 2007. Т. 47, № 6. С. 658-666.
- Рева А.Д., Живалюк О.Б., Лукьяненко А.И., Егорова Е.Г., Дворецкий А.И. Содержание глутатиона и активность глутатион-S-трансферазы в органах и крови крыс после хронического облучения в малых дозах//Радиационная биология. Радиоэкология. 1994. Т. 34, вып. 6. С. 769-773.
- Рябченко Н.И., Иванник Б.П., Хорохорина В.А., Дзиковская Л.А., Синькова Р.В., Рябченко В.И., Грошева И.П., Дегтярева Е.В. Влияние предварительного адаптирующего облучения на содержание продуктов перекисного окисления липидов в сыворотке крови и повреждение ДНК в тимусе облучённых мышей//Радиационная биология. Радиоэкология. 2000. Т. 40, № 6. С. 659-661.
- Скурихин В.Н., Двинская Л.М. Определение альфа-токоферола и ретинола в плазме крови с/х животных методом микроколоночной высокоэффективной жидкостной хроматографии//Сельскохозяйственная биология. 1989. № 4. С. 127-129.
- Черникова С.Б., Готлиб В.Я., Пелевина И.И. Влияние малых доз ионизирующей радиации на чувствительность к последующему облучению//Радиационная биология. Радиоэкология. 1993. Т. 33, вып. 1(4). С. 537-541.
- Feinendegen L.E. The role of adaptive responses following exposure to ionizing radiation//Hum. Exp. Toxicol. 1999. V. 18, N 7. P. 561-585.
- Ramana C.V., Boldogh I., Izumi T., Mitra S. Activation of apurinic/apyrimidinic endonuclease in human cells by reactive oxygen species and its correlation with their adaptive response to genotoxicity of free radicals//Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 5061-5066.
- Wolff S. The adaptive response in radiobiology: evolving insights and implications//Environ. Health. Perspect. 1998. V. 106, suppl. 1. P. 277-283.
- Yacoub A., Kelley M.R., Deutsch P.W. The DNA repair activity of human redox/repair protein APE/Ref-1 is inactivated by phosphorylation//Cancer Research. 1997. V. 57. P. 5457-5459.


