Модуляция автономной нервной системы с помощью денервации почечных артерий для лечения фибрилляции предсердий
Автор: Заманов Дмитрий Анатольевич, Дмитриев Артем Юрьевич, Шильников Никита Владимирович, Иваницкая Элеонора Эдуардовна, Пустовойтов Андрей Владимирович, Романов Александр Борисович, Покушалов Евгений Анатольевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 4 т.18, 2014 года.
Бесплатный доступ
Автономная нервная система играет ключевую роль в модуляции нормальной электрофизиологии сердца. Несмотря на увеличение количества данных о наличии анатомических и функциональных взаимосвязей между нервной системой и сердцем, остается ряд вопросов [1-11]. Денервация почечных артерий, или ренальная денервация (РД), стала важным интервенционным методом лечения резистентной артериальной гипертензии (АГ). Так как АГ является одним из наиболее распространенных сердечно-сосудистых заболеваний, которое усложняет течение нарушений ритма сердца, особенно фибрилляции предсердий, необходимо исследовать потенциальную ценность РД в качестве антиаритмической терапии.
Ренальная денервация, фибрилляция предсердий, резистентная гипертензия
Короткий адрес: https://sciup.org/142140633
IDR: 142140633 | УДК: 616.124-088
Текст научной статьи Модуляция автономной нервной системы с помощью денервации почечных артерий для лечения фибрилляции предсердий
Автономная нервная система и субстрат для развития фибрилляции предсердий
Данные многих опубликованных исследований продемонстрировали, что автономная нервная система (АНС) вносит ведущий вклад в развитие фибрилляции предсердий (ФП) с симпатическими и парасимпатическими компонентами, играющими важную роль. Так, Amar и соавт. показали, что запуску ФП предшествовало увеличение активности симпатической нервной системы, с последующей модуляцией преобладания вагусного тонуса [12, 13]. В настоящее время существуют убедительные доказательства влияния АНС на инициацию и поддержание ФП [14–17]. Гиперактивность АНС с неконтролируемым выбросом избыточного количества нейротрансмиттеров лежит в основе этих изменений, которые, в свою очередь, приводят к укорочению рефрактерности предсердий [14]. Самые высокие уровни высвобождения нейротрансмиттеров происходят в непосредственной близости от вегетативных ганглиев, сконцентрированных в области ганглионарных сплетений (ГС), взаимодействующих с предсердием и легочными венами. Соответственно, эти нейротрансмиттеры, особенно в локально повышенной концентрации, могут вызвать «быструю» эктопическую активность и, таким образом, служить в качестве «драйверов» для инициирования ФП [18].
Экспериментальные данные показали, что электрическая дисперсия (градиент предсердной рефрак-терности) обусловлена не только градиентом иннервации АНС [19, 20], но также, возможно, связана с градиентом распределения скомпрометированных ГС в миокарде предсердий. Источники патологической активности влияния АНС при ФП включают в себя: афферентные сигналы, идущие от «внешней» и «внутренней» нервной системы (почки, барорецепторы, каротидные тела и внутрисердечные ГС), а также эфферентные сигналы от «внешней» нервной системы, эпикардиальные ГС и/или миокардиальные ГС и группы «внутренней» нейронной сети для модуляции взаимодействия между «внешней» и «внутренней» нервной
системами. Модуляция АНС может быть перспективной стратегией для защиты миокарда от проаритми-ческих вегетативных влияний и развития электрического, вегетативного и структурного ремоделирования предсердия [21]. В настоящее время существует несколько стратегий для модулирования сложных взаимодействий между АНС и сердцем. Тем не менее различные подходы модулирования АНС по-разному влияют на прогноз аритмогенных и/или антиаритмичес-ких эффектов. Эти стратегии в основном основаны на почечной симпатической денервации, аблации ГС, аблации звездчатого ганглия, стимуляции блуждающего нерва и барорефлекторной стимуляции.
Почечная симпатическая денервация – новый метод, который может быть эффективным для контроля резистентной гипертензии [22]. Помимо своего антигипертензивного эффекта почечная денервация может также оказывать антиаритмическое действие как при ФП [23], так и при желудочковых тахиаритмиях [24]. Гипертония является признанным фактором риска для ФП [25, 26], и многие случаи возникновения «изолированной» ФП могут быть связаны со скрытой гипертонией [27]. Симпатическая нервная система также играет важную роль в инициации и поддержании ФП [28, 29]. Увеличение симпатического тонуса часто предшествует ФП [30], и симпатическая гиперактивность может прогнозировать рецидивы ФП после катетерной аблации [31]. Ряд исследований продемонстрировали, что автономная денервация, которая влияет на парасимпатический и симпатический компоненты АНС предсердий, так же снижает рецидивы ФП после изоляции легочных вен [32, 33].
Почечные нервы и ренальная денервация
Почка имеет обширную сеть афферентных немие-линизированных волокон, которые передают важную сенсорную информацию в центральную нервную систему (ЦНС). Афферентные волокна от почек проходят вместе с симпатическими нервами и входят в дорсальные корни спинного мозга. Почечные афферентные нервы несут информацию в ЦНС от почечных хемо- и механорецепторов. Большинство стволовых регионов принимают участие в сердечно-сосудистом контроле, включая гипоталамус, получающий информацию от почечных афферентных волокон [34–36]. Активность афферентных нервных волокон непосредственно влияет на симпатический ответ почкам и другим высоко-иннервируемым органам, участвующим в сердечнососудистом контроле, таким как сердце и сосудистая система.
Почечные симпатические эфферентные нервные волокна стимулируют нейроэффекты через почки. Симпатическая активация юкстагломерулярных клеток приводит к увеличению секреции ренина, снижению выделения натрия с мочой и почечной вазоконстрикции. Эффекты симпатической активации включают в себя снижение почечного кровотока и клубочковой фильтрации через сокращение клеток гладкой мускулатуры сосудистой стенки и вазоконстрикции микрососудов, что приводит к секреции ренина, активации ренин-ангиотензин-альдостероновой системы (РААС) и задержке натрия.
Существуют важные взаимодействия между почками и сердцем при различных сердечно-сосудистых состояниях, которые возникают при участие АНС. К ним относятся активация симпатической нервной системы, активация РААС и секреция вазопрессина. Например, изменение гемодинамики во время ФП приводит к увеличению катехоламинов и симпатического тонуса с уменьшением влияния парасимпатического компонента [37]. Активация симпатической нервной системы является частью эффекта циркуляции ренина, выделяемого почками. Почка получает плотную иннервацию симпатических и сенсорных волокон и может быть объектом симпатической активности и источником сигналов, которые управляют симпатическим тонусом.
Электрическое и структурное ремоделирование вносит фундаментальный вклад в субстрат ФП, и их прогрессирование усиливает развитие и поддержание ФП. РААС может быть вовлечена в развитие данной прогрессии, в частности через действие ангиотензина II и альдостерона. Известно, что почечная симпатическая стимуляция вызывает высвобождение ренина, и, наоборот, ангиотензин II оказывает важное действие в модуляции активности симпатической нервной системы. РААС участвует в образовании миокардиального фиброза и увеличении выброса ангиотензина II, вызывая выраженную дилатацию предсердия с локальным фиброзом и развитие ФП [38]. Ингибирование РААС может оказывать протективный эффект на ремоделирование и ухудшение влияния на возникновение и прогрессирование ФП. Например, ингибирование эндогенного ангиотензина II мешает ожидаемым реакциям электрического ремоделирования при быстрой предсердной стимуляции [39]. Во время непрерывной ФП наличие стойкой повышенной симпатической активности и активности РААС могут взаимно усиливать друг друга.
Существует ряд доказательств, что ингибирование РААС у больных может уменьшить вероятность разви- тия ФП. Например, блокаторы РААС предотвращают развитие рецидивов ФП после изоляции легочных вен у пациентов с нечастыми пароксизмами ФП и сопутствующей гипертонией. Данные мета-анализов продемонстрировали, что частота возникновения ФП у пациентов с гипертензией снижается при применении ингибиторов АПФ (ИАПФ) или ингибиторов рецепторов к ангиотензину [40]. Однако недавно проведенные проспективные исследования не подтвердили значимость ингибирования РААС с помощью медикаментов для предотвращения развития ФП [41].
Еще одно свидетельство в поддержку важности кардиоренального взаимодействия выражалось в наличии гипертрофии левого желудочка, а также при сердечной недостаточности [42–44]. Показано, что почечная симпатическая активация является предиктором общей смертности и необходимости в трансплантации сердца у пациентов с сердечной недостаточностью [45].
Если симпатическая активность усиливает условия, способствующие развитию ФП, модуляция АНС благоприятно влияет на обратное ремоделирование во время ФП. Грудная эпидуральная анестезия снижает афферентную и эфферентную передачу нервного импульса и предотвращает развитие устойчивой ФП, при учащающей стимуляции [46]. Интересно, что локальная аблация симпатовагальных нервов не позволяет достичь того же эффекта в аналогичной модели [47]. В результате можно предположить, что блокада афферентных и эфферентных симпатических волокон является более эффективным методом, чем устранение сердечных эфферентных нервных волокон. В связи с этим важно подчеркнуть, что аблация афферентных и эфферентных почечных симпатических нервов с помощью РД снижает почечную и общую симпатическую активность [48]. Методики, использующие радиоизотопные вещества, применялись для оценки выделения норэпинефрина из почек в кровоток до и после РД. Данные работы показали существенное снижение спилловера норэпинефрина, в дополнение к снижению секреции ренина и увеличению почечного кровотока [49].
Некоторые экспериментальные работы показывают, что наиболее эффективным методом автономной модуляции для устранения запуска ФП является комбинированное влияние на симпатический и парасимпатический компоненты. Patterson и соавт. использовали в эксперименте изолированные муфты легочных вен для демонстрации синергичного влияния запуска ФП с помощью симпатической и парасимпатической стимуляции [50]. И, наоборот, подавление транзита Ca и ин- гибирование Na/Са обмена снижает аритмогенность. Если комбинированная блокада АНС (симпатического и парасимпатического компонентов) необходима для оптимального подавления ФП, локальную сердечную денервацию можно считать логичным методом лечения. Если это так, то РД может быть наиболее эффективным или единственным методом лечения, то есть снижение повышенного артериального давления придает также антиаритмический ответ. С другой стороны, если РД вызывает более тщательную симпатическую денервацию, чем альтернативные методы (например бета-блокаторы, аблация сердечных вегетативных ганглиев), то это может способствовать мощному антиаритмическому ответу, если сопровождающаяся парасимпатическая блокада не является целью лечения.
Экспериментальные данные в модели на животных
Недостаточный контроль повышенного АД отрицательно сказывается на результатах катетерной аблации ФП. Так, Lau и соавт. показали в модели ФП на овцах, что у группы животных с гипертензией развивалось прогрессивное увеличение среднего артериального давления, более длительный рефрактерный период предсердий, прогрессивная гипертрофия обоих предсердий, дисфункции ЛП и высокая индуцируемость ФП с повышенным воспалением после 5 недель гипертензии [51].
В модели на свиньях при частой стимуляции предсердий РД вызывала подавление сердечного симпатического тонуса с отрицательным хронотропным и дромотропным эффектами, удлинение эффективного рефрактерного периода АВ-узла и антеградной точки Венкебаха, а также улучшение контроля частоты при индуцированной ФП [52]. Интересно, что продолжительность индуцированных эпизодов ФП была сокращена после РД по сравнению с группой контроля, однако индуцируемость ФП не изменялась. Это может быть связано с тем, что РД не оказывает влияния на индуцируемое предсердной стимуляцией укорочение рефрактерного периода или внутрипредсердное проведение. Результаты этого исследования указывают на то, что РД может быть использована для контроля частоты при ФП.
Zhao и соавт. использовали частую предсердную стимуляцию в модели на собаках и показали, что количество эпизодов и продолжительность ФП уменьшились после выполнения РД вследствие снижения активности РААС [53].
В модели обструктивного ночного апноэ на свиньях РД подавляла укорочение рефрактерности предсердий и снижала вероятность возникновения ФП [54].
После РД эфферентные нервы вызывают функциональную реиннервацию почечной сосудистой стенки с полным восстановлением нервной функции к 8-й неделе [55]. Таким образом, возможно, что некоторая эфферентная симпатическая реиннервация может возникать у пациентов после РД, хотя величина и время данного процесса неизвестна. Интересно, что в отличие от эфферентных нервов афферентные нервы не имеют возможности к регенерации [56].
Клинический опыт
Гипертония является важным фактором риска для развития ФП. Возникновение ФП также увеличивается при гипертрофии левого желудочка, ишемической болезни сердца, сердечной недостаточности и всех последствий плохо контролируемой гипертензии. Данные проведенного пилотного рандомизированного исследования показали, что РД обеспечивает уменьшение рецидивов ФП после изоляции легочных вен у пациентов с симптоматической и рефрактерной к медикаментозной терапии ФП в сочетании с резистентной гипертензией [23]. Механизмы, с помощью которых РД приводит к данному эффекту, могут быть следующие: за счет улучшения контроля артериального давления и снижения центральной симпатической стимуляции. Снижение центрального симпатического тонуса очень важно, и РД, таким образом, может быть эффективна у пациентов без гипертензии или с умеренно резистентной гипертензией.
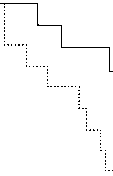
В данное рандомизированное исследование было включено 27 пациентов (14 пациентам выполнялась только изоляция легочных вен, 13 пациентам – изоляция легочных вен в сочетании с РД). Период наблюдения пациентов составил 12 месяцев. 9 (33%) пациентов имели пароксизмальную форму ФП, а 18 (67%) – персистирующую ФП. У всех пациентов была резистентная к терапии гипертензия, несмотря на лечение тремя антигипертензивными препаратами. В конце периода наблюдения у 9 (69%) из 13 пациентов с ИЛВ и РД отсутствовали пароксизмы ФП по сравнению с 4 (29%) из 14 пациентов, которым была выполнена только ИЛВ (р = 0,033) (рис. 1). Никто из пациентов не принимал антиаритмическую терапию. У пациентов, которым была выполнена только ИЛВ, не было выявлено каких-либо значимых изменений систолического (САД) или диастолического (ДАД) артериального давления. В свою очередь, у пациентов, которым была выполнена
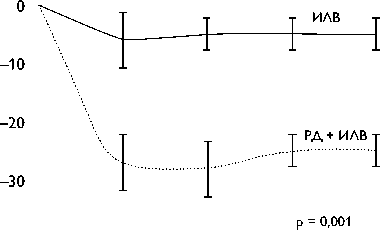
РД, отмечалось значительное снижение систолического и диастолического артериального давления при каждом периоде контроля через 3, 6, 9, и 12 мес. после оперативного вмешательства. Через 12 мес. после операции систолическое и диастолическое артериальное давление было значительно ниже по сравнению с только ИЛВ и составило 25±5 и 10±2 мм рт. ст. соответственно (р <0,001 по сравнению с ИЛВ; рис. 2). Средняя масса миокарда ЛЖ в группе ИЛВ в сочетании с РД была снижена примерно на 10%.
Недавний анализ двух проспективных рандомизированных исследований подтвердил предыдущие данные, но на большем количестве пациентов с более разнообразными подгруппами. Основной вывод данной работы – РД снижает вероятность возникновения ФП при сочетании с ИЛВ у пациентов с артериальной гипертонией [57]. Наиболее выраженный эффект наблюдался у пациентов с резистентной АГ и персистирующей ФП, хотя также наблюдалась тенденция к эффективности данной терапии у пациентов с умеренной гипертензией и пароксизмальной ФП (рис. 3). Однако результаты у данной подгруппы были недостоверны, что возможно вследствие небольшого количества пациентов. Использование РД у пациентов с умеренной гипертензией, а также с пароксизмальной формой ФП нуждается в дальнейшем изучении.
Результаты проведенного исследования не могут ответить на вопрос, каким образом происходит эффект от РД: за счет снижения сосудистого тонуса и предна-грузки на предсердия или за счет уменьшения симпатической активности или сочетания этих двух эффектов. Гипертензия является наиболее распространенной причиной ФП [58, 59], и контроль за повышением АД должен достигаться у пациентов, направленных на изоляцию ЛВ.
Персистирующая ФП, связанная с процессами ремоделирования субстрата наряду с триггерной активностью из легочных вен также может являться «мишенью» для РД. Это преимущество, несмотря на позитивную тенденцию, не было статистически значимым у пациентов с пароксизмальной ФП. Возможно, что у пациентов с пароксизмальной ФП устранение симпатической гиперактивности и/или снижение предсердной нагрузки через лечение гипертонии не может быть достаточным для достижения большого количества эффективных клинических исходов или сама процедура изоляции ЛВ имеет достаточно хорошую эффективность и вклад РД не является столь существенным.
В двух вышеперечисленных исследованиях РД привела к значительному снижению систолического и диа-
1,0
0,8
н с е 0,6
0,4
б
0,2
69%
РД + ИЛВ
29%
ИЛВ
0,0
p = 0,033
2 4 6 8 10 12
Месяцы после операции
Рис. 1. Отсутствие рецидивов фибрилляции предсердий и предсердных тахикардий (ПТ) у пациентов после изоляции легочных вен и изоляции легочных вен в сочетании с ренальной денервацией в течение периода наблюдения 12 мес.
Систолическое АД
–40
Месяцы
Диастолическое АД
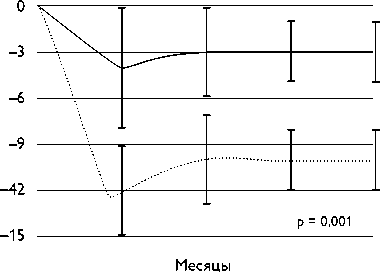
Рис. 2. И зменение систолического и диастолического артериального давления от первоначальных значений в течение периода наблюдения.
столического артериального давления. Эти результаты сопоставимы с данными ряда других исследований, таких как Symplicity HTN-1, 2 и работы Ott и соавт. [60] по влиянию РД у пациентов с умеренной резистентной гипертензией. Несмотря на отрицательные результаты Symplicity HTN-3, многочисленные исследования подтвердили эффективность ренальной денервации для снижения АД в отдаленный период наблюдения [61].
В наших исследованиях мы использовали высокочастотную стимуляцию (ВЧС) для интраоперационной оценки эффективности РД. Данная методика является очень важным «онлайн» инструментом «острой» оценки процедуры РДН. Мы выявили, что ВЧС, проведенная в устье каждой почечной артерии до РД, вызвала резкое увеличение артериального давления (в среднем на 30 мм рт. ст.) и может быть использована для под-
|
Подгруппы ИЛВ, n ИЛВ + РДН, n Все пациенты 39/23 41/15 Пар/Перс с ФП Пароксизмальная ФП 18/7 17/4 Персистирующая ФП 21/16 24/11 Умеренно резистентная / Резистентная АГ Умеренно резистентная АГ 21/10 23/8 Резистентная АГ 18/13 18/7 Второй уровень взаимосвязи Пароксизмальная ФП умеренно резистентная АГ 12/5 13/3 Пароксизмальная ФП резистентная АГ 6/2 4/1 Персистирующая ФП умеренно резистентная АГ 9/5 10/5 Персистирующая ФП резистентная АГ 12/11 14/6 |
—■— |
ОР (95% ДИ), р р* для взаимосвязи 0,45 (0,23–0,86) 0,009 0,827 0,47 (0,14–1,6) |
|||
|
0,39 (0,18–0,85) 0,409 0 56 (0 22–1 4) |
|||||
|
0,37 (0,14–0,93) 0,43 (0,1–1,8) |
|||||
|
0 61 (0 06–6 8) 0,69 (0,2–2,4) |
|||||
|
0,25 (0,09–0,72) |
|||||
0,125 0,25 0,50 1,00 2,00 4,00 8,00
ИЛВ + РДН ИЛВ
Рис. 3. Отношение рисков (ОР) для рецидивов ФП. Основной эффект статистической модели рассчитан с помощью пропорциальной регрессии рисков с поправками на тип исследования и фибрилляции предсердий.
а
б
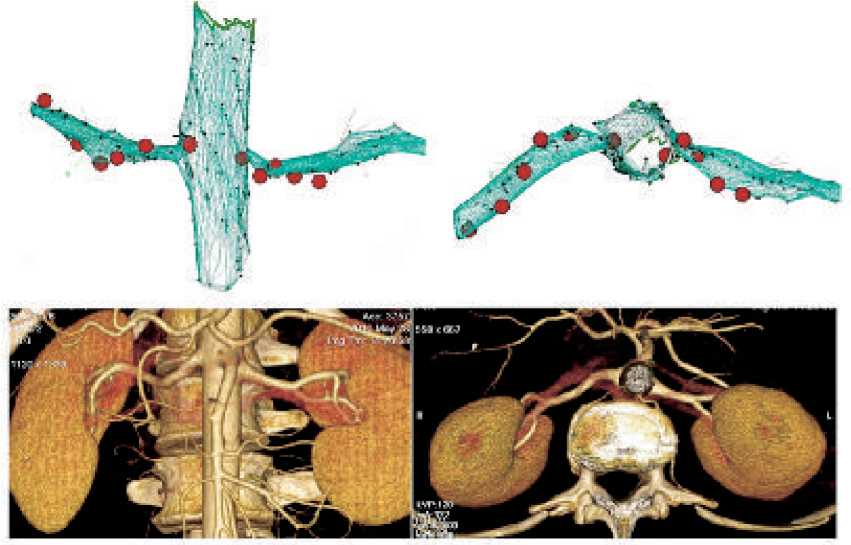
Рис. 4. Представлены: а – 3D-реконструкция аорты и почечных артерий. Коричневые точки – области радиочастотных воздействий; б – данные МРТ через 6 мес. после ренальной денервации (отсутствие стенозов в почечных артериях).
Левая почечная артерия
Правая почечная артерия
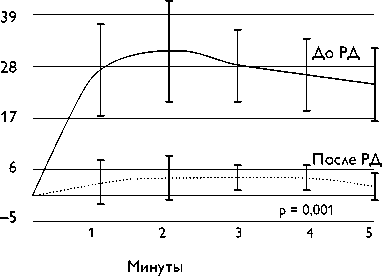
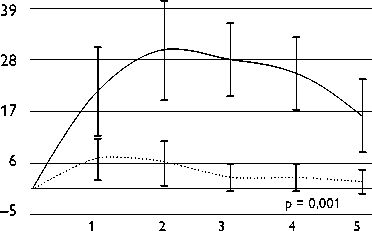
Рис. 5. Изменение систолического артериального давления от первоначальных значений (непрерывное прямое измерение артериального давления) после выполнения высокочастотной стимуляции в правой и левой почечных артериях.
Минуты
тверждения эффективности РД. Данные наблюдения схожи с анатомическими данными Norvell и соавт. которые показали, что аортопочечные ганглии расположены вблизи устьев почечных артерий и аорты [62].
Тем не менее существует ряд ограничений в вышеупомянутых исследованиях. Во-первых, в данных работах использовалось «офисное» измерение АД, согласно рекомендациям Европейского общества кардиологов и Европейского общества гипертензии [63, 64]. При использовании 24-часового мониторинга АД, результаты могли быть разные. Во-вторых, в исследования было включено относительно небольшое количество пациентов. Кроме того, 60 из 146 пациентов были исключены из исследования вследствие отказа от участия или «сложной» анатомии почечных артерий. Таким образом, полученные результаты требует подтверждения в более крупных исследованиях.
Техника выполнения почечной денервации
В исследованиях ИЛВ в сочетании с РД, процедура ренальной аблации производилась с двух сторон сразу после выполнения изоляции легочных вен. Детальная методика РД была подробно описана ранее [23, 57, 65]. Анатомия почечных артерий оценивалась с помощью ангиографии. У ряда пациентов выполнена трехмерная реконструкция аорты и почечных артерий с помощью навигационной системы CARTO XP, и для аблации использовался катетер Navistar Thermocool
(Biosense-Webster Inc., Diamond Bar, CA), который использовался для ИЛВ (рис. 4). Некоторым пациентам РД выполнялась с использованием системы Symplicity (Medtronic Inc., CA). Картирование почечных артерий и ренальная денервация выполнялись при седации пациентов пропофолом. РД выполнялась от дистальной части почечной артерии (первое воздействие) сразу после бифуркации по «спиралевидному» направлению к устью при мощности воздействия от 8–12 Вт (снижение сопротивления более чем на 10%). Продолжительность каждого воздействия составляла от 60 до 120 с, при количестве до 6 воздействий (расстояние между воздействиями более 5 мм).
Для интраоперационного подтверждения эффективности почечной денервации использовалась высокочастотная стимуляция до воздействия и после каждой аблации. ВЧС выполнялась в устье каждой почечной артерии при частоте 20 Гц с амплитудой 15 В и длительностью импульса 10 мс (стимулятор B-53, Биоток Inc., Россия) в течение 10 с. Почечная симпатическая денервация считалась достигнутой, когда внезапное повышение АД (более чем на 15 мм рт. ст. при инвазивном мониторинге) не достигалось после РД при повторной ВЧС (рис. 5).
Имеющиеся данные свидетельствуют о том, что вегетативные влияния способствуют развитию ФП. Таким образом, модуляция вегетативной нервной системы является перспективной стратегией в качестве антиаритмической терапии. Необходимы более крупные рандомизированные исследования для выявления определенных эффектов различных стратегий лечения фибрилляции предсердий.


