Модуляция жизнеспособности клеток, иммобилизованных в пористо-проницаемом инкубаторе из никелида титана, под действием инфракрасного и ультрафиолетового излучений
Автор: Гюнтер Сергей Викторович, Кокорев О.В., Ходоренко В.Н., Дамбаев Г.Ц.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4-2 т.19, 2015 года.
Бесплатный доступ
Клеточный ответ на электромагнитное излучение зависит от многих факторов, в том числе клеточного микроокружения. Клетки по-разному реагируют пн исследуемые типы излучения малой интенсивности. Воздействие инфракрасного и ультрафиолетового излучений малой интенсивности приводит к достоверному изменению количества жизнеспособных клеток. Жизнеспособность клеток опухоли Эрлиха, селезенки и костного мозга мышей С57ВЛ/6 в пористо-проницаемом инкубаторе из никелида титана изменяется при облучении инфракрасным и ультрифиолетовым спектрами электромагнитного излучения. Инфракрасное излучение вызывает увеличение жизнеспособности клеток опухоли Эрлиха, костного мозга и селезенки в 4,6, 2,5 и 1,3 раза, ультрафиолетовое излучение - в 3,9, 1,5 и 1,2 раза соответственно по сравнению с контрольной, в которой инкубировали клетки только при естественном освещении.
Скаффолд, экстрацеллюлярный матрикс, инкубатор-носитель клеток, пористый никелид титана, инфракрасное и ультрафиолетовое излучения
Короткий адрес: https://sciup.org/142140718
IDR: 142140718
Текст научной статьи Модуляция жизнеспособности клеток, иммобилизованных в пористо-проницаемом инкубаторе из никелида титана, под действием инфракрасного и ультрафиолетового излучений
Введение в практику экспериментальной биологии и медицины методов длительного культивирования клеток, в том числе клеток-предшественников специализированных тканей, создало предпосылки для разработки новых технологий заместительной клеточной и тканевой терапии и конструирования биоискусственных органов [1, 2].
Ответственный этап использования культивированных клеток – трансплантация в зону повреждения. Успех предшествующей работы и эффект лечения зависят от того, какая часть клеток попадет в зону дефекта, адгезируют ли культивированные клетки к тканям, сохранят ли они активное функциональное состояние. С точки зрения создания технологии пересадки выращенных in vitro клеток немаловажно обеспечение оптимальных условий реципиентного ложа. Проблемой остается длительное сохранение функциональной активности имплантированных клеток in vivo. Простое введение суспензии клеток-предшественников оказалось малоэффективным, поэтому возникла необходимость поиска адекватного носителя для трансплантации клеток в организм реципиента [3–7].
Используемый клеточной и тканевой инженерией междисциплинарный подход направлен в первую очередь на создание композиционных материалов для восстановления утраченных функций отдельных тканей или органов в целом. Основные принципы этого подхода заключаются в разработке и применении при имплантации в поврежденный орган или ткань носителей из различных биоматериалов, которые используются в сочетании с донорскими клетками и/или биоактивными веществами [8–9].
Материалы, применяемые в тканевой инженерии, должны обладать широким спектром специфических свойств. До тех пор пока новая ткань организма-хозяина в месте имплантации полностью не восстановится,
материал, применяемый для изготовления конструкции, должен поддерживать рост клеток и их организацию в ткань, а имплантат – беспрепятственно отводить продукты обмена клеток [8].
Матриксы (скаффолды) должны обладать многофункциональностью: эластичностью и механической прочностью; биосовместимостью на белковом и клеточном уровне; способностью создавать условия для прикрепления клеток и стимулировать пролиферацию и дифференциацию клеток; возможностью стерилизации без изменения медико-технических свойств. Для реализации потенциала культивированные клетки, организованные в сложные трехмерные структуры, должны определенное время находиться в зафиксированном к носителю состоянии [8–10].
В последние годы активно используют пористо-проницаемые инкубаторы из никелида титана в конструировании биосовместимых матриксов применительно к задачам тканевой инженерии и трансплантологии. Многообещающей является перспектива использования биоматриксов для регенерации поврежденных опухолями и другими этиологиями тканей желез и печени, изготовления биоимплантатов кровеносных сосудов и воздухоносных путей, закрытия дефектов мягких и костных тканей [11– 14].
Методы выделения необходимого количества жизнеспособных клеток не всегда обеспечивают нужный результат, при этом качество взятой у больного ткани различно и зависит от многих причин: степени заболевания пациента, возраста, количества пунктата и т. д. Одна из актуальных проблем клеточной трансплантологии – достижение необходимого количества жизнеспособных клеток для трансплантации. Исследователи эту проблему решают различными путями: совершенствованием методов выделения клеток, увеличением количества взятого биоматериала, применением различных биостимуляторов роста и пролиферации с использованием как химических, так и физических факторов [15–17].
Сложным и важным физическим фактором, воздействующим на клеточные процессы, является электромагнитное излучение. Биологическое поле клеток постоянно изменяется под действием различных видов электромагнитного излучения, существующих как между клетками и тканями, так и с пространством биосферы. Незначительные вариации параметров облучения могут вызывать изменение реакции клеток, вплоть до их гибели, поэтому какая-либо некорректность постановки опыта и задания начальных условий иссле- дования может привести к недостоверным результатам [18, 19].
Электромагнитные волны модифицируют состояние билипидной клеточной мембраны, усиливая или уменьшая проникновение воды в цитоплазму клетки, при этом изменяя поляризацию мембраны и тем самым сигнальную систему клетки. Эти эффекты заметны при увеличении интенсивности излучения – улучшение циркуляции крови в капиллярах и т. д. [20, 21].
При воздействии на ткани инфракрасного (ИК) излучения происходит его поглощение молекулами воды, кислородом, ферментами, мембранами клеток и другими структурами. Выделяющееся при излучении тепло увеличивает колебательную энергию молекул, изменяя процессы в термодинамической системе. Под действием ИК-излучения усиливается биологическая активность клеток, ускоряется кровоток, повышается деятельность желез, снимается мышечный спазм, снижается болевой синдром и т. д. [22, 23].
Под влиянием ультрафиолетового (УФ) излучения изменяются свойства биополимеров – белков и нуклеиновых кислот. Молекулы биополимеров содержат кольцевые группы молекул, которые интенсивно резонируют, то есть поглощают излучение с короткой длиной волны (около 280 нм). Эта поглощенная энергия может передаваться по цепи атомов в пределах молекулы без существенной потери, пока не достигнет слабых связей между атомами и не разрушит их. В течение такого процесса, называемого фотолизом, образуются части молекул, радикалы и ионы, воздействующие на клеточные структуры. Примером служит денатурация белков под действием ультрафиолетового излучения. УФ-излучение, взаимодействуя с веществом, в том числе органическим, часто вызывает его ионизацию, так называемый фотоэлектрический эффект, нарушающий биохимические реакции в клетках. [24]. Таким образом, реакция клеток на электромагнитное воздействие индивидуальна и зависит от множества факторов, включая клеточное микроокружение.
Цель работы – исследование воздействия электромагнитных волн УФ (370 нм) и ИК (860 нм) диапазонов малой интенсивности на клетки различных биологических тканей (селезенки, костного мозга и аденокарциномы Эрлиха), иммобилизованные в пористо-проницаемом инкубаторе из никелида титана (патент на изобретение № 2438699 «Способ изготовления вакцины для лечения аденокарциномы Эрлиха в эксперименте» от 10.01.2012) [25]. В работе поставлены задачи: определить степень воздействия излучения малой интенсивности на клеточную суспензию и

Рис. 1. Пористо-проницаемые инкубаторы из никелида титана, применяемые в клеточной терапии: а – инкубаторы; б – единичный инкубатор
б

Размер:
2,5 х 2,5 х 4 мм
провести сравнительный анализ жизнеспособности клеток, иммобилизованных в пористо-проницаемом никелиде титана, при ИК- и УФ-облучениях.
Материал и методы
В работе использовали пористо-проницаемые инкубаторы из никелида титана, разработанные в НИИ медицинских материалов и имплантатов с памятью формы (Томск, Россия).
Пористые инкубаторы получены методом саморас-пространяющегося высокотемпературного синтеза с проницаемой пористостью около 70%. Инкубаторы вырезаны электроэрозионным способом из медицинского сплава ТН-10 (рис. 1).
Топографию поверхности образцов и структуру порового пространства изучали с использованием растрового электронного микроскопа Quanta 200 3D.
Животные – мыши С57BL\6, массой 20–24 г, возраст 18–12 недель, самцы.
Опухоль – карцинома Эрлиха (асцитный вариант), доза перевивки 5 х 106 клеток.
Выделяли клетки из асцетической жидкости мышей C57BL/6 методом центрифугирования. Затем ресуспен-дировали в полной культуральной среде, состоящей из среды RPMI-1640 (ООО «Панэко», Москва) c 10% эмбриональной телячьей сывороткой, 250 мг/л глутамина и 40 мкг/мл гентамицина (ООО «Панэко», Москва). В аналогичной среде использовали клетки костного мозга и селезенки мышей C57BL/6, полученные по соответствующим методикам.
Раскапывали клетки в 96-луночный планшет по 2 х 105 клеток на лунку, сверху размещали конструк- цию со встроенными светодиодами необходимой длины волны. Облучение проводили на расстоянии 1 см от поверхности жидкости. Культивировали клетки необходимое время в светонепроницаемом СО2-ин-кубаторе при 37 °C и 100% влажности. По окончании культивирования подсчитывали их жизнеспособность с помощью трипанового синего. Для каждого светодиода отводили 3 лунки с образцами клеточной суспензии. Предварительно в опытные лунки добавляли стерильные образцы из пористо-проницаемого никелида титана размером 2,5 х 2,5 х 2 мм, составляющие приблизительно 1/10 культурального объема.
Группы сравнения: первая (контроль) – процент жизнеспособных клеток в культуральной среде; вторая – процент жизнеспособных клеток в присутствии пористого никелида титана; третья – процент жизнеспособных клеток после облучения ИК-спектром малой интенсивности в присутствии пористого никелида титана (контрольная культура облучалась аналогичное время дневным искусственным светом); четвертая – процент жизнеспособных клеток после облучения УФ-спектром малой интенсивности в присутствии пористого никелида титана (контрольную культуру облучали аналогичное время дневным искусственным светом).
Воздействие облучения на клетки и образцы инкубаторов осуществлялось светодиодами типа L-53SF6C (ИК-излучение) и LLT-UVLED11 (УФ-излучение) (Китай) в течение 4 ч при мощности излучения 4–6 мВт/см2 и последующим адаптационным периодом 20 ч. После 30 мин обработки 0,25% раствором трипсина-ЭДТА планшеты центрифугировались. Ресуспендировали клеточные суспензии и подсчитывали количество жизнеспособных клеток с помощью 0,4% трипанового сине-

Рис. 2. Клетки на поверхности образца из никелида титана (SEM) на 7-е сутки после засева: а – селезеночные; б – опухолевые

го. Далее вычисляли процент трипаннегативных клеток от общего количества и анализировали данные статистически.
Статистическую обработку проводили общепринятыми методами с помощью программного пакета Statistica 6.0. Поскольку в исследовании присутствовали выборки, закон распределения числовых показателей в которых отличался от нормального, по данным проверки при помощи критерия Колмогорова – Смирнова, до- стоверность различий изучаемых признаков проверяли при помощи непараметрического U-критерия Манна – Уитни (попарные сравнения независимых совокупностей показателей).
Результаты
Исследования взаимодействия различных клеток с поверхностью пористо-проницаемого никелида титана показали, что поверхность материала является ад-
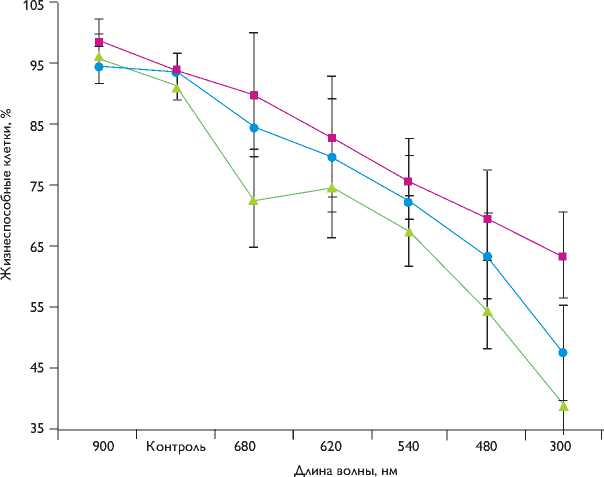
• Селезенка
■ Опухоль Эрлиха
-A- Костный мозг
Рис. 3. Жизнеспособность клеток-мишеней при воздействии излучения различных длин волн малой интенсивности в течение 4 ч
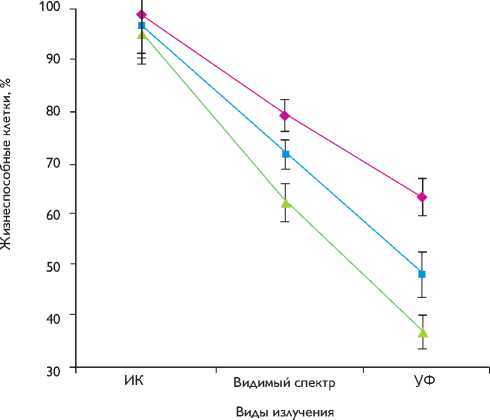
Рис. 4. Сравнение искусственного дневного облучения клеточных популяций с ИК- и УФ-спектрами
-
• Опухоль Эрлиха
-
■ Селезенка
Костный мозг гезирующей и биосовместимой с этим типом клеток подложкой. На внутренней поверхности образцов из никелида титана наблюдали прикрепленные размножающиеся клетки (рис. 2). Опухолевые клетки активно росли и размножались в пористом пространстве инкубатора из никелида титана и заполняли все поры инкубатора в течение 28–30 суток в условиях in vitro.
В исследованиях по влиянию ИК- и УФ-облучений на клетки опухоли Эрлиха, селезенки и костного мозга мышей линии С57BL/6 отмечено, что значимые показатели прослеживаются при воздействии излучения на клетки более 4 ч (рис. 3).
При воздействии ИК-излучения малой интенсивности на все исследуемые популяции клеток наблюдается достоверное повышение количества жизнеспособных клеток по сравнению с искусственным дневным облучением. При УФ-излучении – достоверное снижение жизнеспособности клеточных популяций (рис. 4).
В организме человека клеточное микроокружение и глубина залегания клеток от поверхности играют основную роль в защите от различного вида излучений. Мы попытались охарактеризовать действие ИК- и УФ-излучений на клеточные суспензии, иммобилизованные в пористо-проницаемом никелиде титана.
Отмечено достоверное изменение жизнеспособности клеточных культур в культуральной среде пористого никелида титана с последующим действием излучения. В эксперименте получено однонаправленное действие обоих излучений диапазона волн: инфракрас- ное излучение вызывает увеличение жизнеспособности клеток опухоли Эрлиха, костного мозга и селезенки в 4,6, 2,5 и 1,3 раза, ультрафиолетовое – в 3,9, 1,5 и 1,2 раза соответственно по сравнению с контрольной, в которой инкубировали клетки только при естественном освещении (рис. 5).
Такая реакция клеток на ИК- и УФ-излучения связана с преобразованием энергии спектров излучений в тепловую энергию пористых инкубаторов из никелида титана. При этом происходит сглаживание тепловой энергии в водной среде инкубатора, проявляющееся в возникновении «мягкого» градиента воздействия температуры на клеточную пролиферацию. Инфракрасное и ультрафиолетовое излучения нагревают стенки пор инкубатора и матричную основу, а жидкая окружающая среда за счет проницаемой структуры инкубатора не позволяет разогреваться до критических (для клеток) температур (43–45 °С), что оказывает благоприятное воздействие на процессы клеточной пролиферации (быстроделящихся) стволовых и опухолевых типов клеток. Более того, пористый инкубатор создает экран от прямого воздействия ультрафиолетовых лучей, предохраняя клетки от деградирующего влияния.
Заключение
Полученные данные показывают, что ИК- и УФ-излучения малой интенсивности изменяют жизнеспособность клеток и численность клеточных популяций костного мозга, опухолевых клеток и клеток селезенки:
■ Опухоль Эрлиха

Костный мозг
■ Селезенка
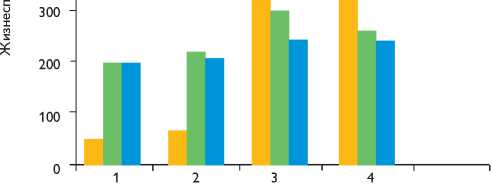
Группа
Рис. 5. Зависимость жизнеспособных клеток опухоли Эрлиха, костного мозга и селезенки от типа воздействия в различных условиях: 1 – питательной среде; 2 – пористых инкубаторах из никелида титана без облучения; 3 – пористых инкубаторах из нике-лида титана после инфракрасного облучения; 4 – пористых инкубаторах из никелида титана после ультрафиолетового облучения
активно повышают (ИК-спектр) или подавляют пролиферативную активность (УФ-спектр).
Эффект воздействия ИК-спектра можно применять в реанимации популяции клеток после выделения из тканевых структур для увеличения количества малочисленной популяции до необходимой величины. Также действие УФ-спектра, возможно, найдет применение в уничтожении остаточных опухолевых очагов или других патологических клеточных популяций.
Присутствие пористо-проницаемых инкубаторов из никелида титана изменяет параметры взаимодействия клеток костного мозга, опухолевых клеток и клеток селезенки с внешней средой, увеличивая их жизнеспособность и пролиферативные потенции. Даже клеточные популяции при УФ-облучении в условиях пористого инкубатора изменяют модуль жизнеспособности на положительный. Аналогичный эффект можно наблюдать и в живых организмах при ультрафиолетовом излучении.
Результаты данного исследования используют при разработке инкубаторов-носителей клеточных культур с размещением в матричной пористой структуре инкубатора миниатюрного генератора электромагнитного излучения с заданными параметрами воздействия.
Работа выполнена при поддержке программы «Научный фонд им. Д.И. Менделеева Национального исследо- вательского Томского государственного университета» (№ проекта 8.1.42.2015).
Список литературы Модуляция жизнеспособности клеток, иммобилизованных в пористо-проницаемом инкубаторе из никелида титана, под действием инфракрасного и ультрафиолетового излучений
- Badylak S.F., Taylor D., Uygun K. Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds//Annu. Rev. Biomed. Eng. 2011. Vol. 13. P. 27-53.
- Atala A. Engineering tissues, organs and cells//J. Tissue Eng. Regen. Med. 2007. Vol. 1. P. 83-96.
- L'Heureux N., McAllister T.N., de la Fuente L.M. Tissue-engineered blood vessel for adult arterial revascularization//New Engl. J. Med. 2007. Vol. 357. P. 1451-3.
- Baptista P.M., Siddiqui M.M., Lozier G., Rodriguez S.R., Atala A., Soker S. The use of whole organ decellularization for the generation of a vascularized liver organoid//Hepatology. 2010. Vol. 53. P. 604-17.
- Badylak S.F. Regenerative medicine and developmental biology: the role of the extracellular matrix//Anat. Rec. 2005. Vol. 287 B. P. 36-41.
- Ott H.C., Matthiesen T.S., Goh S.-K., Black L.D., Kren S.M., Netoff T.I., Taylor D.A. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart//Nature Med. 2008. Vol. 14. P. 213-21.
- Taylor D.A. From stem cells and cadaveric matrix to engineered organs//Curr. Opin. Biotechnol. 2009. Vol. 20. P. 598-605.
- Бенч Л., Джонс Д. Биоматериалы, искусственные органы и инжиниринг тканей. М.: Техносфера, 2007. 304 с.
- Orlando G., Wood K.J., Stratta R.J., Yoo J.J., Atala A., Soker S. Regenerative medicine and organ Transplantation: past, present, and future//Transplantation. 2011. Vol. 91. P. 1310-7.
- Orlando G., Baptista P., Birchall M., De Coppi P., Farney A., Guimaraes-Souza N.K., Opara E., Rogers J., Seliktar D., Shapira-Schweitzer K., Stratta R.J., Atala A., Wood K.J., Soker S. Regenerative medicine as applied to solid organ transplantation: current status and future challenges//Transpl. Int. 2011. Vol. 24. P. 223-32.
- Кокорев О.В., Дамбаев Г.Ц., Ходоренко В.Н., Гюнтер В.Э. Применение пористо-проницаемых инкубаторов из никелида титана в качестве носителей клеточных культур//Клеточная трансплантология и тканевая инженерия. 2010. Т. 5. № 4. С. 31-37.
- Медицинские материалы и имплантаты с памятью формы: В 14 томах//Под ред. В.Э. Гюнтера. Медицинские материалы с памятью формы. Т. 1. Томск: Изд-во МИЦ, 2011. 534 с.
- Медицинские материалы и имплантаты с памятью формы: В 14 томах//Под ред. В.Э. Гюнтера. Имплантаты с памятью формы в хирургии. Т. 11. Томск: Изд-во МИЦ, 2012. 398 с.
- Kokorev O.V., Hodorenko V.N., Chekalkin T.L., Dambaev G.Ts., Gunther V.E. Porous TINI-based alloy scaffold for cell tissue engineering//Journal of Advanced Scientific Research. 2014. Vol. 5. № 3. P. 01-06.
- Almine J.F., Bax D.V., Mithieux S.M., Nivison-Smith L., Rnjak J., Waterhouse A., Wise S.G., Weiss A.S. Elastin-based materials//Chem. Soc. Rev. 2010. Vol. 39. P. 3371-9.
- Kanematsu A., Yamamoto S., Ozeki M., Noguchi T., Kanatani I., Ogawa O., Tabata Y. Collagenous matrices as release carriers of exogenous growth factors//Biomaterials. 2004. Vol. 25. P. 4513-20.
- Price A.P., England K.A., Matson A.M., Blazar B.R., Panoskaltsis-Mortari A. Development of a decellularized lung bioreactor system for bioengineering the lung: the matrix reloaded//Tissue Eng. A. 2010. Vol. 16. P. 2581-91.
- Альбертс Б., Брейт Д. Молекулярная биология клетки. Т. 1. М.: Мир, 1994. 350 с.
- Тучин В.В. Оптическая биомедицинская диагностика. Т. 2. М., 2007. 367 c.
- Ремизов А.Н. Медицинская и биологическая физика. М.: Высш. школа, 1996. 608 с.
- Исаков В.Л. Основные вопросы разработки методических рекомендаций по лазерной медицине//Применение лазеров в биологии и медицине. К., 1995. С. 7-20.
- Антонов В.Ф., Черныш А.М., Пасечник В.И. Биофизика. М.: Физика, 2000. 154 с.
- Вайль Н.С. Инфракрасные лучи в клинической диагностике и медико-биологических исследованиях. М.: Медицина, 1996. 278 с.
- Мейер А., Зейтц Э. Ультрафиолетовое излучение. М.: Науч. лит-ра, 1989. 574 с.
- Патент RU № 2438699. Способ изготовления вакцины для лечения адэнокарциномы Эрлиха в эксперименте//С.В. Гюнтер, О.В. Кокорев. 7 с.


