Молекулярная визуализация и интраоперационная радионавигация при раке предстательной железы
Автор: Румянцев П.О., Бубнов А.А., Свиридов П.В., Никифорович П.А., Трухин А.А., Коренев С.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Актуальность. Рак предстательной железы является одним из самых распространенных злокачественных новообразований. С развитием технологий совершенствуются методы диагностики заболевания на ранних стадиях и последующей терапии. При этом приоритетом является сохранение качества жизни и трудоспособности пациентов после лечения, что достигается путем совершенствования методов фокальной терапии, которая зависит от точности топической диагностики и классификации опухоли. В качестве методов топической диагностики кроме методов структурной визуализации (УЗИ, КТ, МРТ) используют гибридную молекулярную визуализацию (ПЭТ/КТ и ОФЭКТ/КТ), а также интраоперационную визуализацию с помощью методик радионавигации, применяемых в открытой и эндоскопической хирургии онкологии предстательной железы. В настоящее время методика зарекомендовала себя как инструмент, способный уменьшить травматичность операции, локализовать область метастатического поражения с чувствительностью и специфичностью до 95 %. Цель исследования – обзор актуальных сегодня и перспективных в будущем методов интраоперационной радионавигации при хирургическом лечении рака предстательной железы. Материал и методы. В обзоре представлены методы интраоперационной радионавигации при хирургическом лечении рака предстательной железы. Также рассмотрена радионавигация в разрезе использования тумаротропного радиофармпрепарата на основе простат-специфического мембранного антигена, при котором накопление препарата происходит во всех экспрессирующих данный рецептор очагах опухоли. Заключение. Применение предоперационной гибридной визуализации и внедрение интраоперационной радионавигации повышают прецизионность и радикальность хирургического лечения, снижают необоснованную травматичность операций при раке предстательной железы. Гамма-зондирование позволяет обнаружить psma-положительные очаги опухоли вне зависимости от глубины их залегания, в том числе при эндоскопических операциях. Также для интраоперационной детекции патологических очагов в реальном масштабе времени применяются методы флуоресцентной визуализации (icg, фотодинамическая диагностика, аутофлуоресценция). Огромный потенциал имеют многоканальное гамма-зондирование, детекция черенковского излучения, сочетающие в себе достоинства непрямой и прямой интраоперационной визуализации.
Интраоперационная визуализация, молекулярная визуализация, радионавигация, рак предстательной железы, простат-специфический мембранный антиген, черенковское излучение, хирургия
Короткий адрес: https://sciup.org/140254540
IDR: 140254540 | УДК: 616.65-006.6-07 | DOI: 10.21294/1814-4861-2021-20-4-108-115
Текст научной статьи Молекулярная визуализация и интраоперационная радионавигация при раке предстательной железы
Рак предстательной железы (РПЖ) занимает третье место среди онкологических заболеваний, выявляемых у мужчин в Западной Европе, и первое в США [1]. Возрастной пик заболеваемости приходится на 50–60 лет. [2]. В последнее время все чаще наблюдается омоложение данного заболевания: появление РПЖ у мужчин моложе 50 лет, что связано с большим количеством факторов (питание, образ жизни, экология и др.) [3]. В 2018 г. у 62 пациентов с РПЖ он выявлен в возрасте до 44 лет, что раньше было казуистикой. Меняется и структура стадий РПЖ, увеличивается число локализованных форм в результате улучшения диагностики и стадирования опухоли. В 2018 г. больные РПЖ I и II стадии составили 56 % в общей структуре заболеваемости [4], что, вероятнее всего, связано с ранним выявлением опухоли.
В Российской Федерации РПЖ является второй по частоте встречаемости (14,9 %) злокачественной опухолью среди мужчин после рака легкого
Арсенал методов лечения РПЖ при локализованной и местнораспространенной опухоли: простатэктомия, регионарная лимфодиссекция, дистанционная лучевая терапия, радионуклидная терапия и брахитерапия в самостоятельных вариантах, а также сочетание методов лечения. Системная терапия включает гормональную и химиотерапию [6].
Благодаря мероприятиям по раннему выявлению РПЖ отмечается перераспределение в сторону локализованных форм, что актуализирует развитие прецизионности локальных методов лечения, радикальности плана лечения и снижения травматичности. Для этого используется гибридная молекулярная визуализация (ПЭТ/КТ и ОФЭКТ/ КТ), а также интраоперационная визуализация с помощью радиоизотопной и флуоресцентной визуализации. Основным методом интраоперационного гамма-зондирования является радионавигация (англ. Radio-guided surgery), которая сегодня может применяться в открытой и эндоскопической хирургии РПЖ [7]. Методика прочно зарекомендовала себя как инструмент, способный уменьшить травматичность операции, обнаружить метастатические поражения с чувствительностью и специфичностью до 95 % [8].
В данный обзор мы не включили методы флуоресцентной визуализации индоцианином (Indocyanine green – ICG) и гамма-зондирование сторожевых лимфатических узлов, когда радиофармпрепарат (РФП) (наноколлоид, меченный технецием) или ICG вводится в опухолевую или в рядом расположенную ткань и оценивается их накопление в регионарных лимфатических узлах. В данном обзоре речь пойдет о радионавигации при использовании туморотропных РФП на основе антител к простат-специфичному мембранному антигену (Prostate specific membrane antigen – PSMA), при котором накопление РФП происходит во всех экспрессирующих данный рецептор очагах опухоли.
Радионавигация как метод интраоперационного зондирования зародилась в конце 40-х – начале 50-х гг. XX в. [9]. На первом этапе в качестве детекторов применяли счетчики Гейгера–Мюллера, не обладавшие достаточной чувствительностью и коллимацией, необходимой для проведения радионавигации в современном ее варианте. Первым радионуклидом, примененным в интраоперационной визуализации, был 32-фосфор. С 1956 г. для визуализации щитовидной железы используется 131-йод, а для его регистрации применялся гамма-зонд [10]. Этот прибор уже имел необходимый минимальный набор конструктивных и технических характеристик, которых было достаточно для возникновения такого направления, как радионавигационная хирургия. С развитием технологий происходила модернизация гамма-зондов, появлялись новые типы детекторов, более чувствительные к регистрации полезных событий, была спроектирована система коллимации, позволяющая отсекать фоновые и «паразитирующие» события, тем самым делая более прецизионной интраоперационную радионавигацию. Современные устройства для радионавигации отличаются значительной чувствительностью и точностью, а также способны быть миниатюрным аналогом крупногабаритных стационарных систем для предоперационной визуализации, позволяющих непосредственно в ходе операции определять очаги накопления РФП с повышенной метаболической активностью. Таким образом, интраоперационная радионавигация стала связующим звеном между предоперационной визуализацией и непосредственно хирургией.
Основной задачей предоперационной молекулярной визуализации (ОФЭКТ/КТ, ПЭТ/КТ) в сочетании с другими методами исследования (пальпация, ТРУЗИ, ПСА, биопсия, РКТ, МРТ) является определение стадии и точной локализации очагов опухоли [11].
Интраоперационная радионавигация при РПЖ ставит задачу обнаружения очагов опухоли во время операции в режиме реального времени с целью их радикального удаления. Первое упоминание об интраоперационной радионавигации сторожевых лимфоузлов при помощи 99mTc-Nanocolloid при РПЖ датируется концом 1990-х гг. [12]. При помощи PSMA, меченного радиоактивной меткой, можно визуализировать очаги опухоли при внутривенном введении РФП. В качестве радиоактивной метки можно использовать «ОФЭКТ-изотопы» (99mТс, 123I, 131I, 111In, 177Lu и т. д.) и «ПЭТ-изотопы»: 68Ga, 18F, 89Zr, 124I, 64Cu и т. д. Первые детектируются одноканальными и многоканальными гамма-зондами, а вторые – детектором черенковского излучения, комптоновской камерой, одноканальными и многоканальными гамма-зондами с специализированными коллиматорами. Также возможно использование бета-зондов, но чувствительность их низкая ввиду короткого пробега электронов в тканях (до 2 мм).
Целью исследования является обзор актуальных сегодня и перспективных в будущем методов интраоперационной радионавигации при хирургическом лечении РПЖ.
Простат-специфический мембранный антиген (PSMA)
Простат-специфический мембранный антиген является чрезвычайно перспективной молекулой (рис. 1) для специфической визуализации и тар-гетной терапии РПЖ по причине чрезмерной его экспрессии на поверхности клеток РПЖ. В норме рецептор PSMA экспрессирован в эпителии предстательной железы, в почечных канальцах, двенадцатиперстной и толстой кишке, а при карциноме простаты его экспрессия увеличивается на порядки (в 100–1000 раз), что позволяет визуализировать очаги опухоли на ОФЭКТ и ПЭТ [8, 13].
В последние годы разработано несколько низкомолекулярных PSMA для диагностики и радиотераностики (диагностика+терапия) РПЖ. Специфичность и чувствительность методов гибридной молекулярной визуализации РФП на основе PSMA-лигандов (ОФЭКТ/КТ, ПЭТ/КТ) значительно превосходят традиционные УЗИ, КТ
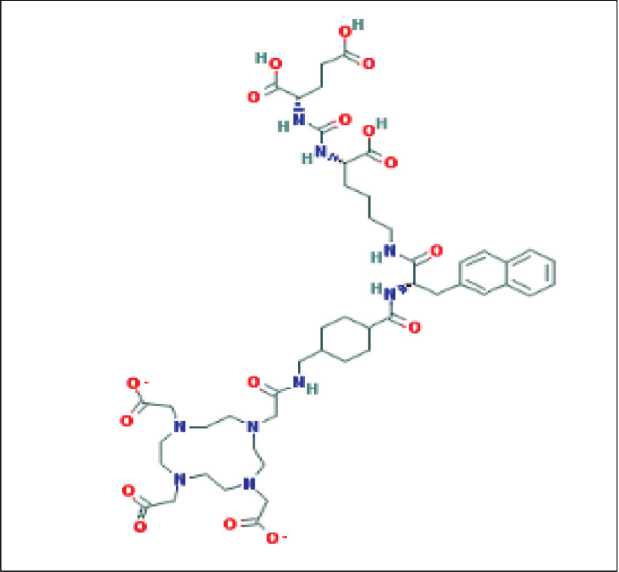
Рис. 1. Структурная формула простат-специфического мембранного антигена
Fig. 1. Structural formula of prostate-specific membrane antigen
и МРТ, которые куда менее специфично визуализируют метастазы в лимфатических узлах небольших размеров (до 10 мм) [14, 15]. Технологии молекулярной визуализации и интраоперационной радионавигации позволяют идентифицировать метастазы начиная с 2 мм [16].
В целях комплементарности технологий визуализации сначала выполняется ОФЭКТ/КТ с меченным технецием-99m PSMA, и при положительном результате предоперационной визуализации осуществляется интраоперационная радионавигация с тем же РФП (рис. 2). ОФЭКТ/КТ с PSMA необходим даже в случае положительного результата ПЭТ с PSMA по той же самой причине.
Предоперационная навигация РПЖпри помощи PSMA
При РПЖ используются различные методы лечения и их сочетания, которые подбираются индивидуально в зависимости от группы клинического риска, оценки первичной опухоли по шкале Глисона, уровню ПСА в крови и результатам
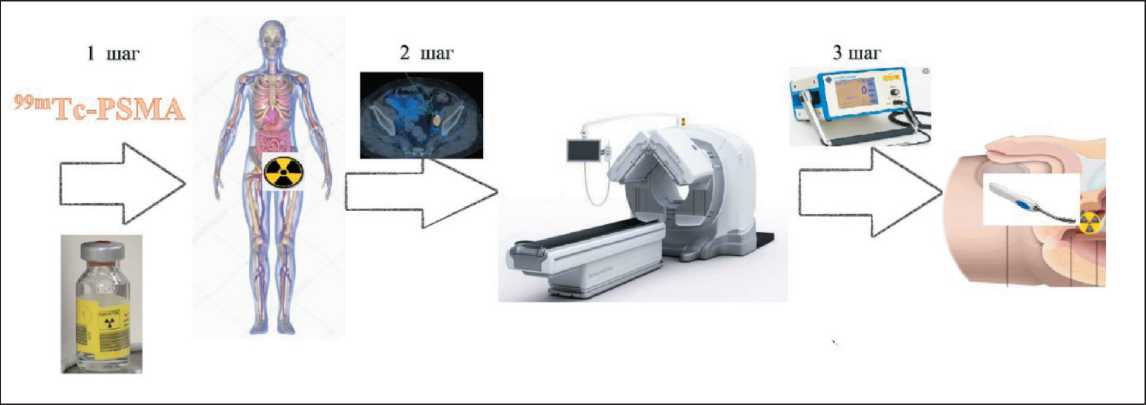
Рис. 2. Захват радиофармрепарата рецепторами РSМA и поэтапный процесс визуализации. 1-й шаг – введение 99mTc-РSМA; 2-й шаг – получение предоперационной карты с применением системы ОФЭКТ/КТ; 3-й шаг – интраоперационная радионавигация с применением гамма-зонда
Fig. 2. Radiopharmaceutical uptake by РSМA receptors and steps of visualization. 1 step – administration 99mTc-РSМA.
2 step – creation of preoperative map using SРECT/CT system. 3 step – intraoperative radionavigation using gamma-probe
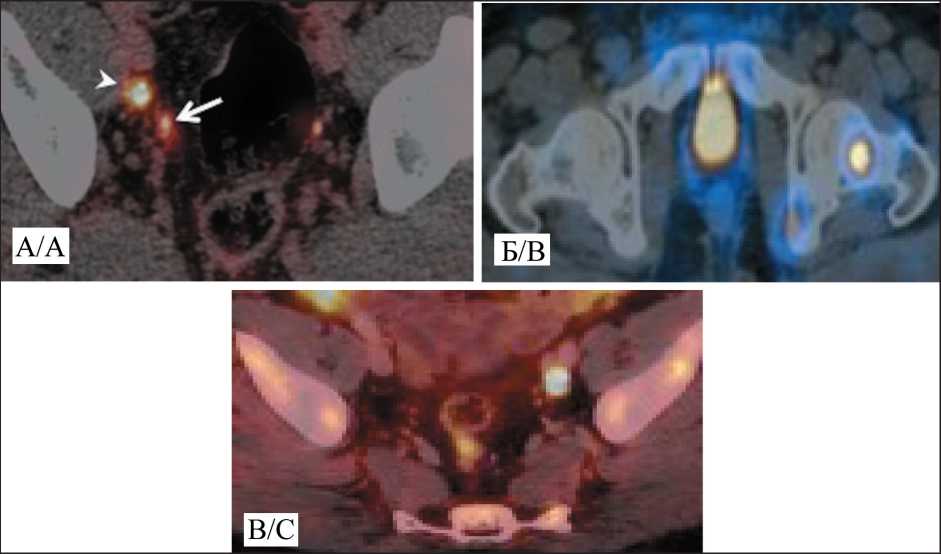
Рис. 3. Предоперационная визуализация метастазов при РПЖ. А – 68Ga-РSМA-11; Б – 99mTc-РSМA-617;
В – 18F-РSМA-1007 Fig. 3. Рreoperative visualization of metastasis in prostate cancer. А – 68Ga-РSМA-11; B – 99mTc-РSМA-617; C – 18F-РSМA-1007
структурной (УЗИ, КТ, МРТ) и молекулярной визуализации (ОФЭКТ/КТ, ПЭТ/КТ) [16, 17]. ПЭТ/ КТ с фтордезоксиглюкозой (ФДГ) не обладает высокой специфичностью и чувствительностью при РПЖ. Это связано с низким метаболизмом глюкозы в клетках РПЖ. Куда более информативны ОФЭКТ/КТ с 99mTc-HYNIC-iPSMA, а также ПЭТ/ КТ с 18F-холином, 68Ga/18F-PSMA [18]. В последнее время часто используют ПЭТ/КТ с 18F-PSMA-1007 в качестве дополнения или как альтернативу к ПЭТ/КТ с 68Ga-PSMA-11 [19] (рис. 3).
Интраоперационная навигация с введением ОФЭКТ-изотопов.
Гамма-навигация
Радионавигационная хирургия РПЖ основана на применении РФП на основе PSMA, меченных радиоизотопами, излучающими гамма-кванты в диапазоне энергий 100–400 кэВ. Эти энергии регистрируются стационарными или портативными гамма-камерами, их можно классифицировать как ОФЭКТ-изотопы. К ним относится 99mTc, 177Lu, 111In (табл. 1). Чаще всего из вышеперечисленных изотопов используют 99mTc в силу его короткого периода полураспада, низкой дозовой нагрузки, доступности (генератор) и дешевизны. Средняя вводимая активность составляет 570 МБк и вводится накануне операции [20]. Регистрация в операционном поле осуществляется при помощи гамма-зонда (рис. 4).
Интраоперационная навигация с введением ПЭТ-изотопов. Черенковая визуализация. Комптоновская гамма-камера
В настоящее время для интраоперационной навигации при РПЖ могут применяться ПЭТ-изотопы, а для их визуализации в операционном поле применяют либо специальные гамма-зонды, комптоновские гамма-камеры, либо системы визуализации черенковского излучения. Ограничение на визуализацию накладывают физические свойства ПЭТ-изотопов. При их распаде образуются позитроны, которые взаимодействуют с электронами среды, вследствие чего аннигилируют, образуя гамма-кванты с энергией 511 кэВ. Высокоэнерге-тичные кванты сложно детектировать обычными одноканальными зондами, толщина кристаллов в которых составляет 4–6 мм (в ПЭТ применяются детекторы толщиной от 10–20 мм).
Перспективным направлением в интраоперационной навигации с использованием ПЭТ-изотопов является регистрация черенковского излучения (или эффект Вавилова–Черенкова). Это излучение было открыто в 1934 г. советским физиком Павлом Черенковым, который проводил исследования люминесценции при взаимодействии гамма-квантов с водой. Ученый обнаружил слабое свечение голубого оттенка, возникающее при прохождении электронов с фазовой скоростью, превосходящей скорость света в среде. Первые эксперименты Черенкова выявили ряд необъяснимых особенностей излучения: свечение наблюдается у всех прозрачных жидкостей, причем яркость мало зависит от их химического состава и химической природы, излучение поляризовано с преимущественным направлением электрического вектора вдоль направления распространения частиц. На основании этих данных Вавиловым было сделано основополагающее утверждение, что обнаруженное явление не люминесценция, а свет, который излучают движущиеся в жидкости быстрые электроны. За это открытие в 1958 г. П.А. Черенков, Е.И. Тамм и И.М. Франк были награждены Нобелевской премией в области физики [21].
Черенковское излучение возникает, когда бета-частица, образовавшаяся в ходе распада ПЭТ-изотопа, движется в среде, где её скорость больше фазовой скорости света в этой среде. Из этого следует, что есть некоторая энергия, которая является критической и при которой возникает особое
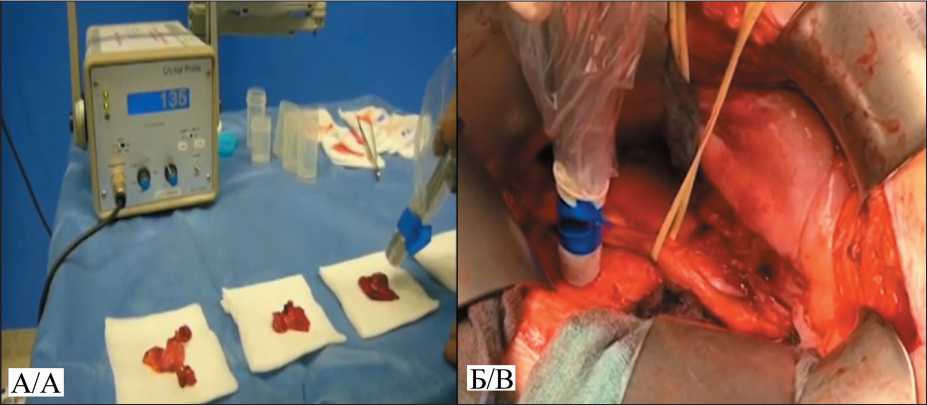
Рис. 4. Регистрация событий гамма-зондом при использовании 99mTc-РSМA:
А. Ex vivo измерение скорости счета от удаленной части предстательной железы и регионарных лимфоузлов;
Б. In vivo измерение скорости счета одноканальным гамма-зондом непосредственно в операционном поле
Fig. 4. Detection events by gamma-probe from region of interest with 99mTc-РSМA. А. Мeasurement of counts rate depends on the removed part of the prostate and regional lymph nodes Ex vivo . B. Мeasurement of counts rate single-channel gamma-probe in vivo
Таблица 1/table 1
Характеристики ОФЭКТ-изотопов для интраоперационной навигации при РПЖ characteristics of spect-isotopes for intraoperative navigation in prostate cancer
|
Радионуклид/ Radionuclide |
Тип распада/ Type of decay |
Период полураспада, ч/ Half-life, h |
Способ получения/ Method of producing |
Энергии гамма-квантов, кэВ/ Energy of gamma quanta, keV |
Вероятность возникновения/ Probability of occurrence |
|
99m Tc |
Изомерный переход/ Isomeric transition |
6,01 |
Генератор/Generator |
140 |
89 % |
|
111 In |
Бета/Beta |
67,2 |
Циклотрон/ Cyclotron |
245,4 171,3 |
94,1 % 90,6 % |
|
177 Lu |
Бета/Beta |
159,4 |
Реактор/Reactor |
208 113 |
10,41 % 6,23 % |
Таблица 2/table 2
Характеристики ПЭТ-изотопов для интраоперационной навигации при РПЖ characteristics of pet-isotopes for intraoperative navigation in prostate cancer
|
Радионуклид/ Radionuclide |
Тип распада/ Type of decay |
Период полураспада, ч/ Half-life, h |
Способ получения/ Method of producing |
Максимальная энергия позитронов, кэВ/ Maximum positron energy, keV |
Вероятность возникновения/ Probability of occurrence |
|
18 F |
Бета плюс (97 %), электронный захват (3 %)/Beta plus (97 %), electronic capture (3 %) |
1,82 |
Циклотрон/ Cyclotron |
633,4 |
96,7 % |
|
68 Ga |
Бета плюс (87 %) электронный захват (13 %)/Beta plus (87 %) electronic capture (13 %) |
1,13 |
Генератор/ Generator |
1900 |
90 % |
|
89 Zr |
Бета плюс (23 %), электронный захват (77 %)/Beta plus (23 %), electronic capture (77 %) |
79,2 |
Циклотрон/ Cyclotron |
897 |
24 % |
|
90 Y |
Бета плюс/ Beta plus |
64 |
Реактор/Reactor |
933,7 |
99,9 % |
(черенковское) излучение. Для воды с оптической плотностью n=1,33 энергия бета-частицы должна быть выше 219 кэВ, а для мягких тканей n=1,4 и энергия частиц должна быть не менее 263 кэВ. Однако черенковское излучение слабое по интенсивности, и для его регистрации необходимы оптические приборы, обладающие высокой чувствительностью при минимальной интенсивности света вокруг. Излучение относится к ближнему ультрафиолетовому спектру, а именно к синей зоне видимого спектра в диапазоне 250–400 нм. Наиболее перспективные изотопы для детекции черенковского излучения 68Ga, 18F, 89Zr, 90Y (табл. 2). Для визуализации РПЖ применяют 68Ga-PSMA, т.к. было выяснено, что интенсивность черенков-ского излучения от галлия в 22 раза выше, чем от фтора [22].
В настоящее время ведутся клинические исследования на основе черенковского излучения при интраоперационной визуализации [23]. Создан аппарат для интраоперационной визуализации черенковского излучения (модель LightPath® CLI, Великобритания).
Комптоновская гамма-камера
Одним из перспективных методов интраоперационной визуализации наравне с черенковским излучением является метод, основанный на комптоновском рассеянии гамма-квантов. Впервые метод получения гамма-изображений на основе принципа комптоновской камеры был опробован в астрономии и радиационной безопасности [24, 25]. Принцип получения изображения заключается в последовательной регистрации места взаимодействия (рассеяния) в первом на пути гамма-частицы детекторе и места поглощения или рассеяния на втором детекторе, отведенным на заданное расстояние от первого. Преимуществом комптоновской визуализации является отсутствие элемента коллимации в конструктиве прибора (вместо нее применяется электронная коллимация) и возможность эксплуатации устройства в магнитном поле, что делает его легче и чувствительнее в сравнении с ранее описанными методами. Достоинства метода, описанного выше, закладывают мощный фундамент для применения его не только для визуализации очагов накопления РФП, связанных с опухолями предстательной железы, но и для интра- операционной визуализации в целом. В настоящее время на рынке уже есть коммерческие варианты комптоновской гамма-камеры, но в медицине эта технология еще не апробирована.
Заключение
Предоперационная гибридная визуализация (ОФЭКТ/КТ, ПЭТ/КТ) с РФП на основе 99mTc|68Ga|18F-PSMA позволяет установить локализацию опухолевых очагов, что необходимо при планировании хирургического лечения, брахитерапии, дистанционной лучевой терапии, а также адъювантной радиолигандной терапии. Интраоперационная радионавигация позволяет обнаружить метаболически активные очаги опухоли, визуализируемые при ОФЭКТ/КТ и/или ПЭТ/КТ. Внедрение интраоперационной радионавигации повышает прецизионность и радикальность хи- рургического лечения, снижает необоснованную травматичность. Интраоперационная радионавигация с помощью гамма-зондирования позволяет обнаружить PSMA-положительные очаги опухоли вне зависимости от глубины их залегания, в том числе при эндоскопических операциях. Для интраоперационной детекции патологических очагов в реальном масштабе времени также применяются методы флуоресцентной визуализации (ICG, фотодинамическая диагностика, аутофлуоресценция). Новый гибридный способ радионавигации при РПЖ основан на одновременном детектировании флуоресценции (нижний ИК-спектр 760–900 нм) и гамма-квантов. Огромный потенциал имеет многоканальное гамма-зондирование, детекция черенковского излучения, сочетающие в себе достоинства непрямой и прямой интраоперационной визуализации.
Список литературы Молекулярная визуализация и интраоперационная радионавигация при раке предстательной железы
- Rawla P. Epidemiology of Prostate Cancer. World J Oncol. 2019 Apr; 10(2): 63-89. https://doi.org/10.14740/wjon1191.
- World Health Organization. Global cancer observatory: cancer today [Internet]. URL: https://gco.iarc.fr/today (cited 16.11.2020).
- Pernar C.H., Ebot E.M., Wilson K.M., Mucci L.A. The Epidemiology of Prostate Cancer. Cold Spring Harb Perspect Med. 2018 Dec 3; 8(12): a030361. https://doi.org/10.1101/cshperspect.a030361.
- Alekseev B.Ya., Kaprin A.D., Kolontarev K.B.,Matveev V.B., Pushkar' D.Yu., Rasner P.I., Kharchilava R.R. Klinicheskie rekomendatsii. Rak predstatel'noi zhelezy. 2018. 7.
- Pieters B. Randomized trial for the evaluation of erectile dysfunction after whole or partial gland prostate brachytherapy. 2018. 25 p.
- Chen F.Z., Zhao X.K. Prostate cancer: current treatment and prevention strategies. Iran Red Crescent Med J. 2013; 15(4): 279-84. https://doi.org/10.5812/ircmj.6499.
- Vidal-Sicart S., Valdés Olmos R., Nieweg O.E, Faccini R., Grootendorst M.R., Wester H.J., Navab N., Vojnovic B., van der Poel H., Martínez-Román S., Klode J., Wawroschek F., van Leeuwen F.W.B. From interventionist imaging to intraoperative guidance: New perspectives by combining advanced tools and navigation with radio-guided surgery. Rev Esp Med Nucl Imagen Mol (Engl Ed). 2018 Jan-Feb; 37(1): 28-40. https://doi.org/10.1016/j.remn.2017.06.004.
- Maurer T., Graefen M., van der Poel H., Hamdy F., Briganti A., Eiber M., Wester H.J., van Leeuwen F.W.B. Prostate-Specific Membrane Antigen-Guided Surgery. J Nucl Med. 2020; 61(1): 6-12. https://doi.org/10.2967/jnumed.119.232330.
- Povoski S.P., Neff R.L., Mojzisik C.M., O'Malley D.M., Hinkle G.H., Hall N.C., Murrey D.A.Jr., Knopp M.V., Martin E.W.Jr. A comprehensive overview of radioguided surgery using gamma detection probe technology. World J Surg Oncol. 2009 Jan 27; 7: 11. https://doi.org/10.1186/1477-7819-7-11.
- Parris C.C., Bigelow R.R., Francis J.E., Kelly G.G., Bell P.R. A Csi(Ti)-crystal surgical scintillation probe. Nucleonics. 1956; 14: 102-108.
- Descotes J.L. Diagnosis of prostate cancer. Asian J Urol. 2019 Apr; 6(2): 129-136. https://doi.org/10.1016/j.ajur.2018.11.007.
- Wawroschek F., Vogt H., Weckermann D., Wagner T., Harzmann R. The sentinel lymph node concept in prostate cancer - first results of gamma probe-guided sentinel lymph node identification. Eur Urol. 1999 Dec; 36(6): 595-600. https://doi.org/10.1159/000020054.
- Silver D.A., Pellicer I., Fair W.R., Heston W.D., Cordon-Cardo C. Prostate-specific membrane antigen expression in normal and malignant human tissues. Clin Cancer Res. 1997 Jan; 3(1): 81-5.
- Hovels A.M., Heesakkers R.A., Adang E.M., Jager G.J., Strum S., Hoogeveen Y.L., Severens J.L. , Barentsz J.O. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. Clin Radiol. 2008; 63: 387-395.
- De Visschere P.J.L., Standaert C., Fütterer J.J., Villeirs G.M., Panebianco V., Walz J., Maurer T., Hadaschik B.A., Lecouvet F.E., Giannarini G., Fanti S. A Systematic Review on the Role of Imaging in Early Recurrent Prostate Cancer. Eur Urol Oncol. 2019 Feb; 2(1): 47-76. https://doi.org/10.1016/j.euo.2018.09.010.
- van Leeuwen F.W.B., Winter A., van Der Poel H.G., Eiber M., Suardi N., Graefen M., Wawroschek F., Maurer T. Technologies for imageguided surgery for managing lymphatic metastases in prostate cancer. Nat Rev Urol. 2019 Mar; 16(3): 159-171. https://doi.org/10.1038/s41585-018-0140-8.
- Litwin M.S., Tan H.J. The Diagnosis and Treatment of Prostate Cancer: A Review. JAMA. 2017; 317(24): 2532-2542. https://doi.org/10.1001/jama.2017.7248.
- Wallitt K.L., Khan S.R., Dubash S., Tam H.H., Khan S., Barwick T.D. Clinical PET Imaging in Prostate Cancer. Radiographics. 2017 Sep-Oct; 37(5): 1512-1536. https://doi.org/10.1148/rg.2017170035.
- Rauscher I., Krönke M., König M., Gafita A., Maurer T., Horn T., Schiller K., Weber W., Eiber M. Matched-Pair Comparison of 68Ga-PSMA-11 PET/CT and 18F-PSMA-1007 PET/CT: Frequency of Pitfalls and Detection Efficacy in Biochemical Recurrence After Radical Prostatectomy. J Nucl Med. 2020 Jan; 61(1): 51-57. https://doi.org/10.2967/jnumed.119.229187.
- Maurer T., Robu S., Schottelius M., Schwamborn K., Rauscher I., van den Berg N.S., van Leeuwen F.W.B., Haller B., Horn T., Heck M.M., Gschwend J.E., Schwaiger M., Wester H.J., Eiber M. 99mTechnetiumbased Prostate-specific Membrane Antigen-radioguided Surgery in Recurrent Prostate Cancer. Eur Urol. 2019 Apr; 75(4): 659-666. https://doi.org/10.1016/j.eururo.2018.03.013.
- Watson A.A. The discovery of Cherenkov radiation and its use in the detection of extensive air showers. Nuclear Physics. 2011; 212-213: 13-19. https://doi.org/10.1016/j.nuclphysbps.2011.03.003.
- Olde Heuvel J., de Wit-van der Veen B.J., Vyas K.N., Tuch D.S., Grootendorst M.R., Stokkel M.P.M., Slump C.H. Performance evaluation of Cerenkov luminescence imaging: a comparison of 68Ga with 18F. EJNMMI Phys. 2019 Oct 24; 6(1): 17. https://doi.org/10.1186/s40658-019-0255-x.
- Olde Heuvel J., de Wit-van der Veen B.J., van der Poel H.G., Bekers E.M., Grootendorst M.R., Vyas K.N., Slump C.H., Stokkel M.P.M. 68Ga-PSMA Cerenkov luminescence imaging in primary prostate cancer: first-in-man series. Eur J Nucl Med Mol Imaging. 2020 Oct; 47(11): 2624-2632. https://doi.org/10.1007/s00259-020-04783-1.
- Todd R., Nightingale J., Everett D. A proposed Gamma camera. Nature. 1974; 251: 132-134. https://doi.org/10.1038/251132a0.
- Schonefelder V., Diehl R., Lichti G.G., Steinle H., Swanenburg B.N., Deerenberg A.J.M., Aarts H., Lockwood J., Webber W. The imaging Compton telescope COMPTEL on the gamma ray observatory. IEEE Trans. Nucl. Sci. 1984; 66-70. https://doi.org/10.1109/TNS.1984.4333363.


