Молекулярно-биологические свойства патогенных вирусов болезни Ньюкасла, выделенных на территории Казахстана
Автор: Орынбаев М.Б., Султанкулова К.Т., Керимбаев А.А., Строчков В.М., Шалгынбаев Э.К., Омарова З.Д., Мусаева Г.К., Бурашев Е.Д., Кыдырбаев Ж.К., Сансызбай А.Р.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Молекулярная эпидемиология вирусов
Статья в выпуске: 2 т.51, 2016 года.
Бесплатный доступ
Болезнь Ньюкасла (БН) - высококонтагиозная вирусная инфекция птиц, характеризующаяся пневмонией, энцефалитом, множественными точечными кровоизлияниями и поражением внутренних органов, - в настоящее время распространена в разных регионах мира. Все выделенные до настоящего времени вирусы БН (сем. Paramyxoviridae, род Paramyxovirus ) разделены на два класса, представляющие разнообразные и постоянно развивающиеся группы вирусов. Несмотря на повсеместную вакцинацию, болезнь трудно поддается контролю, в связи с чем ее возбудитель внесен в список наиболее важных патогенов. В последние годы исследований по генетической вариабельности штаммов БН в Казахстане не проводилось, хотя именно здесь пересекаются многие трансконтинентальные пути миграции диких птиц - основных переносчиков возбудителей заболевания. Настоящее исследование было проведено с целью изучения особенностей циркуляции, а также выделения и характеристики изолятов вируса болезни Ньюкасла, вызвавших заболевание птиц в различных регионах Республики Казахстан в 2010, 2012 и 2013 годах. На 10-суточных развивающихся куриных эмбрионах (РКЭ) изучали изоляты вируса, выделенные от павшей птицы при вспышках БН в птицеводческих хозяйствах и на частных подворьях в Алматинской, Северо-Казахстанской и Жамбылской областях Казахстана. Определяли среднее время гибели эмбрионов (mean death time, MDT) и интрацеребральный индекс патогенности (intracerebral pathogenicity index, IСРI). Выделяли РНК вируса, выполняли ПЦР-амплификацию, проводили детекцию ее продуктов, очищали и секвенировали. Полученные нуклеотидные последовательности анализировали в программе Sequencher v. 4.5 («Gene Codes Corporation», США). Для построения филогенетического дерева и определения генотипа был использован набор нуклеотидных последовательностей из международной базы данных GenBank (NCBI). Филогенетический анализ последовательностей проводили с помощью программы Mega 6.06 со следующими параметрами: Statistical Method - Neighbor-joining; Test of Phylogeny - Bootstrap method; No. of Bootstrap Replications - 500; Model/Method - Kimura 2-parameter model. Исследования показали, что БН вызывает вспышки и у вакцинированной, и у невакцинированной птицы. Выделенные вирусы БН относились к велогенным штаммам. Все они имели сайт протеолитического расщепления 110GGRRQKRF117 белка слияния, характерный для V-патотипа. Секвенирование и филогенетический анализ F -гена показал, что вирус, выделенный на птицефабрике в Алматинской области от павших особей из вакцинированного поголовья, относится к генотипу VIId, а вирусы, выделенные от невакцинированных птиц в частных подворьях Алматинской, Жамбылской и Северо-Казахстанской областей, - к генотипу VIIb. Согласно полученным данным, несмотря на географическую отдаленность вспышек, на территории Северного Казахстана циркулировали те же генотипы, что и в южных регионах страны. Широкое распространение БН в Казахстане требует от ветеринарных служб принятия мер по разработке эффективных мер контроля с учетом данных молекулярной эпидемиологии.
Болезнь ньюкасла, штамм, индекс патогенности, пцр, секвенирование, филогенетический анализ
Короткий адрес: https://sciup.org/142213936
IDR: 142213936 | УДК: 619:578.2(574) | DOI: 10.15389/agrobiology.2016.2.255rus
Текст научной статьи Молекулярно-биологические свойства патогенных вирусов болезни Ньюкасла, выделенных на территории Казахстана
Болезнь Ньюкасла (БН) — это высококонтагиозная вирусная инфекция птиц, характеризующаяся пневмонией, энцефалитом, множественными точечными кровоизлияниями и поражением внутренних органов (1). Впервые она была зарегистрирована на острове Ява в 1926 году (2). Возбудитель болезни (РНК-содержащий вирус из семейства Paramyxoviridae , род Paramyxovirus ) выделен и описан как фильтрующийся вирус во время вспышки в г. Ньюкасл (Великобритания, 1926 год) (3), а заболевание получило название «ньюкаслская болезнь». Вирус БН был обнаружен у 241 вида из 27 отрядов класса Птицы ( Aves ) (4).
Все выделенные до настоящего времени вирусы БН разделены на два класса, представляющие собой разнообразные и постоянно развивающиеся группы. Вирусы I класса распространены по всему миру среди диких птиц, относятся к низковирулентным и в настоящее время разделяются на девять генотипов (5). Вирусы II класса до последнего времени разделяли на 10 генотипов. Однако в 2012 году D.G. Diel с соавт. (6) предложили новую генетическую классификацию вирусов БН. Авторы разделили вирусы II класса на 15 генотипов, в которые вошли 10 ранее известных и 5 новых. Позже S.C. Courtney с соавт. (7), изучив вирусы, выделенные в Доминиканской Республике и Мексике, показали существование XVI генотипа, а C.J. Snoeck с соавт. (8) классифицировали вирусы, выделенные в Западной и Центральной Африке, как XVII и XVIII генотипы.
В настоящее время филогенетический анализ выполнен для огромного числа штаммов вируса БН и определены основные генотипы, циркулирующие в различных частях мира, всего их 18 (6, 7). Группой ученых из стран СНГ установлено, что все изоляты вируса БН, выделенные на территории России, Казахстана, Киргизии и Украины от домашних и синантропных птиц за период с 1993 по 2007 годы, относились к генотипам VIIa, VIIb и VIId (9-11). Показано также, что в популяциях голубей на территории России циркулируют вирусы II класса VI генотипа (12, 13), в популяциях водоплавающих птиц — вирусы I генотипа (13, 14), а среди домашней птицы — вирусы VII генотипа (15, 16). Однако, несмотря на изученность этого вируса, в разных странах, в том числе на территории Республики Казахстан, происходят массовые заболевания птиц с высокой смертностью.
В последние годы исследования генетической вариабельности у штаммов БН в Казахстане не проводились. В настоящей работе мы изучали варианты вируса БН, циркулирующие на территории Республики Казахстан и изменившиеся в процессе эволюции, что представляло особый интерес, поскольку именно здесь пересекаются многие трансконтинентальные пути миграции диких птиц — основных переносчиков инфекции.
Целью нашей работы было изучение особенностей циркуляции, а также выделение и характеристика изолятов вируса болезни Ньюкасла, вызвавших заболевание птиц в разных регионах Республики Казахстан.
Методика . Изучали изоляты вируса, выделенные от павшей птицы при вспышках БН в птицеводческих хозяйствах и на частных подворьях на территории Казахстана в 2010, 2012 и 2013 годах.
В качестве системы культивирования использовали 10-суточные развивающиеся куриные эмбрионы (РКЭ). Среднее время гибели (mean death time, MDT) определяли посредством деления суммы часов гибели всех эмбрионов, вызванной минимальной летальной дозой, на число эмбрионов (17). Интрацеребральный индекс патогенности (intracerebral pathogenicity index, IСРI) определяли по общепринятой методике (18).
РНК выделяли с помощью набора QIAmp Viral RNA mini kit («Qia-gen GmbH», Германия) согласно инструкции изготовителя. Для получения ПЦР-продуктов использовали пару праймеров (19) (Fwd-upper-f1 — TTGCTTA-TAGTTAGTTCGCCTGTC, Rev-down-f2 — ACCCGTGTATTGCTCTTTGG) и набор One-step RT-PCR Kit («Qiagen GmbH», Германия).
Детекцию ПЦР-продуктов проводили в 1 % Трис-ацетатном буфере с добавлением бромистого этидия в гель документирующей системе Bio Rad («Bio-Rad Laboratories, Inc.», США). ПЦР-продукты очищали с помощью набора QIAquick PCR purification kit («Qiagen GmbH», Германия) согласно инструкции изготовителя. Секвенирование ПЦР-продуктов проводили с использованием набора BigDye terminator v.3.1 cycle sequencing kit («Applied Biosystems, Inc.», США) на автоматическом анализаторе 3130xl 256
Genetic Analyzer («Applied Biosystems, Inc.», США; «Hitachi», Япония).
Полученные нуклеотидные последовательности анализировали в программе Sequencher v. 4.5 («Gene Codes Corporation», США). При помощи комплекса компьютерных программ Mega 6.0 (20) провели выравнивание нуклеотидной последовательности. Для построения филогенетического дерева и определения генотипа использовали набор нуклеотидных последовательностей из международной базы данных GenBank (NСBI). Филогенетический анализ последовательностей проводили с помощью программы Mega 6.06 при следующих параметрах: Statistical Method — Neighbor-joining; Test of Phylogeny — Bootstrap method; No. of Bootstrap Replications — 500; Model/Method — Kimura 2-parameter model.
Результаты . Эпизоотическое благополучие в птицеводческих хозяйствах Республики Казахстан поддерживается благодаря интенсивной вакцинации птиц, начиная с первых дней жизни. Во многих хозяйствах отработаны схемы вакцинации для поддержания высокого количества поствакцинальных антител, которое требуется для обеспечения невосприимчивости птиц к болезни Ньюкасла. Однако, несмотря на все проводимые мероприятия, эпизоотические вспышки болезни Ньюкасла наносят ущерб птицеводству на территории Казахстана.
В ноябре 2010 года на птицефабрике «Аллель Агро» (Илийский р-н, Алматинская обл.) произошла массовая гибель 30-40-суточных цыплят-бройлеров. В хозяйстве имелась отработанная программа профилактической вакцинации, все птицы вакцинировались живой вакциной (Nobilis ND Clone 30, «Intervet international B.V.», Нидерланды). Несмотря на вакцинацию, за 1 нед пало более 2000 птиц. В октябре 2012 года была зарегистрирована массовая гибель птицы на частных подворьях пос. Аксуат (Тимирязевский р-н, Северо-Казахстанская обл.) — пало более 900 особей. В июне 2013 года на частных подворьях в пос. Отар (Кордайский р-н, Жамбылская обл.) и пос. Матыбулак (Жамбылский р-н, Алматинская обл.) также отмечалась массовая гибель домашней птицы. Птица на частных подворьях не была вакцинирована против БН.
Мы установили, что во всех случаях заболевание и гибель птицы вызывал вирус БН (табл.).
Биологическая характеристика изолятов вируса болезни Ньюкасла, выделенных в разных областях Республики Казахстан ( Х ± m , n = 3, культивирование на 10-суточных развивающихся куриных эмбрионах)
|
Изолят (ID GenBank) |
Место (год выделения), хозяин |
БА |
ГА |
СВГ |
IСРI |
СР |
|
Chicken/KZ/Almaty/11/ Алматинская обл. (2010), 2010 (KT719396) домашняя курица |
9,20±0,047 |
8,06±0,12 |
56 |
1,76 |
110GGRRQKRF117 |
|
|
Chicken/KZ/SKO/12/ 2012 (KT719397) |
Северо-Казахстанкая обл. (2012), домашняя курица |
8,80±0,080 |
8,53±0,12 |
52 |
1,82 |
110GGRRQKRF117 |
|
Chicken/KZ/Kordai/06/Жамбылская обл. (2013), 2013 (KT719398) домашняя курица |
9,26±0,074 |
8,20±0,08 |
56 |
1,82 |
110GGRRQKRF117 |
|
|
Chicken/KZ/Almaty/07/Алматинская обл. (2013), 2013 (KT719399) домашняя курица |
9,58±0,069 |
8,73±0,05 |
56 |
1,80 |
110GGRRQKRF117 |
|
П р и м еч а ни е. БА — биологическая активность, lg ЭИД50/см3 (эмбриональная инфицирующая доза);
ГА — гемагглютинирующая активность, log2; СВГ — среднее время гибели куриных эмбрионов, ч; IСРI — интрацеребральный индекс патогенности; СР — сайт протеолитического расщепления продукта F -гена.
Среднее время гибели эмбрионов для выделенных вирусов БН составляло 52-56 ч, что соответствует показателю для велогенных штаммов вируса БН. ICPI был в пределах 1,76-1,82 и подтвердил вирулентность выделенных на территории Казахстана вирусов БН.
Анализ показал наличие сходной последовательности в сайте протеолитического расщепления (110GGRRQKRF117) белка слияния F, харак- терной для V-патотипа (velogenic) БН (21). Следовательно, результаты генетических исследований согласовывались с данными биологических тестов (ICPI и MDT) и подтвердили вирулентность изученных изолятов БН.
94j A chicken/KZ/Korday/05/2013 A chicken/KZ/Almaty/07/2013
44 LAchicken/KZ/SKO/12/2012
89 Vllb-253740370-ostrich/China/YZ-22-07-Os/2007
28|61L Vllb-253740358-chicken/ChinaXZ-9-08-Ch/2008
l-Vllb-253740332-chicken/China/HN-7-06-Ch/2006
"----Vllb-33286089-China/Y98/1998 fusion
— Vllb-78714428-China/SL03/2003
Vlld-281429793-dove/Serbia/749/2007
Ц|-----Vlld-253740314-chicken/China/HN-6-07-Ch/2007
8irVlld-77994255-China/SGM01/2001
25Ц1- VI Id-86371010-China/TJ05/2005
Vlld-33188023-goose/China/GPV-SF02/2002
-
— • chicken/KZ/Almaty/11/2010
VII
FJ434400 APMV-1 /chicken/Bishkek/1015/05
I FJ434398 APMV-1/chicken/Almaty/545/04 78L FJ434393 APMV-1/chicken/Taldykorgan/344/03
VI le-18042244-goose/China/GD-1 -98-GO/1998
----Vlle-86371012-China/Jinan04/2004
I-----VI le-15011278-fowl/Taiwan/TW-00/2000
]j— Vlle-67550206-chicken/China/GX1 -00/2000
,—Vlle-33188027-China/YN-C1
100rVllf-77994267-chicken/China/SWS03/2003
-
1 Vllf-77994251 -goose/Cina/JS02/2002
Vllf-296396399-China/ND-03-018/2008
Г Vllf-14669154-fowl/China/CH-A7-96/1996
-
1 Vllf-20152943-chicken/China/JS-3-00/2000 _
98| FJ434384 APMV-1/chicken/Almaty/68/00
8Ap-FJ434386 APMV-1/chicken/Konyr/125/01
-
1— XIII-58003480-Sterna/Russia/2755/2001
U XIII-60651127-indjgenous-type-poultry/lran/MK13-75/1996 RF
XIII
I г AY847361 APMV-1 /chicken/Almaty/43/98 981" FJ385771 APMV-1/chicken/Astana/53/98
I-----XI11-290918501 -chicken/Pakistan/ND33/2007
I1------XIII-290918489-chicken/Pakistan/ND43/2008
XIV
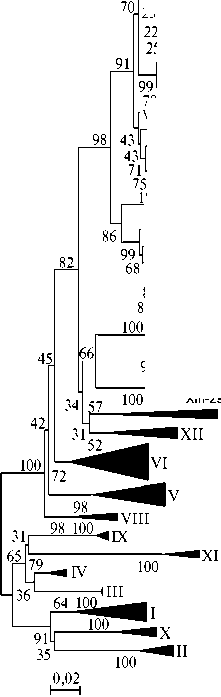
Филогенетическое дерево F -гена, кодирующего белок слияния вируса болезни Ньюкасла II класса: I-XIV — генотипы; ▲ и • — изоляты, выделенные в Казахстане (соответственно вирусы VIIb и VIId генотипов; дендрограмма построена с использованием нуклеотидных последовательностей, депонированных в GenBank, методом Neighbor-joining, bootstrap = 500).
Углубленное изучение генетических связей между вирусами, выделенными в различных географических зонах, дало важную информацию о молекулярной эпидемиологии БН. Требовалось выяснить, к каким генотипам относятся штаммы, вызвавшие эпизоотические вспышки болезни Ньюкасла в Алматинской, Жамбылской и Северо-Казахстанской областях. Для этого мы провели выравнивание нуклеотидных последовательностей выделенных вирусов с последовательностями вируса БН, доступными в GenBank, и построили филогенетическое дерево (рис.). Все вирусы БН, выделенные на территории Казахстана, оказались близки к циркулирующим в Азии и относились к VII генотипу. Вирусы VII генотипа впер- вые выделены в Тайване в 1984 году (22). Позже их обнаружили в Европе (23), Китае (24), Африке (25, 26), а также на территории СНГ — в России, на Украине, в Казахстане, Кыргызстане (9-11, 27).
При использовании референтных штаммов, предложенных D.G. Diel с соавт. (6), изолят Chicken/KZ/Almaty/11/2010 вируса БН, выделенный от вакцинированной птицы, павшей на птицефабрике, был отнесен к генотипу VIId, а изоляты Chicken/KZ/SKO/12/2012, Chicken/KZ/Kordai/06/2013, Chicken/KZ/Almaty/06/2013, полученные от невакцинированной птицы на частных подворьях в Алматинской, Жамбылской и Северо-Казахстанской областях, — к генотипу VIIb.
То есть, несмотря на географическую отдаленность вспышек, на территории Северного Казахстана циркулировали те же генотипы, что и в южных регионах страны. Наши данные подтверждают, что каждая генетическая группа географически имела свой ареал, а ее распространение, возможно, было связано с путями миграции диких птиц. Того же мнения придерживаются И.С. Коротецкий с соавт. (11), которые установили, что наличие короткого пути миграции между странами Северной Европы и Украиной привело к локальному распространению вирусов БН VIIа генотипа только на территории Украины, а мощные миграционные пути от Юго-Восточной Азии через Россию, Казахстан и Киргизию на Каспий и далее — к распространению вирусов VIIb и VIId генотипов.
Проведенные исследования показали, что БН вызывал вспышки среди как вакцинированной, так и невакцинированой птицы. Как отмечалось выше, на птицефабрике «Аллель Агро» (Алматинская обл.) проводилась профилактическая вакцинация живой вакциной. Следует отметить, что штамм вируса БН, используемый для приготовления вакцины, по имеющимся в доступной литературе данным, относится ко II генотипу (28). Возможно, вспышка заболевания произошла в результате снижения иммунитета, поскольку при хорошо отработанной схеме вакцинации классические вакцины, относящиеся ко II генотипу, обеспечивают 100 % защиту птиц независимо от антигенных различий эпизоотического штамма (24, 29, 30). Предполагается, что вакцинация против БН должна обеспечивать иммунитет против заражения и подавление размножения вируса. Однако, по данным некоторых авторов, существующие вакцины предотвращают болезнь, но не могут остановить репликацию и распространение вируса (31-33). Анализ этих исследований показывает, что продукция вируса была значительно ниже только при использовании вакцины на основе определенного генотипа (34, 35).
Итак, заболевание и гибель домашней птицы в Алматинской, Жам-былской и Северо-Казахстанской областях Республики Казахстан в 2010, 2012 и 2013 годах были вызваны вирусом болезни Ньюкасла (БН). Исследования показали, что вирус БН приводит к вспышкам как среди вакцинированных, так и невакцинированых птиц. Вспышка заболевания среди вакцинированных птиц, возможно, произошла в результате снижения иммунитета. Биологические характеристики (среднее время гибели — MDT, интрацеребральный индекс патогенности — IСРI), а также последовательность сайта протеолитической активации F белка у изученных вирусов БН соответствовали таковым у велогенных штаммов. Филогентический анализ показал, что вирус, выделенный от птиц, павших на птицефабрике среди вакцинированного поголовья, относится к генотипу VIId, а изоляты, выделенные от невакцинированных птиц на частных подворьях Алматинской, Жамбылской и Северо-Казахстанской областей, — к генотипу VIIb. Широкое распространение болезни Ньюкасла в Республике Казахстан требует от ветеринарных служб разработки эффективных мер контроля с
учетом данных молекулярной эпидемиологии.
Список литературы Молекулярно-биологические свойства патогенных вирусов болезни Ньюкасла, выделенных на территории Казахстана
- Alexander D.J., Aldous E.W., Fuller C.M. The long view: a selective review of 40 years of Newcastle disease research. Avian Pathology, 2012, 41(4): 329-335 ( ) DOI: 10.1080/03079457.2012.697991
- Kraneveld F.C. A poultry disease in the Dutch East Indies. Ned. Indisch. Bl. Diergeneeskd., 1926, 38: 448-450.
- Doyle T.M. A hitherto unrecorded disease of fowls due to a filter-passing virus. J. Comp. Pathol. Theory, 1927, 40(1): 44-69.
- Kaleta E.F., Baldaus C. Newcastle disease in free-living and pet birds. In: Newcastle disease/D.J. Alexander (ed.). Kluwer Acad. Publ., Boston, 1988: 197-246 ( ) DOI: 10.1007/978-1-4613-1759-3_12
- Kim L.M., King D.J., Curry P.E., Suarez D.L., Swayne D.E., Stallknecht D.E., Slemons R.D., Pedersen J.C., Senne D.A., Winker K., Afonso C.L. Phylogenetic diversity among low-virulence newcastle disease viruses from waterfowl and shorebirds and comparison of genotype distributions to those of poultry-origin isolates. J. Virol., 2007, 81: 12641-12653 ( ) DOI: 10.1128/JVI.00843-07
- Diel D.G., Silva L.H.A., Liu H., Wang Z., Miller P.J., Afonso C.L. Genetic diversity of avian paramyxovirus type 1: Proposal for a unified nomenclature and classification system of Newcastle disease virus genotypes. Infect. Genet. Evol., 2012, 12: 1770-1779 ( ) DOI: 10.1016/j.meegid.2012.07.012
- Courtney S.C., Susta L., Gomez D., Hines N.L., Pedersen J.C., Brown C.C., Miller P.J., Afonso C.L. Highly divergent virulent isolates of Newcastle disease virus from the Dominican Republic are members of a new genotype that may have evolved unnoticed for over 2 decades. J. Clin. Microbiol., 2013, 51: 508-517 ( ) DOI: 10.1128/JCM.02393-12
- Snoeck C.J., Owoade A.A., Couacy-Hymann E., Alkali B.R., Okwen M.P., Adeyanju A.T., Komoyo G.F., Nakouné E., Le Faou A., Muller C.P. High genetic diversity of Newcastle disease virus in poultry in West and Central Africa: Cocirculation of genotype XIV and newly defined genotypes XVII and XVIII. J. Clin. Microbiol., 2013, 51(7): 2250-2260 ( ) DOI: 10.1128/JCM.00684-13
- Bogoyavlenskiy A., Berezin V., Prilipov A., Usachev E., Lyapina O., Levandovskaya S., Korotetskiy I., Tolmacheva V., Makhmudova N., Khudyakova S., Tustikbaeva G., Zaitseva I., Omirtaeva E., Ermakova O., Daulbaeva K., Asanova S., Kydyrmanov A., Sayatov M., King D. Molecular characterization of virulent Newcastle disease virus isolates from chicken during the 1998 NDV outbreaks in Kazakhstan. Virus Genes, 2005, 31: 13-20 ( ) DOI: 10.1007/s11262-004-2195-2
- Bogoyavlenskiy A., Berezin V., Prilipov A., Usachev E., Lyapina O., Korotetskiy I., Zaitceva I., Asanova S., Kydyrmanov A., Daulbaeva K., Shakhvorostova L., Sayatov M., King D. Newcastle disease outbreaks in Kazakhstan and Kyrgyzstan during 1998, 2000, 2001, 2003, 2004, and 2005 were caused by viruses of the genotypes VIIb and VIId. Virus Genes, 2009, 39: 94-101 ( ) DOI: 10.1007/s11262-009-0370-1
- Коротецкий И.С., Богоявленский А.Я., Прилипов А.Г., Усачев Е.В., Усачева О.В., Турмагамбетова А.С., Зайцева И.А., Кыдырманов А., Шахворостова Л.И., Саятов М.Х., Борисов В.В., Пчелкина И.П., Герилович А.П., Березин В.Э. Молекулярно-генетическая характеристика велогенных изолятов вируса болезни Ньюкасла, выделенных на территории Российской Федерации, Украины, Казахстана и Киргизии. Вопросы вирусологии, 2010, 4: 29-32.
- Pchelkina I.P., Manin T.B., Kolosov S.N., Starov S.K., Andriyasov A.V., Chvala I.A., Drygin V.V., Yu Q., Miller P.J., Suarez D.L. Characteristics of pigeon paramyxovirus serotype-1 isolates (PPMV-1) from the Russian Federation from 2001 to 2009. Avian Dis., 2013, 57(1): 2-7 ( ) DOI: 10.1637/10246-051112-Reg.1
- Пчелкина И.П., Колосов С.Н., Чвала И.А., Старов С.К. Генетический анализ и изучение генотипической принадлежности изолятов вируса ньюкаслской болезни, выделенных на территории Российской Федерации в 2010 г. Труды Федерального центра охраны здоровья животных (Владимир), 2011, 9: 94-103.
- Щелканов М.Ю., Чумаков В.М., Славский А.А., Федякина И.Т., Усачев Е.В., Санков М.Н., Киреев Д.Е., Ананьев В.Ю., Баранов Н.И., Гореликов В.Н., Коломеец С.А., Семенов В.И. Вирус болезни Ньюкасла в популяциях диких птиц на территории юга Приморского края в период осенних миграций 2001-2004 гг. Вопросы вирусологии, 2006, 4: 37-41.
- Пчелкина И.П., Колосов С.Н., Щербакова Л.О., Манин Т.Б., Андриясов А.В., Чвала И.А., Старов С.К., Дрыгин В.В. Генетический анализ изолятов вируса ньюкаслской болезни, выявленных у домашних, синантропных и диких птиц на территории Российской Федерации и Украины (Крыма). Труды Федерального центра охраны здоровья животных (Владимир), 2007, 5: 162-175.
- Дрыгин В.В., Щербакова Л.О., Бочков Ю.А., Старов С.К., Ельников В.В., Минин Т.Б., Пчелкина И.П. Характеристика полевого изолята ньюкаслской болезни, выделенного во время вспышки на птицефабрике в Ленинградской области в 2002 году. Вопросы вирусологии, 2002, 6: 41-43
- Alexander D.J. In: A laboratory manual for the isolation and identification of avian pathogens/D.E. Swayne, J.R. Glisson, M.W. Jackwood, J.E. Pearson, W.M. Reed (eds.). American Association of Avian Pathologists, Kennett Square, PA, 1998: 156-163.
- Alexander D.J. Newcastle disease, in OIE manual of diagnostic tests and vaccines for terrestrial animals. Paris, 2008 (http://www.oie.int).
- Aldous E.W., Mynn J.K., Banks J., Alexander D.J. A molecular epidemiological study of avian paramyxovirus type 1 (Newcastle disease virus) isolates by phylogenetic analysis of a partial nucleotide sequence of the fusion protein gene. Avian Pathol, 2003, 32(3): 239-256 ( ) DOI: 10.1080/030794503100009783
- Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Mol. Biol. Evol., 2013, 30(12): 2725-2729 ( ) DOI: 10.1093/molbev/mst197
- Munir M., Zohari S., Abbas M., Khan M.T., Berg M. Genomic and biological characterization of a velogenic Newcastle disease virus isolated from a healthy backyard poultry flock in 2010. Virology Journal, 2012, 9: 46 ( ) DOI: 10.1186/1743-422X-9-46
- Yang C.Y., Shieh H.K., Lin Y.L., Chang P.C. Newcastle disease virus isolated from recent outbreaks in Taiwan phylogenetically related to viruses (genotype VII) from recent outbreaks in Western Europe. Avian Dis., 1999, 43: 125-130 ( ) DOI: 10.2307/1592771
- Lomniczi B., Wehmann E., Herczeg J., Ballagi-Pordany A., Kaleta E.F., Werner O., Meulemans G., Jorgensen P.H., Mante A.P., Gielkens A.L., Capua I., Damoser J. Newcastle disease outbreaks in recent years in Western Europe were caused by an old (VI) and a novel genotype (VII). Arch. Virol., 1998, 143: 49-64 ( ) DOI: 10.1007/s007050050267
- Liu X.F., Wan H.Q., Ni X.X., Wu Y.T., Liu W.B. Pathotypical and genotypical characterization of strains of Newcastle disease virus isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001. Arch. Virol., 2003, 148: 1387-1403 ( ) DOI: 10.1007/s00705-003-0014-z
- Abolnik C., Horner R.F., Bisschop S.P., Parker M.E., Romito M., Viljoen G.J. A phylogenetic study of South African Newcastle disease virus strains isolated between 1990 and 2002 suggests epidemiological origins in the Far East. Arch. Virol., 2004, 149: 603-619 ( ) DOI: 10.1007/s00705-003-0218-2
- Snoeck C.J., Ducatez M.F., Owoade A.A., Faleke O.O., Alkali B.R., Tahita M.C., Tarnagda Z., Ouedraogo J.B., Maikano I., Mbah P.O., Kremer J.R., Muller C.P. Newcastle disease virus in West Africa: new virulent strains identified in non-commercial farms. Arch. Virol., 2009, 154: 47-54 ( ) DOI: 10.1007/s00705-008-0269-5
- Пчелкина И.П., Колосов С.Н., Манин Т.Б., Чвала И.А., Щербакова Л.О., Старов С.К., Дрыгин В.В. Определение генотипической принадлежности изолятов вируса ньюкаслской болезни, выявленных на территории Российской Федерации в 2006 году. Ветеринарная патология, 2007, 4(23): 162-167.
- Wang J.Y., Liu W.H., Ren J.J., Tang P., Wu N., Wu H.Y., Ching C.D., Liu H.J. Characterization of emerging Newcastle disease virus isolates in China. Virology Journal, 2015, 12: 119 ( ) DOI: 10.1186/s12985-015-0351-z
- Dortmans J.C., Peeters B.P., Koch G. Newcastle disease virus outbreaks: vaccine mismatch or inadequate application? Vet. Microbiol., 2012, 160(1-2): 17-22 ( ) DOI: 10.1016/j.vetmic.2012.05.003
- Bwala D.G., Abolnik C., van Wyk A., Cornelius E., Bisschop S.P. Efficacy of a genotype 2 Newcastle disease vaccine (Avinew) against challenge with highly virulent genotypes 5d and 3d. J. S. Afr. Vet. Assoc., 2009, 80: 174-178 ( ) DOI: 10.4102/jsava.v80i3.197
- Kapczynski D.R., King D.J. Protection of chickens against overt clinical disease and determination of viral shedding following vaccination with commercially available Newcastle disease virus Vaccines upon challenge with highly virulent virus from the California 2002 exotic Newcastle disease outbreak. Vaccine, 2005, 23: 3424-3433 ( ) DOI: 10.1016/j.vaccine.2005.01.140
- Yu L., Wang Z., Jiang Y., Chang L., Kwang J. Characterization of newly emerging Newcastle disease virus isolates from the People’s Republic of China and Taiwan. J. Clin. Microbiol., 2001, 39: 3512-3519 ( ) DOI: 10.1128/JCM.39.10.3512-3519.2001
- Miller P.J., King D.J., Afonso C.L., Suarez D.L. Antigenic differences among Newcastle disease virus strains of different genotypes used in Vaccine formulation affect viral shedding after a virulent challenge. Vaccine, 2007, 25: 7238-7246 ( ) DOI: 10.1016/j.vaccine.2007.07.017
- Hu S., Ma H., Wu Y., Liu W., Wang X., Liu Y., Liu X. A Vaccine candidate of attenuated genotype VII Newcastle disease virus generated by reverse genetics. Vaccine, 2009, 27: 904-910 ( ) DOI: 10.1016/j.vaccine.2008.11.091
- Miller P.J., Estevez C., Yu Q., Suarez D.L., King D.J. Comparison of viral shedding following vaccination with inactivated and live Newcastle disease vaccines formulated with wild-type and recombinant viruses. Avian Dis., 2009, 53: 39-49 ( ) DOI: 10.1637/8407-071208-Reg.1


