Молекулярно-генетическая диагностика наследственного неполипозного рака толстой кишки
Автор: Янус Г.А., Корнилов А.В., Суспицын Е.Н., Зайцева О.А., Яцук О.С., Стрекалов Д.Л., Поляков И.C., Бреништер С.И., Правосудов И.В., Гуляев А.В., Семиглазов В.В., Имянитов Е.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (50), 2012 года.
Бесплатный доступ
На долю наследственного неполипозного рака толстой кишки (hereditary non-polyposis colorectal cancer; HNPCC) приходится 2-3 % всех случаев колоректальных карцином. Развитие данного синдрома обусловлено наличием мутации в генах, кодирующих ферменты репарации неспаренных оснований ДНК. В результате изучения 672 историй болезни больных колоректальным раком, подвергшихся хирургическому лечению в НИИ онкологии им. Н.Н. Петрова, на молекулярно-генетическое обследование была отобрана группа из 16 пациентов с выраженными клиническими признаками HNPCC-синдрома. На первом этапе диагностики HNPCC выполнялся тест на микросателлитную нестабильность (microsatellite instability, MSI), предусматривающий использова- ние 3 мононуклеотидных маркеров (ВАТ26, ВАТ25 и ВАТ40); присутствие MSI было подтверждено в 10 из 16 случаев. Образцы ДНК нормальной ткани MSI-положительных пациентов были исследованы на предмет наличия наследственных мутаций в генах MLH1 и MSH2. Высокоточный анализ кривых плавления (high resolution melting analysis, HRMA) с последующим секвенированием аномальных фрагментов позволил выявить потенциально патогенные мутации у 5 пациентов.
Наследственный неполипозный рак толстой кишки, микросателлитная нестабильность, наследственные мутации
Короткий адрес: https://sciup.org/14056200
IDR: 14056200
Текст научной статьи Молекулярно-генетическая диагностика наследственного неполипозного рака толстой кишки
Рак толстой кишки (РТК) занимает пятое-шестое место в структуре онкологической заболеваемости [2, 3]. Около 5 % РТК имеют наследственную природу [5]. Наиболее характерными формами наследственного РТК являются семейный аденоматозный полипоз (FAP, familial adenomatous polyposis) и так называемый синдром Линча (наследственный неполипозный рак толстой кишки, hereditary non-polyposis colorectal cancer, HNPCC). Встречаемость HNPCC в некоторых популяциях достигает значений 1:500–1:1000 [1, 17], что делает этот синдром одним из самых частых наследственных заболеваний. Средний возраст развития колоректального рака при HNPCC составляет около 45 лет [11]. В основе патогенеза данного синдрома лежит нарушение системы репарации неспаренных оснований ДНК. В опухолевых клетках дефект репарации проявляется в виде нестабильности длины микросателлитных повторов (так называемой микросателлитной нестабильности, microsatellite instability, MSI) [5, 24, 25].
К настоящему времени идентифицировано 4 гена, достоверно ассоциированных с развитием синдрома Линча: hMLH1, hMSH2, hMSH6 и hPMS2. Основная доля мутаций (около 90 %) приходится на гены hMLH1 и hMSH2, тогда как hMSH6 и PMS2 вовлекаются относительно нечасто и, как правило, ассоциированы с менее выраженным семейным анамнезом [16]. В редких случаях синдром Линча связан с делецией 3'-концевой последовательности гена TACSTD1 (EPCAM). Следует отметить, что перечисленные выше мутации обнаруживаются далеко не у всех пациентов с HNPCC, поэтому усилия исследователей направлены на идентификацию новых генов предрасположенности к раку толстой кишки [14].
Диагностика наследственного неполипозного РТК представляет собой сложную задачу и складывается из тщательного анализа семейной истории с последующим проведением ДНК-тестирования. Первым этапом молекулярно-генетической диагностики обычно является анализ образца опухолевой ткани, полученной в ходе операции, на предмет наличия микросателлитной нестабильности. Согласно данным литературы, тест на MSI оказывается положительным более чем в 90 % случаев синдрома Линча [24]. Примерно в 8–15 % cпорадических случаев колоректального рака MSI-тест также может быть позитивным и поэтому не является абсолютным признаком наследственного заболевания.
Целью исследования является оценка спектра наследственных мутаций в генах MMR у пациентов с MSI-положительными РТК, соответствующих клиническим критериям HNPCC.
Материал и методы
Работа основана на ретроспективном анализе данных историй болезни 672 первичных больных раком ободочной кишки, подвергшихся хирургическому лечению в НИИ онкологии им. Н.Н. Петрова (г. Санкт-Петербург) в период с 1999 по 2009 г. В этой группе у 653 (97,2 %) больных выявлялась одна опухоль, оставшиеся 19 (2,8 %) пациентов страдали первично-множественными новообразованиями ободочной кишки. Возраст на момент диагноза составлял от 19 до 85 лет. Подавляющее большинство больных находилось в возрастной группе старше 50 лет (88,4 %). Отмечалось некоторое преобладание женщин, доля которых составила 63 % (425 человек).
Все опухоли были представлены аденокарциномами различной степени злокачественности. У 370 (55 %) пациентов новообразования обладали умеренной, у 100 (15 %) – высокой, у 168 (25 %) – низкой степенью дифференцировки. В 34 (5 %) случаях наблюдался недифференцированный рак. Стадия опухолевого процесса определялась согласно Международной классификации злокачественных опухолей по системе TNM (2003). У 295 (44 %) больных диагностирована I–II стадии, у 377 (56 %) – III-IV стадии РТК.
Выделение ДНК. В случае использования архивного патоморфологического материала срезы толщиной 15 мм депарафинизировались в двух сменах ксилола по 5 мин. Затем образцы промывались в двух сменах 96 % этанола по 2 мин. После тщательного удаления этанола к тканям добавлялся лизирующий буфер (10 мМ Tris-HCl (pH=8,0), 0,1 мМ ЭДТА; pH=8,0, 2 % натрия додецилсульфат) и протеиназа К (20 мг/мл). Инкубация образцов проводилась при 60ºС в течение 8–16 ч до полного лизиса тканей. Далее проводилась фенол-хлороформная экстракция. К лизату добавлялся однократный объем нейтрального фенола и 0,3 объема смеси хлороформ-изоамиловый спирт (24:1). После интенсивного встряхивания пробирки в течение 10 мин проводилось центрифугирование при 15000 g в течение 20 мин. Затем надосадочная жидкость отбиралась в чистые пробирки, в которые добавляли 0,1 объема 3 М ацетата натрия (pH=4,0) и 0,3 объема хлороформа. После интенсивного встряхивания образцы центрифугировались при 15000 g в течение 20 мин. Cупернатант отбирался в чистые эппендорфы; после добавления гликогена (20 мг/мл) и 1 объема холодного изопропанола образцы подвергались длительному (3 ч и более) охлаждению до –20ºС. Затем пробирки центрифугировались при 15000 g в течение 30 мин. Изопропанол удалялся, а полученный осадок однократно промывался в 70 % этаноле в течение 10 мин. После тщательного удаления этанола осадок подсушивался в термостате при 40ºС, а затем растворялся в 30 мкл стерильной воды при 65ºС. Раствор ДНК хранился при –20ºС до использования в ПЦР. Выделение ДНК из лейкоцитов периферической крови проводилось посредством модифицированного соль-хлороформного метода [18].
Анализ микросателлитной нестабильности. Микросателлитная нестабильность выявлялась при помощи квазимономорфных мононуклеотидных маркеров BAT25, BAT26 и BAT40 [5, 7, 12]. Использовались следующие пары праймеров: BAT25: TCGCCTCCAAGAATGTAAGT и TCTGCATTT-TAACTATGGCTC; BAT26: TGACTACTTTTGACT-TCAGCC и AACCATTCAACATTTTTAACCC; BAT40: ATTAACTTCCTACACCACAAC и GTA-GAGCAAGACCACCTTGTCTC. Полимеразная цепная реакция (ПЦР) проводилась в конечном
1 2 3 4 5
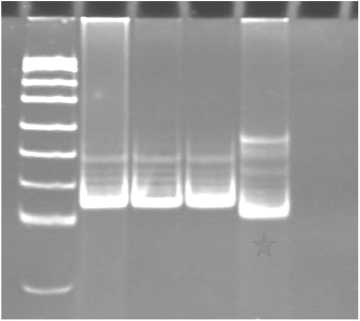
Рис. 1. Микросателлитная нестабильность по маркеру BAT-26:
1 – маркер молекулярного веса; 2–4 – образцы без микросателлитной нестабильности; 5 – образец с микросателлит-ной нестабильностью (пациент 16); - – негативный контроль объеме 10 мкл. Каждая реакция содержала 1 мкл раствора ДНК, 0,5 ед. термостабильной ДНК-полимеразы, 1х ПЦР-буфер (pH 8,3), 2,5 мМ MgCl2, 200 мкМ каждого из четырех нуклеотидтрифосфатов, 0,3 мкМ прямого и обратного праймеров. Использовались следующие условия реакции: стартовая 10-минутная активация Taq-полимеразы при 95ºC; 45 циклов амплификации (денатурация: 15 сек при 95ºC; отжиг: 30 сек при 60ºC; элонгация 30 сек при 72ºC). Полученный продукт разделяли методом электрофореза в 15 % полиакриламидном геле. Позитивным (MSI+) считался образец, демонстрирующий изменение длины одной или нескольких микросателлитных последовательностей. Наличие феномена микросателлитной нестабильности (рис. 1) служило критерием отбора для дальнейшего генетического анализа.
Анализ мутации BRAF V600E. Детекция замены V600E в гене BRAF проводилась методом аллель-специфической ПЦР с использованием праймеров GGTGATTTTGGTCTAGCTACAGT (аллель дикого типа), GGTGATTTTGGTCTAGC-TACAGA (мутантный аллель) и ATAGCCTCAAT-TCTTACCATCC (общий праймер). ПЦР в режиме реального времени проводилась на оборудовании iCycler iQ Real-Time PCR Detection System (BioRad Laboratories, Hercules, USA) и состояла из 50 циклов (денатурация: 15 сек при 95ºC; отжиг: 30 сек при 63ºC; синтез: 30 сек при 72ºC). Каждая ПЦР-реакция (суммарный объем 20 мкл) содержала 1 мкл раствора ДНК, 1 ед. ДНК-полимеразы, 1-кратный ПЦР-буфер (pH 8,3), 2,5 мМ MgCl2, 200 мкМ каждого из нуклеотидтрифосфатов, 0,3 мкМ каждого праймера и 0,2х SYBR green I.
Анализ мутаций в генах hMLH1 и hMSH2. Выявление мутаций в кодирующих последовательностях генов hMLH1 (экзоны 1–19) и hMSH2 (экзоны 1–16) проводилось при помощи комбинации методов полимеразной цепной реакции (ПЦР) и высокоразрешающего анализа кривых плавления ДНК (high resolution melting analysis, HRMA). Последовательности праймеров для проведения ПЦР-HRMA приведены в табл. 1.
ПЦР c анализом кривых плавления проводили на приборе Rotor Gene 6000 (Corbett Research, Австралия). В качестве флуоресцентного красителя использовали 1Х раствор EvaGreen. Условия реакции для амплификации всех экзонов были одинаковыми: 95ºС 10 мин, 55 циклов 95ºС 15 сек/60ºС
Таблица 1
|
Название праймера |
Последовательность 5’-3’ |
Размер фрагмента, п.н. |
|
MLH1ex1_F |
CTTCCGTTGAGCATCTAGAC |
184 |
|
MLH1ex1_R |
CCCGGCTCGACTCCCTC |
|
|
MLH1ex2_F |
CATTAGAGTAGTTGCAGACTG |
184 |
|
MLH1ex2_R |
CCATGAAGCGCACAAACATC |
|
|
MLH1ex3_F |
CTCATCTTTTTGGTATCTAACAG |
151 |
|
MLH1ex3_R |
TTTACACATTTCTTGAATCTTTAG |
|
|
MLH1ex4_F |
GGTGAGGTGACAGTGGGTG |
167 |
|
MLH1ex4_R |
TATGAGTAAAAGAAGTCAGCAC |
|
|
MLH1ex5_F |
TCTCTCTACTGGATATTAATTTG |
160 |
|
MLH1ex5_R |
TCTCCCATGTACCATTCTTAC |
|
|
MLH1ex6_F |
GCTTTTGCCAGGACATCTTG |
186 |
|
MLH1ex6_R |
CAAATCTCAGAGACCCACT |
|
|
MLH1ex7_F |
GCTCTGACATCTAGTGTGTG |
127 |
|
MLH1ex7_R |
CCCCATAAACCAAGAACTTAC |
|
|
MLH1ex8_F1 |
CAGCCATGAGACAATAAATCC |
142 |
|
MLH1ex8_R1 |
CATACCGACTAACAGCATTTC |
|
|
MLH1ex8_F2 |
CAATGCCTCAACCGTGGAC |
150 |
|
MLH1ex8_R2 |
ACACATAATATCTTGAAAGGTTC |
|
|
MLHex9_F |
CTGATTCTTTTGTAATGTTTGAG |
204 |
|
MLH1ex9_R |
TTCCCATGTGGTTCTTTTTAAC |
|
|
MLH1ex10_F |
CCCCTCAGGACAGTTTTGAA |
161 |
|
MLH1ex10_R |
AGGAGTTTGGTGCTACATTA |
|
|
MLH1ex11_F |
CACTATCTAAGGTAATTGTTCTC |
235 |
|
MLH1ex11_R |
CAAAGGCCCCAGAGAAGTAG |
|
|
MLH1ex12_2_F |
GACTTGCTGGCCCCTCTG |
138 |
|
MLH1ex12_2_R |
GAAATGCATCAAGCTTCTGTTC |
|
|
MLH1ex12_3_F |
CCAGATGGTTCGTACAGATTC |
139 |
|
MLH1ex12_3R |
AGTTCAAGCATCTCCTCATCT |
|
|
MLH1ex12_4_F |
CTAGGCAGCAAGATGAGGAG |
139 |
|
MLH1ex12_4_R |
CTGGGGTTGCTGGAAGTAG |
|
|
MLH1ex12_5_F |
TGGAGGGGGATACAACAAAG |
175 |
|
MLH1ex12_5_R |
AGTCAGGCAGAGAGAAGATG |
|
|
MLH1ex13_F |
GATCTGCACTTCCTTTTCTTC |
199 |
|
MLH1ex13_R |
GCAGGCCACAGCGTTTAC |
|
|
MLH1ex14_F |
GTAGGATTCTATTACTTACCTG |
194 |
|
MLH1ex14_R |
GTAGCTCTGCTTGTTCACAC |
|
|
MLH1ex15_F |
CCCAACTGGTTGTATCTCAAG |
210 |
|
MLH1ex15_R |
CAAATAAGATATTAGTGGAGAGC |
|
|
MLH1ex16_1F |
TCTTGGGAATTCAGGCTTCAT |
195 |
|
MLH1ex16_1R |
GCCTTCTTCTTCAGAAACTCA |
|
|
MLH1ex16_F2 |
AGAGGAAGATGGTCCCAAAG |
124 |
|
MLH1ex16_R2 |
GTATAAGAATGGCTGTCACAC |
Продолжение таблицы 1
|
MLH1ex17_F |
CATTATTTCTTGTTCCCTTGTC |
167 |
|
MLH1ex17_R |
ACCGAAATGCTTAGTATCTGC |
|
|
MLH1ex18F |
GAGGTATTGAATTTCTTTGGAC |
155 |
|
MLH1ex18R |
TGCATCACCACTGTACCTG |
|
|
MLH1ex19_F1 |
CAAACAGGGAGGCTTATGAC |
230 |
|
MLH1ex19_R2 |
CCCACAGTGCATAAATAACCA |
|
|
MSH2ex1_1F |
AACCAGGAGGTGAGGAGGT |
215 |
|
MSH2ex1_1R |
TCACCCCCTGGGTCTTGAA |
|
|
MSH2ex1_2F |
CGACCGGGGCGACTTCTA |
162 |
|
MSH2ex1_2R |
TCCCCAGCACGCGCCGT |
|
|
MSH2ex2_1F |
GCAGCATGAAGTCCAGCTAA |
164 |
|
MSH2ex2_1R |
CTCTATACTGACGAACCAGAA |
|
|
MSH2ex2_2F |
GATCTTCTTCTGGTTCGTCA |
124 |
|
MSH2ex2_2R |
GGGGGTAAATTAAAAAGGAAGA |
|
|
MSH2_ex 3_1F |
GGGGGAGTATGTTCAAGAGT |
145 |
|
MSH2_ex 3_1R |
GACATTTTAACACCCACAACAC |
|
|
MSH2_ex 3_2F |
AACAATGATATGTCAGCTTCCA |
130 |
|
MSH2_ex 3_2R |
TATCAGGGAATTCACACAGTC |
|
|
MSH2ex3_3F |
GGATTCCATACAGAGGAAACT |
125 |
|
MSH2ex3_3R |
CTCCTCTATCACTAGACTCAA |
|
|
MSH2ex4_1F |
TGTAGGTGAATCTGTTATCACT |
185 |
|
MSH2ex4_1R |
GTTGAGGTCCTGATAAATGTC |
|
|
MSH2ex4_2F |
GGGATAATTCAAAGAGGAGGA |
176 |
|
MSH2ex4_2R |
GGGGTTCACATTTATAATCCAT |
|
|
MSH2_ex5_1_F |
ATCCAGTGGTATAGAAATCTTC |
174 |
|
MSH2_ex5_1_R |
GACTGCTGCAATATCCAATTTC |
|
|
MSH2_ex5_2_R |
CATCACTGTCTGCGGTAATC |
230 |
|
MSH2_ex5_F2 |
TATAAGCTTCTTCAGTATATGTC |
|
|
MSH2ex6_1F |
CTAATGAGCTTGCCATTCTTTC |
178 |
|
MSH2ex6_1R |
CTCTCCTCTATTCTGTTCTTAT |
|
|
(m13)MSH2ex6_2F |
TGTAAAACGACGGCCAGTGTGGATTAAGCAGCCTCTCA |
129 |
|
(m13)MSH2ex6_2R |
AGCGGATAACAATTTCACACAGGGCAGGTTACATAAAAC TAACGA |
|
|
MSH2ex7_1F |
GAGACTTACGTGCTTAGTTGA |
195 |
|
MSH2ex7_1R |
TGCTTGTCTTTGAAACTTCTTG |
|
|
MSH2_ex 7_2F |
CCCAGATCTTAACCGACTTG |
177 |
|
MSH2_ex 7_2R |
AGTATATATTGTATGAGTTGAAG |
|
|
MSH2_ex 8_F |
GGGGGAGATCTTTTTATTTGT |
162 |
|
MSH2_ex 8_R |
TATTGCATACCTGATCCATATC |
|
|
MSH2ex9F |
TTGTCACTTTGTTCTGTTTGC |
176 |
|
MSH2ex9R |
TATTCCAACCTCCAATGACC |
|
|
MSH2ex10_1F |
AATGGTAGTAGGTATTTATGGAA |
126 |
|
MSH2ex10_1R |
CCTTACAGGTTACACGAAAGT |
Продолжение таблицы 1
|
MSH2ex10_2F |
GCACAGTTTGGATATTACTTTC |
173 |
|
MSH2ex10_2R |
ATCATGTTAGAGCATTTAGGGA |
|
|
MSH2ex11F |
GTACACATTGCTTCTAGTACA |
200 |
|
MSH2ex11R |
CAGGTGACATTCAGAACATTA |
|
|
MSH2ex12_1F |
GTATTCCTGTGTACATTTTCTG |
174 |
|
MSH2ex12_1R |
TTCTTCCTTGTCCTTTCTCCA |
|
|
MSH2ex12_2F |
ACGTGTCAAATGGAGCACCT |
207 |
|
MSH2ex12_2R |
CCCACAAAGCCCAAAAACCA |
|
|
MSH2ex13_1F |
CATCAGTGTACAGTTTAGGAC |
207 |
|
MSH2ex13_1R |
CAGTCCACAATGGACACTTC |
|
|
MSH2ex13_2F |
GTGCCATGTGAGTCAGCAG |
183 |
|
MSH2ex13_2R |
CTCACAGGACAGAGACATAC |
|
|
MSH2_ex14_1 F |
TATGTGATGGGAAATTTCATGTA |
143 |
|
MSH2_ex14_1R |
TGTTGCAATGTATTCTGATATAG |
|
|
MSH2_ex14_2F |
TTTGGGTTAGCATGGGCTATA |
136 |
|
MSH2_ex14_2R |
GTGCTGTGACATGTAGATTATTA |
|
|
MSH2_ex14_3F |
TGCCTTGGCCAATCAGATAC |
132 |
|
MSH2_ex14_3R |
CCAAGTTCTGAATTTAGAGTAC |
|
|
MSH2ex15_1F |
GCTGTCTCTTCTCATGCTGT |
225 |
|
MSH2ex15_1R |
TCTCTTTCCAGATAGCACTTC |
|
|
MSH2ex15_2F |
CCCTAAGCATGTAATAGAGTG |
200 |
|
MSH2ex15_2R |
AACCTTCATCTTAGTGTCCTG |
|
|
MSH2ex16_1F |
GGGACATTCACATGTGTTTCA |
214 |
|
MSH2ex16_1R |
CATTCCATTACTGGGATTTTTC |
|
|
MSH2ex16_2F |
CCTTTACTGAAATGTCAGAAGAA |
224 |
|
MSH2ex16_2R |
ACTGACAGTTAACACTATGGAA |
Праймеры для ПЦР и высокоточного анализа кинетики плавления ДНК
30 сек/72ºС 30 секунд. Интервал плавления – с 75ºС до 95ºС с шагом 0,1ºС, время удержания каждой температуры 10 сек. Кривые, нормализованные по уровню флуоресценции, анализировались с помощью установленного производителем программного обеспечения. Кривые плавления исследуемых образцов сравнивались с кривыми плавления ДНК здоровых доноров. Образцы ДНК, обладающие аномальной кривой плавления, были отобраны для дальнейшего анализа. Секвенирование проводилось с помощью набора GenomeLab DTCS Quick Start Kit (Beckman Coulter, USA) согласно рекомендациям производителя. Продукт реакции после преципитации этанолом разбавлялся в 40 мл SLS (Sample Loading Solution, Beckman Coulter, USA) и подвергался капиллярному электрофорезу в системе генетического анализа CEQ 8000 (Beckman Coulter, USA).
Результаты и обсуждение
Для молекулярно-генетического исследования были отобраны 16 пациентов, у которых молодой возраст пациентов (<50 лет) сочетался с присутствием в истории болезни сведений о семейном анамнезе HNPCC-ассоциированных заболеваний [23, 25]. Первый этап молекулярно-генетического исследования – тест на микросателлитную нестабильность (MSI) – оказался положительным у 10 из 16 исследуемых больных (63 %); при этом в 7 опухолях наблюдалось вовлечение 2 или 3 маркеров (табл. 2).
Полный анализ нуклеотидной последовательности генов репарации неспаренных оснований ДНК является очень трудоёмким и дорогостоящим мероприятием, поэтому многие исследовательские коллективы используют дополнительные критерии отбора MSI-положительных опухолей на эту
Таблица 2
Характеристика пациентов с феноменом микросателлитной нестабильности
процедуру. В частности, некоторые специалисты рекомендуют иммуногистохимический анализ опухоли на предмет экспрессии MMR-белков с последующим отбором для секвенирования только тех генов, продукты которых не выявляются соответствующими антителами. Однако мы приняли решение не использовать данный подход, так как он не лишен существенных недостатков. Например, если инактивирующая мутация не затрагивает домен стабильности белка, его экспрессия может сохраняться [15]. Другой способ дифференциальной диагностики между наследственными и спорадическими MSI-положительными карциномами предусматривает мутационный анализ гена BRAF.
Патогенез спорадических опухолей толстой кишки c микросателлитной нестабильностью влечет потерю экспрессии hMLH1, которая возникает за счет метилирования промоторной области этого гена [26]. Показано, что в таких опухолях часто встречается мутация BRAF V600E, которая никогда не обнаруживается в «истинных» (т.е. связанных с наследственными дефектами MMR) случаях HNPCC [6]. В данной работе все образцы с микро-сателлитной нестабильностью были проверены на наличие этой мутации, однако замена V600E не была обнаружена ни в одном случае.
Таким образом, все 10 MSI-положительных образцов были подвергнуты анализу нуклеотид-
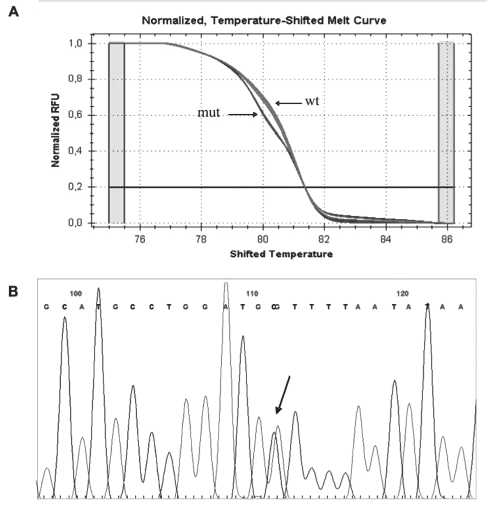
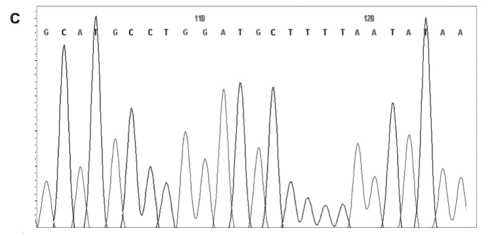
Рис. 2. Мутация A636P, пациент 16: А – высокоразрешающее плавление (HRMA) ПЦР-продукта экзона 12 гена hMSH2. mut – кривая плавления образца с мутацией; wt – кривая плавления контрольных образцов без мутации; В – нуклеотидная замена с.1906 G>C (A636P) в гене hMSH2; C – образец ДНК здорового донора ной последовательности генов hMLH1 и hMSH2 посредством высокоточного анализа кинетики плавления ДНК с последующим секвенированием кандидатных фрагментов. Эти мутации были обнаружены у 5 из 10 пациентов (табл. 2). Важно отметить, что функциональная значимость обнаруживаемых мутаций не всегда очевидна, особенно в случае мутаций, не ведущих к появлению стоп-кодонов. Для выяснения этого вопроса, помимо литературы, использовалась информация специализированных баз данных: InSiGHT (International Society for Gastrointestinal Hereditary Tumors) и Mismatch Repair
Genes Variant Database mmrvariants/.
Мутация А636P (рис. 2) является известным «founder»-вариантом, возникшим около 200–500 лет назад в популяции евреев Ашкенази [20]. Замена аланина на пролин в АТФазном домене нарушает связывание белка с неспаренными основаниями. Это повреждение имеет популяционную частоту 0,4–0,7 % [13] и встречается более чем у 1 % не-селектированных больных раком эндометрия [4] и в 7 % случаев раннего рака толстой кишки [9]. Данная мутация многократно увеличивает риск развития колоректального рака и рака эндометрия в течение жизни, поэтому в группе евреев восточноевропейского происхождения целесообразен скрининг с целью выявления носителей. Мутация hMLH1 R226L обнаружена в ряде европейских стран. Результаты функциональных тестов и оценки in silico предполагают, что данная мутация может дестабилизировать конформацию белка [22]. Патогенность остальных трех обнаруженных мутаций (hMLH1 R659X, hMSH2 E878fsX3, hMSH2 N139fsX) не вызывает сомнений, так как их последствием является преждевременная терминация синтеза белка. При этом мутация в 3 экзоне гена МSH2 – N139 fsX (c.415-416delAA) ранее в литературе не описана.
Таким образом, мутации, ответственные за развитие наследственного опухолевого синдрома, выявлены в половине MSI-позитивных случаев. У остальных пациентов заболевание могло быть связано с повреждением других генов системы репарации (hMSH6, PMS2 и др.). Кроме того, нельзя исключить наличие более масштабных повреждений hMLH1 и hMSH2 (делеции и дупликации одного или нескольких экзонов), которые не могут быть детектированы секвенированием. Для проверки такой возможности необходимо применение таких методов диагностики. как MLPA (Multiple Ligation-dependent Probe Amplification).
Учитывая большие размеры России и разнообразие народностей, которые ее населяют, любопытным фактом является наличие в нашей стране выраженного «эффекта основателя». В частности, анализ BRCA мутаций у женщин c признаками наследственного рака молочной железы и яичников показал, что в различных, удаленных друг от друга регионах России преобладает одна и та же мутация – 5382insC в гене BRCA1 [18, 21].
Ожидалось, что и для пациентов с HNPCC удастся найти повторяющиеся варианты, однако в нашем исследовании все обнаруженные мутации уникальны, что можно объяснить небольшим числом наблюдений.
Конечной целью медико-генетического консультирования пациентов с HNPCC является выявление мутации, ответственной за развитие заболевания в данной семье, и разъяснение риска развития новообразований взрослым членам семьи. Если генетическое повреждение выявлено у больного, становится возможным пресимптоматическое тестирование ближайших родственников на предмет наследования этой мутации. При обнаружении мутации можно говорить о чрезвычайно высокой вероятности развития опухолевого синдрома (не менее 80 %) в течение жизни [19]. Поэтому таким лицам необходимо рекомендовать комплекс мероприятий, направленных на максимально раннюю диагностику опухолей HNPCC-спектра. Оправданным является проведение колоноскопии (раз в 1 или 2 года), начиная с 25-летнего возраста, а у женщин – УЗИ матки с 30–35 лет [11]. Кроме того, при лечении пациентов с HNPCC следует учитывать некоторые особенности течения заболевания, такие как относительно благоприятный прогноз, небольшая вероятность метастазирования, низкая чувствительность к терапии фторпиримидинами и хороший ответ на лечение иринотеканом [8, 10].
Генетическая диагностика наследственного неполипозного рака толстой кишки в настоящее время представляет собой непростую задачу. Сложности связаны с целым рядом факторов (большое количество генов, ассоциированных с развитием синдрома; необходимость анализа всей последовательности этих генов; отсутствие выраженного «эффекта родоначальника»). Использование методики высокоразрешающего плавления ПЦР-продуктов (HRMA) является перспективным подходом к поиску наследственных мутаций в генах репарации ДНК у пациентов с клиническими признаками HNPCC и наличием микросателлитной нестабильности.
Работа выполнена при поддержке грантов РФФИ (№ 10-04-00962-а), Министерства образования и науки Российской Федерации (№ 02.740.11.0780) и Правительства Москвы (№ 15/11-Ген-М).


