Молекулярно-генетическая характеристика колоректального рака
Автор: Сеферов Б.Д., Грицкевич О.Ю., Лазарев А.Э., Голубинская Е.П., Максимова П.Е.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзор и аналитика. Канцерогенез
Статья в выпуске: 4 т.13, 2023 года.
Бесплатный доступ
Колоректальный рак занимает третье место по заболеваемости среди всех онкологических заболеваний. Ежегодно в мире регистрируется свыше 1 млн случаев, половина из которых приводит к летальному исходу. На сегодняшний день актуально изучение молекулярно-генетических механизмов возникновения опухолей, что является важным вкладом в перспективу определения прогноза и тактики лечения. Представленная обзорная статья раскрывает современную классификацию механизмов опухолевой прогрессии при колоректальном раке.
Колоректальный рак, молекулярная генетика, мутации
Короткий адрес: https://sciup.org/140304595
IDR: 140304595 | DOI: 10.18027/2224-5057-2023-13-4-78-83
Текст научной статьи Молекулярно-генетическая характеристика колоректального рака
Колоректальный рак (КРР) занимает третье место по заболеваемости среди всех онкологических заболеваний. Ежегодно в мире регистрируется свыше 1 млн случаев, половина из них приводит к летальному исходу [1]. КРР развивается в ходе поэтапных диспластических и молекулярно-генетических изменений, к которым приводят как системные процессы в организме, так и результат взаимодействия и образования перекрестных связей между опухолевой клеткой и разными типами клеток, окружающих её (микроокружения). Опухолевая прогрессия КРР характеризуется рядом механизмов, включающих в себя четыре подтипа КРР, которые различаются между собой не только по молекулярно-генетическому принципу, но и по своему клиническому течению и ответу на терапию [2] (рис. 1). Однако именно молекулярно-генетическое исследование опухоли и её микроокружения приводят к пониманию диагностической тактики, помогает определить предиктивные и прогностические факторы. Определение геномного профилирования опухоли является необходимым этапом при выборе эффективной терапии и, кроме того, может стать основой для прогноза возникновения наследственного КРР.
Хромосомная нестабильность при колоректальном раке
Среди механизмов опухолевой прогрессии до 90% приходится на изменение кариотипа, при котором число хромосом в клетках не кратно гаплоидному набору
(анеуплоидия) и аберрации хромосом (делеция, инверсия, дупликация, транслокация). В 1990 году Фироном и Фогельштейном был предложен путь хромосомной нестабильности при КРР или многоступенчатая генетическая модель колоректального канцерогенеза (рис. 2) [3].
Активация сигнального пути начинается с инактивации гена-супрессора опухоли аденоматозного полипоза APC. Данный ген кодирует большой белок с множеством функциональных доменов, который регулирует дифференцировку, адгезию, полярность, миграцию, развитие, апоптоз и даже хромосомную сегрегацию. Это способствует внутриклеточному накоплению белка бета-катенина. Доказано, что накопление этого белка способствует пролиферации и выживанию опухолевых клеток [4,5]. Кроме того, бета-катенин может поддерживать рост опухоли за счёт участия в регуляции экспрессии VEGF — гена эндотелиального фактора роста сосудов [6,7]. Для последующей прогрессии до ранних карцином требуется активация мутации гена K-RAS, который является протоонкогеном, и наличие данной мутации клинически ассоциировано с неблагоприятным прогнозом заболевания [8,9]. Дальнейшая злокачественная трансформация обусловлена дополнительными мутациями в путях TGF-β, PIK3CA и TP53 [10].
В 1998 году Гуллу Горгонг и соавт. в ходе исследований доказали, что сверхэкспрессия Аврора киназы (AURKA) приводит к хромосомной нестабильности и является причиной развития различных видов рака, в том числе КРР, при этом является самой высокой в наборе данных об аденокарциноме прямой кишки, вызывая дисрегуляцию сигнальных генов Wnt [11–13]. На сегодняшний день воздействие на AURKA изучается в качестве мишени для терапии рака [14].
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА КОЛОРЕКТАЛЬНОГО РАКА
Механизмы опухолевой прогрессии при КРР
|
Хромосомная нестабильность |
Микросателлитная нестабильность |
«Метиляторный» фенотип |
Зубчатый путь развития аденокарциномы |
|
Анеуплоидия и аберрация хромосом |
Нарушение репарации ДНКв результате мутации генов репарации |
гиперметилирование промотерных сайтов, приводящая к инактивации генов-супрессоров опухолевого роста |
|
|
Мутация генов MLH1, MLH3, MSH2, MSH3, MSH6, PMS1 и PMS2. |
мутации в генах KRAS, BRAF и ТР53 |
|
|
Молекулярные подтипы КРР |
|||
|
CMS1 Иммунный (микросателлитно нестабильный) |
CMS2 CMS3 (канонический) (метаболический) |
CMS4 (мезенхимальный) |
|
|
Повышенная экспрессия генов MSI |
Эпителиальная Гетерогенны по дифференцировка; MSI активация сигнального пути WNT и MYC |
Активация TGF-b; эпителиально мезенхи мальный переход; |
|
Рисунок 1. Молекулярные механизмы прогрессии и молекулярные подтипы КРР.
Согласно современным данным, около трети всех злокачественных новообразований ассоциированы с мутациями в генах семейства RAS, например, ген K-RAS мутирует практически в 40–50% случаев при КРР [15]. Однонуклеотидные мутации блокируют фермент, связанный с GTP в активированной форме, что приводит к активации сигнальный путь RAS. Каскадный сигнальный путь RAS-RAF-MEK-ERK представляет собой цепь белков, передающих сигнал внутрь ядра клетки. Каскад участвует в процессе пролиферации и опухолевой прогрессии: активация инвазии, метастазирования, включение антиапоптозных механизмов. Белки взаимодействуют и активируют друг друга между собой с помощью де- и фосфорилирования [16] (рис. 3).
Сигнальный путь RAS может быть активирован внеклеточными сигналами посредством EGFR и других рецепторов: гормоны, факторы роста (EGF и фактор некроза опухо-ли-a (TGF-a), амфирегулин, эпирегулин, HB-EGF), хемокины и нейротрансмиттеры, которые распознаются соответствующими рецепторными тирозинкиназами или рецепторами, нормальная слизистая оболочка
AURKA
АРС/ Р-катенин
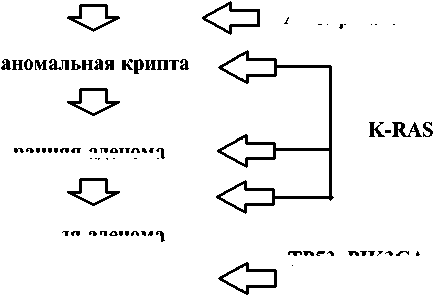
ранняя аденома поздняя аденома инвазивный рак
ТР53, PIK3CA, потеря гетерозиготности в хромосоме 18q
Рисунок 2. Путь хромосомной нестабильности при колоректальном раке.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА КОЛОРЕКТАЛЬНОГО РАКА
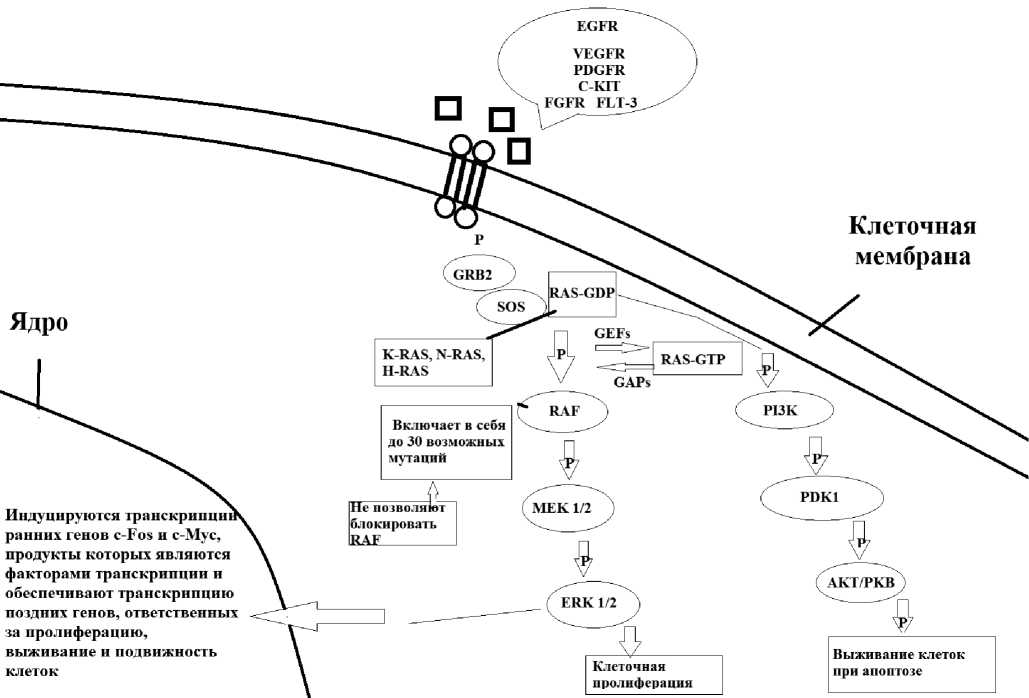
Рисунок 3. Сигнальный путь RAS.
ассоциированными с G-белками, функционирующими в качестве вторичных посредников во внутриклеточных сигнальных каскадах. Следующим этапом активируются факторы обмена гуанина, такие как SOS, стимулирующие диссоциацию связанного ГДФ (неактивная форма) из RAS, и он обменивается на ГТФ (активная форма), что приводит к постоянной активной конформации RAS-GTP. Мутировавшая RAS остаётся в активном состоянии, регулируя при этом ряд клеточных функций [10]. RAS в активном состоянии может поддерживать одна из 30 имеющихся RAF мутаций, в том числе наиболее часто выявляемая мутация 600 кодона гена BRAF [17]. Последующее фосфорилирование активирует MEK и ERK, который в свою очередь через белки передаёт сигнал в клеточное ядро, где запускается процесс транскрипции c-FOS и c-MYC, так называемых ранних генов, приходящих в активацию в течение 15 минут после первичной их стимуляции. Работа ранних генов активирует клеточную пролиферацию, дифференцировку и программу антиапоптоза. Комплекс RAS-GTP также связывает каталитическую субъединицу PI3Ks, которая транслоцируется в плазматическую мембрану для генерации липидов. Активация PI3K играет центральную роль в приобретенной устойчивости к комбинации анти-EGFR и ингибитора MEK в клеточных линиях КРР с мутацией KRAS. Активация PI3K достигается за счет совместной активации множества рецепторных тирозинкиназ, таких как HER2 и HER3. Следует отметить, что PIK3CA мутирует почти в 20% в случае КРР [18]. Изучение столь сложного взаимодействия в работе сигнального пути RAS дало возможность выявить прогностические маркёры, которые оказывают влияние на выбор тактики лечения, позволяют учесть чувствительность и резистентность к лекарственным препаратам на основе индивидуальных молекулярногенетических характеристик.
Существует несколько вариантов блокирования онкогенного эффекта, активированного геном EGFR: использование низкомолекулярных ингибиторов, применение рекомбинантных пептидных лигандов, использование моноклональных антител. Различные элементы сигнального пути RAS могут оказывать разный эффект на воздействие некоторых препаратов (табл. 1).
Таблица 1. Статистика встречаемости основных мутаций при КРР и их влияние на выбор таргетной терапии [19].
|
Мутация в гене |
Частота встречаемости мутации |
Влияние мутации на таргетную терапию |
|
K-RAS |
40–50% |
Резистентность к панитумумабу и цетуксимабу |
|
N-RAS |
1–6% |
|
|
BRAF |
10% |
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА КОЛОРЕКТАЛЬНОГО РАКА
Микросателитная нестабильность при колоректальном раке
С 1993 года начали появляться статьи о частом молекулярно-генетическом явлении при КРР — микросателлитная стабильность [20]. Микросателлиты представляют собой короткие участки последовательности ДНК, повторяющиеся в виде трёх пар оснований, встречающиеся по всему геному человека (рис. 4). Именно из-за их частой повторяющейся структуры эти участки подвержены мутациям вследствие ошибок репликации, которые в норме должны быть устранены генами, ответственными за это: MLH1, PMS2, MSH2, MSH6, MLH3, MSH3, PMS1 [21].
МИКРОСАТЕЛЛИТЫ
ATGCGTAGCTA CAACAACAACAACAACAACAACAACAA AGCGTAAGCATGCC
Результат после нарушения репликации
ATGCGTAGCTA СААСААСААСААСАА AGCGTAAGCATGCC
Рисунок 4. Пример нарушения тандемной последовательности микросателлитов в результате нарушения работы генов репарации.
Исследование микросателлитной нестабильности даёт возможность делать прогноз относительно течения заболевания. Имеющие высокий уровень микросателлит-ной нестабильности КРР не склонны к метастазированию, что доказывает более высокий процент выявления нестабильности при 2 стадии опухолевого процесса по сравнению с 3 и 4 стадией [22]. Основное значение MSI-H — использование ингибиторов иммунных контрольных точек, так как их использование даёт успешный результат при лечении КРР. Эти ингибиторы способствуют выживаемости в группе химиорефрактерных пациентов [23].
«Гиперметилированный» фенотип колоректального рака
Одним из изученных механизмов канцерогенеза при КРР, не вызывающих изменений в нуклеотидной последовательности в ДНК, является гиперметилирование промотерных участков, приводящее к подавлению генов-супрессоров опухолевого роста. Метилирование как эпигенетический фактор заключается в присоединении метильной группы (CH3) к цитозину в составе CpG-динуклеотида в позиции С5 цитозинового кольца (рис. 5).
Промотерные участки являются стартовой площадкой для начала транскрипции генов. Инактивация генов-супрессоров, таких как K-RAS, BRAF и P53, запускает процесс канцерогенеза по сигнальному пути Wnt [24]. Важно, что метилирование — это обратимый процесс, и он является перспективной мишенью в эпигенетическом перепрограммировании КРР [25].
Зубчатый путь развития аденокарциномы
Ещё одна группа опухолей, объединённая в так называемый «зубчатый путь», включает в себя два варианта развития КРР из зубчатого полипа. Первый вариант — это возникновение мутации в гене-супрессоре BRAF. Его мутация приводит к подавлению генов, ответственных за систему репарации неспаренных оснований ДНК, и к возникновению микросателлитной нестабильности высокого и низкого уровня, что в итоге приводит к возникновению опухоли — «зубчатый полип-рак». Второй вариант развивается из традиционной зубчатой аденомы вследствие мутации K-RAS и микросателлитной нестабильности низкого уровня [2].
ЗАКЛЮЧЕНИЕ
Изучение молекулярно-генетического влияния на развитие опухолевого процесса продолжает быть актуально темой исследований, так как является основой для определения прогноза и тактики лечения. Особенности возникновения рака во многом могут быть зависимы от индивидуального генотипа человека, который кодирует различные механизмы, как участвующие в канцерогенезе, так и препятствующие ему [26].
Список литературы Молекулярно-генетическая характеристика колоректального рака
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020 : GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 ; 71 (3) : 209-249. https://doi.org/10.3322/caac.21660.
- Кит О.И., Дженкова Е.А., Мирзоян Э.А., Геворкян Ю.А., Сагакянц А.Б., Тимошкина Н.Н., идр. Молекулярногенетическая классификация подтипов колоректального рака : современное состояние проблемы. Южно-Российский онкологический журнал / SouthRussianJournalofCancer. 2021 ; 2 (2) : 50-56.
- Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990 ; 61 (5) : 759-767. https://doi.org/10.1016/0092-8674(90)90186-i.
- Valenta T., Hausmann G., Basler K. The many faces and functions of b-catenin. EMBO J. 2012 ; 31 : 2714-2736.
- Morin PJ. beta-catenin signaling and cancer. Bioessays. 1999 ; 21 (12) : 1021-1030.
- Easwaran V, Lee SH, Inge L, Guo L, Goldbeck C, Garrett E, et al. beta-Catenin regulates vascular endothelial growth factor expression in colon cancer. Cancer Res. 2003 ; 63 (12) : 3145-3153.
- Shivanna S., Harrold I., Shashar M., Meyer R., Kiang C., Francis J., et al. The c-Cbl ubiquitin ligase regulates nuclear β-catenin and angiogenesis by its tyrosine phosphorylation mediated through the Wnt signaling pathway. J Biol Chem. 2015. https://doi.org/10.1074/jbc. M114.616623.
- Muller MF, Ibrahim AEK, Arends MJ. Molecular pathological classifi cation of colorectal cancer. VirchowsArch. 2016 ; 469 (2) : 125-134.
- Bosman F, Yan P. Molecular pathology of colorectal cancer. Pol J Pathol. 2014 ; 65 (4) : 257-266.
- Pino MS, Chung DC. The chromosomal instability pathway in colon cancer. Gastroenterology. 2010 ; 138 (6) : 2059-72.
- Zhou H, Kuang J, Zhong L, Kuo WL, Gray JW, Sahin A, et al. Tumour amplified kinase STK15 / BTAK induces centrosome amplification, aneuploidy and transformation. Nat Genet. 1998 ; 20 : 189-93.
- Du R, Huang C, Liu K, Li X, Dong Z. Targeting AURKA in Cancer : molecular mechanisms and opportunities for Cancer therapy. Mol Cancer. 2021 ; 20 (1) : 15. https://doi.org/10.1186/s12943-020-01305-3.
- Jacobsen A, Bosch LJW, Martens-de Kemp SR, Carvalho B, Sillars-Hardebol AH, Dobson RJ, et al. Aurora kinase A (AURKA) interaction with Wnt and Ras-MAPK signalling pathways in colorectal cancer. SciRep. 2018 ; 14 ; 8 (1) : 7522.
- Pino MS, Chung DC. The chromosomal instability pathway in colon cancer. Gastroenterology. 2010 ; 138 (6) : 2059-72.
- Santini D, Loupakis F, Vincenzi B, Floriani I, Stasi I, Canestrari, E, et al. High concordance of KRAS status between primary colorectal tumors and related metastatic sites : implications for clinical practice. Oncologist. 2008 ; 13 (12) : 1270-1275.
- ТороповскийА. Н., ПавловаО. Н., ВикторовД. А., Никитин А.Г. Молекулярно-генетические механизмы сигнального каскада RAS-RAF-MEK-ERK, связанные с развитием опухолевого процесса и назначением таргетных препаратов при колоректальном раке. Вестник медицинского института «РЕАВИЗ». Реабилитация, Врач и Здоровье. 2021 ; (4) : 25-35.
- Wan PT, Garnett MJ, Roe SM, Lee S, Niculescu-Duvaz D, Good VM, et al. Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF. Cell. 2004 ; 116 (6) : 855-867. https://doi.org/10.1016/s0092-8674(04)00215-6.
- Samuels Y, Velculescu VE. Oncogenic mutations of PIK3CA in human cancers. Cell Cycle. 2004 ; 3 (10) : 1221-4.
- Телышева Е.Н., Новикова Е.И., Снигирева Г.П. Молекулярно-генетические маркеры при колоректальном раке. Вестник Российского научного центра рентгенорадиологии Минздрава России. 2019 ; 19 : 3 : 96-121.
- Thibodeau SN, Bren G, Schaid D. Microsatellite instability in cancer of the proximal colon. Science. 1993 ; 260 (5109) : 816-9.
- Vilar E, Gruber SB. Microsatellite instability in colorectal cancer-the stable evidence. Nat Rev ClinOncol. 2010 ; 7 (3) : 153-62.
- Федянин М.Ю., Трякин А.А., Тюляндин С.А. Роль микросателлитной нестабильности при раке толстой кишки. Тазоваяхирургия и онкология. 2012 ; (3) : 19-25. https://doi.org/10.17650/2220-3478-2012-0-3-321-338.
- Алексей А. Трякин, Гульноз Г. Хакимова, Татьяна Н. Заботина, Анна А. Борунова, & Ольга А. Малихова. Современные иммунологические биомаркеры рака толстой кишки. Злокачественные опухоли. 2018 ; 8 : 4 : 50-58. https://doi.org/10.18027/2224-5057-2018-8-4-50-58.
- De’ Angelis GL, Bottarelli L, Azzoni C, De’ Angelis N, Leandro G, Di Mario F, et al. Microsatellite instability in colorectal cancer. Acta Biomed. 2018 ; 89 (9-S) : 97-101.
- Suvà ML, Riggi N, Bernstein BE. Epigenetic Reprogramming in Cancer. Science (2013) 339 : 1567-70.
- Куликов Е.П., Судаков А.И., Никифоров А.А., Мерцалов С.А., Григоренко В.А. Значение полиморфизма генов в развитии колоректального рака. Российский медико-биологический вестник им. академика И.П. Павлова. 2020 : 28 : 2 : 127-134.


