Молекулярно-генетическая характеристика патогенности штаммов лакто-зонегативной Escherichia coli, выделенных у больных COVID-19 и в постковидный период
Автор: Назарова М.В., Мастиленко А.В., Потатуркина-Нестерова Н.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
Проведено проспективное молекулярно-генетическое исследование клинических изолятов лактозонегативной Escherichia coli, выделенных у больных COVID-19 в острый период заболевания (1-ая группа обследованных). 2-ю и 3-ю группы составили пациенты с отдаленными последствиями COVID-19 – через 3 месяца и через 6 месяцев соответственно. Диагноз подтверждали методом ПЦР РНК SARS Cov-2 с обратной транскрипцией. Произведено определение полных нуклеотидных последовательностей участков генов патогенности, кодирующих синтез фимбриальных адгезинов (fimH), аэробактина (aer), белка IbeA (ibeA) и гемолизина (hlyF). Проведен биоинформационный анализ консервативных участков исследованных фрагментов геномов лактозонегативной E. coli. Установлено, что частота встречаемости олигонуклеотидных последовательностей генов, детерминирующих патогенность, в первой группе составила 95.2%, во второй – 95.2%, в третьей – 100% (в контрольной группе здоровых – 20.0% изолятов), что свидетельствует о повышении патогенного потенциала исследованных штаммов лактозонегативной E. coli во всех группах. В первой группе ген fimH обнаружен у 81.0%, ген aer – у 33.3%, ген ibeA – у 23.8%, ген hlyF – у 19.0% штаммов. Во второй группе ген fimH выявлен у 88.3%, ген ibeA – у 26.2%, ген aer – у 31.0%, ген hlyF – у 9.5% штаммов. В третьей группе ген fimH обнаружен у 100.0% штаммов, ген aer – у 64.0%, ген ibeA – у 56.0%, ген hlyF – у 40.0%. В контроле ген fimH и ген aer были выявлены у 10.0% и 10.0% штаммов соответственно. Следовательно, наиболее встречаемым геном явился fimH. Частота его встречаемости в первой группе в 8.1, во второй – в 8.8 и в третьей – в 10.0 раз была выше контрольных значений, гена aer – в 3.3, 3.0 и 6.4 раза соответственно.
Гены патогенности, Escherichia coli, COVID-19, микробиота кишечника
Короткий адрес: https://sciup.org/147252077
IDR: 147252077 | УДК: 579.258 | DOI: 10.17072/1994-9952-2025-3-270-278
Текст научной статьи Молекулярно-генетическая характеристика патогенности штаммов лакто-зонегативной Escherichia coli, выделенных у больных COVID-19 и в постковидный период
Больший интерес исследователей вызывает изучение COVID-19 в острый период заболевания, в то время как полученные в последние годы данные свидетельствуют о развитии отдаленных последствий заболевания, которые пока остаются недостаточно изученными [Корсунский, Белоусова, Будзинская, 2023]. Отдаленные симптомы заболевания могут сохраняться после завершения острой фазы и обладать дальнейшим разрушительным действием [Gupta et al., 2020].
Выявление поражений различных органов и систем после завершения острой фазы заболевания нашло свое отражение в Международном классификаторе болезней 10-го пересмотра, в который был внесен отдельный код для описания постковидного синдрома (ПКС): «U09.9 – состояние после COVID-19» (МКБ-10, код рубрики U09.9 «Состояние после COVID-19 неуточнённое»). ПКС развивается или продолжается после окончания ковидной инфекции и длится от 12 недель до 12 месяцев и более [43-я Всемирная …, 2023].
В последние годы показано наличие отсроченных поражений желудочно-кишечного тракта (ЖКТ), когда у переболевших коронавирусной инфекцией развиваются осложнения в течение нескольких недель или же месяцев после заражения [Megyeri et al., 2021]. Данные, полученные Elmunzer et al. и Rizvi et al., также свидетельствуют о симптомах поражения ЖКТ, которые могут проявляться как с первых дней заболевания COVID-19, так и после выздоровления [Elmunzer et al., 2021; Rizvi et al., 2021].
Описаны основные гастроинтестинальные жалобы и наиболее распространённые гастроэнтерологические симптомы в постковидный период [Шилов, 2022]. Авторами представлены результаты проведенного исследования факторов риска развития нарушений со стороны системы пищеварения у больных, перенесших коронавирусную инфекцию, и даны рекомендации по включению пробиотических препаратов в схемы лечения длительно текущего коронавирусного синдрома.
Установлено, что у больных COVID-19 происходят качественные и количественные изменения микробиоты кишечника. Так, Zuo et al. [2020] показано изменение микробного состава данного биотопа при COVID-19 с превалированием условно-патогенных микроорганизмов и даже наличием корреляции между их количеством и тяжестью течения заболевания.
По данным Лутовиной с соавт., при продолжительных респираторно-вирусных инфекциях происходит увеличение количественных показателей E. coli в микробиоте кишечника. Авторами отмечена высокая частота встречаемости лактозонегативной E. coli – у 75.9% обследованных [Лутовина и др., 2017]. Аналогичные результаты представлены в работе Поповой и соавт. [2024].
Показано, что при ковидной инфекции происходит увеличение более чем в 30 раз количественных показателей лактозонегативной Escherichia coli, известной способностью вызывать состояния, характерные для кишечных заболеваний, по сравнению с аналогичными данными у здоровых людей [Назарова, Потатуркина-Нестерова, Ильина, 2024]. Однако до сих пор остаются мало изученными механизмы реализации патогенности у представителей микроценоза кишечника в остром и постковидном периодах.
-
E. coli является одним из наиболее значимых симбионтов кишечника, выполняющим ряд жизненно важных для макроорганизма функций [Ильина, Карпеева, Гусева, 2008; Кузнецова, Гизатуллина, 2019]. В то же время кишечная палочка, обладая высокой пластичностью генома, способна проявлять выраженную патогенную активность. Обмен мобильными генетическими элементами приводит к появлению новых вариантов вида с более высоким патогенным потенциалом [Иванова и др., 2014].
Важнейшими факторами патогенности E. coli являются адгезины, гемолизины, аэробактин и инвазивный белок IbeA [Johnson, 1991; Жабченко, 2013]. К генетическим структурам, детерминирующим фимбриальную активность, относится ген fimН, обеспечивающий взаимодействие с маннозой [Устюжанин, Чистякова, Ремизова, 2020; Новикова и др., 2023]. Аэробактин кодируется геном aer и отвечает за связы- вание и перенос железа в бактериальную клетку для накопления в биотопах, что обеспечивает устойчивость кишечной палочки к антимикробному белку лактоферрину [Здвижкова, Андрющенко, 2017; Raeispour, Ranjbar, 2018].
Гемолизин кодируется несколькими генами, среди которых наибольший интерес вызывает ген hlyF , который экспрессируется E. coli , имеющей способность вызывать инфекции даже внекишечной локализации [Murase et al., 2016; Здвижкова, Андрющенко, 2017].
Белок IbeA выступает фактором вирулентности кишечной палочки, отвечающий за ее способность к инвазии. Он кодируется геном ibeA и экспрессируется, как правило, E. coli , вызывающими также внеки-шечные инфекции [Germon et al., 2005]. Однако проблема молекулярно-генетической характеристики кишечной микробиоты, обнаруживаемой в острый и постковидный периоды COVID-19, в настоящее время остается мало изученной. Это свидетельствует о необходимости дополнительных исследований генетических детерминант патогенности представителей микробного консорциума кишечника для определения возможного их участия в развитии патологических состояний, ассоциированных с COVID-19 и постковидным состоянием.
В связи с этим целью исследования явилось выявление генов патогенности, детерминирующих адгезивную и гемолитическую активность, а также способность образования аэробактина и инвазивного белка IbeA у лактозонегативной E. coli , выделенной у пациентов в острый и постковидный периоды COVID-19.
Материалы и методы исследования
В изучаемую когорту вошли пациенты без признаков поражения желудочно-кишечного тракта в острый и постковидный периоды COVID-19. Диагноз подтверждали методом ПЦР РНК SARS Cov-2.
Объектом исследования служили 21 штамм лактозонегативной E. coli , выделенные у больных COVID-19 (первая группа), 42 – через 3 месяца (вторая группа) и 25 – через 6 месяцев от начала заболевания (третья группа). Контрольную группу составили штаммы лактозонегативной E. coli , выделенные у клинически здоровых людей, репрезентативных по полу и возрасту.
Забор копрологических проб производили общепринятым методом [Сигидаев и др., 2014]. Культивирование кишечной микробиоты проводили в соответствии с Приказом МЗ РФ № 231 [Об утверждении …, 2003]. Культуры лактозонегативной E. coli получали на среде Мюллера–Хинтона (НИИ центр фармакотерапии, ЗАО, Санкт-Петербург) при температуре 37°С.
Идентификацию представителей кишечной микробиоты осуществляли при помощи автоматического бактериологического анализатора Vitek 2 Compact (Biomerieux, Франция).
Для характеристики патогенного потенциала полученных штаммов лактозонегативной E. coli методом ПЦР-РВ выявляли гены, детерминирующие синтез фимбриальных адгезинов ( fimН ), аэробактина ( aer ), гемолизина ( hlyF ) и инвазивного белка ( ibeA ). Бактериальную ДНК выделяли из суточной культуры лактозонегативной E. coli с помощью набора реагентов «ДНК-сорб-А-вариант 100» (АмплиСенс, Москва) согласно инструкции производителя. Для очистки и выделения нуклеиновых кислот использовали Taq-ДНК-полимеразу с ингибирующими активность фермента антителами (состав набора: дезоксинуклеозидтрифосфаты, 2.5 мМ, 500 мкл; 10-кратный ПЦР буфер, 500 мкл; МgCl2, 25 мМ, 500 мкл; Taq ДНК-полимераза с ингибирующими активность фермента антителами, 5 Е/мкл, 50 мкл; деионизированная вода, 2х1.7 мл) (ООО «Синтол», Москва) [Мастиленко и др., 2014; Феоктистова и др., 2022].
Статистическую обработку результатов проводили с помощью пакета прикладных программ Excel-2024
Результаты и их обсуждение
В ходе проведенных исследований определены полные нуклеотидные последовательности участков генов и проведен биоинформационный анализ консервативных участков исследуемых фрагментов геномов лактозонегативной E. coli согласно протоколу проведения амплификации (таблица).
Протокол проведения амплификации
[Amplification protocol]
|
№ шага |
Температура, t ºС |
Время, сек |
Количество повторов |
|
1 |
95 |
300 |
1 |
|
2 |
95 |
10 |
5 |
|
60 |
30 |
||
|
3 |
95 |
5 |
50 |
|
60 |
10-флуоресценция |
В результате генетического анализа выявлено наличие генов fimH, aer, ibeA, hlyF, детерминирующих патогенность клинических изолятов лактозонегативной E. coli. Во всех случаях наблюдалось превыше- ние порога сигнала по каналу Fam, что свидетельствует о наличии искомых нуклеотидных последовательностей в пробах (рис. 1).
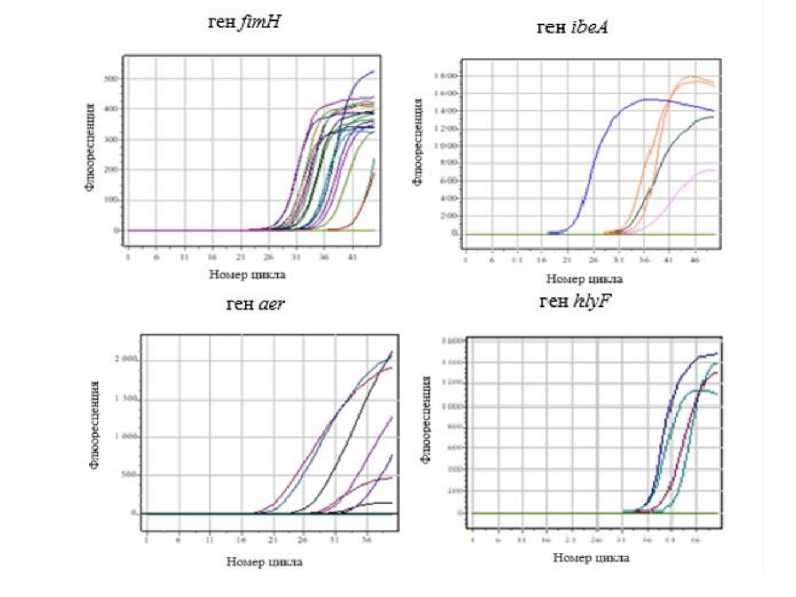
Рис. 1 . Результаты амплификации фрагмента генов лактозонегативной E. coli в первой группе
[Results of amplification of a fragment of genes of lactose-negative E. coli in the first group]
Выявление нуклеотидных последовательностей у лактозонегативной E. coli показало присутствие генов патогенности у 95.2% штаммов в первой и во второй группах соответственно и у 100.0% штаммов в третьей группе (рис. 2).
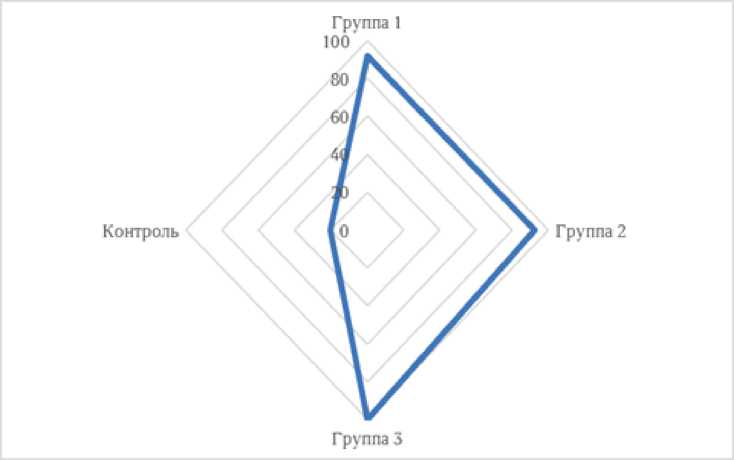
Рис. 2 . Частота встречаемости генов патогенности лактозонегативной E. coli в группах [Frequency of the occurrence of genes of lactose-negative pathogenicity E. coli in groups]
В контроле гены патогенности обнаружены у 20.0% штаммов. Так, гены fimH и aer были выявлены лишь у 10.0% штаммов. Гены ibeA и hlyF у лактозонегативной E coli в контроле не выявлены (рис. 3).
В первой группе ген fimH обнаружен у 81.0%, aer – у 33.3%, ibeA – у 23.8%, hlyF – у 19.0% штаммов.
У 4.8% штаммов наличие генов, детерминирующих патогенность, не выявлено. Установлено одновре-
менное присутствие трех генов патогенности у 19.0% штаммов, двух – у 23.8%. У 52.4% штаммов установлено присутствие только одного гена.
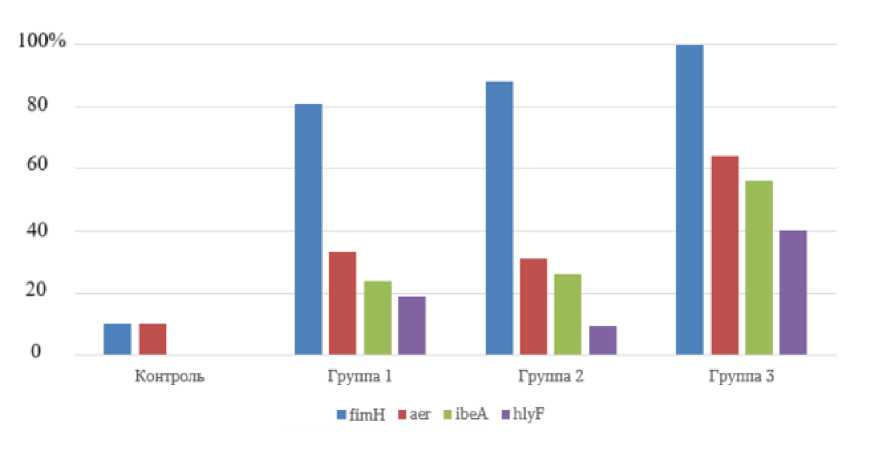
Рис. 3 . Встречаемость генов fimН , aer , ibeA и hlyF лактозонегативной E. coli в группах
[The occurrence of fimН , aer , ibeA и hlyF genes of lactose-negative E. coli in groups]
Во второй группе ген fimH обнаружен у 88.3%, ibeA – у 26.2%, aer – у 31.0%, hlyF – у 9.5% штаммов. У 4.8% штаммов наличие генов патогенности не установлено. Одновременное присутствие четырех генов выявлено у 21.4% штаммов, трех – у 38.1% и двух – у 26,2%. Наличие одного гена патогенности отмечено у 9.5% штаммов.
В третьей группе гены патогенности лактозонегативной E. coli выявлены у всех исследованных изо-лятов. Так, ген fimH обнаружен у 100.0% штаммов, aer – у 64.0%, ibeA – у 56.0%, hlyF – у 40.0%. Одновременное присутствие четырех генов патогенности установлено у 24.0% штаммов, трех – у 48.0% и двух генов – у 28.0% штаммов.
Следовательно, отмечается повышение экспрессии генов, детерминирующих патогенность лактозонегативной E. coli не только при COVID-19, но и в постковидный период.
COVID-19 часто сопровождается симптомами поражения ЖКТ и изменением состава кишечной микробиоты [Садретдинова и др., 2022]. Это может быть связано с непосредственным воздействием вируса, а также лекарственных веществ (антибиотики и др.) на слизистую оболочку ЖКТ и взаимодействующие с ней микроорганизмы.
Происходящее повышение патогенности кишечных палочек в постковидный период можно объяснить нарушениями нормального физиологического состояния кишечника, проявляющегося в нарушении биохимических процессов и состояния слизистой оболочки. Данные патологические изменения среды вегетирования E. coli приводят к нарушению микробного равновесия и изменению свойств кишечной палочки [Юсупов, Одилова, Шайкулов, 2021]. E. coli обладает высокой пластичностью генома, связанной с мобильными «островами» патогенности [Мурзабаева и др., 2016; Хуснутдинова и др., 2024],. вследствие чего в процессе адаптации происходит повышение их патогенного потенциала. Это подтверждается работами Ивановой с соавт. [2013, 2015], в которых показано усиление патогенности E. coli в условиях повышенной конкурентности при нарушении видового состава микробиоты кишечника. Авторами также отмечена необходимость комплексных исследований факторов патогенности для определения этиологической значимости данного микроорганизма.
По данным Kaczmarek et al. [2017] и Sarowska et al. [2019], лактозонегативные штаммы E. coli способны нести в своем геноме гены, определяющие их патогенность ( fimH , aer , ibeA , hlyF ). Kaczmarek et al. [2017] определили закономерность, при которой гемолизин HlyF встречался у данной бактериальной группы лишь у 1.7%, а гены, фланкирующие фимбриальные антигены, были выявлены у 86% исследованных штаммов.
Результаты указывают на необходимость дополнительных генетических исследований патогенного потенциала лактозонегативной E. coli не только при COVID-19, но и в постковидный период.
Заключение
Таким образом, проведенные исследования свидетельствуют о повышении экспрессии генов, детерминирующих патогенность лактозонегативной E. coli у больных COVID-19, через 3 месяца происходило дальнейшее накопление данных генов, достигавшее максимума через 6 месяцев от начала заболевания. В 1-ой и 2-ой группах частота выявления генов патогенности была одинакова и составляла 95.2%. Наибольших значений данный показатель достигал в 3-ей группе (100.0%). Наиболее часто выявляемый ген – fimH , детерминирующий адгезивную активность E. coli. Частота его встречаемости в 1-ой группе в 8.1, во 2-ой в 8.8 и в 3-ей в 10.0 раз превышала контрольные значения, гена aer – в 3.3, в 3.0 и в 6.4 раза соответственно. Данные результаты исследования являются подтверждением возрастающей в настоящее время обеспокоенности долгосрочными последствиями COVID-19, требующими дальнейшего изучения.


