Молекулярно-генетическая оценка риска детерминированности повышенной активности ангиотензинпревращающего ферментапри геморрагической лихорадке с почечным синдромом
Автор: Байгильдина Асия Ахметовна, Исламгулов Денис Владимирович, Камилов Феликс Хусаинович, Хабелова Тамара Александровна, Минниахметов Илдар Рамилевич
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Биохимия
Статья в выпуске: 1 т.6, 2010 года.
Бесплатный доступ
Цель работы - изучение активности ангиотензинпревращающего фермента (АПФ) в сыворотке крови и поли¬морфизма гена рецептора ангиотензина II (AT II) 1 типа при геморрагической лихорадке с почечным синдромом (ГЛПС) как возможного предиктора заболевания. Обследованы 409 больных в возрасте от 15 до 65 лет. Актив¬ность АПФ определялась кинетически с использованием набора фирмы ВьМггапп (Швейцария). Геномная ДНК из периферической крови выделялась методом фенол-хлороформной экстракции, генотипирование локусов изучаемой ДНК проводилась методом ПЦР синтеза ДНК. Статистически незначимое снижение активности АПФ наблюдается только в лихорадочный период среднетяжелой и тяжелой формы без осложнений; во все осталь¬ные периоды и при всех формах наблюдается статистически значимая гиперактивность АПФ. При тяжелой форме без осложнений наблюдаются резкие колебания активности АПФ в динамике болезни. При осложненной форме имеет место статистически значимая стабильно высокая активность фермента на всем протяжении бо¬лезни. Анализ полиморфизма гена рецептора АТ II 1 типа свидетельствуют о том, что аллели *А1166 и *С1166, а также, генотипы *А1166 А1166 и *С1166 С1166 не ассоциированы со степенью тяжести течения ГЛПС. По¬вышение активности АПФ при ГЛПС не носит адаптивный характер из-за дефектов в рецепции АТ II и является адекватным метаболическим ответом организма в ответ на внедрение эндотелиотропного вируса
Ангиотензинпревращающий фермент, геморрагическая лихорадка с почечным синдромом, ген рецептора ангиотензина ii 1 типа
Короткий адрес: https://sciup.org/14916998
IDR: 14916998
Текст научной статьи Молекулярно-генетическая оценка риска детерминированности повышенной активности ангиотензинпревращающего ферментапри геморрагической лихорадке с почечным синдромом
Методы. В исследование включили 409 больных с серологически подтвержденным методом непрямых флюоресцирующих антител диагнозом ГЛПС (346 мужчин и 63 женщин) в возрасте от 15 до 65 лет (средний возраст 33,6±3,5 лет), находившихся на стационарном лечении в МУ «Инфекционная клиническая больница № 4» г. Уфы и в отделении гемодиализа Республиканской клинической больницы им. Г.Г. Куватова в 2003-2008 годах. Критериями исключения из групп исследования были наличие в анамнезе гипертонической болезни, болезней сердца и сосудов, сахарного диабета, ревматизма, злокачественных заболеваний, заболеваний печени и почек. При определении степени тяжести ГЛПС использовали классификацию Б.З. Сиротина [9]. Среднетяжелая форма выявлена у 252 больных (61,6%), тяжелая без осложнений – у 109 больных (26,7%), тяжелая с осложненным течением – у 48 больного (11,7%). Группу контроля составили 52 практически здоровых лица, сопоставимых по полу и возрасту.
Для определения активности АПФ взятие крови объемом 5 мл производили путем венепункции локтевой вены утром натощак. Собранную в специальные пробирки без антикоагулянтов кровь выдерживали 2 часа при температуре 18°С, после чего центрифугировали при температуре 4°С и 1000g и собирали сыворотку. Образцы сыворотки крови для анализа хранили при температуре -20°С не более 6 месяцев. Активность АПФ в сыворотке крови определяли кинетическим ме тодом с использованием набора фирмы «Вьhlmann»
450097 г. Республика Башкортостан, г. Уфа, бульвар Х. Давлетшиной, д.18., кв. 101.
Тел. 89173484738;
(Швейцария). Абсорбцию света регистрировали с помощью ИФА-ридера «Вench mark» компании «Вio-Rad». Для генетического исследования пробы венозной крови брали в пробирки типа вакутейнера с ЭДТА. ДНК выделяли из периферической крови методом фенольно-хлороформной экстракции [ 10 ] . Анализ полиморфизма A1166С гена AGTR1 проводили методом полимеразной цепной реакции синтеза ДНК с последующим ферментативным гидролизом с использованием эндонуклеазы рестрикции BstDEI « Сибэнзим». Результаты амплификации оценивали с помощью электрофореза в 2% агарозном геле с последующим окрашиванием бромидом этидия и визуализацией в проходящем ультрафиолетовом свете. В результате амплификации участка гена AGTR1 , содержащего нуклеотидную замену А1166С, получали ампликон длиной 225 п.о. Ампликон, содержащий аллель * С1166 , несет сайт узнавания фермента рестрикции BstDEI , и, расщепляясь, образует продукты размером 110 и 115 п.о., в то время как фрагмент ДНК, содержащий аллель * А1166 , остается нерасщепленным. Наличие фрагмента длиной 225 п.о. после обработки BstDEI соответствует генотипу * А1166 /* А1166 , двух фрагментов (110 и 115 п.о.) – генотипу * С1166 /* С1166 и трех (110, 115 и 225 п.о.) – гетерозиготному генотипу * А1166 /* С1166 .
Обработку результатов исследования проводили с использованием стандартного статистического пакета программ Statistica 7.0 for Windows и SPSS 13. Результаты исследования активности АПФ оценивали методами непараметрической статистики: определяли медиану (Ме), интерквартильный интервал [25% и 75%], достоверность межгрупповых различий средних величин оценивали при помощи критерия Манна-Уитни. Результаты исследования представляли как Ме [Ԛ1; Ԛ3]. При сравнении частот генотипов, аллелей в группах больных ГЛПС с различной степенью тяжести заболевания использовали критерий2 (хи-квадрат) Пирсона. Для всех видов анализа различия принимали за значимые при р<0,05.
Результаты. Определение активности АПФ в сыворотке крови больных ГЛПС показало, что она в равной степени зависит и от периода заболевания, и от степени его тяжести (табл. 1). Лихорадочный период заболевания при среднетяжелой форме характеризуется статистически незначимой тенденцией к снижению активности АПФ, в остальные периоды данной формы наблюдается статистически значимый рост активности фермента с пиком в период полиурии – в 3,1 раза выше значений для контроля (рис. 1). Аналогичная тенденция к изменению изучаемого показателя имеет место и при тяжелой форме болезни без осложнений. Однако, несмотря на динамику, сходную со среднетяжелой формой, активность фермента в полиурический период и в период восстановленного диуреза неосложненной формы ГЛПС достигает более высоких значений (в 3,5 раз выше контрольных значений) вплоть до статистически значимых различий в последний период не только с группой контроля, но и между данными группами больных при восстановлении диуреза. Осложненная форма ГЛПС имеет отличную от остальных форм болезни динамику изменения активности АПФ: гиперактивность энзима без значительных колебаний от периода к периоду регистрируется в течение всей болезни также с максимумом в полиурический период – в 3,3 раза выше контрольных значений – и со статистически незначимой тенденцией к снижению в период восстановленного диуреза. При присоединении осложнений статистически значимыми становятся не только раз- личия с контролем, но различия со среднетяжелой и неосложненной формами болезни. Нормализации изучаемого показателя к периоду восстановленного диуреза при всех формах тяжести ГЛПС на фоне базисной терапии не происходит.
Тип полиморфизма, последовательность праймеров и номенклатура аллелей анализируемых полиморфных локусов гена ген рецептора (тип 1) ангиотензина II ( AGTR1 ) представлены в таблице 2. Результаты оценки распределения частот аллелей и генотипов полиморфного локуса А1166С гена AGTR1 у больных ГЛПС в зависимости от степени тяжести заболевания представлены в таблице 3. Во всех изученных выборках распределение частот генотипов соответствовало распределению Харди-Вайнберга. Сравнительный анализ распределения частот генотипов полиморфного локуса A1166C гена AGTR1 не выявил статистически значимые различия между группами больных с различной степенью тяжести
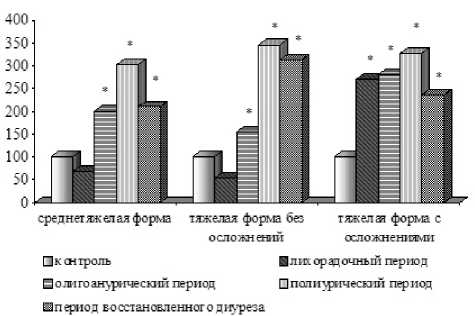
Рис. 1. Активность АПФ в сыворотке крови больных ГЛПС в зависимости от тяжести заболевания (% к контролю); * – статистическая значимость различий с контролем
Таблица 1
Активность АПФ в сыворотке крови больных ГЛПС различной степени тяжести на фоне базисной лекарственной терапии (мкмоль/л х мин)
|
Период заболевания |
Форма заболевания |
||
|
среднетяжелая |
тяжелая без осложнений |
тяжелая с осложнениями |
|
|
лихорадочный |
12,4 [8,8; 18,2] р>0,07 |
9,7 [1,1; 14,1] р>0,06; р1>0,9 |
49,0 [42,4; 50,3] р<0,002; р2<0,006; р3<0,006 |
|
олиго- |
36,2 [28,2;54,7] |
28,2 [21,2; 47,7] |
50,8 [45,9; 63,5] |
|
анурический |
р<0,006 |
р<0,019; р1>0,38 |
р<0,003; р2<0,03; р3<0,009 |
|
полиурический |
55,0 [35,3; 71,5] р<0,0006 |
60,9 [50,6; 77,6] р<0,0002; р1>0,2 |
59,2 [45,9; 70,6] р<0,0001; р2>0,4; р3>0,5 |
|
восстановленного диуреза контроль 18,05 [15,0; 21,5] |
38,0 [34,4; 45,9] р<0,0001 |
56,5 [44,1; 59,0] р<0,0004; р1<0,02 |
49,4 [42,4; 58,3] р<0,0001; р2<0,03; р3>0,14 |
Примечание: р – значимость различий с группой контроля; р1 – значимость различий между среднетяжелой формой и тяжелой формой без осложнений; р2 –значимость различий между среднетяжелой формой и тяжелой формой с осложнениями; р3 – значимость различий между тяжелой формой без осложнений и тяжелой формой с осложнениями.
Тип полиморфизма, последовательность праймеров и номенклатура аллелей анализируемых полиморфных локусов
Таблица 2
|
ген [OMIM], локализация |
полиморфизм (аллели) |
праймеры (фермент рестрикции) |
|
АGTR1 [106165] 3q21-q25 |
А1166С *А1166 - 225 п.о. *С1166 - (110 п.о.+115 п.о.) |
5' GСАССАTGTTTTGАGGTTGА 3' 5' TGTGGСTTTGСTTTGTСTTG 3' (ВstDEI ) |
Таблица 3
Распределение частот генотипов и аллелей полиморфного локуса A1166С генома AGTR1 у больных ГЛПС различной степени тяжести заболевания
|
форма заболевания |
генотипы |
аллели |
||||
|
*А/*А |
*А/*С |
*С/*С |
*А |
*С |
||
|
n |
84 |
65 |
6 |
233 |
77 |
|
|
среднетяжелая |
pi±Sp, СI% |
54,19±4,00 |
41,94±3,96 |
3,87±1,55 |
75,16±2,45 |
24,84±2,45 |
|
тяжелая без |
n |
54 |
30 |
6 |
138 |
42 |
|
осложнений |
pi±Sp, СI% |
60,00±5,16 |
33,33±4,97 |
6,67±2,63 |
76,67±3,15 |
23,33±3,15 |
|
тяжелая с |
n |
32 |
12 |
3 |
76 |
18 |
|
осложнениями |
pi±Sp, СI% |
68,09±6,80 |
25,53±6,36 |
6,38±3,57 |
80,85±4,06 |
19,15±4,06 |
Примечание: n – абсолютное число генотипов (аллелей); pi – частота; Sp – ошибка pi.;2 – хи квадрат; p – уровень значимости; df – число степеней свободы.
ГЛПС (p>0,05). Выявлено равнозначное распределение частот генотипа *C1166 / *C1166 в группах больных со средней и тяжелой формой UKGС (54% и 60% соответственно). Гетерозиготный генотип *A1166 / *C1166 встречался почти на 10% больше у больных с средней тяжестью (42%) по сравнению с тяжелой формой ГЛПС (33%). У больных более тяжелой формой ГЛПС отмечено почти в 2 раза увеличение частоты генотипа *C1166 / *C1166 (6,7%) по сравнению со средней степенью тяжести заболевания (3,9%) (рис. 2).
Обсуждение. Основная часть АПФ синтезируется в эндотелии сосудов и в норме. Около 90% фермента фиксирована на эндотелиальной мембране и только около 10% его активности приходится на плазму крови. Основным эффектором АПФ является АТ II, действие которого реализуется через специфические ангиотензиновые рецепторы. Наибольшее значение имеет рецептор АТ II 1 типа, через стимуляцию которого реализуется большинство как физиологических, так и патофизиологических эффектов данного пептида: вазоконстрикция, увеличение минутного объема сердца, стимуляция секреции альдостерона и подавление вазопрессина, повышение уровня ингибитора тканевого активатора плазминогена, стимуляция выработки цитокинов с инициацией воспалительного процесса в сосудистой стенке, стимуляция генерации активных форм кислорода и др. [11, 12]. При ГЛПС, вызываемом эндотелиотропным вирусом, имеет место как гиперактивация эндотелия, так и его повреждение [13, 14], что ведет, с одной стороны, к усиленной экспрессии ее клетками АПФ, а с другой – к протеолитическому отщеплению молекул фермента от поврежденных эндотелиоцитов и, как следствие, – к повышению пула плазменного АПФ. Нельзя исключить также усиленную экспрессию АПФ по принципу обратной связи вследствие отсутствия его прессорного эффекта в результате нарушения рецепции продукта катализируемой им реакции – АТ II. Нами выявлены значительные сдвиги в активности данного фермента зависимости от тяжести ГЛПС и наличия осложнений: среднетяжелая форма характеризуется наименее выраженной по сравнению с остальными формами болезни активностью фермента и отсутствием его «скачков» в динамике, при тяжелой форме заболевания без осложнений имеет место выраженный подъем активности к периоду развития полиурии, а при наличии осложнений гиперактивность АПФ наблюдается на всем протяжении заболевания со с статистически значимыми межгрупповыми различиями. Однако изучение полиморфизма гена рецептора АТ II 1 типа показало, что аллели *А1166 и *С1166, а также генотипы *А1166/*А1166, *А1166/*С1166 и *С1166/*С1166 не ассоциированы с со степенью тяжести течения ГЛПС, что позволяет сделать вывод о том, что высокая активность АПФ при ГЛПС, которая тем выраженнее, чем тяжелее течение болезни, не обусловлена нарушенной рецепцией АТ II из-за отсутствия васкулярного эффекта и может быть расценена как вполне адекватная реакция макроорганизма в ответ на метаболические изменения, первоначально обусловленные действием хантавируса – возбудителя ГЛПС.
Заключение .
-
1. У больных ГЛПС выявлено статистически значимое повышение в крови активности АПФ, зависящее от периода и степени тяжести заболевания.
-
2. Сравнительный анализ распределения частот генотипов полиморфного локуса A1166C гена ангиотензина II AGTR1 не выявил статистически значимые
-
3. Повышение активности АПФ при ГЛПС, особенно выраженное при тяжелой форме, не носит адаптивный характер из-за дефектов в рецепции АТ II при ГЛПС и является адекватным метаболическим ответом организма в ответ на внедрение эндотелио-тропного вируса.
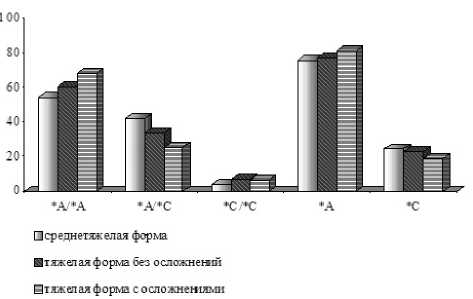
Рис. 2. Распределение частот генотипов и аллелей полиморфного локуса А1166С генома АGTR1 у больных ГЛПС в зависимости от тяжести заболевания (%)
различия между группами больных с различной степенью тяжести ГЛПС.
Список литературы Молекулярно-генетическая оценка риска детерминированности повышенной активности ангиотензинпревращающего ферментапри геморрагической лихорадке с почечным синдромом
- Behavioural and structural factors in health: an empirical analysis/K. Stronks, H. Van de Mheen, Loomon et al.//Sociology of health and illness. -1996. -№ 18. -P. 653-674.
- Assiciation between angiotensin II type 1 receptors gene and human essential hypertension/H. Fan, S. Li, W. Gu et al.//Chung Hua I Hsueh I ChuanHsuen Tsa Chi. -1998. -Vol. 1015. -№ 2. -P. 101-103.
- Association between renin-angiotensin system gene polymorphism and essential hypertension: a community-based study/X. Jiang, H. Sheng, J. Li et al.//J Hum Hypertens. -2009. -№ 3. -P. 176-181.
- Angiotensin II type 1 receptor gene polymorphism predicts development of hypertension and metabolic syndrome/P. Palatini, G. Ceolotto, F. Dorigatti et al.//Am J Hypertens. -2009. -№ 2. -P. 208-214.
- Synergistic effects on angiotensin-converting enzyme and angiotensin II receptor gene polymorphism on risk of myocardial infarction/A. Bonnardeaux, L. Tiret, O. Poirier et al.//Lancet. -1994. -Vol. 344. -№ 3. -P. 910-913.
- Synergistic effects of angiotensin converting enzyme and angiotensin II type 1 receptor gene polymorphisms on ischemic events/P.P. van Geel, Y.M. Pinto, A.H. Zwinderman et al.//XX Congress of the European society of Cardiology. -Abstract. -P. 386.
- Полиморфизм генов ренин-ангиотензиновой системы и дисфункция эндотелия у мужчин, перенесших инфаркт миокарда в молодом возрасте/О.А. Беркович, Е.А. Баженова, Н.В. Вахрамеева и др.//Артериальная гипертензия. -2008. -Т. 14. -№ 3. -C. 239-244.
- Mutations in genes in the renin-angiotensin system are associated with autosomal recessive renal tubular dysgenesis/O. Gribouval, M. Gonzales, Neuhaus et al.//Nature Genet. -2005. -№ 37. -P. 964-968.
- Сиротин, Б.З. Геморрагическая лихорадка с почечным синдромом. Монография/Б.З. Сиротин. -Хабаровск. -1994. -300 с.
- Маниатис, Т. Методы генетической инженерии. Молекулярное клонирование/Т. Маниатис, Э. Фрич, Дж. Сембрук. -М.: Мир, 1984. -352 с.
- Дроздова, Г.А. Клеточные механизмы артериальной гипертензии/Г.А. Дроздова//Патологическая физиология. -2000. -№ 2. -C. 26-31.
- Galle, J. Angiotensin II and oxidized LDL: an unholy alliance creating oxidative stress/J. Galle, K. Heermeier//Nephrol Dial Transplant. -1999. -№ 14. -P. 2585-2589.
- Камилов, Ф.Х. Состояние целостности эндотелия сосудов при ГЛПС/Ф.Х. Камилов, А.А. Байгильдина, В.Ш. Вагапова //Морфология. -2008. -№ 4. -C. 72.
- Камилов, Ф.Х. Экспрессия VCAM-1 как отражение активации эндотелия при ГЛПС/Ф.Х. Камилов, А.А. Байгильдина//Морфология. -2008. -№ 2. -C. 57.


