Молекулярно-генетические изменения тканей яичек пациентов с COVID-19
Автор: Демяшкин Григорий Александрович, Болдырев Дмитрий Владимирович, Щекин Владимир Иванович, Жиганова Марианна Сергеевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.30, 2022 года.
Бесплатный доступ
Несмотря на определенный прогресс в изучении влияния инфекции COVID-19 на человеческий организм, многие вопросы, связанные с возникающими патологическими процессами после перенесения заболевания, а также с развитием так называемого «постковидного» синдрома, остаются не разрешенными. Одним из таких вопросов является влияние SARS-CoV-2 на мужскую фертильность. Результаты проведенных ранее в данном направлении исследований противоречивы, в связи с чем на данный момент нет чётких доказательств непосредственного поражения мужских гонад коронавирусом. Таким образом, гипотеза о потенциальной таргетности яичек для SARS-CoV-2 нуждается в подтверждении. Цель исследования: оценка молекулярно-генетического профиля образцов препаратов тканей яичек у пациентов с COVID-19. Образцы тканей яичек пациентов с подтвержденным COVID-19 (n=96, возраст 25-91 год) были изучены методом полимеразной цепной реакции в режиме реального времени для определения экспрессии вирусной РНК SARS-CoV-2 и генов, кодирующих белковые комплексы АПФ-2 и фурина. Критериями исключения были: эпидемический паротит, бесплодие, сепсис, бактериальная инфекция, носительство ВИЧ, вирусов гепатита В и С, Эпштейна-Барра. Контрольную группу наблюдений (n=20) составили архивные парафиновые блоки аутопсийного материала нормальных яичек, полученные не позднее 6 часов после констатации биологической смерти, без макроскопических признаков наличия воспалительного и/или опухолевого процесса, все пациенты этой подгруппы были фертильны и ранее не подвергались воздействию токсинов или лекарственных препаратов. В результате исследования у пациентов, пораженных COVID-19, было зафиксировано наличие генетического материала коронавируса в яичках. Кроме того, в ткани яичек выявлена повышенная экспрессия АПФ-2 и фурина, что определяет благоприятные условия для поражения SARS-CoV-2. Таким образом, по результатам ПЦР-тестирования препаратов яичковых тканей на наличие РНК вируса SARS-CoV-2, оценки экспрессии АПФ-2 и фурина, можно с большой вероятностью утверждать о потенциальной таргетности мужских половых клеток, клеток Сертоли и Лейдига для него.
Яички, sars-cov-2, апф-2, фурин, фертильность
Короткий адрес: https://sciup.org/143178904
IDR: 143178904 | DOI: 10.20340/mv-mn.2022.30(2).573
Текст научной статьи Молекулярно-генетические изменения тканей яичек пациентов с COVID-19
Демяшкин Г.А., Болдырев Д.В., Щекин В.И., Жиганова М.С. Молекулярно-генетические изменения тканей яичек пациентов с COVID-19. Морфологические ведомости. 2021;30(2):573 (2).573
Demyashkin GA, Boldyrev DV, Shchekin VI, Zhiganova MS. Molecular genetic changes in the testis tissues of Covid-19 patients. Morfologicheskie Vedomosti – Morphological newsletter. 2022;30(2):573 (2).573
Введение. Появление, а затем и чрезвычайно быстрый темп распространения новой коронавирусной инфекции COVID-19, вызванной вирусом SARS-CoV-2, привели к более 120 миллионам случаев инфицирования и около 2 500 000 смертей по всему миру [1]. Проникновение вируса SARS-CoV-2 в клетки происходит посредством специфического взаимодействия вируса с ангиотензин-превращающим ферментом 2 (далее - АПФ-2) и сериновой протеазой – фурином [2]. Обладая троп-ностью к этим белкам, локализующимся на мембранах различных клеток, SARS-CoV-2 может приводить к поражению многих органов, таких как почки, сердце, кишки, легкие и другие, поэтому COVID-19 можно рассматривать как системное заболевание [1]. При этом вопрос о поражении органов мужской репродуктивной системы, и в первую очередь процессов сперматогенеза, остается открытым.
Согласно проведенному ПЦР-анализу (далее – полимеразной цепной реакции – ПЦР) SARS-CoV-2 был обнаружен в тканях яичка, при иммуногистохимическом исследовании выявили увеличение концентрации рецепторов AПФ-2 в сперматогониях, клетках Лейдига и Сертоли [2-8]. Однако проведенные секвенирования генома (далее - scRNA-seq) мужских половых клеток и их микроокружения с целью обнаружения SARS-CoV-2 демонстрировали спорные результаты, в большинстве случаев следов вируса как в яичках, так и сперме не было обнаружено [9-11]. Тем не менее, авторы других работ утверждают обратное [12]. Учитывая минимальное количество информации о возможном повреждающем действии SARS-CoV-2 на мужские гонады, а также очевидный интерес к проблеме мужской фертильности в условиях широкого распространения заболевания COVID-19, проведение научных работ в данном направлении является остро актуальным.
Цель исследования: оценка молекулярно-генетического профиля образцов препаратов тканей яичек у пациентов с COVID-19.
Материалы и методы исследования. Дизайн эксперимента состоял в следующем. На основании анамнестических, клинических и морфологических данных были сформированы группы, каждая из которых включала подгруппы согласно возрастной периодизации ВОЗ (табл. 1). I группа наблюдения (n=96) в возрасте от 25 до 91 года, (в среднем 59 лет) – аутопсий-ный материал яичек пациентов, умерших с установленным клиническим и патологоанатомическим диагнозом коронавирусная инфекция (COVID-19, ПЦР+). Критерии исключения: эпидемический паротит, бесплодие, сепсис, бактериальная инфекция, носительство ВИЧ, вирусов гепатита В и С, Эпштейна-Барра. Группа наблюдения II (n=20) – архивные парафиновые блоки (2015–2016 гг.) аутопсийного материала нормальных яичек, полученных не позднее 6 часов после констатации биологической смерти, без макроскопических признаков наличия воспалительного и/или опухолевого процесса, все пациенты этой подгруппы имели по крайней мере одного генетически собственного ребенка и ранее не подвергались воздействию токсических веществ.
Таблица 1
Распределение наблюдений по группам, согласно возрастной периодизации ВОЗ (2014)
|
возраст|age |
подгруппа|subgroup |
n |
возраст|age |
подгруппа|subgroup |
N |
|
25–44 (молодой|young) |
I – COVID-19 |
9 |
61–75 (пожилой|old) |
I – COVID-19 |
43 |
|
II – контроль | control |
5 |
II – контроль | control |
5 |
||
|
45–60 (средний|mature) |
I – COVID-19 |
17 |
76–90 (старческий|senile); >90 (долгожители| centenarians) |
I – COVID-19 |
27 |
|
II – контроль | control |
5 |
II – контроль | control |
5 |
Количественные данные, полученные в ходе ПЦР в режиме реального времени (далее ПЦР-РВ), были проанализированы с использованием рангового дисперсионного анализа ANOVA.
Результаты исследования и обсуждение. При морфологическом исследовании яичек во всех образцах обнаружили признаки вирусного орхита (рис. 1). В большинстве извитых семенных канальцах наблюдали частые отслоения мужских половых клеток от базальной мембраны, которая была утолщена и разрыхлена. Перитубулярное пространство – отечное, с умеренной воспалительной инфильтрацией (плазмоциты, тучные клетки, лимфоциты, единичные нейтрофилы и эозинофилы). Кроме того, отмечали обильные внутрисосудистые тромбозы и слущение эндотелио-цитов, снижение количества половых клеток; утолщение и отек интерстициальной ткани, миграцию плазмоцитов, микротромбы в просвете кровеносных сосудов мелкого калибра.
Во всех изученных образцах (n=96) в ткани яичка при ПЦР-РВ обнаружен SARS-CoV-2, в то время как в ткани придатка (n=96) она была отрицательная. При ПЦР-РВ анализе экспрессии АПФ-2 и фу-рина в тканях яичка и придатка яичка (n=96) показали приблизительно схожие паттерны экспрессии, нормализованные по GAPDH (глицеральдегид-3-фосфат дегидрогеназе, табл. 3). В ткани яичка у пациентов с COVID-19 отмечали увеличение экспрессии АПФ-2 по сравнению с контролем почти в 7 раз – 8,46±0,85 против 1,23±0,02 (p<0,01, соответственно). В SARS-CoV-2-позитивных образцах относительная экспрессия АПФ-2 в тканях яичка была выше в 1,8 раз, чем в тканях придатка яичка (4,74±0,61, p<0,01). При распределении экспрессии АПФ-2 отмечали тенден- цию к ее уменьшению с возрастом в обеих группах (табл. 4).
Экспрессия фурина в тканях яичка у COVID-19-пациентов была выше почти в 3 раза по сравнению с мужчинами контрольной группы – 6,18±0,42 против 2,18±0,68 (p<0,01, соответственно). В тканях яичка экспрессия фурина превалировала в 1,5 раза над значениями в тканях придатка яичка (4,22±0,54, p<0,01), а также не зависела от возраста (табл. 5).
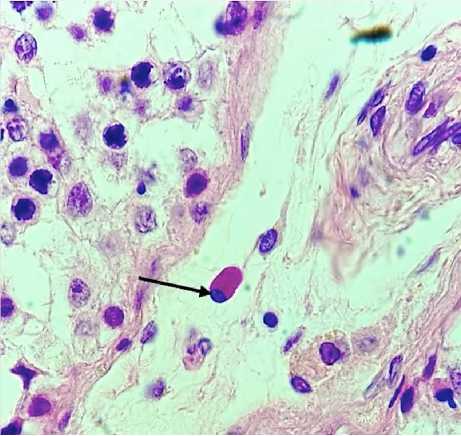
Рис. 1. Микроскопическая картина яичка (случай К., 58 лет). Обозначения: стрелка – миграция плазмоцита. Окр.: гематоксилином и эозином. Ув.: х 1000.
Настоящее исследование посвящено изучению SARS-CoV-2 вирусной нагрузки в яичках и придатках яичек у пациентов с подтвержденным диагнозом COVID-19 в разных возрастных группах с использованием ПЦР-РВ. При ПЦР-РВ
SARS-CoV-2 был обнаружен во всех изучаемых образцах (n=96) тканей яичка, что частично согласуется с результатами других исследований и свидетельствует о по-
Таблица 2
Используемые праймеры для SARS-CoV-2, АПФ-2 и фурина
|
гены | genes |
5´-праймер | 5´-primer |
3´-праймер | 3´-primer |
|
SARS-CoV-2 |
WuhanCoV-spk2-f 5'-TTTCCTCGTGAAGGTGTCTTTGT-3 ' |
|
|
WuhanCoV -spk2-r 5'-TGTGGTTCATAAAAATTCCTTTGTG-3 ' |
||
|
WuhanCoV-spk2-hex-p5'-HEX-TCAAATGGCACACACTGGTTTGT-BHQ1 |
||
|
АПФ-2 | ACE-2 |
ACCTCACTATTTGAAAGCACTTGGT |
GCTTGCTTGAGCAGGAAGTTTATTT |
|
фурин | Furin |
CCACATGACTACTCTGCTGATGG |
CGAAGTGAACTTGGTCAGCGT |
Таблица 3
|
гены | genes |
яичко | testis |
придаток яичка | epididymis |
p |
||
|
I – COVID-19 |
II – контроль | control |
I – COVID- 19 |
II – контроль | control |
||
|
АПФ-2|ACE-2 |
8,46±0,85 |
1,23±0,02 |
4,74±0,61 |
1,28±0,42 |
p<0,01 |
|
фурин | Furin |
6,18±0,42 |
2,18±0,68 |
4,22±0,54 |
2,56±0,82 |
p<0,01 |
Таблица 4
Распределение экспрессии АПФ-2 при ПЦР-РВ по возрастам в условных единицах
|
возраст | age |
подгруппа | subgroup |
АПФ-2 | ACE-2 |
возраст | age |
подгруппа | subgroup |
АПФ-2 | ACE-2 |
|
25–44 years (молодой | young) |
I – COVID-19 |
8,54±0,12 * |
61–75 years (пожилой | old) |
I – COVID-19 |
8,49±0,21 * |
|
II – контроль | control |
2,79±0,11 |
II – контроль | control |
0,85±0,14 |
||
|
45–60 years (средний | mature) |
I – COVID-19 |
8,51±0,14 * |
76–90 years (старческий | senile); > 90 (долгожители | centenarians) |
I – COVID-19 |
8,39±0,33 * |
|
II – контроль | control |
1,34±0,21 |
II – контроль | control |
0,52±0,22 |
Примечание: * - достоверность различий с показателями контроля p<0,01
Таблица 5
Распределение экспрессии фурина при ПЦР-РВ по возрастам в условных единицах
|
возраст | age |
подгруппа | subgroup |
фурин | Furin |
возраст | age |
подгруппа | subgroup |
фурин | Furin |
|
25–44 years (молодой | young) |
I – COVID-19 |
5,43±0,11 * |
61–75 years (пожилой | old) |
I – COVID-19 |
6,23±0,11 * |
|
II – контроль | control |
4,17±0,12 |
II – контроль | control |
4,21±0,12 |
||
|
45–60 years (средний | middle) |
I – COVID-19 |
5,52±0,12 * |
76–90 years (старческий| senile); > 90 (долгожители| Centenarians) |
I – COVID-19 |
5,69±0,13 * |
|
II – контроль | control |
4,18±0,11 |
II – контроль | control |
4,22±0,13 |
Примечание: * - достоверность различий с показателями контроля p<0,01
Результаты ПЦР-РВ на АПФ-2 и фурин в условных единицах
тенциальной уязвимости мужской половой железы к этому антигену. Однако, вероятность проникновения вируса через гематотестикулярный барьер можно рассматривать лишь гипотетически.
В литературе описаны случаи, подтверждающие способность некоторых вирусов приводить к развитию спермато-генной недостаточности в результате прямого воздействия на мужские половые клетки, сопровождающиеся местными воспалительными реакциями. Например, при паротите, вирусных инфекциях Эбола, Зика и SARS-CoV. Однако, SARS-CoV-2 не был найден в адлюминальном ком-партменте извитых семенных канальцев. Проводя аналогию между полученными данными по вирусам паротита, Эбола, Зика, результатами настоящего и ранее про- веденных исследований, можно высказать предположение о возможности SARS-CoV-2 проникать через гематотестикулярный барьер и поражать мужские половые клетки [12-13, 7].
Другой механизм, который также не исключается в случае COVID-19 - цито-киновое воздействие. При эпидемическом паротите увеличивается продукция цитокинов в основном TNF-α, IL-6 и нарушается функционирование гематотестикуляр-ного барьера, что снижает количество контактных белков клеток Сертоли, в первую очередь ZO-1 белка приводя к де-компартментализации семенных канальцев (клетки Сертоли являются таргетными для вируса) [14]. Вирус Зика, также снижает проницаемость гематотестикулярного барьера, что приводит к поражению кле- ток Сертоли и ухудшению барьерных свойств мужских гамет [15]. При инфицировании вирусом Эбола в гематотестику-лярном барьере и микроокружении наблюдается повышение активности иммунокомпетентных клеток [13]. При этом ПЦР-РВ на указанные инфекции в тканях яичек демонстрировали присутствие вирусной РНК [15-19].
SARS-CoV-2 не был выявлен в придатках яичек. Этот факт свидетельствует о способности вируса инфицировать только клетки, характерные для паренхимы мужских гонад, а именно – половые клетки, клетки Сертоли и Лейдига, и позволяет исключить поражение стромального компонента, представленного рыхлой волокнистой соединительной тканью в обоих органах. Учитывая, что придаток яичка является резервуаром для дозревания сперматозоидов, то полученный отрицательный результат на SARS-CoV-2 позволяет считать потенциально таргетными для SARS-CoV-2 мужские половые клетки, не достигшие фазы формирования.
Возбудитель COVID-19 преимущественно поражает органы дыхательной и мочевыделительной систем, желудочнокишечного тракта, сердце [20-22], тенденция к инфицированию которых может быть обоснована значительной экспрессией АПФ-2 и фурина в аппарате Гольджи, за счет которых вирус способен проникать в клетки. SARS-CoV-2 содержит внеклеточный, трансмембранный и внутриклеточный домены. Первый образован субъединицей, которая связывается с мембранным рецептором АПФ-2 через рецептор-связывающий домен, вторая субъединица способствует образованию комплекса «вирус-рецептор» [2]. Нами наблюдалось значительное увеличение экспрессии генов, кодирующих молекулярные компоненты АПФ-2 и фурина, что свидетельствует о потенциальной таргетности тканей яичек к проникновению в них и воздействию SARS-CoV-2. В то же время, выявленное снижение экспрессии АПФ-2 с возрастом можно связать с физиологическими процессами старения яичка. АПФ-2 оказывает регулирующее действие на 5-гидрокситриптаминовый 3A (HTR3A) и холинергический Nicotinic Alpha 1 (CHRNA1) рецепторы. HTR3A опосредованно влияет на апоптоз через продукцию TNF-α, увеличивая секрецию серотонина. CHRNA1 в очаге воспаления взаимодействует с лейкоцитами. Можно предположить, что увеличение экспрессии АПФ-2 при воспалительной реакции в яичках, вызванной SARS‐ CoV‐2 приведет к дисфункции сперматогенеза и в целом к тестикулярной недостаточности.
Анализируя паттерн экспрессии фурина в ткани яичка, мы наблюдали повышенное содержание этой протеазы, что возможно свидетельствует об увеличении вирусной нагрузки, так как он расщепляет последовательность S-белка SARS-CoV-2, способствуя внутриклеточной инвазии. Принимая во внимание данные по секвенированию scRNA-seq из публичных карт «The Human Protein Atlas», согласно которым в норме АПФ-2 и фурин на 65–80% экспрессируются в мужских половых клетках, то с высокой долей вероятности можно утверждать, что они являются клетками-мишенями для SARS-CoV-2. Это предположение было отчасти подтверждено в одном из последних исследований, в котором при помощи секвенирования технологией Single-cell transcriptome scRNA-seq на основании протоколов «Gene Expression Omnibus» и «Sequence Read Archive» была выявлена высокая экспрессия АПФ-2 в сперматогониях, клетках Лейдига и Сертоли [7].
Подводя итоги исследования с абсолютной уверенностью можно утверждать об уязвимости тканей мужских половых желез к вирусной инфекции SARS-CoV-2, что следует из результатов ПЦР-РВ. Принимая во внимание собственные результаты и ранее полученные данные других исследователей, нами предлагаются некоторые гипотезы о таргетности отдельных тканевых структур яичек для этой инфекции, в первую очередь мужских гамет, однако данный вопрос остается по-прежнему окончательно не решенным и требует дальнейшего изучения.
Заключение. Таким образом по результатам полимеразной цепной реакции в режиме реального времени на РНК ви- руса SARS-CoV-2, оценки экспрессии АПФ-2 и фурина, можно с большой вероятностью утверждать о присутствии вируса в тканях яичка, а также о его потенциальной таргетности к мужским половым клеткам, клеткам Сертоли и Лейдига.
Список литературы Молекулярно-генетические изменения тканей яичек пациентов с COVID-19
- Kogan EA, Berezovsky YuS, Protsenko DD i dr. Patologicheskaya anatomiya infectsii vyzvannoy SARS-CoV-2. Sudebnaya Meditsina. 2020;6(2):8–30. In Russian. DOI: 10.19048/2411-8729-2020-6-2-8-30
- Hoffmann M, Kleine-Weber H, Schroeder S. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181:271–280
- Douglas GC, O'Bryan MK, Hedger MP et al. The novel angiotensin-converting enzyme (ACE) homolog, ACE2, is selectively expressed by adult Leydig cells of the testis. Endocrinology. 2004 Oct;145(10):4703-4711
- Fan C, Li K, Ding Y, Lu LW, Wang J. ACE2 expression in kidney and testis may cause kidney and testis damage after 2019-nCoV infection. MedRxiv. 2020. DOI: 10.1101/2020.02.12.20022418
- Li MY, Li L, Zhang Y, Wang XS. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissues. Infect Dis Pov-erty. 2020;9(1):45. DOI: 10.1186/s40249-020-00662-x
- Verma S, Saksena S, Sadri-Ardekani H. ACE2 Receptor Expression in Testes: Implications in COVID-19 Pathogenesis. Biol Reprod. 2020; ioaa080. DOI: 10.1093/biolre/ioaa080
- Wang Z, Xu X. scRNA-seq profiling of human testes reveals the presence of the ACE2 receptor, a target for SARS-CoV-2 infection in spermato-gonia, Leydig and Sertoli cells. Cells. 2020;9:920
- Yang M, Chen S, Huang B, et al. Pathological Findings in the Testes of COVID-19 Patients: Clinical Implications. Eur Urol Focus. 2020;S2405-4569(20):30144-30149. DOI: 10.1016/j.euf.2020.05.009
- Pan F, Xiao X, Guo J et al. No evidence of SARS-CoV-2 in semen of males recovering from COVID-19. Fertil Steril. In press. DOI: 10.1016/j.fertnstert.2020.04.024
- Song C, Wang Y, Li W, Hu B, Chen G, Xia P, Wang W, Li C, Diao F, Hu Z, Yang X, Yao B et al. Absence of 2019 novel coronavirus in se-men and testes of COVID-19 patients. Biol Reprod. 2020. DOI: 10.1093/biolre/ioaa050
- Younis JS, Abassi Z, Skorecki K. Is there an impact of the COVID-19 pandemic on male fertility? The ACE2 connection. Am J Physiol Endo-crinol Metab. 2020;318(6):E878-E880. DOI: 10.1152/ajpendo.00183.2020
- Li D, Jin M, Bao P, Zhao W, & Zhang S. Clinical characteristics and results of semen tests among men with coronavirus disease 2019. JAMA Network Open. 2020;3(5):e208292. DOI: 10.1001/jamanetworkopen.2020.8292
- Schindell BG, Webb AL, Kindrachuk J. Persistence and Sexual Transmission of Filoviruses. Viruses. 2018;10(12):683. DOI: 10.3390/v10120683
- Wu H, Jiang X, Gao Y et al. Mumps virus infection disrupts blood-testis barrier through the induction of TNF-α in Sertoli cells. FASEB J. 2019;33(11):12528-12540. DOI: 10.1096/fj.201901089R
- Siemann DN, Strange, DP, Maharaj PN et al. Zika Virus Infects Human Sertoli Cells and Modulates the Integrity of the In Vitro Blood-Testis Barrier Model. Journal of Virology. 2017;91(22). DOI: 10.1128/jvi.00623-17
- Deen GF, Broutet N, Xu W et al. Ebola RNA Persistence in Semen of Ebola Virus Disease Survivors - Final Report. N Engl J Med. 2017; 377(15):1428-1437. DOI: 10.1056/NEJMoa1511410
- Gorchakov R, Berry RM, Patel SM et al. Optimizing PCR Detection of Zika Virus from Various Body Fluids. Am J Trop Med Hyg. 2019; 100(2):427-433. DOI: 10.4269/ajtmh.18-0755
- Govero J, Esakky P, Scheaffer SM et al. Zika virus infection damages the testes in mice. Nature. 2016; 540(7633):438-442. DOI:10.1038/nature20556
- Matusali G, Houzet L, Satie AP et al. Zika virus infects human testicular tissue and germ cells. J Clin Invest. 2018;128(10):4697-4710. DOI: 10.1172/JCI121735
- Clarke NE, Turner AJ. Angiotensin-converting enzyme 2: the first decade. Int J Hypertens 2012: 3073(15). DOI: 10.1155/2012/307315
- Donoghue M, Hsieh F, Baronas E et al. A novel angiotensin‐converting enzyme‐related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1‐9. Circ Res. 2000; 87:E1‐E9.
- Warner FJ, Lew RA, Smith AI et al. Angiotensin-converting enzyme 2 (ACE2), but not ACE, is preferentially localized to the apical surface of polarized kidney cells. J Biol Chem. 2005;280:39353–39362. DOI: 10.1074/jbc.M508914200


