Молекулярно-генетические маркеры эффективности неоадъювантной химиотерапии с применением антрациклинов у больных раком молочной железы
Автор: Казанцева Полина Вадимовна, Цыганов Матвей Михайлович, Слонимская Елена Михайловна, Литвяков Николай Васильевич, Чердынцева Надежда Викторовна, Ибрагимова Марина Константиновна, Дорошенко Артем Васильевич, Тарабановская Наталья Анатольевна, Паталяк Станислав Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (74), 2016 года.
Бесплатный доступ
Цель исследования - изучение эффективности неоадъювантной химиотерапии антрациклинами в зависимости от наличия делеций и амплификаций различных хромосомных локусов и уровня экспрессии топоизомеразы 2а в опухолевой ткани у больных раком молочной железы. Материал и методы. В исследование включено 46 больных раком молочной железы TNMстадии, получивших 2-6 курсов 2-40-30 НАХТ по схемам FAC и CAX. результаты. При оценке зависимости эффекта НАХТ с включением антрациклинов от различных молекулярно-генетических характеристик опухоли получены данные о связи уровня экспрессии Тор2а>5, делеции ABCB1; ABCB3; 18р11.21; 11q22.1 локусов и амплификация 1q24.1-43 с высокой эффективностью предоперационного лечения. Наличие в опухолевой ткани хотя бы одного из указанных маркеров выявлено у 34 больных, из них у 85,3 % в ответ на НАХТ была зарегистрирована регрессия новообразования более 50 % и у 14,7 % наблюдалась стабилизация и прогрессирование заболевания. В опухолевой ткани 12 пациенток отсутствовали все указанные маркеры, при этом предоперационное лечение ни в одном случае не было эффективным. Заключение. Полученные результаты позволяют рассматривать высокий уровень экспрессии Тор2а>5, делецию ABCB1; ABCB3; 18р11.21; 11q22.1 локусов и амплификацию 1q24.1-43 в качестве предсказательных критериев высокой эффективности НАХТ с включением антрациклинов. Наличие хотя бы одного из представленных маркеров позволяет в 85,3 % наблюдений предсказать высокую эффективность предоперационного лечения антрациклинами.
Рак молочной железы, неоадъювантная химиотерапия, предсказательные критерии, уровень экспрессии тор2а, делеция генов авс-транспортеров, cnv днк опухоли
Короткий адрес: https://sciup.org/14056667
IDR: 14056667 | УДК: 18.19-006.6-08:615.28:577.21 | DOI: 10.21294/1814-4861-2016-15-2-29-35
Текст научной статьи Молекулярно-генетические маркеры эффективности неоадъювантной химиотерапии с применением антрациклинов у больных раком молочной железы
Неоадъювантная химиотерапия (НАХТ) является одним из этапов комбинированного лечения рака молочной железы (РМЖ). Применение цитостатических препаратов в предоперационном периоде при первично-операбельном раке молочной железы продиктовано стремлением к уменьшению объема первичной опухоли, что создает, во-первых, более благоприятные условия для выполнения органосохраняющих операций. Во-вторых, определение чувствительности первичной опухоли к проводимой химиотерапии in vivo позволяет по результатам оценки эффективности адекватно планировать лечение в адъювантном режиме. В-третьих, тем, что достижение полной морфологической регрессии (ПМР) способствует улучшению отдаленных результатов [5, 16]. Кроме того, в последнее время в литературе появились данные, свидетельствующие о том, что не только полная, но и выраженная частичная регрессия опухоли в ответ на НАХТ ассоциирована с улучшением показателей выживаемости [10, 14].
Однако значимое уменьшение размеров опухоли в ответ на проводимое лечение наблюдается далеко не всегда. В качестве одной из наиболее значимых причин неэффективности химиотерапии злокачественных новообразований рассматривается множественная лекарственная устойчивость (МЛУ) опухолевых клеток, которую наиболее часто связывают с работой энергозависимых ABC-транспортеров (ATP-Binding Cassette), осуществляющих выброс цитостатических и тар-гетных препаратов из опухолевых клеток против градиента концентрации с затратой энергии АТФ. По данным литературы, 75–85 % случаев низкой эффективности цитостатической терапии при РМЖ обусловлено развитием МЛУ клеток опухоли. Семейство ABC-транспортеров насчитывает 50 генов, и главными подсемействами являются
ABCB , ABCC и ABCG [1, 2, 8, 12, 13, 15]. Известно, что при делеции локусов генов АВС в опухолевых клетках отмечается снижение экспрессии этих генов и, как правило, наблюдается выраженный ответ на НАХТ [9].
В последние годы получены новые данные, свидетельсвующие о том, что CNV (Copy Number Variation) (делеции и амплификации) в регионах, не являющиеся генами АВС, также могут быть ассоциированы как с химиорезистентностью опухоли, так и с показателями выживаемости [4, 17]. В работе корейских ученых была установлена связь между амплификацией 8q (24,3, 24.22, 22.1-3), 13q21.1, 20q (13.2-13.33) регионов, деле-цией 8р23.3-1 и 17р13.3 в ткани опухоли молочной железы с отсутствием эффекта при проведении предоперационной химиотерапии таксанами [3]. В исследовании Н.В. Литвякова и др. [9] также были выявлены хромосомные регионы, CNV в которых сопряжены с чувствительностью опухоли молочной железы к неоадъювантной химиотерапии (НАХТ): 18р11.21; 11q22.1-23.3; 1q24.1-43. Несмотря на результаты проводимых исследований, демонстрирующих зависимость эффективности предоперационной химиотерапии от определенных хромосомных аберраций в ДНК опухоли, нет однозначного мнения относительно предсказательной значимости изучаемых критериев.
Также не существует и унифицированного подхода к выбору схемы при РМЖ. Однако накоплено значительное количество информации относительно связи эффективности НАХТ с уровнем экспрессии некоторых молекул (TOP2A, TUBB3, TYMS), являющихся мишенями для действия цитостатиков. Наиболее изученной и доказанной является корреляция между высоким уровнем экспрессии топоизомеразы 2α (Top2а) и эффективностью антрациклинсодержащих схем химиотерапии [7]. Несмотря на это, определение экспрессии генов-мишений в опухолевой ткани для персонализированного выбора препарата при проведении НАХТ широкого внедрения в практику не получило, хотя с клинических позиций является достаточно актуальным еще и потому, что на сегодняшний день антрациклины – одни из наиболее эффективных и часто используемых цитостатиков при РМЖ.
Цель исследования – изучение эффективности НАХТ антрациклинами в зависимости от наличия делеций и амплификаций различных хромосомных локусов и уровня экспрессии топоизомеразы 2а в опухолевой ткани у больных раком молочной железы.
Материал и методы
В исследование было включено 46 пациенток с диагнозом рак молочной железы T2-4N0-3M0 стадии, средний возраст составил 49 ± 8 лет (29–68 лет). До начала лечения пациентам под контролем УЗИ выполнялась пистолетная биопсия опухоли. По стандартной методике определялись: гистологический тип опухоли, степень злокачественности, рецепторный статус (РЭ, РП), статус Her2Neu и уровень Ki-67. У 28 пациенток имел место люминальный В подтип опухоли, у 12 – трижды негативный, у 6 - Her2 положительный не люминальный. В ходе комбинированного лечения все больные получали 2–6 курсов НАХТ по схемам, включающим антрациклины (FAC: фторурацил, 500 мг/м2; доксорубицин, 50 мг/м2; циклофосфамид, 500 мг/м2; внутривенно в 1-й день, CAX: циклофосфамид, 100 мг/м2, внутримышечно в течение 14 дней; доксорубицин, 30 мг/м2 внутривенно в 1-й и 8-й дни; капецитабин, 2 000 мг/м2/ сут внутрь на два приема в течение 14 дней). Для определения CNV и уровня экспрессии Тор2а из опухолевой ткани выделяли ДНК и РНК. Для этого образцы опухоли помещали в консервирующий раствор RNALater (Ambion, USA) и сохраняли в холодильнике при -80ºС. ДНК из опухолевой ткани выделяли с помощью набора QIAamp DNA mini Kit (Qiagen, Germany) и исследовали с помощью микрочипов фирмы Affymetrix (USA) CytoScanTM HD Array в соответствии с инструкциями производителя , www.affymetrix. com). Тотальная РНК была выделена из биопсийных образцов до лечения с использованием набора RNeasy mini kit Plus, содержащего DNase I (Qiagen, Germany). Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора RevertAid™ (Fermentas, Lithuania). Уровень экспрессии ТОР2а оценивали методом количественной ПЦР в режиме реального времени (qPCR) по технологии TaqMan на амплификаторе Rotor-Gene-6000 (Qiagen, Germany). Ранее была описана методика проведения ПЦР [8] и последовательность праймеров Тор2а.
Оценка эффективности неоадъювантной химиотерапии осуществлялась по шкале ВОЗ, исходя из данных УЗИ и маммографии. Статистическая обработка проводилась с использованием пакета программ SPSS 17.0.
Результаты и обсуждение
Из 46 пациентов, включенных в исследование, регрессия опухоли более чем на 50 % была отмечена в 29 (63 %), стабилизация и прогрессирование – в 17 (37 %) наблюдениях. При определении в опухолевой ткани уровня экспрессии Тор2а оказалось, что он колебался от 0,08 до 18,49, медиана составила 3,5 (1,05–7,2). Анализ сопряженности эффективности предоперационной химиотерапии с уровнем экспрессии Тор2а показал, что регрессия новообразования в ответ на антрациклин-содержащие схемы лечения наблюдалась чаще в опухолях с исходно высоким уровнем экспрессии топоизомеразы. Эмпирическим путем было выявлено, что в качестве разделяющего критерия таблица 1
Частота встречаемости отдельных cnv в опухоли молочной железы и их связь с эффективностью неоадъювантной химиотерапии
По результатам исследования опухолевой ткани были выделены CNV, ассоциированные с высокой эффективностью НАХТ. Так, делеции локусов генов ABCB1(7q21.1) и ABCB3(6p21.32) в 100 % случаев были сопряжены с частичной и полной регрессией опухоли. При делеции MVP(16p11.2), АВСG2(4q22), ABCC1(16p13.1) непосредственная эффективность предоперационной химиотерапии была несколько ниже и составила 75–80 %, но уровень доверительной значимости оказался больше 0,05 (табл. 1). Можно полагать, что в результате аллельной делеции повышение экспрессии гена АВС в опухолевых клетках в ответ на химиотерапию оказывается недостаточным для элиминации лекарственных средств, что обусловливает высокую химиочувствительность опухолевых клеток.
Относительно других ранее выявленных генетических маркеров эффективности предоперационного лечения было показано, что делеции 18р11.21 и 11q22.1 – 23.3 регионов ассоциированы с регрессией новообразования в 100 и 85 % случаев соответственно. Амплификация региона 1q24.1-43 была связана с высокой эффективностью НАХТ также в 85 % случаев (табл. 1). Данных о сопряженности амплификации локуса 1q24.1–43, делеций 11q22.1–23.3 и 18p11.21 в опухоли молочной железы с эффективностью химиотерапии в литературе не представлено.
Несмотря на высокую частоту регрессии опухоли (75–80 %), ассоциированную с делецией генов АВСС1 , АВСG2 и MVP , проверку на статистиче-
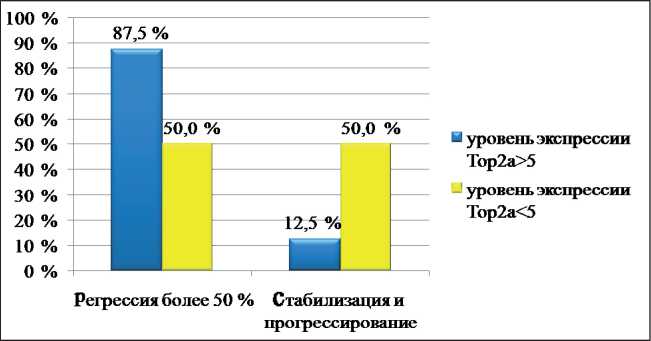
Рис. 1. Зависимость эффективности НАХТ антрациклинами от уровня экспрессии Тор2а в опухолевой ткани
таблица 2
Эффективность нахт в зависимости от различного количества в опухолевой ткани генетических маркеров эффективности предоперационного лечения
|
Кол-во маркеров в ткани опухоли |
Наличие/отсут-ствие изучаемого кол-ва маркеров (n) |
Регрессия опухоли более 50 % |
Стабилизация и прогрессирование |
Чувствительность |
Специфичность |
|
Только 1 |
+(8/46) |
75 % (6/8) |
25 % (2/8) |
20,6 % |
88,2 % |
|
-(38/46) |
60,5 % (23/38) |
39,5 % (15/38) |
|||
|
Только 2 |
+(8/46) |
75 % (6/8) |
25 % (2/8) |
20,6 % |
88,2 % |
|
-(38/46) |
60,5 % (23/38) |
39,5 % (15/38) |
|||
|
3 и более |
+(18/46) |
94,4 % (17/18) |
5,6 % (1/18) |
58,6 % |
94,1 % |
|
-(28/46) |
42,9 % (12/28) |
57,1 % (16/28) |
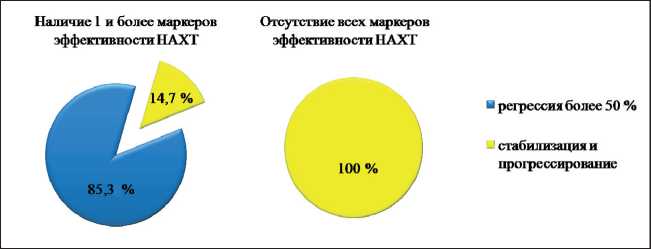
Рис. 2. Эффективность НАХТ в зависимости от наличия в опухолевой ткани хотя бы 1 из генетических маркеров эффективности предоперационного лечения (чувствительность – 100 %, специфичность – 70,6 %)
скую значимость при сравнении частоты ответа у больных с делецией и без делеции эти маркеры не прошли (р=0,405–0,604) (табл. 1). По этой причине дальнейший анализ предполагал оценку предсказательной значимости следующих маркеров: делеций АВСВ1 , АВСВ3 , 18р11.21, 11q22.1–23.3, амплификации 1q24.1–43 и уровня экспрессии ТОР2а>5.
Оказалось, что наличие в опухолевой ткани только одного из 6 перечисленных выше маркеров наблюдалось у 8 пациентов, регрессия опухоли более 50 % имела место в 75 % (6 из 8) наблюдений. Аналогичные результаты получились при наличии только двух изучаемых маркеров. Чувствительность в обоих случаях составила 20,6 %, а специфичность – 88,2 %. Одновременное наличие трех и более маркеров было отмечено у 18 пациентов, а у 17 из них диагностирована регрессия опухоли на фоне НАХТ более 50 %, что составляет 94,4 %, чувствительность метода – 58,6 %; специфичность – 94,1 % (табл. 2).
При анализе общей группы больных у 34 пациентов в опухолевой ткани определялся хотя бы один или любое другое количество изучаемых маркеров. У 85,3 % из них (29 из 34) в ответ на предоперационное лечение была зарегистрирована регрессия новообразования более 50 %, и только у 14,7 % (5 из 34) пациенток имело место прогрессирование заболевания. У остальных 12 пациенток предоперационное лечение ни в одном случае не было эффективно (уровень доверительной вероятности по критерию Фишера р=1,59×10-7). Чувствительность данного подхода составила 100 %, специфичность – 70,6 % (рис. 2).
Заключение
Полученные данные свидетельствуют о том, что эффективность антрациклинсодержащих схем НАХТ у больных раком молочной железы ассоциирована не только с высоким исходным уровнем ТОР2а, но и с наличием в опухолевой ткани ряда генетических маркеров, таких как делеция локусов генов АВС: ABCB1 (7q21.1), ABCB3 (6p21.32), а также хромосомных аберраций в регионах ДНК, не связанных напрямую с генами АВС, – делеция 18р11.21; 11q22.1 локусов и амплификация 1q24.1-43, что позволяет рассматривать их в качестве информативных предсказательных параметров. Наиболее значимым результатом проведенной работы, на наш взгляд, является тот факт, что наличие хотя бы одного из представленных генетических маркеров позволяет не только предсказать высокую эффективность предоперационного лечения антра-циклинами, но и имеет чувствительность, равную 100 %, при достаточно высокой специфичности – 70,6 %. Таким образом, применение описанного выше подхода в клинической практике целесообразно при определении показаний к назначению НАХТ антрациклинами у больных раком молочной железы.
Список литературы Молекулярно-генетические маркеры эффективности неоадъювантной химиотерапии с применением антрациклинов у больных раком молочной железы
- Eechoute K., Sparreboom A., Burger H., Franke R.M., Schiavon G., Verweij J., Loos W.J., Wiemer E.A., Mathijssen R.H. Drug transporters and imatinib treatment: implications for clinical practice//Clin. Cancer Res. 2011. Vol. 17 (3). P. 406-415 DOI: 10.1158/1078-0432.CCR-10-2250
- Gillet J.P., Gottesman M.M. Overcoming multidrug resistance in cancer:35years after thediscoveryofABCB1//DrugResist Updat.2012. Vol. 15 (1-2). P. 2-4 DOI: 10.1016/j.drup.2012.03.001
- Han S., Park K., Shin E., Kim H.J., Kim J.Y., Kim J.Y., Gwak G. Genomic change of chromosome 8 predicts the response to taxane-based neoadjuvant chemotherapy in node-positive breast cancer//Oncol. Reports. 2010. Vol. 24 (1). P. 121-128.
- Han W., Woo J.H., Yu J.H., Lee M.J., Moon H.G., Kang D., Noh D.Y. Common genetic variants associated with breast cancer in Korean women and differential susceptibility accoding to intrisic subtype//Cancer Epidemiol. Biomarkers Prev. 2011. Vol. 20 (5). P. 793-798 DOI: 10.1158/10559965.EPI-10-1282
- Kaufmann M., von Minckwitz G., Mamounas E.P., Cameron D., Carey L.A., Cristofanilli M., Denkert C., Eiermann W., Gnant M., Harris J.R., Karn T., Liedtke C., Mauri D., Rouzier R., Ruckhaeberle E., Semiglazov V., Symmans W.F., Tutt A., Pusztai L. Recommendations from an international consensus conference on the current status and future of neoadjuvant systemic therapy in primary breast cancer//Ann. Surg. Oncol. 2012. Vol. 19 (5). P. 1508-1516 DOI: 10.1245/s10434-011-2108-2
- Kawachi K., Sasaki T., Murakami A., Ishikawa T., Kito A., Ota I., Shimizu D., Nozawa A., Nagashima Y., Machinami R., Aoki I. The topoisomerase II alpha gene status in primary breast cancer is a predictive marker of the response to anthracycline-based neoadjuvant chemotherapy//Pathol. Res. Pract. 2010. Vol. 206 (3). P. 156-162. doi: 10.1016/j. prp.2009.10.009.
- Konecny G.E., Pauletti C., Untch M., Wang H.-J., Modus V., Kulin W., Thomssen C., Harbeck N., Wang L., Apple S., Janicke F., Slamon D.J. Association between HER2, TOP2A, and response to antracycline-based preoperative chemotherapy in high-risk primary breast cancer//Breast Cancer Res. Treat. 2010. Vol. 120. P. 481-489 DOI: 10.1007/s10549010-0744-z
- Litviakov N., Cherdyntseva N., Tsyganov M., Denisov E., Garbukov E., Merzliakova M., Volkomorov V., Vtorushin S., Zavyalova M., Slonimskaya E. Changing the expression vector of multidrug resistance genes is related to neoadjuvant chemotherapy response//Cancer Chemother. Pharmacol. 2013. Vol. 71 (1). P. 153-163 DOI: 10.1007/s00280012-1992-x
- Litviakov N.V., Cherdyntseva N.V., Tsyganov N.V., Slonimskaya E.M., Ibragimova M.K., Kazantseva P.V., Kzhyshkowska J., Choinzonov E.L. Deletions of multidrug resistance gene loci in breast cancer leads to the down-regulation of its expression and predict tumor response to neoadjuvant chemotherapy//Oncotarget. 2016. Vol. 7 (7). P. 7829-7841 DOI: 10.18632/oncotarget.6953
- Miller M., Ottesen R.A., Niland J.C., Kruper L., Chen S.L., Vito C. Tumor response ratio predicts overall survival in breast cancer patients treated with neoadjuvant chemotherapy//Ann.Surg.Oncol.2014.Vol. 21. P. 3317-3323 DOI: 10.1245/s10434-014-3922-0
- Miyoshi Y., Kurosumi M., Kurebayashi J., Matsuura N., Takahashi M., Tokunaga E., Egawa C., Masuda N., Kono S., Morimoto K., Kim S.J., Okishiro M., Yanagisawa T., Ueda S., Taguchi T., Tamaki Y., Noguchi S. Predictive factors for anthracycline-based chemotherapy for human Breast Cancer//Breast Cancer. 2010. Vol. 17 (2). P. 103-109 DOI: 10.1007/s12282-009-0152-6
- O'Driscoll L., Clynes M. Molecular markers of multiple drug resistance in breast cancer//Chemotherapy. 2006. Vol. 52 (3). P. 125-129.
- Schinkel A.H., Jonker J.W. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family: an overview//Adv. Drug Deliv. Rev. 2012. Vol. 64. P. 138-153.
- Symmans W.F., Peintinger F., Hatzis C., Rajan R., Kuerer H., Valero V., Assad L., Poniecka A., Hennessy B., Green M., Buzdar A.U., Singletary S.E., Hortobagyi G.N., Pusztai L. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy//J. Clin. Oncol. 2007. Vol. 25 (28). P. 4414-4422.
- Szakacs G., Paterson J.K., Ludwig J.A., Booth-Genthe C., Gottesman M.M. Targeting multidrug resistance in cancer//Nat. Rev. Drug Discov. 2006. Vol. 5 (3). P. 219-234.
- Von Minckwitz D., Untch M., Blohmer J.U., Costa S.D., Eidtmann H., Fasching P.A., Gerber B., Eiermann W., Hilfrich J., Huober J., Jackisch C., Kaufmann M., Konecny C., Denkert C., Nekljudova V., Mehta K., Loibl S. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes//J. Clin. Oncol. 2012. Vol. 30 (15). P. 1796-1804 DOI: 10.1200/JCO.2011.38.8595
- Wikman H., Sielaff-Frimpong B., Kropidlowski J., Witzel I., Milde-Langosch K., Sauter G., Westphal M., Lamszus K., Pantel K. Clinical Relevance of Loss of 11p15 in Primary and Metastatic Breast Cancer: Association with Loss of PRKCDBP Expression in Brain Metastases//PLoS ONE. 2012. Vol. 7 (10): e47537 DOI: 10.1371/journal.pone.0047537


